Кобалт
 Електролитски рафинирани парчиња кобалт | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Општи својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име и симбол | кобалт (Co) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изглед | цврст сив сјаен метал | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кобалтот во периодниот систем | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски број | 27 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандардна атомска тежина (±) (Ar) | 58,933194(4)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категорија | преоден метал | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Група и блок | група 9, d-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Периода | IV периода | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електронска конфигурација | [Ar] 3d7 4s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
по обвивка | 2, 8, 15, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физички својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Боја | металик сива | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза | цврста | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка на топење | 1.768 K (1.495 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка на вриење | 3.200 K (2.927 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Густина близу с.т. | 8,90 г/см3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| кога е течен, при т.т. | 8,86 г/см3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлина на топење | 16,06 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлина на испарување | 377 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Моларен топлински капацитет | 24,81 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
парен притисок
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Оксидациони степени | −3, −1, +1, +2, +3, +4, +5[2] (амфотерен оксид) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електронегативност | Полингова скала: 1,88 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Енергии на јонизација | I: 760,4 kJ/mol II: 1.648 kJ/mol II: 3.232 kJ/mol (повеќе) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски полупречник | емпириски: 125 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентен полупречник | Слаб спин: 126±3 pm Силен спин: 150±7 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Разни податоци | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристална структура | шестаголна збиена (шаз) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Брзина на звукот тенка прачка | 4.720 м/с (при 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлинско ширење | 13,0 µм/(m·K) (при 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлинска спроводливост | 100 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електрична отпорност | 62,4 nΩ·m (при 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнетно подредување | феромагнетно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул на растегливост | 209 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул на смолкнување | 75 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул на збивливост | 180 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Поасонов сооднос | 0,31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мосова тврдост | 5,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Викерсова тврдост | 1.043 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бринелова тврдост | 470–3.000 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-број | 7440-48-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Историја | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Откриен | Георг Брандт (1732) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Најстабилни изотопи | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Кобалт — хемиски елемент со симбол Co и атомски број 27. Како никел, кобалт е застапен во Земјината кора само во хемиски комбинирана форма, освен за малите депозити кои се наоѓаат во легури на природно метеорско железо. Слободниот елемент, произведен со редуктивно топење е тежок, блескав, сребрено-сив метал.
Сините пигменти засновани на кобалт се користат уште од стариот век за накит и бои и за давање карактеристична сина боја на стаклото, но подоцна алхемичарите сметаа дека бојата се должи на познатиот метал бизмут. Рударите долго време го користеле името руда од коболд (германски за гоблинска руда) за некои од минералите за производство на син пигмент; тие беа така именувани затоа што не беа познати метали, и испуштаа отровни гасови што содржат арсен, кога се топат. Во 1735 година, било откриено дека таквите руди можат да бидат сведени во нов метал (првиот бил откриен уште од античките времиња), и тоа било крајното именување на коболдот.
Денес, некои кобалти се произведуваат специјално од еден од големиот број метално-блескави руди, како на пример кобалтит (CoAsS). Сепак, елементот најчесто се произведува како нуспродукт од бакар и никел. Бакарниот појас во Демократска Република Конго (ДРК) и Замбија произведува најголемо количество на кобалт во светот. Само ДРК произведуваше повеќе од 50% од светското производство во 2016 година (123.000 тони), според Министерството за природни ресурси на Канада.[3]
Кобалтот првенствено се користи во производството на магнетни легури, легури отпорни на абење и легури со висока јачина. Соединенијата кобалт силикат и кобалт(II) алуминат (CoAl2O4, кобалт син) даваат карактеристична длабока сина боја на стакло, керамика, мастила, бои и лакови. Кобалтот природно се јавува како единствен стабилен изотоп, кобалт-59. Кобалт-60 е комерцијално важен радиоизотоп, кој се користи како радиотрасер и за производство на високоенергетски гама-зраци.
Кобалтот е активен центар на група коензими наречени кобаламини. Витамин Б12, најпознатиот пример од оваа група, е неопходен витамин за сите животни. Кобалт во неорганска форма е исто така микронутриент за бактерии, алги и габи.
Карактеристики[уреди | уреди извор]

Кобалтот е феромагнетски метал со специфична тежина од 8,9. Кјуриевата температура е 1115 °C (2039 °F)[4], а магнетниот момент е 1,6-1,7 Борови магнетони по атом.[5] Кобалтот има релативна пермеабилност две третини од пермеабилноста на железото.[6] Металниот кобалт се јавува во две кристалографски структури: зес и ткс. Идеалната транзициона температура помеѓу зес и ккс структурите е 450 °C (842 °F), но во пракса енергетската разлика помеѓу нив е толку мала што случаен пораст на двете структури е честа појава.[7][8][9]
Кобалтот е слабо редуцирачки метал кој е заштитен од оксидација со пасивизационен оксиден филм. Тој е нападнат од халогени и сулфур. Греењето во кислородот создава Co3O4, којшто губи кислород на 900°С (1650 °F) за да се добие моноксид CoO.[10] Металот реагира со флуор (F2) на 520К за да даде CoF3; со хлор (Cl2), бром (Br2) и јод (I2), создавајќи еквивалентни бинарни халиди. Не реагира со водороден гас (H2) или азотен гас (N2), дури и кога е загреан, но реагира со бор, јаглерод, фосфор, арсен и сулфур.[11] На собни температури, бавно реагира со минерални киселини, и многу бавно со влажен, но не реагира со сув воздух.
Соединенија[уреди | уреди извор]
Честите оксидациски состојби на кобалтот ги вклучуваат +2 и +3, иако се познати и соединенијата со оксидни состојби кои се движат од -3 до +5. Честа оксидациска состојба за едноставни соединенија е +2 (кобалт (II)). Овие соли го формираат металниот аквакомплекс со розова боја [Co(H2O)6]2+ во вода. Додавањето на хлорид дава интензивна сина [CoCl4]2−.[2] Во тест за огнот на боракс, кобалтот покажува длабоко сина и во оксидирачки и во редуцирачки оган.[12]
Кислородни и халогени соединенија[уреди | уреди извор]
Има неколку познати оксиди на кобалт. Зелениот кобалт(II) оксид (CoO) има тесерална структура. Лесно се оксидизира со вода и кислород до кафеав кобалт(III) хидроксид (Co(OH)3). На температури од 600-700 °C, CoO оксидира до синиот кобалт(II, III) оксид (Co3O4), кој има спинелна структура.[2] Црниот кобалт(III) оксид (Co2O3) е исто така познат.[13] Оксидите од кобалт се антиферомагнетици при ниска температура: CoO (Неелова температура: 291 K) и Co3O4 (Неелова температура: 40 K), што е аналогно на магнетит (Fe3O4), со мешавина од +2 и +3 оксидациски состојби.[14]
Главните халкогениди на кобалтот ги вклучуваат црниот кобалт(II) сулфиди, CoS2, кои усвојуваат структура слична на пирит, и кобалт(III) сулфид (Co2S3).
Халиди[уреди | уреди извор]

Познати се четири дихалиди на кобалт(II): кобалт(II) флуорид (CoF2, розов), кобалт(II) хлорид (CoCl2, син), кобалт(II) бромид (CoBr2, зелен), кобалт(II) јодид (CoI2 , сино-црна). Овие халиди постојат во безводни и хидрирани форми. Додека анхидридниот дихлорид е син, хидратот е црвен.[15]
Редукциониот потенцијал на реакцијата Co3+ + e- → Co2+ е еднаков на 1,92 V, што е повеќе од оној за хлор до хлорид, 1,36 V. Следствено, кобалт(III) и хлорид ќе резултираат со намалување на кобалт(III) на кобалт(II). Бидејќи редукциониот потенцијал за флуор да флуорид е многу висок, +2,87 V, кобалт(III) флуорид е еден од ретките едноставни стабилни кобалт(III) соединенија. Кобалт(III) флуорид, кој се користи во некои флуорни реакции, енергично реагира со вода.[10]
Координатни соединенија[уреди | уреди извор]
Како и за сите метали, молекуларните соединенија и повеќеатомските јони на кобалтот се класифицирани како координатни комплекси, односно молекули или јони кои содржат кобалт поврзан со неколку лиганди. Принципите на електронегативност и цврстина-мекост на серија лиганди може да се користат за да се објасни вообичаената оксидациска состојба на кобалтот. На пример, комплексите Co+3 се склони да имаат амино лиганди. Бидејќи фосфорот е помек од азотот, фосфинските лиганди имаат тенденција да ги прикажуваат помеките Co2+ и Co+, на пример трис(трифенилфосфин)кобалт(I) хлорид ((P(C6H5)3)3CoCl). Повеќе електронегативниот (и потежок) оксид ќе овозможи и флуоридот да може да ги стабилизира Co4+ и Co5+ дериватите, на пр. цезиум хексафлуорокобалтат (Cs2CoF6) и калиум перкобалт (K3CoO4).[10]
Алфред Вернер, прв добитник на Нобелова награда за координатна хемија, работел со соединенија со емпириска формула [Co(NH3)6]Cl3. Еден од утврдените изомери беше кобалт(III) хексамин хлорид. Овој координатен комплекс, типичен Вернеров комплекс, се состои од централен атом на кобалт координиран од шест амински ортогонални лиганди и три хлоридни контрајони. Користењето хелантни етилендиамин лиганди на местото на амонијак дава трис(етилендиамин) кобалт(III) хлорид ([Co(ен)3]Cl3), што беше еден од првите координатни комплекси кои биле решени во оптички изомери. Комплексот постои во две форми од "пропелер со три лопатки". Овој комплекс првпат го изолирал Вернер како жолто-златни игли, со изглед на кристали.[16][17]
Органометални соединенија[уреди | уреди извор]
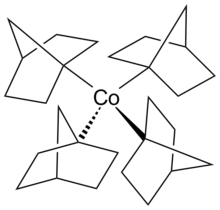
Кобалтоцен е структурен аналог на фероцен, со кобалт наместо железо. Кобалтоценот е многу поосетлив на оксидација отколку фероценот.[18] Кобалт карбонил (Co2(CO)8) е катализатор во реакциите на карбонилација и хидросилилација.[19] Витаминот Б12 е органометално соединение пронајдено во природата и е единствениот витамин кој содржи метален атом.[20] Пример за еден алкилкобалтов комплекс во невообичаената +4 оксидациона состојба на кобалтот е хомолептичниот комплекс тетракис(1-норборнил) кобалт(IV) (Co (1-норб)4), транзициски метал-алкил комплекс, кој е значаен за неговата стабилност до β-водород елиминацијата.[21] Исто така се познати кобалт(III) и кобалт(V) комплексите [Li(THF)4]- + [Co(1-норб)4]- и [Co(1-норб)4]+[BF4]-.[22]
Изотопи[уреди | уреди извор]
59Co е единствениот стабилен кобалтен изотоп и единствениот изотоп што постои во природата. Дваесет и два радиоизотопи се одликуваат; најстабилниот, 60Co има период на полураспад 5,2714 години, 57Co има 271,8 дена, 56Co има 77,27 дена, а 58Co 70,86 дена. Сите други радиоактивни изотопи на кобалтот имаат период на полураспад помал од 18 часа, а во повеќето случаи помалку од 1 секунда. Овој елемент, исто така има 4 мета состојби, од кои сите имаат полураспади пократки од 15 минути.[23]
Изотопите на кобалт можат да имаат атомска тежина од 50 u (50Co) до 73 u (73Co). Примарниот начин на распаѓање на изотопи со вредности на атомска единица на маса помали од вредностите на најзастапениот стабилен изотоп, 59Co, е електронски зафат, а примарен начин на распаѓање на изотопи со атомска маса поголема од 59 атомски единици на маса е бета распаѓање. Примарните производи од распаѓање на изотопи помали од 59Co се изотопите на елементот 26 (железо), а продуктитеод распаѓање на изотопи поголеми од 59Co се изотопите на елементот 28 (никел).[23]
Историја[уреди | уреди извор]

Кобалтните соединенија со векови се користеле за да се пренесе сина боја на стакло, глазури и керамика. Кобалт е откриен во египетската скулптура, во персискиот накит од третиот милениум п.н.е., во урнатините на Помпеја, уништени во 79 н.е., и во Кина, кои датираат од династијата Танг (618-907 година) и династијата Минг (1368-1644 година).[24]
Кобалтот се користи за боење на стакло уште од бронзената доба. Ископувањето на бродоломот Улубурун даде инготи на сино стакло, фрлено во текот на 14 век п.н.е.[25][26] Синото стакло од Египет било обоено со бакар, железо или кобалт. Најстарото стакло со кобалт-боја е од осумнаесеттата династија на Египет (1550-1292 п.н.е.). Изворот за кобалт којшто Египќаните го користеле не е познат.[27]
Зборот кобалт е изведен од германскиот кобалт, од коболд што значи "гоблин", суеверен термин кој се користи за руда на кобалт. Првите обиди за топење на овие руди не успеа, давајќи наместо кобалт, кобалт(II) оксид. Бидејќи основните руди на кобалтот секогаш содржат арсен, топењето на рудата го оксидира арсенот во високо токсичен и испарлив арсенов оксид, додавајќи го на озлогласеноста на рудата.[28]
Шведскиот хемичар Георг Брант (1694-1768) е заслужен за откривање на кобалт околу 1735 година, покажувајќи дека претходно бил непознат елемент, различен од бизмут и другите метали. Брант го нарече нов "полуметал".[29][30] Тој покажал дека соединенијата од кобалт се извор на сина боја кај стаклото, што претходно му се припишува на бизмутот пронајден со кобалт. Кобалт стана првиот метал што бил откривен после предисторискиот период. Сите други познати метали (железо, бакар, сребро, злато, цинк, жива, калај, олово и бизмут) немале регистрирани откривачи.[31]
Во текот на 19 век, значителен дел од светското производство на кобалт син (боја составена од кобалтни соединенија и алуминиум) и смалт (кобалт стакло во прав за употреба во керамика и сликарство) беше спроведена на норвешкиот Бларфарвеверкет.[32][33] Првите рудници за производство на смалт во 16 век се наоѓале во Норвешка, Шведска, Саксонија и Унгарија. Со откривањето на кобалтовата руда во Нова Каледонија во 1864 година, рударството на кобалт во Европа се намалило. Со откривањето на руда наоѓалишта во Онтарио, Канада во 1904 година и откривањето на уште поголеми депозити во покраината Катанга во Конго во 1914 година, рударските операции повторно започнаа.[28] Кога конфликтот Шаба започна во 1978 година, рудниците за бакар во провинцијата Катанга речиси го прекинаа производството.[34][35] Овој конфликт имаше помало влијание врз светската економија на кобалт од очекуваното: кобалтот е редок метал, пигментот е многу токсичен, и индустријата веќе воспостави ефикасни начини за рециклирање на материјалите од кобалтот. Во некои случаи, индустријата можеше да се смени до алтернативи без кобалт.[34][35]
Во 1938 година, Џон Живоуд и Глен Т. Себорг го откриле радиоизотопот кобалт-60.[36] Овој изотоп бил користен на Универзитетот Колумбија во 1950-тите за да се утврди погрешка на парност во радиоактивното бета распаѓање.</ref>[37]
По Втората светска војна, САД сакаа да го гарантираат снабдувањето со руда од кобалт за воена употреба (како што правеле Германците) во границите на територијата на САД. Адекватното снабдување со руда беше пронајдено во Ајдахо кај кањонот Блекбард. Компанијата "Калера рударска компанија" започна со производство кобалт.[38]
Настанување[уреди | уреди извор]
Стабилната форма на кобалт се произведува во супернови преку р-процесот.[39] Во Земјината кора е застапен со 0,0029%. Слободниот кобалт (чист метал) не се наоѓа на Земјата поради кислородот во атмосферата и хлорот во океаните. И двете се во изобилство во горните слоеви на Земјината кора за да го спречат создавањето на кобалт. Освен како предаден во метеорско железо, кобалт во чиста метална форма не е познат на Земјата. Елементот има средно изобилство, но природни соединенија на кобалт се бројни и сите количини на кобалтни соединенија се наоѓаат во повеќето карпи, почви, растенија и животни.
Во природата, кобалтот често асоцира на никел. И двете се карактеристични компоненти на метеорското железо, иако кобалтот е многу помалку застапен во метеорското железо од никелот. Како и со никелот, кобалтот во метеорски железни легури е доволно добро заштитен од кислородот и влагата да остане како слободен (но легуиран) метал,[40] иако ниту еден елемент не се гледа во таа форма во античката терестријална кора.
Кобалт во соединенијата се јавува во минерали на бакар и никел. Тоа е главната метална компонента која се комбинира со сулфур и арсен во сулфурен кобалтит (CoAsS), сафлорит (CoAs2), глаукодот ((Co,Fe)AsS) и скутерудит (CoAs3).[10] Минералниот катиерит е сличен на пирит и се јавува заедно со весит во бакарните наоѓалишта на покраината Катанга.[41] Кога ќе стигне до атмосферата, се појавуваат атмосферски влијанија; сулфидните минерали оксидираат и формираат розов еритрит ("кобалтен поглед": Co3(AsO4)2·8H2O) и сферокобалтити (CoCO3).[42]
Кобалтот исто така е составен дел на чадот од тутунот.[43] Тутунот лесно ги апсорбира и акумулира тешките метали како кобалт. Тие потоа се вдишуваат за време на пушењето.[44]
Производство[уреди | уреди извор]
| Држава | Производство | Резерви |
|---|---|---|
| 64,000 | 3,500,000 | |
| 5,600 | 250,000 | |
| 5,000 | 1,200,000 | |
| 4,300 | 250,000 | |
| 4,200 | 500,000 | |
| 4,000 | 280,000 | |
| 3,800 | 150,000 | |
| 3,200 | 51,000 | |
| 2,900 | 270,000 | |
| 2,800 | - | |
| 2,500 | 29,000 | |
| 650 | 23,000 | |
| Други држави | 5,900 | 560,000 |
| Вкупно во светот |

Главните руди на кобалтот се кобалтит, еритрит, глаукодот и скутерудит, но поголем дел кобалт се добива со намалување на кобалтните нуспроизводи од никел и бакар и со топење.[46][47] Од кобалт генерално се произведуваат како нус-производ, понудата на кобалт зависи во голема мера на економската остварливост на бакар и никел рударството во даден пазар. Побарувачката за кобалт е проектиран да расте 6% во 2017.[48]

Постојат неколку начини за одвојување на кобалтот од бакар и никел, во зависност од концентрацијата на кобалтот и точниот состав на искористената руда. Еден начин е пенетска флотација, во кој сурфактантите се врзуваат за различни компоненти на рудата, што доведува до збогатување на кобалтните руди. Последователното печење ги претвора рудите во кобалт сулфат, и бакарот и железото се оксидираат до оксид. Ликсивијацијата со вода го екстрахира сулфатот заедно со арсенатите. Остатоците понатаму прават ликсивијација со сулфурна киселина, давајќи раствор од бакар сулфат. Кобалтот, исто така, може да биде ликсивијациран од згура од топење на бакар.[49]
Производите од горенаведените процеси се трансформираат во кобалт оксид (Co3O4). Овој оксид е редуциран на метал со алуминиотермична реакција или редукција со јаглерод на високи температури.[10]
Кобалтна екстракција[уреди | уреди извор]
Геолошкиот топографски институт на САД ги проценува светските резерви на кобалт на 7.100.000 тони.[50] Демократска Република Конго (ДРК) произведува 63% од светскиот кобалт. Овој удел на пазарот може да достигне 73% до 2025 година ако планираните проширувања од рударските производители како „Гленкор“ се одвиваат како што се очекува. Но, до 2030 година, глобалната побарувачка би можела да биде 47 пати повеќе отколку што беше во 2017 година.[51]
Промените што Конго ги направи во рударските закони во 2002 година овозможи привлекување на инвеститори за производство на бакар и кобалт. Сепак „Гленкор“ доминира на пазарот на колтан во ДРК. Рудникот Мутанда минатата година испорача 24.500 тони кобалт, што е 40% од производството на Конго и речиси една четвртина од светското производство. Гленкоровиот проект за рударство во Катанга продолжува и треба да произведе 300.000 тони бакар и 20.000 тони кобалт до 2019 година, според „Гленкор“.[48]
Демократска Република Конго[уреди | уреди извор]
Во 2005 година, врвниот производител на кобалт беа бакарните наоѓалишта во покраината Катанга во Демократска Република Конго. Порешната покраина Шаба, имаше речиси 40% од светските резерви, објави Геолошкиот институт на Британија во 2009 година.[52] До 2015 година, Демократската Република Конго (ДРК) испорача 60% од светското производство на кобалт, 32.000 тони со 20.000 до 26.000 долари по тон. Неодамнешниот раст на производството може барем делумно да се должи на тоа како ниското рударско производство паднало за време на многу насилните граѓански војни во Конго во раните 2000-ти, или на промените што земјата ги направила во својот кодекс за рударство во 2002 година за да ги охрабри странските инвестиции и што донесе голем број на инвеститори, вклучувајќи ги и Гленкор.
Рударството од мал обем обезбеди 10% до 25% од производството на ДРК.[53] Околу 100.000 рудари на кобалт во Конго користат рачни алатки за да копаат, со мало планирање и помалку безбедносни мерки, велат работниците и владините и невладини претставници, како и набљудувањата на Вашингтон Пост за посети на изолирани рудници. Недостатокот на безбедносни мерки често предизвикува повреди или смрт.[54] Рударството ја загадува околината и ги изложува околните животни и растенија и домородните заедници на токсични метали кои предизвикуваат вродени недостатоци и потешкотии во дишењето, според здравствените работници.[55]
Активистите за човековите права тврдат, а истражувачкото новинарство објави потврда[56][57] дека детскиот труд се користи во рударството на кобалт во африканското рударство од мал обем.[53][58] Ова откритие го поттикна производителот на мобилни телефони Ејпл, на 3 март 2017 година да престане да купува руда од снабдувачите како што е Жеџијанг Хујау Кобалт, чии извори од мали рудници се во ДРК и почнале да користат само добавувачи кои се верифицирани да ги исполнат работните стандарди.[59][60]
Политичката и етничката динамика на регионот во минатото предизвика насилства и вооружени конфликти, како и мигрирање на населението. Оваа нестабилност влијаеше на цената на кобалтот и исто така ги поттикна борбените лица од Првата и Втората граѓанска војна за продолжување на борбите, со оглед на тоа што пристапот до рудници за дијаманти и други вредни ресурси помогна во финансирањето на нивните воени цели, кои честопати се обвинуваат за геноцид, и исто така ги збогати борците. Додека Конго во 2010-тите беше нападнат од соседните држави, некои од најбогатите минерални наоѓалишта се поврзуваат со области каде што Тутси и Хуту сè уште често се судруваат, продолжуваат немирите, иако во помал обем.[61]
Кобалтот извлечен од рудници од мал обем во Конго, во 2007 година овозможи да дојде една кинеска компанија, Конго ДонгФанг интернационално рударство. Еден од најголемите производители на кобалт во светот, Конго ДонгФанг испорача кобалт кај некои од најголемите светски производители на батерии. Така, корпоративните договори за етичкиот синџир на снабдување беа исполнети со недоверба. Голем број набљудувачи ги повикаа техничките корпорации и другите производители да ги избегнат конфликтите за изворите на метали во Централна Африка, наместо да ризикуваат да постигнат финансиска експлоатација, злоупотреба на човековите права како киднапирања за присилна работа, еколошки опустошувања и човечки жртви на насилство, сиромаштија и токсични состојби.
Проектот за планината Мукондо, управуван од Централноафриканското претпријатие за рударство и истражување (ЦАПРИ) во покраината Катанга, е можеби најбогат резерват на кобалт во светот. Нивното производство е проценето на една третина од вкупното светско производство на кобалт во 2008 година.[62] Во јули 2009 година, ЦАПРИ објави долгорочен договор за испорака на целокупното годишно производство на кобалт од планината Мукондо до Жеџијанг Галико Кобалт и Никел Материјали на Кина.[63]
Во февруари 2018 година, глобалната компанија за управување со средства АлиансБернштејн го дефинира ДРК како економски "Саудиска Арабија од електрична возраст на возилото", поради своите кобалтни ресурси, како суштинско значење за литиум-јонските батерии што пренесуваат електрични возила.[64]
На 9 март 2018 година, претседателот Џозеф Кабила го ажурира кодот за рударство за 2002 година, со зголемување на надоместокот за кралско семејство и прогласување на кобалтот и колтанот за "стратешки метали".[65][66]
Канада[уреди | уреди извор]
Во 2017 година, некои истражувачки компании планирале да ги истражат старите сребрени и кобалтни рудници во областа Кобалт, Онтарио, каде што се верува дека има значителни депозити.[67] Градоначалникот на Кобалт изјави дека жителите на Кобалт ги одобриле новите рударски напори и истакнаа дека локалната работна сила е мирна и зборува англиски, а добрата инфраструктура многу полесно ќе овозможи извори на резервни делови за опремата или другите набавки отколку што требаше да бидат пронајдени во конфликт-зони.
Апликации[уреди | уреди извор]
Кобалтот се користи во производството на легури со високи перформанси.[46][47] Тој исто така може да се користи за правење на акумулатори, а откривањето на електричните возила и нивниот успех со потрошувачите веројатно има голема врска со зголеменото производство на ДР Конго. Други важни фактори беа Кодексот за рударство од 2002 година, кој ги охрабри инвестициите на странски и транснационални корпорации како што се Гленкор и крајот на Првата и Втората војна во Конго.
Легури[уреди | уреди извор]
Суперлегури засновани на кобалт историски го претставуваат најголемиот дел од произведениот кобалт. Температурната стабилност на овие легури ги прави погодни за турбинските сечила за гасни турбини и авионски млазни мотори, иако монокристалните легури засновани на никел ги надминуваат нив во перформансите.[68] Легурите засновани на кобалт исто така се корозивни и отпорни на абење, што ги прави, како титаниумот, корисни за правење ортопедски импланти кои престануваат со абење со текот на времето. Развојот на алуминиумски кобалтни легури отпорен на абење започна во првата деценија на 20 век со стелински легури, кои содржат хром со различни количества на волфрам и јаглерод. Легурите со хром и волфрам карбиди се многу тврди и отпорни на абење.[69] Специјални кобалт-хром-молибден легури како виталиум се користат за протетски делови (замена на колк и колено).[70] Кобалтните легури исто така се користат за забна протеза како корисна замена за никел, кој може да биде алергентен.[71] Некои брзорезни челици, исто така, содржат кобалт за зголемена топлина и отпорност на абење. Специјални легури на алуминиум, никел, кобалт и железо, познати како алнико, и на самариум и кобалт (магнет од самариум-кобалт) се користат во постојани магнети.[72] Исто така е легиран со 95% платина за накит, со што се добива легура погодна за фино лиење, што исто така е малку магнетно.[73]
Батерии[уреди | уреди извор]
Литиум кобалт оксид (LiCoO2) е многу користен во литиум-јонските батерии. Материјалот е составен од слоеви на кобалт оксид со литиум интеркалација. За време на празнењето, литиумот се ослободува како литиумски јони.[74] Никел-кадмиум[75] (NiCd) и никел метал хидрид[76] (NiMH) батерии, исто така вклучуваат кобалт за подобрување на оксидацијата на никел во батеријата. Истражувањето на пазарот за транспарентност го проценува глобалниот пазар на литиум-јонски батерии на 30 000 000 000$ во 2015 година и предвидува зголемување преку 75.000.000.000$ до 2024 година.[77]
Иако во 2018 година најмногу кобалт во батериите се користеше кај мобилните уреди,[78] понов уред за кобалт се батерии за полнење на електрични автомобили. Оваа индустрија се зголеми пет пати во побарувачката за кобалт, што го прави итно да се најдат нови суровини во постабилни области на светот.[79] Побарувачката се очекува да продолжи или да се зголеми со зголемувањето на распространетоста на електричните возила.[80] Истражувањето во 2016-2017 година, ја вклучуваше површина околу Кобалт, Онтарио, област каде што многу сребрени рудници престанаа да функционираат пред неколку децении.[79]
Бидејќи децата и робовите постојано се пријавувале во рударството со кобалт, пред сè во рудниците од мал обем на ДР Конго, технолошките компании кои бараат етички синџир на набавка се соочиле со недостаток на оваа суровина[81] и цената на кобалтoт достигна висока цена во октомври 2017, повеќе од 30$ за килограм, наспроти 10$ на крајот од 2015 година.[82]
Катализатори[уреди | уреди извор]
Неколку кобалтни соединенија се оксидациски катализатори. Кобалтниот ацетат се користи за претворање на ксилен во терефтална киселина, претходник на најголемиот дел од полиетилен терефталат. Типични катализатори се кобалт карбоксилатите (познати како кобалтни сапуни). Тие исто така се користат во бои, лакови и мастила како "средства за сушење" преку оксидација на масла за сушење.[74] Истите карбоксилати се користат за подобрување на адхезијата помеѓу челикот и гумата во челични радијални гуми. Покрај тоа, тие се користат како акцелератори во полиестерна смола.
Катализаторите засновани на кобалт се користат во реакции кои вклучуваат јаглерод моноксид. Кобалтот е, исто така, катализатор во процесот Фишер-Тропшовиот процес за хидрогенација на јаглерод моноксид во течни горива.[83] Хидроформилација на алкени често користи кобалт октакарбонилот како катализатор,[84] иако често се заменува со поефикасни катализатори засновани на иридиум и родиум, на пр. Катива процесот.
Хидродесулфуризацијата на нафтата користи катализатор добиен од кобалт и молибден. Овој процес помага да се исчисти нафтата од нечистотии од сулфур што го попречуваат рафинирањето на течните горива.[74]
Пигменти и бои[уреди | уреди извор]


Пред 19 век, кобалтот главно се користел како пигмент. Се користи од средниот век за да се направи смалт, сино стакло. Смалт се произведува со топење на мешавина од печени минерален смалтит, кварц и калиум карбонат, што дава темносино силикатно стакло, кое е фино мелено по производството.[85] Смалт широко се користеше за обојување на стакло и како пигмент за слики.[86] Во 1780 година, Свен Ринман открил кобалт зелен, а во 1802 Луј Жак Тенар открил кобалт син.[87] Кобалт-пигменти како што се кобалт син (кобалтен алуминат), церулеан син (кобалт (II) станат), разни нијанси на кобалт зелен (мешавина од кобалт (II) оксид и цинк оксид) и кобалт виолетов (кобалтен фосфат) се користат како уметнички пигменти поради нивната супериорна хроматска стабилност.[88][89] Ауреолин (кобалт жолт) сега е во голема мера заменет со поголема светлина жолти пигменти.
Радиоизотопи[уреди | уреди извор]
Кобалт-60 (Co-60 или 60Co) е корисен како извор на гама-зраци, бидејќи тие можат да бидат произведени во предвидлива количина и висока активност со бомбардирање на кобалт со неутрони. Произведува гама-зраци со енергија од 1,17 и 1,33 MeV.[23][90]
Кобалтот се користи за телерадиотерапија, за стерилизација на медицински потрошен материјал и медицински отпад, за третман на зрачење на храна за стерилизација (ладна пастеризација),[91] индустриска радиографија (на пример, радиографија за интегритет на заварување), мерење на густина (на пример мерење на густината на бетон) и резервоарите за пополнување на висина на резервоарот. Металот има несреќно својство за производство на прашина, предизвикувајќи проблеми со заштита од зрачење. Кобалтот од машините за радиотерапија е сериозна опасност кога не се исфрла правилно, а една од најлошите несреќи за загадување од зрачење во Северна Америка се случила во 1984 година, кога отфрлената единица за радиотерапија која содржи кобалт-60 била погрешно разложена во складиште со отпад во Хуарез, Мексико.[92][93]
Кобалт-60 има радиоактивен период на полуураспад од 5,27 години. Загубата на потенцијата бара периодична замена на изворот во радиотерапијата и е една од причините зошто машините за кобалт во голема мера се заменети со линеарни акцелератори во современата радиотерапија.[94] Кобалт-57 (Co-57 или 57Co) е најчесто користен кобалт радиоизотоп во медицинските тестови, како радиотрасер за навлегување на витамин Б12, и за Шилингов тест. Кобалт-57 се користи како извор во Месбауеровата спектроскопија и е еден од неколкуте можни извори во уредите за флуоресценција со рендгенски зраци.[95][96]
Дизајнерите за јадрено оружје можеа намерно да инкорпорираат 59Co, од кои некои би се активирале во јадрена експлозија за да се произведе 60Co. 60Co, дисперзиран како јадрена последица, понекогаш се нарекува кобалтна бомба.[97]
Други употреби[уреди | уреди извор]
- Кобалтот се користи во електроплатирање поради неговиот привлечен изглед, цврстина и отпорност на оксидација;[98]
- Исто така се користи како основен премаз за порцелански емајли.[99]
Биолошка улога[уреди | уреди извор]


Кобалт е од суштинско значење за метаболизмот на сите животни. Тој е клучна состојка на кобаламин, исто така познат како витамин Б12, примарен биолошки резервоар на кобалт како ултратрасен елемент.[100][101] Бактериите во стомаците на животните преживари ги претвораат кобалтните соли во витамин Б12, соединение кое може да се произведува само од бактерии или археи. Затоа минималното присуство на кобалт во почвите значително го подобрува здравјето на тревојадите животни, а се препорачува земање од 0,20 mg/kg на ден, бидејќи тие немаат друг извор на витамин Б12.[102]
Во раниот 20 век, за време на развојот на земјоделството на Северено Исландското Вулканско Плато на Нов Зеланд, добитокот страдаше од "грмушка болест". Беше откриено дека вулканските почви немаат соли на кобалт кои се од суштинско значење за синџирот на исхрана.[103][104]
"Бреговата болест" на овците во пустината Деведесет Милји на југоисточниот дел на Јужна Австралија во 1930-тите беше пронајдено дека потекнува од хранливи недостатоци на елементите кобалт и бакар. Дефицитот на кобалт беше надминат со развојот на "кобалт куршуми", густи топчиња од кобалт оксид се мешаат со глина внесена орално за сместување во предниот желудникот на животното.[105][104]
Белковини засновани на кобалинот користат корин за одржување на кобалтот. Коензимот Б12 има реактивна С-Со врска која учествува во реакциите.[106] Кај луѓето, Б12 има два вида алкилен лиганд: метил и аденозил. MeB12 ги промовира метил (-CH3) групите. Аденозилната верзија на Б12 ги катализира преуредувањата во кои атомот на водород е директно префрлен помеѓу два соседни атоми со истовремена размена на вториот супституент X, кој може да биде јаглероден атом со супституенти, кислороден атом на алкохол или амин. Метилмалонил коензим А мутаза (MUT) го претвора MMl-CoA во Su-CoA, важен чекор во екстракција на енергија од белковини и масти.[107]
Иако далеку поретки од другите металобелковини (на пример, оние од цинк и железо), познати се и други кобалтобелковини покрај Б12. Овие белковини го вклучуваат метионин аминопептидаза 2, ензим кој се јавува кај луѓето и другите цицачи кои не го користат коринчкиот прстен на Б12, но директно го врзуваат кобалтот. Друг некорин кобалтен ензим е нитрил хидратаза, ензим во бактериите кои ги метаболизира нитрилите.[108]
Мерки на претпазливост[уреди | уреди извор]
| Опасност | |
|---|---|
| GHS-ознаки: | |
Пиктограми
|

|
Сигнални зборови
|
Опасност |
Изјави за опасност
|
H317, H334, H413 |
Изјави за претпазливост
|
P261, P280, P342+P311[109] |
| NFPA 704 | |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Дополнителни податоци Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) Наводи
Кобалтот е основен елемент за живот. Се проценува дека LD50 вредноста за растворливи соли на кобалт е помеѓу 150 и 500 mg/kg.[110] Во САД, Администрацијата за безбедност и здравје при работа (OSHA) назначи дозволена граница на изложеност (ДГИ) на работното место како временски просек (ВП) од 0,1 mg/м3. Националниот институт за безбедност и здравје при работа (NIOSH) постави препорачана граница на изложеност (ПГИ) од 0,05 mg/м3 просечно време. Вредноста на ВОЖЗ (веднаш опасен за живот и здравје) е 20 mg/м3.[111]
Сепак, хроничното внесување на кобалт предизвика сериозни здравствени проблеми при дози кои се далеку помали од смртоносната доза. Во 1966 година, додавањето на кобалтните соединенија за стабилизирање на пивната пена во Канада довело до специфична форма на кардиомиопатија, индуцирана од токсини, која била позната како кардиомиопатија на пијаници.[112][113]
Тоа предизвикува респираторни проблеми при вдишување.[114] Исто така, предизвикува проблеми со кожата кога се допираат; по никел и хром, кобалтот е главна причина за контактен дерматитис.[115] Со овие ризици се соочуваат рудари на кобалт.
Кобалтот може ефикасно да се апсорбира од коските на изгорените свињи; сепак, овој процес е инхибиран од бакар и цинк, кои имаат поголеми афинитети за поврзување со коските.[116]
Поврзано[уреди | уреди извор]
- Рударска индустрија на Демократска Република Конго
- Колтан
- Конфликтна суровина
- Економија на Демократска Република Конго
Дополнителна литература[уреди | уреди извор]
- Harper, E. M.; Kavlak, G.; Graedel, T. E. (2012). „Tracking the metal of the goblins: Cobalt's cycle of use“. Environmental Science & Technology. 46 (2): 1079–86. doi:10.1021/es201874e. PMID 22142288.
- Narendrula, R.; Nkongolo, K. K.; Beckett, P. (2012). „Comparative soil metal analyses in Sudbury (Ontario, Canada) and Lubumbashi (Katanga, DR-Congo)“. Bulletin of Environmental Contamination and Toxicology. 88 (2): 187–92. doi:10.1007/s00128-011-0485-7. PMID 22139330.
- Pauwels, H.; Pettenati, M.; Greffié, C. (2010). „The combined effect of abandoned mines and agriculture on groundwater chemistry“. Journal of Contaminant Hydrology. 115 (1–4): 64–78. doi:10.1016/j.jconhyd.2010.04.003. PMID 20466452.
- Bulut, G. (2006). „Recovery of copper and cobalt from ancient slag“. Waste Management & Research : The Journal of the International Solid Wastes and Public Cleansing Association, Iswa. 24 (2): 118–24. doi:10.1177/0734242X06063350. PMID 16634226.
- Jefferson, J. A.; Escudero, E.; Hurtado, M. E.; Pando, J.; Tapia, R.; Swenson, E. R.; Prchal, J.; Schreiner, G. F.; Schoene, R. B.; Hurtado, A.; Johnson, R. J. (2002). „Excessive erythrocytosis, chronic mountain sickness, and serum cobalt levels“. Lancet. 359 (9304): 407–8. PMID 11844517.
- Løvold, T. V.; Haugsbø, L. (1999). „Cobalt mining factory--diagnoses 1822-32“. Tidsskrift for den Norske Laegeforening : Tidsskrift for Praktisk Medicin, NY Raekke. 119 (30): 4544–6. PMID 10827501.
- Bird, G. A.; Hesslein, R. H.; Mills, K. H.; Schwartz, W. J.; Turner, M. A. (1998). „Bioaccumulation of radionuclides in fertilized Canadian Shield lake basins“. The Science of the Total Environment. 218 (1): 67–83. PMID 9718743.
- Nemery, B. (1990). „Metal toxicity and the respiratory tract“. The European Respiratory Journal. 3 (2): 202–19. PMID 2178966.
- Kazantzis, G. (1981). „Role of cobalt, iron, lead, manganese, mercury, platinum, selenium, and titanium in carcinogenesis“. Environmental Health Perspectives. 40: 143–61. doi:10.1289/ehp.8140143. PMC 1568837. PMID 7023929.
- Kerfoot, E. J.; Fredrick, W. G.; Domeier, E. (1975). „Cobalt metal inhalation studies on miniature swine“. American Industrial Hygiene Association Journal. 36 (1): 17–25. doi:10.1080/0002889758507202. PMID 1111264.
Наводи[уреди | уреди извор]
- ↑ Standard Atomic Weights 2013. Commission on Isotopic Abundances and Atomic Weights]]
- ↑ 2,0 2,1 2,2 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. изд.). Butterworth-Heinemann. стр. 1117–1119. ISBN 0080379419.
- ↑ Danielle Bochove (November 1, 2017). „Electric car future spurs Cobalt rush: Swelling demand for product breathes new life into small Ontario town“. Vancouver Sun. Bloomberg.
- ↑ Enghag, Per (2004). Encyclopedia of the elements: technical data, history, processing, applications. Cobalt. стр. 667. ISBN 978-3-527-30666-4.
- ↑ Murthy, V. S. R (2003). Structure And Properties Of Engineering Materials. Magnetic Properties of Materials. стр. 381. ISBN 978-0-07-048287-6.
- ↑ Celozzi, Salvatore; Araneo, Rodolfo; Lovat, Giampiero (2008-05-01). Electromagnetic Shielding. стр. 27. ISBN 978-0-470-05536-6.
- ↑ Lee, B.; Alsenz, R.; Ignatiev, A.; Van Hove, M.; Van Hove, M. A. (1978). „Surface structures of the two allotropic phases of cobalt“. Physical Review B. 17 (4): 1510–1520. Bibcode:1978PhRvB..17.1510L. doi:10.1103/PhysRevB.17.1510.
- ↑ „Properties and Facts for Cobalt“. American Elements. Посетено на 2008-09-19.
- ↑ Cobalt, Centre d'Information du Cobalt, Brussels (1966). Cobalt. стр. 45.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ 10,0 10,1 10,2 10,3 10,4 Holleman, A. F.; Wiberg, E.; Wiberg, N. (2007). Lehrbuch der Anorganischen Chemie. Cobalt (германски) (102nd. изд.). de Gruyter. стр. 1146–1152. ISBN 978-3-11-017770-1.
- ↑ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3rd. изд.). Prentice Hall. стр. 722. ISBN 978-0131755536.
- ↑ Rutley, Frank (2012-12-06). Rutley’s Elements of Mineralogy (англиски). Springer Science & Business Media. стр. 40. ISBN 9789401197694.
- ↑ Krebs, Robert E. (2006). The history and use of our earth's chemical elements: a reference guide (2. изд.). Greenwood Publishing Group. стр. 107. ISBN 0-313-33438-2.
- ↑ Petitto, Sarah C.; Marsh, Erin M.; Carson, Gregory A.; Langell, Marjorie A. (2008). „Cobalt oxide surface chemistry: The interaction of CoO(100), Co3O4(110) and Co3O4(111) with oxygen and water“. Journal of Molecular Catalysis A: Chemical. 281: 49–58. doi:10.1016/j.molcata.2007.08.023.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. изд.). Butterworth-Heinemann. стр. 1119–1120. ISBN 0080379419.
- ↑ Werner, A. (1912). „Zur Kenntnis des asymmetrischen Kobaltatoms. V“. Chemische Berichte. 45: 121–130. doi:10.1002/cber.19120450116.
- ↑ Gispert, Joan Ribas (2008). Coordination chemistry. Early Theories of Coordination Chemistry. стр. 31–33. ISBN 978-3-527-31802-5. Архивирано од изворникот на 2016-05-05. Посетено на 2019-03-29.
- ↑ James E. House (2008). Inorganic chemistry. Academic Press. стр. 767–. ISBN 978-0-12-356786-4. Посетено на 2011-05-16.
- ↑ Charles M. Starks; Charles Leonard Liotta; Marc Halpern (1994). Phase-transfer catalysis: fundamentals, applications, and industrial perspectives. Springer. стр. 600–. ISBN 978-0-412-04071-9. Посетено на 2011-05-16.
- ↑ Sigel, Astrid; Sigel, Helmut; Sigel, Roland, уред. (2010). Organometallics in Environment and Toxicology (Metal Ions in Life Sciences). Cambridge, UK: Royal Society of Chemistry Publishing. стр. 75. ISBN 978-1-84755-177-1.
- ↑ Byrne, Erin K.; Richeson, Darrin S.; Theopold, Klaus H. (1986-01-01). „Tetrakis(1-norbornyl)cobalt, a low spin tetrahedral complex of a first row transition metal“. Journal of the Chemical Society, Chemical Communications (англиски). 0 (19): 1491. doi:10.1039/C39860001491. ISSN 0022-4936.
- ↑ Byrne, Erin K.; Theopold, Klaus H. (1987-02-01). „Redox chemistry of tetrakis(1-norbornyl)cobalt. Synthesis and characterization of a cobalt(V) alkyl and self-exchange rate of a Co(III)/Co(IV) couple“. Journal of the American Chemical Society. 109 (4): 1282–1283. doi:10.1021/ja00238a066. ISSN 0002-7863.
- ↑ 23,0 23,1 23,2 Audi, G.; Bersillon, O.; Blachot, J.; Wapstra, A. H. (2003). „The NUBASE Evaluation of Nuclear and Decay Properties“. Nuclear Physics A. Atomic Mass Data Center. 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- ↑ Cobalt, Encyclopædia Britannica Online.
- ↑ Pulak, Cemal (1998). „The Uluburun shipwreck: an overview“. International Journal of Nautical Archaeology. 27 (3): 188–224. doi:10.1111/j.1095-9270.1998.tb00803.x.
- ↑ Henderson, Julian (2000). The Science and Archaeology of Materials: An Investigation of Inorganic Materials. Glass. Routledge. стр. 60. ISBN 978-0-415-19933-9.
- ↑ Lucas, A. (2003). Ancient Egyptian Materials and Industries. Kessinger Publishing. стр. 217. ISBN 978-0-7661-5141-3.[мртва врска]
- ↑ 28,0 28,1 Dennis, W. H (2010). Metallurgy: 1863–1963. Cobalt. стр. 254–256. ISBN 978-0-202-36361-5.
- ↑ Georg Brandt first showed cobalt to be a new metal in: G. Brandt (1735) "Dissertatio de semimetallis" (Dissertation on semi-metals), Acta Literaria et Scientiarum Sveciae (Journal of Swedish literature and sciences), vol. 4, pages 1–10.
See also: (1) G. Brandt (1746) "Rön och anmärkningar angäende en synnerlig färg—cobolt" (Observations and remarks concerning an extraordinary pigment—cobalt), Kongliga Svenska vetenskapsakademiens handlingar (Transactions of the Royal Swedish Academy of Science), vol. 7, pp. 119–130; (2) G. Brandt (1748) "Cobalti nova species examinata et descripta" (Cobalt, a new element examined and described), Acta Regiae Societatis Scientiarum Upsaliensis (Journal of the Royal Scientific Society of Uppsala), 1st series, vol. 3, pp. 33–41; (3) James L. Marshall and Virginia R. Marshall (Spring 2003) "Rediscovery of the Elements: Riddarhyttan, Sweden". The Hexagon (official journal of the Alpha Chi Sigma fraternity of chemists), vol. 94, no. 1, pages 3–8. - ↑ Wang, Shijie (2006). „Cobalt—Its recovery, recycling, and application“. Journal of the Minerals, Metals and Materials Society. 58 (10): 47–50. Bibcode:2006JOM....58j..47W. doi:10.1007/s11837-006-0201-y.
- ↑ Weeks, Mary Elvira (1932). „The discovery of the elements. III. Some eighteenth-century metals“. Journal of Chemical Education. 9: 22. Bibcode:1932JChEd...9...22W. doi:10.1021/ed009p22.
- ↑ Ramberg, Ivar B. (2008). The making of a land: geology of Norway. Geological Society. стр. 98–. ISBN 978-82-92394-42-7. Посетено на 2011-04-30.
- ↑ Cyclopaedia (1852). C. Tomlinson. 9 divs (уред.). Cyclopædia of useful arts & manufactures. стр. 400–. Посетено на 2011-04-30.
- ↑ 34,0 34,1 Wellmer, Friedrich-Wilhelm; Becker-Platen, Jens Dieter. „Global Nonfuel Mineral Resources and Sustainability“. United States Geological Survey.
- ↑ 35,0 35,1 Westing, Arthur H; Stockholm International Peace Research Institute (1986). Global resources and international conflict: environmental factors in strategic policy and action. cobalt. стр. 75–78. ISBN 978-0-19-829104-6.
- ↑ Livingood, J.; Seaborg, Glenn T. (1938). „Long-Lived Radio Cobalt Isotopes“. Physical Review. 53 (10): 847–848. Bibcode:1938PhRv...53..847L. doi:10.1103/PhysRev.53.847.
- ↑ Wróblewski, A. K. (2008). „The Downfall of Parity – the Revolution That Happened Fifty Years Ago“ (PDF). Acta Physica Polonica B. 39 (2): 251. Bibcode:2008AcPPB..39..251W.
- ↑ "Richest Hole In The Mountain" Popular Mechanics, May 1952, pp. 65–69.
- ↑ Ptitsyn, D. A.; Chechetkin, V. M. (1980). „Creation of the Iron-Group Elements in a Supernova Explosion“. Soviet Astronomy Letters. 6: 61–64. Bibcode:1980SvAL....6...61P.
- ↑ Nuccio, Pasquale Mario and Valenza, Mariano (1979). „Determination of metallic iron, nickel and cobalt in meteorites“ (PDF). Rendiconti Societa Italiana di Mineralogia e Petrografia. 35 (1): 355–360.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ Kerr, Paul F. (1945). „Cattierite and Vaesite: New Co-Ni Minerals from the Belgian Kongo“ (PDF). American Mineralogist. 30: 483–492.
- ↑ Kerr, Paul F. (1945). „Cattierite and Vaesite: New Co-Ni Minerals from the Belgian Kongo“ (PDF). American Mineralogist. 30: 483–492.
- ↑ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). „Hazardous Compounds in Tobacco Smok“. International Journal of Environmental Research and Public Health. 8 (12): 613–628. doi:10.3390/ijerph8020613. ISSN 1660-4601. PMC 3084482. PMID 21556207.
- ↑ Pourkhabbaz, A; Pourkhabbaz, H (2012). „Investigation of Toxic Metals in the Tobacco of Different Iranian Cigarette Brands and Related Health Issues“. Iranian Journal of Basic Medical Sciences. 15 (1): 636–644. PMC 3586865. PMID 23493960.
- ↑ Cobalt Statistics and Information (PDF), U.S. Geological Survey, 2018
- ↑ 46,0 46,1 Shedd, Kim B. „Mineral Yearbook 2006: Cobalt“ (PDF). United States Geological Survey. Посетено на 2008-10-26.
- ↑ 47,0 47,1 Shedd, Kim B. „Commodity Report 2008: Cobalt“ (PDF). United States Geological Survey. Посетено на 2008-10-26.
- ↑ 48,0 48,1 Henry Sanderson (March 14, 2017). „Cobalt's meteoric rise at risk from Congo's Katanga“. Financial Times.
- ↑ Davis, Joseph R. (2000). ASM specialty handbook: nickel, cobalt, and their alloys. ASM International. стр. 347. ISBN 0-87170-685-7.
- ↑ „Cobalt“ (PDF). United States Geological Survey, Mineral Commodity Summaries. January 2016. стр. 52–53.
- ↑ Thomas Wilson (October 26, 2017). „We'll All Be Relying on Congo to Power Our Electric Cars“. Архивирано од изворникот на 2019-04-02. Посетено на 2019-04-02.CS1-одржување: бот: непознат статус на изворната URL (link)
- ↑ „African Mineral Production“ (PDF). British Geological Survey. Посетено на 2009-06-06.
- ↑ 53,0 53,1 Frankel, Todd C. (2016-09-30). „Cobalt mining for lithium ion batteries has a high human cost“. Washington Post. Посетено на 2016-10-18.
- ↑ Mucha, Lena; Sadof, Karly Domb; Frankel, Todd C. (2018-02-28). „Perspective - The hidden costs of cobalt mining“. Washington Post (англиски). ISSN 0190-8286. Посетено на 2018-03-07.
- ↑ Todd C. Frankel (September 30, 2016). „THE COBALT PIPELINE: Tracing the path from deadly hand-dug mines in Congo to consumers' phones and laptops“. Washington Post.
- ↑ Crawford, Alex. Meet Dorsen, 8, who mines cobalt to make your smartphone work. Sky News UK. Посетено на 2018-01-07.
- ↑ Are you holding a product of child labour right now? (Video). Sky News UK (2017-02-28). Посетено на 2018-01-07.
- ↑ Child labour behind smart phone and electric car batteries. Amnesty International (2016-01-19). Посетено на 2018-01-07.
- ↑ Reisinger, Don. (2017-03-03) Child Labor Revelation Prompts Apple to Make Supplier Policy Change. Fortune. Посетено на 2018-01-07.
- ↑ Frankel, Todd C. (2017-03-03) Apple cracks down further on cobalt supplier in Congo as child labor persists. The Washington Post. Посетено на 2018-01-07.
- ↑ Wellmer, Friedrich-Wilhelm; Becker-Platen, Jens Dieter. „Global Nonfuel Mineral Resources and Sustainability“. Посетено на 2009-05-16.
- ↑ „CAMEC – The Cobalt Champion“ (PDF). International Mining. July 2008. Посетено на 2011-11-18.
- ↑ Amy Witherden (6 July 2009). „Daily podcast – July 6, 2009“. Mining weekly. Архивирано од изворникот на 2012-01-18. Посетено на 2011-11-15.
- ↑ Mining Journal "The [Ivanhoe] pullback investors have been waiting for", Aspermont Ltd., London, UK, February 22, 2018. Retrieved November 21, 2018.
- ↑ Shabalala, Zandi "Cobalt to be declared a strategic mineral in Congo", Reuters, March 14, 2018. Retrieved October 3, 2018.]
- ↑ Reuters "Congo's Kabila signs into law new mining code", March 14, 2018. Retrieved October 3, 2018.]
- ↑ The Canadian Ghost Town That Tesla Is Bringing Back to Life. Bloomberg (2017-10-31). Посетено на 2018-01-07.
- ↑ Donachie, Matthew J. (2002). Superalloys: A Technical Guide. ASM International. ISBN 978-0-87170-749-9.
- ↑ Campbell, Flake C (2008-06-30). Elements of metallurgy and engineering alloys. Cobalt and Cobalt Alloys. стр. 557–558. ISBN 978-0-87170-867-0.
- ↑ Michel, R.; Nolte, M.; Reich M.; Löer, F. (1991). „Systemic effects of implanted prostheses made of cobalt-chromium alloys“. Archives of Orthopaedic and Trauma Surgery. 110 (2): 61–74. doi:10.1007/BF00393876. PMID 2015136.
- ↑ Disegi, John A. (1999). Cobalt-base Aloys for Biomedical Applications. ASTM International. стр. 34. ISBN 0-8031-2608-5.
- ↑ Luborsky, F. E.; Mendelsohn, L. I.; Paine, T. O. (1957). „Reproducing the Properties of Alnico Permanent Magnet Alloys with Elongated Single-Domain Cobalt-Iron Particles“. Journal of Applied Physics. 28 (344): 344. Bibcode:1957JAP....28..344L. doi:10.1063/1.1722744.
- ↑ Biggs, T.; Taylor, S. S.; Van Der Lingen, E. (2005). „The Hardening of Platinum Alloys for Potential Jewellery Application“. Platinum Metals Review. 49: 2–15. doi:10.1595/147106705X24409.
- ↑ 74,0 74,1 74,2 Hawkins, M. (2001). „Why we need cobalt“. Applied Earth Science: Transactions of the Institution of Mining & Metallurgy, Section B. 110 (2): 66–71. doi:10.1179/aes.2001.110.2.66.
- ↑ Armstrong, R. D.; Briggs, G. W. D.; Charles, E. A. (1988). „Some effects of the addition of cobalt to the nickel hydroxide electrode“. Journal of Applied Electrochemistry. 18 (2): 215–219. doi:10.1007/BF01009266.
- ↑ Zhang, P.; Yokoyama, Toshiro; Itabashi, Osamu; Wakui, Yoshito; Suzuki, Toshishige M.; Inoue, Katsutoshi (1999). „Recovery of metal values from spent nickel–metal hydride rechargeable batteries“. Journal of Power Sources. 77 (2): 116–122. Bibcode:1999JPS....77..116Z. doi:10.1016/S0378-7753(98)00182-7.
- ↑ Carmakers' electric dreams depend on supplies of rare minerals. The Guardian (2017-07-29). Посетено на 2018-01-07.
- ↑ Castellano, Robert (2017-10-13) How To Minimize Tesla's Cobalt Supply Chain Risk. Seeking Alpha.
- ↑ 79,0 79,1 As Cobalt Supply Tightens, LiCo Energy Metals Announces Two New Cobalt Mines. CleanTechnica (2017-11-28). Посетено на 2018-01-07.
- ↑ Shilling, Erik (2017-10-31) We May Not Have Enough Minerals To Even Meet Electric Car Demand. jalopnik.com
- ↑ Hermes, Jennifer. (2017-05-31) Tesla & GE Face Major Shortage Of Ethically Sourced Cobalt. Environmentalleader.com. Посетено на 2018-01-07.
- ↑ Electric cars yet to turn cobalt market into gold mine – Nornickel. MINING.com (2017-10-30). Посетено на 2018-01-07.
- ↑ Khodakov, Andrei Y.; Chu, Wei & Fongarland, Pascal (2007). „Advances in the Development of Novel Cobalt Fischer-Tropsch Catalysts for Synthesis of Long-Chain Hydrocarbons and Clean Fuels“. Chemical Reviews. 107 (5): 1692–1744. doi:10.1021/cr050972v. PMID 17488058.
- ↑ Hebrard, Frédéric & Kalck, Philippe (2009). „Cobalt-Catalyzed Hydroformylation of Alkenes: Generation and Recycling of the Carbonyl Species, and Catalytic Cycle“. Chemical Reviews. 109 (9): 4272–4282. doi:10.1021/cr8002533. PMID 19572688.
- ↑ Overman, Frederick (1852). A treatise on metallurgy. D. Appleton & company. стр. 631–637.
- ↑ Muhlethaler, Bruno; Thissen, Jean; Muhlethaler, Bruno (1969). „Smalt“. Studies in Conservation. 14 (2): 47–61. doi:10.2307/1505347. JSTOR 1505347.
- ↑ Gehlen, A. F. (1803). „Ueber die Bereitung einer blauen Farbe aus Kobalt, die eben so schön ist wie Ultramarin. Vom Bürger Thenard“. Neues allgemeines Journal der Chemie, Band 2. H. Frölich. (German translation from L. J. Thénard; Journal des Mines; Brumaire 12 1802; p 128–136)
- ↑ Witteveen, H. J.; Farnau, E. F. (1921). „Colors Developed by Cobalt Oxides“. Industrial & Engineering Chemistry. 13 (11): 1061–1066. doi:10.1021/ie50143a048.
- ↑ Venetskii, S. (1970). „The charge of the guns of peace“. Metallurgist. 14 (5): 334–336. doi:10.1007/BF00739447.
- ↑ Mandeville, C.; Fulbright, H. (1943). „The Energies of the γ-Rays from Sb122, Cd115, Ir192, Mn54, Zn65, and Co60“. Physical Review. 64 (9–10): 265–267. Bibcode:1943PhRv...64..265M. doi:10.1103/PhysRev.64.265.
- ↑ Wilkinson, V. M; Gould, G (1998). Food irradiation: a reference guide. стр. 53. ISBN 978-1-85573-359-6.
- ↑ Blakeslee, Sandra (1984-05-01). „The Juarez accident“. New York Times. Посетено на 2009-06-06.
- ↑ „Ciudad Juarez orphaned source dispersal, 1983“. Wm. Robert Johnston. 2005-11-23. Посетено на 2009-10-24.
- ↑ National Research Council (U.S.). Committee on Radiation Source Use and Replacement; National Research Council (U.S.). Nuclear and Radiation Studies Board (January 2008). Radiation source use and replacement: abbreviated version. National Academies Press. стр. 35–. ISBN 978-0-309-11014-3. Посетено на 2011-04-29.
- ↑ Meyer, Theresa (2001-11-30). Physical Therapist Examination Review. стр. 368. ISBN 978-1-55642-588-2.
- ↑ Kalnicky, D.; Singhvi, R. (2001). „Field portable XRF analysis of environmental samples“. Journal of Hazardous Materials. 83 (1–2): 93–122. doi:10.1016/S0304-3894(00)00330-7. PMID 11267748.
- ↑ Payne, L. R. (1977). „The Hazards of Cobalt“. Occupational Medicine. 27 (1): 20–25. doi:10.1093/occmed/27.1.20.
- ↑ Davis, Joseph R; Handbook Committee, ASM International (2000-05-01). Nickel, cobalt, and their alloys. Cobalt. стр. 354. ISBN 978-0-87170-685-0.
- ↑ Committee On Technological Alternatives For Cobalt Conservation, National Research Council (U.S.); National Materials Advisory Board, National Research Council (U.S.) (1983). Cobalt conservation through technological alternatives. Ground–Coat Frit. стр. 129.
- ↑ Yamada, Kazuhiro (2013). Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (уред.). Interrelations between Essential Metal Ions and Human Diseases. Chapter 9. Cobalt: Its Role in Health and Disease. Metal Ions in Life Sciences. 13. Springer. стр. 295–320. doi:10.1007/978-94-007-7500-8_9.
- ↑ Cracan, Valentin; Banerjee, Ruma (2013). Banci, Lucia (уред.). Metallomics and the Cell. Chapter 10 Cobalt and Corrinoid Transport and Biochemistry. Metal Ions in Life Sciences. 12. Springer. doi:10.1007/978-94-007-5561-10_10. ISBN 978-94-007-5560-4. electronic-book ISBN 978-94-007-5561-1 ISSN 1559-0836 electronic-ISSN 1868-0402 .
- ↑ Schwarz, F. J.; Kirchgessner, M.; Stangl, G. I. (2000). „Cobalt requirement of beef cattle – feed intake and growth at different levels of cobalt supply“. Journal of Animal Physiology and Animal Nutrition. 83 (3): 121–131. doi:10.1046/j.1439-0396.2000.00258.x.
- ↑ „Soils“. Waikato University. Архивирано од изворникот на 2012-01-25. Посетено на 2012-01-16.
- ↑ 104,0 104,1 McDowell, Lee Russell (2008). Vitamins in Animal and Human Nutrition (2. изд.). Hoboken: John Wiley & Sons. стр. 525. ISBN 9780470376683.
- ↑ Australian Academy of Science > Deceased Fellows > Hedley Ralph Marston 1900–1965 Accessed 12 May 2013.
- ↑ Voet, Judith G.; Voet, Donald (1995). Biochemistry. New York: J. Wiley & Sons. стр. 675. ISBN 0-471-58651-X. OCLC 31819701.
- ↑ Smith, David M.; Golding, Bernard T.; Radom, Leo (1999). „Understanding the Mechanism of B12-Dependent Methylmalonyl-CoA Mutase: Partial Proton Transfer in Action“. Journal of the American Chemical Society. 121 (40): 9388–9399. doi:10.1021/ja991649a.
- ↑ Kobayashi, Michihiko; Shimizu, Sakayu (1999). „Cobalt proteins“. European Journal of Biochemistry. 261 (1): 1–9. doi:10.1046/j.1432-1327.1999.00186.x. PMID 10103026.
- ↑ https://www.sigmaaldrich.com/catalog/product/aldrich/356891?lang=en®ion=US
- ↑ Donaldson, John D. and Beyersmann, Detmar (2005) "Cobalt and Cobalt Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. doi:10.1002/14356007.a07_281.pub2
- ↑ „Џебен водич за опасните хемиски материи #0146“. Национален институт за безбедност и здравје при работа (NIOSH). (англиски)
- ↑ Morin Y; Tětu A; Mercier G (1969). „Quebec beer-drinkers' cardiomyopathy: Clinical and hemodynamic aspects“. Annals of the New York Academy of Sciences. 156 (1): 566–576. Bibcode:1969NYASA.156..566M. doi:10.1111/j.1749-6632.1969.tb16751.x. PMID 5291148.
- ↑ Barceloux, Donald G. & Barceloux, Donald (1999). „Cobalt“. Clinical Toxicology. 37 (2): 201–216. doi:10.1081/CLT-100102420.
- ↑ Elbagir, Nima; van Heerden, Dominique; Mackintosh, Eliza (May 2018). „Dirty Energy“. CNN. Посетено на 30 May 2018.
- ↑ Basketter, David A.; Angelini, Gianni; Ingber, Arieh; Kern, Petra S.; Menné, Torkil (2003). „Nickel, chromium and cobalt in consumer products: revisiting safe levels in the new millennium“. Contact Dermatitis. 49 (1): 1–7. doi:10.1111/j.0105-1873.2003.00149.x. PMID 14641113.
- ↑ Xiangliang, Pan; Jianlong, Wang; Daoyong, Zhang (January 2009). „Sorption of cobalt to bone char: Kinetics, competitive sorption and mechanism“. Salination. 249 (2): 609–614. doi:10.1016/j.desal.2009.01.027.
Надворешни врски[уреди | уреди извор]
- Cobalt at The Periodic Table of Videos (University of Nottingham)
- Centers for Disease and Prevention – Cobalt
- The Cobalt Institute
- Responsible Cobalt Institute Архивирано на 7 март 2021 г.
| Периоден систем на елементите | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| I | H | He | |||||||||||||||||||||||||||||||
| II | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| III | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| IV | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| V | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| VI | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| VII | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||
|


