Амин (хемија)
Во хемијата, амините се органски соединенија кои во својата структура како хетероатом имаат азот. Всушност, амините се деривати на амонијакот во кој еден или повеќе водородни атоми се заменети со алкил или арил групи. Според тоа, општите формули на амините се RNH2, R2NH, R3N, каде R може да биде било кој алкил или арил радикал, т.е. група.
Во наједноставниот амин, метиламин (CH3NH2), еден водороден атом од амонијак се заменува со метил група. Во метиламинот и другите амини, атомот на азот има 5 валентни електрони во 4 sp3 хибридни атомски орбитали. Овие орбитали се насочени кон аглите на еден тетраедар. Три од овие орбитали се полупополнети; четвртата содржи пар на несврзани електрони што играат мошне важна улога во хемиските својства на амините.


Многу амини се физиолошки активни. Тие влијаат на мозокот, на ‘рбетниот мозок и на нервниот систем. Во овие соединенија спаѓаат и невротрансмитерите адреналин (епинефрин), серотонин и допамин. Адреналинот го стимулира претворањето на складираниот гликоген во гликоза. Серотонинот е хормон што предизвикува спиење, а недостатокот на серотонин е причина за некои форми на ментална депресија. Кога концентрацијата на допаминот е мала, настанува Паркинсоновата болест.
Хетероцикличните соединенија што содржат повеќе атоми на азот се потребни за пренесување на генетичките информации. ДНК и РНК содржат супституирани пиримидин и пурин прстени.
Белковините, една од најважните и најразновидните класи на биолошки соединенија, се изградени од молекули што содржат азот наречени α-аминокиселини. Аминофункционалната група на една α-аминокиселина реагира со карбоксилната група на друга α-аминокиселина и формира пептидна врска.
Структура и класификација на амините[уреди | уреди извор]
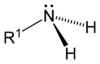
Како што алкохолите и етерите можат да се сметаат за органски деривати на водата, така и амините можат да се сметаат за органски деривати на амонијакот. Меѓутоа, тие не се класифицираат како алкохолите, туку според бројот на алкил (или арил) групите поврзани за атомот на азот:
| Примарен амин | Секундарен амин | Терциерен амин |
|---|---|---|
 |
 |
 |
Амините во кои еден атом на азот е дел од прстен се многу чести во природата. Соединенијата што имаат еден или повеќе други атоми освен јаглерод во прстенот се хетероциклични соединенија. На пример, пиролидин и пиперидин се пет и шестчлени хетероциклични соединенија што содржат азот.
| Пиперидин |
|---|
 |
Именување на амините[уреди | уреди извор]
Вообичаеното име на еден примарен амин се добива со именување на алкил групата поврзана со аминогрупата (-NH2) и со додавање на наставката -амин. Целото име се пишува како еден збор. Вообичаеното име за еден секундарен или терциерен амин се добива со наведување на алкил групите по азбучен редослед. Кога се присутни две или повеќе идентични алкил групи се користат претставките ди- и три-.
За да се даде вообичаено име на посложен примарен амин, аминогрупата се третира како супституент. Супституентот што содржи азот во сложени секундарни и терциерни амини се именува како N-алкиламино (-NHR) или N, N-диалкиламино (-NRR') група. Големата буква N покажува дека алкил групата е поврзана со атомот на азот, а не со основната низа. Најголемата или најкомплицираната група се користи како основна молекула.
| Пониските амини се именуваат со наставка -амин. |
Посложените амини ја имаат претставката амино како функционална група.
|
Физички својства[уреди | уреди извор]
Агрегатна состојба, точки на вриење[уреди | уреди извор]
Амините со мала молекулска маса при собна температура се гасови, но амините со поголема молекулска маса се течни или цврсти супстанци. Амините имаат точки на вриење што се повисоки од оние на алканите со слична молекулска маса, но пониски од оние на алкохолите.
Амините имаат повисоки точки на вриење од јаглеводородите со споредлива молекулска маса бидејќи врската C-N е пополарна од врската C-C. Исто така, примарните и секундарните амини можат да образуваат меѓумолекулски водородни врски бидејќи тие можат да служат и како дарители на водородни врски и како акцептори.
Терциерните амини немаат водородни атоми поврзани со атомот на азот и не можат да служат како дарители на водородна врска. Затоа, овие амини не можат да образуваат меѓумолекулски водородни врски. Како последица на тоа, тие имаат пониски температури (точки) на вриење од примарните и секундарните амини со споредлива молекулска маса.
Амините имаат пониски точки на вриење од алкохолите бидејќи азотот е помалку електронегативен од кислородот. Како резултат на тоа, врската N-H е понеполарна од врската O-H, а N-H...N водородната врска во амините е послаба од O-H...O водородната врска во алкохолите.
Растворливост[уреди | уреди извор]
Примарните и секундарните амини функционираат и како дарители и како акцептори на водородни врски, и тие лесно формираат водородни врски со водата. Амините со 5 или помалку јаглеродни атоми се растворливи во вода во сите односи. Дури терциерните амини се растворливи во вода бидејќи несврзувачкиот електронски пар на атомот на азот е акцептор на водородна врска од еден водороден атом на водата.
Растворливоста на амините се намалува со зголемување на молекулската маса бидејќи функционалната група е понезначителен дел од структурата.
Мирис[уреди | уреди извор]
Амините со ниска молекулска маса имаат јаки продорни мириси слични на амонијакот. Оние со повисока молекулска маса мирисаат на риба што се распаѓа. Две соединенија што се причина за мирисот на животинското ткиво што се распаѓа се наречени путресцин и кадаверин.
Хемиски својства[уреди | уреди извор]
- Амините се прилично слаби бази. Тие примаат протон од водата и формираат амониум јон и хидроксид јон. Рамнотежната константа за реакцијата на една база со вода е базно јонизирачка константа и се означува со Kb. Вредностите на Kb на алкил супституираните амини се помали од 10−3. Типичен пример е реакцијата на метиламинот со вода:
Арил супституираните амини се послаби бази од амонијакот бидејќи слободниот електронски пар на атомот на азот е резонантно делокализиран околу π орбиталниот систем на бензеновиот прстен. Како резултат на тоа, осамениот електронски пар на азот потешко се поврзува со протон.
- Поради присуството на слободниот електронски пар на азотниот атом, овие соединенија покажуваат особини на нуклеофилни супстанци. Тие учествуваат во неколку карактеристични реакции на нуклеофилна супституција при што даваат амиди на киселини и други деривати (како сулфонамиди), кои се важни соединенија како лекови.
- Во зависност од структурата на аминот, овие соединенија даваат различни производи при реакцијата со азотеста киселина:
Така, примарните алифатични амини со оваа киселина даваат диазониумови соли, кои се распаѓаат, при што се добива сложена смеса од различни органски производи.
| ||||||||||||||||||||||
|




![{\displaystyle {K_{b}}={[OH^{-}][CH_{3}NH_{3}^{+}] \over [CH_{3}NH_{2}]}={4,4\cdot 10^{-4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5f7fd84bcc1c0b230ea15b491e2a4450a707e25c)
