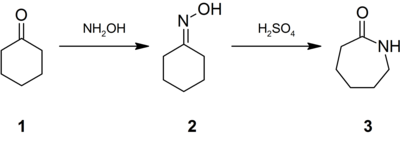Хидроксиламин
| |||

| |||
Други називи Азинозна киселина | |||
| Назнаки | |||
|---|---|---|---|
| 7803-49-8 | |||
| 3DMet | B01184 | ||
| ChEBI | CHEBI:15429 | ||
| ChEMBL | ChEMBL1191361 | ||
| ChemSpider | 766 | ||
| EC-број | 232-259-2 | ||
| 478 | |||
| |||
| 3Д-модел (Jmol) | Слика | ||
| KEGG | C00192 | ||
| MeSH | Hydroxylamine | ||
| PubChem | 787 | ||
| RTECS-бр. | NC2975000 | ||
| |||
| UNII | 2FP81O2L9Z | ||
| Својства | |||
| Хемиска формула | |||
| Моларна маса | 0 g mol−1 | ||
| Изглед | Живописни бели, непроѕирни кристали | ||
| Густина | 1.21 g cm−3 (at 20 °C)[2] | ||
| Точка на топење | |||
| Точка на вриење | |||
| log P | −0.758 | ||
| Киселост (pKa) | 6.03 ([NH 3OH]+ ) | ||
| Константа на базицитет (pKb) | 7.97 | ||
| Структура | |||
| Тригонална во N | |||
| Геометрија на молекулата | Тетраедар во N | ||
| Диполен момент | 0.67553 D | ||
| Термохемија | |||
| Ст. енталпија на образување ΔfH |
−39.9 kJ/mol | ||
| Стандардна моларна ентропија S |
236.18 J K−1 mol−1 | ||
| Специфичен топлински капацитет, C | 46.47 J K−1 mol−1 | ||
| Опасност | |||
| GHS-ознаки: | |||
Пиктограми
|
Предлошка:GHS01   
| ||
Сигнални зборови
|
Опасност | ||
Изјави за опасност
|
H200, H290, H302, H312, H315, H317, H318, H335, H351, H373, H400 | ||
Изјави за претпазливост
|
P201, P202, P234, P260, P261, P264, P270, P271, P272, P273, P280, P281, P301+P312, P302+P352, P304+P340, P305+P351+P338, P308+P313, P310, P312, P314, P321, P322, P330, P332+P313, P333+P313, P362, P363, P372, P373, P380, P390, P391, P401, P403+P233, P404, P405, P501 | ||
| NFPA 704 | |||
| Температура на запалување | 129 °C (264 °F; 402 K) | ||
| 265 °C (509 °F; 538 K) | |||
| Смртоносна доза или концентрација: | |||
LD50 (средна доза)
|
408 mg/kg (oral, mouse); 59–70 mg/kg (intraperitoneal mouse, rat); 29 mg/kg (subcutaneous, rat)[3] | ||
| Безбедносен лист | ICSC 0661 | ||
| Дополнителни податоци | |||
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |||
| Наводи | |||
Хидроксиламин (исто така познат како хидроксиамонија) — неорганско соединение со формулата NH
2OH. Материјалот е бело кристално, хигроскопно соединение.[4] Хидроксиламин речиси секогаш се обезбедува и се користи како воден раствор. Се троши речиси исклучиво за производство на најлон-6 и исто така е посредник во биолошката нитрификација. Оксидацијата на NH
3 до хидроксиламин е чекор во биолошката нитрификација.[5]
Историја
[уреди | уреди извор]Хидроксиламинот првпат бил подготвен како хидроксиламониум хлорид во 1865 година од германскиот хемичар Вилхелм Клеменс Лосен (1838-1906); тој реагирал калај и хлороводородна киселина во присуство на етил нитрат.[6] За прв пат бил подготвен во чиста форма во 1891 година од холандскиот хемичар Лобри де Брујн и од францускиот хемичар Леон Морис Крисмер (1858-1944).[7][8] Координативниот комплекс ZnCl
2(NH
2OH)
2, познат како Крисмерова сол, ослободува хидроксиламин при загревање.[9]
Производство
[уреди | уреди извор]Хидроксиламинот или неговите соли може да се произведуваат преку неколку начини, но само два се комерцијално одржливи. Исто така, се произведува природно како што било дискутирано во делот за биохемија.
Од азотен оксид
[уреди | уреди извор]NH
2OH главно се произведува како негов водород сулфат со хидрогенизација на азотен оксид преку платина катализатори во присуство на сулфурна киселина.
Рашигов процес
[уреди | уреди извор]Друг пат до NH
2OH е т.н. Рашигов процес: воден амониум нитрит се намалува за HSO−
3 и SO
2 на 0 °C за да се добие анјон на хидроксиламидо-N,N-дисулфонат:
- [NH
4]NO
2 + 2 SO
2 + NH
3 + H
2O → 2 [NH
4]+
+ N(OH)(SO
3)2−
2
Овој анјон потоа се хидролизира за да се добие хидроксиламониум сулфат [NH
3OH]
2SO
4:
- N(OH)(SO
3)2−
2 + H
2O → NH(OH)(SO
3)−
+ HSO−
4 - 2 NH(OH)(SO
3)−
+ 2 H
2O → [NH
3OH]
2SO
4 + SO2−
4
Цврст NH
2OH може да се собере со третман со течен амонијак. Амониум сулфат ,[NH
4]
2SO
4, спореден производ нерастворлив во течен амонијак, се отстранува со филтрација; течниот амонијак се испарува за да се добие саканиот производ.[4] Нето реакцијата е:
- 2 NO−
2 + 4 SO
2 + 6 H
2O + 6 NH
3 → 4 SO2−
4 + 6 [NH
4]+
+ 2 NH
2OH
Солите на хидроксиламониум потоа може да се претворат во хидроксиламин со неутрализација:
- [NH
3OH]Cl + NaOBu → NH
2OH + NaCl + BuOH[4]
Други методи
[уреди | уреди извор]Јулиус Тафел открил дека хидрохлоридните или сулфатните соли може да се произведат со електролитичка редукција на азотна киселина со HCl илиH
2SO
4 соодветно:[10][11]
- HNO
3 + 3 H
2 → NH
2OH + 2 H
2O
Хидроксиламинот може да се произведе и со редукција на азотна киселина или калиум нитрит со бисулфит:
- HNO
2 + 2 HSO−
3 → N(OH)(OSO
2)2−
2 + H
2O → NH(OH)(OSO
2)−
+ HSO−
4 - NH(OH)(OSO
2)−
+ [H
3O]+
→ [NH
3OH]+
+ HSO−
4 (100 °C, 1 h)
Реакции
[уреди | уреди извор]Хидроксиламинот реагира со електрофили, како што се алкилирачките агенси, кои можат да се прикачат или на атомите на кислород или на азот:
- R–X + NH
2OH → R–ONH
2 + HX - R–X + NH
2OH → R–NHOH + HX
Реакцијата наNH
2OH со алдехид или кетон произведува оксим.
- R
2C=O + NH
2OH · HCl → R
2C=NOH + NaCl + H
2O (in NaOH solution)
Оваа реакција е корисна за прочистување на кетони и алдехиди: ако хидроксиламин се додаде на алдехид или кетон во раствор, се формира оксим, кој генерално се таложи од растворот; загревањето на талогот со неорганска киселина потоа го обновува оригиналниот алдехид или кетон.[12]
Оксими како што е диметилглиоксим исто така се користат како лиганди.
NH
2OH реагира со хлоросулфонска киселина и дава хидроксиламин-О-сулфонска киселина, корисен реагенс за синтеза на капролактам.
- HOSO
2Cl + NH
2OH → NH
2OSO
2OH + HCl
Хидроксиламин -О -сулфонска киселина, која треба да се чува на 0 °C за да се спречи распаѓање, може да се провери со јодометриска титрација.
NH
2OH и N-органилхидроксиламини (R-NHOH), може да се редуцираат до амонијак NH
3 и амини R–NH
2, соодветно, каде што R е органил група.[13]
- NH
2OH (Zn, HCl) → NH
3 - R–NHOH (Zn, HCl) → R–NH
2
Хидроксиламин експлодира со топлина:
- 4 NH
2OH + O
2 → 2 N
2 + 6 H
2O
Високата реактивност делумно доаѓа од делумната изомеризација на NH
2OH до амонијак оксид (исто така познат како азан оксид), со цвитерјонска структураNH+
3–O−
.[14]
Функционална група
[уреди | уреди извор]
Познати се супституираните деривати на хидроксиламин. Ако хидроксил водородот е супституиран, тој се нарекува О -хидроксиламин, ако еден од аминските хидрогени е супституиран, тој се нарекува N -хидроксиламин. Во принцип, N -хидроксиламините се почести. Слично на обичните амини, може да се разликуваат примарни, секундарни и терциерни хидроксиламини, а последните две се однесуваат на соединенија каде што два или три водороди се супституирани, соодветно. Примери на соединенија кои содржат функционална група на хидроксиламин се N - tert -бутил-хидроксиламин или гликозидната врска во калихеамицин. <i id="mw7A">N</i>, <i id="mw7Q">O</i> -Диметилхидроксиламин е средство за спојување, кое се користи за синтеза на Вејнребни амиди.
- Синтеза
Најчестиот метод за синтеза на супституирани хидроксиламини е оксидација на амин со бензоил пероксид. Мора да се внимава да се спречи прекумерна оксидација до нитрон. Други методи вклучуваат:
- Хидрогенизација на оксим
- Алкилација на хидроксиламин
- Термичка деградација на амин оксидите преку реакцијата на Коп.
Употреба
[уреди | уреди извор]Приближно 95% од хидроксиламин се користи во синтезата на циклохексанон оксим, претходник на најлон 6. Третманот на овој оксим со киселина го индуцира Бекмановото преуредување за да даде капролактам ( 3 ).[15] Последново потоа може да претрпи полимеризација со отворање на прстенот за да се добие најлон 6.[16]
Лабораториски употреби
[уреди | уреди извор]Хидроксиламинот и неговите соли најчесто се користат како редуцирачки агенси во огромен број органски и неоргански реакции. Тие исто така можат да дејствуваат како антиоксиданти за масните киселини.
Високите концентрации на хидроксиламин се користат од страна на биолозите за воведување мутации со тоа што делува како ДНК- нуклеобаза амин-хидроксилирачки агенс.[17] Се смета дека во главно делува преку хидроксилација на цитидин во хидроксиаминоцитидин, кој погрешно се чита како тимидин, со што предизвикува транзиција C:G во T:A мутации.[18] Но, високите концентрации или прекумерната реакција на хидроксиламин ин витро се навидум способни да модифицираат други региони на ДНК и да доведат до други видови мутации.[18] Ова може да се должи на способноста на хидроксиламинот да се подложи на неконтролирана хемија на слободните радикали во присуство на метали во трагови и кислород, всушност во отсуство на неговите слободни радикали ефекти. Т: Ефект на транзиција и дури се смета дека хидроксиламинот е најспецифичниот познат мутаген.[19] Практично, тој е во голема мера надминат со помоќни мутагенси како што се EMS, ENU или нитрозогуанидин, но како многу мало мутагено соединение со висока специфичност, откри некои специјализирани употреби како што е мутација на ДНК спакувана во капсиди на бактериофаги,[20] и мутација на прочистена ДНК ин витро.[21]

Овој пат исто така вклучува Бекманово преуредување, како што е конверзија од циклохексанон во капролактам.
Алтернативна индустриска синтеза на парацетамол развиена од Hoechst – Celanese вклучува конверзија на кетон во кетоксим со хидроксиламин.
Некои нехемиски употреби вклучуваат отстранување на влакна од животински кожи и решенија за фотографирање.
Биохемија
[уреди | уреди извор]Во биолошката нитрификација, оксидацијата на NH
3 до хидроксиламин е посредуван од амонијак монооксигеназа (АМО). Хидроксиламин оксидоредуктаза (HAO) дополнително го оксидира хидроксиламинот до нитрит.[22]
Цитохром P460, ензим кој се наоѓа во бактеријата која оксидира амонијак Nitrosomonas europea, може да го претвори хидроксиламинот во азотен оксид, моќен стакленички гас.[23]
Хидроксиламинот може да се користи и за високо селективно расцепување на аспарагинил - глицин пептидните врски во пептидите и белковините.[24] Исто така, се врзува и трајно ги оневозможува (отрови) ензимите што содржат хемобелковина. Се користи како неповратен инхибитор на комплексот на фотосинтеза кој развива кислород поради неговата слична структура со водата.
Загриженост за безбедноста и животната средина
[уреди | уреди извор]Хидроксиламинот може да експлодира при загревање. Природата на опасноста од експлозив не е добро разбрана. Најмалку две фабрики кои се занимаваат со хидроксиламин се уништени од 1999 година со загуба на животи. Сепак, познато е дека солите на железо го забрзуваат распаѓањето на 50% NH
2OH.[25] Хидроксиламинот и неговите деривати се побезбедно ракувани во форма на соли.
Тоа е надразнување на респираторниот тракт, кожата, очите и другите мукозни мембрани. Може да се апсорбира преку кожата, е штетен доколку се проголта и е можен мутаген.[26]
Дополнителна литература
[уреди | уреди извор]- Хидроксиламин[мртва врска] [ трајна мртва врска ]
- Волтерс, Мајкл А. и Ендрју Б. Хоем. „Хидроксиламин“. е-Енциклопедија на реагенси за органска синтеза. 2001 година.
- Лабораторија за компјутерска хемија Schupf
- MW Rathke AA Millard "Борани во функционализација на олефини до амини: 3-пинамин" органски синтези, Кол. Vol. 6, стр. 943; Vol. 58, стр. 32. (подготовка на хидроксиламин-О-сулфонска киселина).
Наводи
[уреди | уреди извор]- ↑ „Front Matter“. Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. стр. 993. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ↑ Lide, David R., уред. (2006). CRC Handbook of Chemistry and Physics (87. изд.). Boca Raton, FL: CRC Press. ISBN 0-8493-0487-3.
- ↑ Martel, B.; Cassidy, K. (2004). Chemical Risk Analysis: A Practical Handbook. Butterworth–Heinemann. стр. 362. ISBN 978-1-903996-65-2.
- ↑ 4,0 4,1 4,2 Greenwood and Earnshaw.
- ↑ Lawton, Thomas J.; Ham, Jungwha; Sun, Tianlin; Rosenzweig, Amy C. (2014-09-01). „Structural conservation of the B subunit in the ammonia monooxygenase/particulate methane monooxygenase superfamily“. Proteins: Structure, Function, and Bioinformatics (англиски). 82 (9): 2263–2267. doi:10.1002/prot.24535. ISSN 1097-0134. PMC 4133332. PMID 24523098.
- ↑ W. C. Lossen (1865) "Ueber das Hydroxylamine" (On hydroxylamine), Zeitschrift für Chemie, 8 : 551-553.
- ↑ C. A. Lobry de Bruyn (1891) "Sur l'hydroxylamine libre" (On free hydroxylamine), Recueil des travaux chimiques des Pays-Bas, 10 : 100-112.
- ↑ L. Crismer (1891) "Préparation de l'hydroxylamine cristallisée" (Preparation of crystalized hydroxylamine), Bulletin de la Société chimique de Paris, series 3, 6 : 793-795.
- ↑ Walker, John E.; Howell, David M. (1967). „Dichlorobis(hydroxylamine)zinc(II) (Crismer's Salt)“. Inorganic Syntheses. Inorganic Syntheses. 9. стр. 2–3. doi:10.1002/9780470132401.ch2. ISBN 9780470132401.
- ↑ James Hale, Arthur (1919). The Manufacture of Chemicals by Electrolysis (1. изд.). New York: D. Van Nostrand Co. стр. 32. Посетено на 5 June 2014.
manufacture of chemicals by electrolysis hydroxylamine 32.
- ↑ Osswald, Philipp; Geisler, Walter (1941). Process of preparing hydroxylamine hydrochloride (US2242477) (PDF). U.S. Patent Office.
- ↑ Ralph Lloyd Shriner, Reynold C. Fuson, and Daniel Y. Curtin, The Systematic Identification of Organic Compounds: A Laboratory Manual, 5th ed.
- ↑ Smith, Michael and Jerry March.
- ↑ Kirby, AJ; Davies, JE; Fox, DJ; Hodgson, DR; Goeta, AE; Lima, MF; Priebe, JP; Santaballa, JA; Nome, F (28 February 2010). „Ammonia oxide makes up some 20% of an aqueous solution of hydroxylamine“. Chemical Communications. 46 (8): 1302–4. doi:10.1039/b923742a. PMID 20449284.
- ↑ Clayden, Jonathan; Greeves, Nick; Warren, Stuart (2012). Organic chemistry (2. изд.). Oxford University Press. стр. 958. ISBN 978-0-19-927029-3.
- ↑ Nuyken, Oskar; Pask, Stephen (25 April 2013). „Ring-Opening Polymerization—An Introductory Review“. Polymers. 5 (2): 361–403. doi:10.3390/polym5020361.
- ↑ Waugh, Robbie; Leader, David J.; McCallum, Nicola; Caldwell, David (2006). „Harvesting the potential of induced biological diversity“. Trends in Plant Science. Elsevier BV. 11 (2): 71–79. doi:10.1016/j.tplants.2005.12.007. ISSN 1360-1385. PMID 16406304.
- ↑ 18,0 18,1 Busby, Stephen; Irani, Meher; de Crombrugghe, Benoít (1982). „Isolation of mutant promoters in the Escherichia coli galactose operon using local mutagenesis on cloned DNA fragments“. Journal of Molecular Biology. Elsevier BV. 154 (2): 197–209. doi:10.1016/0022-2836(82)90060-2. ISSN 0022-2836. PMID 7042980.
- ↑ Hollaender, Alexander (1971). Chemical Mutagens : Principles and Methods for Their Detection Volume 1. Boston, MA: Springer US. стр. 41. ISBN 978-1-4615-8968-6. OCLC 851813793.
- ↑ Hong, J.-S.; Ames, B. N. (1971-12-01). „Localized Mutagenesis of Any Specific Small Region of the Bacterial Chromosome“. Proceedings of the National Academy of Sciences. 68 (12): 3158–3162. Bibcode:1971PNAS...68.3158H. doi:10.1073/pnas.68.12.3158. ISSN 0027-8424. PMC 389612. PMID 4943557.
- ↑ Forsberg, Susan. „Hydroxylamine Mutagenesis of plasmid DNA“. PombeNet. University of Southern California. Посетено на 9 December 2021.
- ↑ Arciero, David M.; Hooper, Alan B.; Cai, Mengli; Timkovich, Russell (1993-09-01). „Evidence for the structure of the active site heme P460 in hydroxylamine oxidoreductase of Nitrosomonas“. Biochemistry. 32 (36): 9370–9378. doi:10.1021/bi00087a016. ISSN 0006-2960. PMID 8369308.
- ↑ Caranto, Jonathan D.; Vilbert, Avery C.; Lancaster, Kyle M. (2016-12-20). „Nitrosomonas europaea cytochrome P460 is a direct link between nitrification and nitrous oxide emission“. Proceedings of the National Academy of Sciences (англиски). 113 (51): 14704–14709. Bibcode:2016PNAS..11314704C. doi:10.1073/pnas.1611051113. ISSN 0027-8424. PMC 5187719. PMID 27856762.
- ↑ Bornstein, Paul; Balian, Gary (1977). „Cleavage at Asn-Gly bonds with Hydroxylamine“. Methods in Enzymology. 47(Enzyme Struct., Part E): 132–45. doi:10.1016/0076-6879(77)47016-2. PMID 927171.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ Cisneros, L. O.; Rogers, W. J.; Mannan, M. S.; Li, X.; Koseki, H. (2003). „Effect of Iron Ion in the Thermal Decomposition of 50 mass% Hydroxylamine/Water Solutions“. J. Chem. Eng. Data. 48 (5): 1164–1169. doi:10.1021/je030121p.
- ↑ MSDS Sigma-Aldrich
Надворешни врски
[уреди | уреди извор]- Калориметриски студии за распаѓање на хидроксиламин
- Информации за хемиската компанија БАСФ
- MSDS
- Смртоносна детонација на хидроксиламин во објектот Concept Sciences
| ||||||||||||||||||||||
|