Амониум
| |||
| |||
Назив според МСЧПХ Амониум јон | |||
| Систематско име | Азаниум[1] | ||
| Назнаки | |||
|---|---|---|---|
| 14798-03-9 | |||
| ChEBI | CHEBI:28938 | ||
| ChemSpider | 218 | ||
| |||
| 3Д-модел (Jmol) | Слика | ||
| MeSH | D000644 | ||
| PubChem | 16741146 | ||
| |||
| UNII | 54S68520I4 | ||
| Својства | |||
| Хемиска формула | |||
| Моларна маса | 0 g mol−1 | ||
| Киселост (pKa) | 9.25 | ||
| Конјуг. база | Ammonia | ||
| Структура | |||
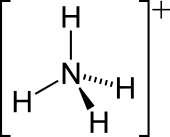
| Геометрија на молекулата | Тетраедарен | ||
| Дополнителни податоци | |||
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |||
| Наводи | |||
Амониумскиот катјон ― позитивно наелектризиран повеќеатомски јон со хемиска формула NH+
4. Се образува со протонирање на амонијак (NH3). Амониумот е исто така општо име за позитивно наелектризираните или протонирани заменети амини и квартерни амониумски катјони (NR+
4), каде што еден или повеќе атоми на водород се заменети со органски групи (означени со R).
Киселинско-базни својства[уреди | уреди извор]

Амониумскиот јон се создава кога амонијакот, слаба база, реагира со Бренстедови киселини (дарители на протони):
- H+ + NH3 → NH+
4
Амониумскиот јон е слабо кисел, реагирајќи со Бренстедовите бази за да се врати во ненаполнетата молекула на амонијак:
- NH+
4 + B− → HB + NH3
Така, третманот на концентрирани раствори на соли на амониум со силна база дава амонијак. Кога амонијакот се раствора во вода, мала количина од него се претвора во јони на амониум:
- H2O + NH3 ⇌ OH− + NH+
4
Степенот до кој амонијакот го образува амониумскиот јон зависи од рН на растворот. Ако pH вредноста е ниска, рамнотежата се поместува надесно: повеќе молекули на амонијак се претвораат во јони на амониум. Ако pH вредноста е висока (концентрацијата на водородните јони е ниска, а јоните на хидроксид е висока), рамнотежата се поместува налево: јонот на хидроксид апстрахира протон од јонот на амониум, создавајќи амонијак.
Образување на соединенија на амониум може да се случи и во фазата на пареа; на пример, кога пареата на амонијак доаѓа во контакт со пареата на хлороводород, се образува бел облак од амониум хлорид, кој на крајот се таложи како цврста супстанца во тенок бел слој на површините.
Соли[уреди | уреди извор]

Амониумскиот катјон се наоѓа во различни соли како што се амониум карбонат, амониум хлорид и амониум нитрат. Повеќето едноставни амониумови соли се многу растворливи во вода. Исклучок е амониум хексахлороплатинат, чиешто создавање некогаш било користено како тест за амониум. Амониумовите соли на нитрат и особено перхлорат се многу експлозивни, во овие случаи амониумот е средството за намалување.
Во необичена постапка, јоните на амониум создаваат амалгам. Таквите видови се подготвуваат со додавање на натриум амалгам во раствор од амониум хлорид.[2] Овој амалгам на крајот се распаѓа и ослободува амонијак и водород.[3]
За да се открие дали јонот на амониум е присутен во солта, прво солта се загрева во присуство на алкален хидроксид со што се ослободува гас со особен мирис кој секако е амонијак.
Амониумскиот јон кога е додаван во хлороплатинската киселина дава жолт талог.
Органски јони[уреди | уреди извор]
Водородните атоми во амониумскиот јон може да се заменат со алкилна група или некоја друга органска група за да образуваат супституиран амониумски јон (номенклатура МСЧПХ: аминиум јон). Во зависност од бројот на органски групи, амониумскиот катјон се нарекува примарен, секундарен, терцијарен или кватернарен. Со исклучок на квартерните амониумски катјони, органските амониумски катјони се слаби киселини.
Пример за реакција која образува амониумски јон е онаа помеѓу диметиламин, (CH3)2NH и киселина за да се добие диметиламониумски катјон, (CH3)2NH+2:
Кватернарните амониумски катјони имаат четири органски групи прикачени на азотниот атом, им недостасува водороден атом поврзан со атомот на азот. Овие катјони, како што е катјонот тетра- <i id="mwnQ">n</i> -бутиламониум, понекогаш се користени за замена на натриумски или калиумски јони за да се зголеми растворливоста на поврзаниот анјон во органски растворувачи. Примарните, секундарните и терциерните амониумски соли ја имаат истата функција, но се помалку липофилни. Тие исто така се користат како катализатори за пренос на фаза и сурфактанти.
Невообичаена класа на органски амониумски соли се деривати на катјони на аминските радикали, R3N+• како што е трис(4-бромофенил)амониумил хексахлороантимонат.
Биологија[уреди | уреди извор]
Амониумските јони се отпаден производ на метаболизмот на животните. Кај рибите и водните безрбетници, тој се излачува директно во водата. Кај цицачите, ајкулите и водоземците, тој во циклусот на уреа се претвора во уреа, бидејќи уреата е помалку токсична и може поефикасно да се складира. Кај птиците, влекачите и копнените полжави, метаболниот амониум се претвора во мочна киселина, која е цврста и затоа може да се излачи со минимална загуба на вода.[4]
Амониумот е важен извор на азот за многу растителни видови, особено оние кои растат на хипоксични почви. Сепак, тој е исто така токсичен за повеќето растителни видови и ретко се применува како единствен извор на азот.[5]
Метал[уреди | уреди извор]
Амониумскиот јон има многу слични својства на катјоните на потешките алкални метали и често се смета за близок еквивалент.[6][7][8] Се очекува амониумот да се однесува како метал (NH+4 јони во море од електрони) при многу високи притисоци, како што се во внатрешноста на гасните џиновски планети како што се Уран и Нептун.[7][8]
Во нормални услови, амониумот не постои како чист метал, туку постои како амалгам (легура со жива).[9]
Поврзано[уреди | уреди извор]
Наводи[уреди | уреди извор]
- ↑ Предлошка:RedBookRef
- ↑ „Pseudo-binary compounds“. Архивирано од изворникот на 27 јули 2020. Посетено на 27 јуни 2022.
- ↑ „Ammonium Salts“. VIAS Encyclopedia.
- ↑ Campbell, Neil A.; Jane B. Reece (2002). „44“. Biology (6. изд.). Сан Франциско: Pearson Education, Inc. стр. 937–938. ISBN 978-0-8053-6624-2.
- ↑ Britto, DT; Kronzucker, HJ (2002). „NH4+ toxicity in higher plants: a critical review“ (PDF). Journal of Plant Physiology. 159 (6): 567–584. doi:10.1078/0176-1617-0774.
- ↑ Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (уред.), Inorganic Chemistry, Преведено од Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, ISBN 0-12-352651-5
- ↑ 7,0 7,1 Stevenson, D. J. (20 ноември 1975). „Does metallic ammonium exist?“. Nature. 258 (5532): 222–223. Bibcode:1975Natur.258..222S. doi:10.1038/258222a0.
- ↑ 8,0 8,1 Bernal, M. J. M.; Massey, H. S. W. (3 февруари 1954). „Metallic Ammonium“. Месечни известувања на Кралското астрономско друштво. 114 (2): 172–179. Bibcode:1954MNRAS.114..172B. doi:10.1093/mnras/114.2.172.
- ↑ Reedy, J.H. (1 октомври 1929). „Lecture demonstration of ammonium amalgam“. Journal of Chemical Education. 6 (10): 1767. Bibcode:1929JChEd...6.1767R. doi:10.1021/ed006p1767.
| ||||||||||||||||||||||
|





2(aq) + H2SO4(aq)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a3c265d2824540c0b74a76f5b5a8977f15ebb759)
 + NH4+(aq) -> (NH4)2[PtCl6](s) + 2H+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a69d6ef31e3c9bcf45ee5c44678d905e8b2da4b7)
 + 3NH4(aq) -> (NH4)3[Co(NO2)6](s) + 3Na+(aq)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ca9e44f38ac92628b9a0c11a84b0f472df75b722)
