Точка на вриење

Точка на вриење — температура на која парниот притисок на течноста е еднаков со притисокот кој ја опкружува течноста и течноста преминува во пареа.
Точката на вриење на течноста[1][2] варира во зависност од притисокот на околината кој го опкружува. Течноста во делумен вакуум има пониска точка на вриење отколку кога течноста е под атмосферски притисок. Течноста со голем притисок има повисока точка на вриење отколку кога течноста е под атмосферскиот притисок. За даден притисок, различни течности имаат различни температури на вриење.
Нормална точка на вриење (уште наречена и атмосферска точка на вриење) на течноста е специјален случај кога парниот притисок на течноста се изедначува со дефинираниот атмосферски притисок на ниво на морето, 1 атмосфера.[3][4] На таа температура, парниот притисок на течноста станува доволен за да го надмине атмосферскиот притисок и дозволува меурчиња на пареа да се формираат во внатрешноста на течноста. Стандарната точка на вриење дефинирана од страна на IUPAC од 1982 како температура на која вриењето се случува на притисок помал од 1 bar.[5]
Топлината на испарување е енергија која е потребна за да се претвори одредено количевство на (a mol, kg, pound, etc.) на супстанца од течна форма во гас со даден притисок (често атмосферски притисок).
Течностите може да преминат во пареа на температура помала од нивната точка на вриење преку процесот на испарување. Испарувањето е површински феномен во кој молекулите сместени во близина на работ на течноста, не содржат доволно притисок на таа страна и затоа во околината ,,бегаат'' како пареа. Од друга страна, вриењето е процес во кој молекулите насекаде во течноста ,,бегаат'', што резултира со формирање на меурчиња насекаде во течноста.
Заситеност на температурата и притисокот
[уреди | уреди извор]Заситената течност содржи толку топлинска енергија колку што содржи без вриење (или обратно заситената пареа содржи мала топлинска енергија колку што може без кондензација).
Заситена температура е точка на вриење. Заситената температура е температура за соодветниот заситен притисок на кој течноста врие и се претвора во гас. Течноста може да се каже дека е заситена со топлинска енергија. Било кој прилог на топлинска енергија резултира со фазен премин.
Ако притисикот во системот отанува константен (изобарен), пареата на заситена температура ќе почне да се кондензира во течна фаза како топлинска енергија (топлина) и ќе се отстрани. Слично на тоа, течноста на заситена температура и притисокот ќе вријат во нејзината пареа со дополнителна топлинска енергија.
Точката на вриење одговара на температурата на која парниот притисок на течноста е еднаков со приток од околината која ја опкружува. Така, точката на вриење зависи од притисокот. Точките на вриење може да бидат објавени со одобрение на NIST, USA каде стандардниот притисок е од 101.325 kPa (или 1 atm), или стандардниот притисок од IUPAC од 100.000 kPa. На повисоки надморски висини, каде атмосферскиот притисок е многу помал, точката на вриење е исто така помала. Точката на вриење се зголемува со зголемување на притисокот до критичната точка, каде својствата на гасот и течноста стануваат идентични. Точката на вриење не може да биде над критичната точка. Слично на тоа, точката на вриење се намалува со намалување на притисокот, сè додека не се достигне тројната точка. Точката на вриење не може да се намали под тројната точка.
Ако топлината на испарувањето и парниот притисок на течноста на дадена температура, точката на вриење може да се пресмета со употреба на Clausius–Clapeyron-овата равенка:
| каде: | |
| = точка на вриење на притисок зземен по интерес (in K) | |
| =идеална гасна константа, 8.314 J · K−1 · mol−1 | |
| = е парен притисок на течноста со притисок од интерес, или atm или kPa зависи од стандардниот притисок кој е употребен | |
| = е некој притисок каде соодвествува на која е позната , (обично се достапни на 1atm или100kPa) | |
| = топлина на испарување на течноста, J · mol−1 во | |
| = температура на вриење, во K | |
| = природен логоритам |
Заситениот притисок е притисок за соодветна заситена температура на која течноста врие до пареа. Заситениот притисок и температура имаат директна врскаː како притисокот се зголемува така ќе се зголемува и температурата.
Ако температурата во системот останува константа (изотермалниот систем), пареата на заситениот притисок и температура ќе почната да ја кондензираат во течност со што притисокот ќе се зголемува. Слично, течноста на заситен притисок и температура ќе се стреми да трепери неговата парна фаза со што се намалува притисокот во системот.
Има два договори во поглед на стандарната точка на вриење на водата. Нормална точка на вриење е 99.97 °C (211.9 °F) на притисок од 1 atm (односно, 101.325 kPa). IUPAC препорачува стандардна точка на вриење на водата на стандарден притисок од 100 kPa (1 bar)[6] да е 99.61 °C (211.3 °F).[5][7] За споредба, на врвот на Монт Еверест на 8,848 m (29,029 ft) височина, притисокот е околу 34 kPa (255 Torr)[8] и точка на вриење на водата е 71 °C (160 °F). Целзијусовата температурна скала до 1954 беше дефинирана со две точки - 0 °C дефинирана од точката на замрзнување на водата и 100 °C дефинирана од точката на вриење на водата на стандарден атмосферски притисок.
Релацијата помеѓу нормална точка на вриење и парниот притисок на течностите
[уреди | уреди извор]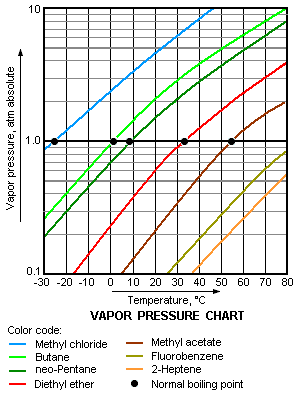
Што е повисок парниот притисок на течноста на дадена температура, толку е помала нормалната точка на вриење (односно, точката на вриење на атмосферскиот притисок) на течноста.
Дијаграмот на парниот притисок од десно има графи од парни притисоци наспроти температурите за различни течности.[9] Како што може да видиме во дијаграмот, течностите со најголеми парни притисоци имаат најниски точки на вриење.
За пример, на било која дадена температура, метил хлоридот има најголем парен притисок од било кој од течносите во графикот. Исто така има и најмала точка на вриење (−24.2 °C), каде што парниот притисок од метил хлорид (сината линија) се сече со хоризонталната линија на притисокот од една атмосфера (atm) на апсолутен парен притисок.
Особини на елементите
[уреди | уреди извор]Елементот со најниска точка на вриење е хелиумот. Двете точките на вриење на рениумот и волфрамот преминуваат 5000 K на стандарден притисок; затоа што е тешко да се измерат екстремните температури прецизно, и двата елементи биле наведени дека имаат повисока точка на вриење.[10]
Точка на вриење како својство на некое чисто соеднинение
[уреди | уреди извор]Како што може да се види од горниот нацрт на логоримот на парниот притисок наспроти температурата на било кое чисто хемиско соединение, неговата нормална точка на вриење може да послужи како показател на вкупната нестабилност на системот. Дадено чисто соединение, има само една нормална точка на вриење, доколку има, нормална температура на вриење и топење, може да послужи како карактеристично физичко својство за тоа соединение. Колку е повисока температурата на вриење на смесата, толку помалку е непроменливо соединението во целост и обратно, со помала точка на вриење на соединението, тоа е непроменливо во целост. Некои соединенија се распаѓаат на високи температури пред да ја достигнат точката на вриење или понекогаш дури и температурата на топење. За стабилно соединение, точката на вриење се движи од нејзината тројна точка до критичната точка, во зависност од надворешниот притисок. Надвор од нејзината тројна точка, соединението доколку има точка на вриење, ќе биде повисока од точката на топење. Надвор од критичката точка, течната и гасовита фаза на соединението ќе се спојат во една фаза која се нарекува прегреан гас. На дадена температура, ако точката на вриење на соединението е пониска, тогаш соединението ќе постои само како гас на атмосферски притисок. Ако точката на вриење на соединението е повисока, тогаш соединението може да постои во течна или цврста состојба на таа дадена температура на атмосферски притисок и така ќе постигнат рамнотежа со пареата (ако е непроменлива) ако пареата се содржи. Ако соединението не содржи пареа, тогаш некои непроменливи соединенија може евентувално да испарат далеку и покрај нивните високи точки на вриење.
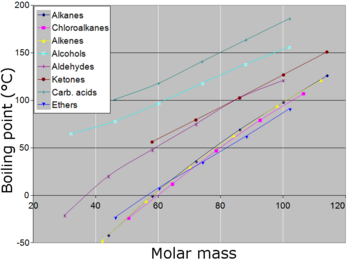
Генерално, јонско поврзаните соединенија, имаат високо нормлана точка на вриење, ако не се распаднат додека стигнат до високи температури. Многу метали, имаат високи точки на вриење, но не сите. Обично со дугите фактори се еднакви во соединенија каде молекулите се врзуваат ковалентно, односно како што се зголемува големината на молекулата (молекуларната маса), се зголемува и точката на вриење. Кога молекуларна големина станува онаа на макромолекулите,полимерите или на друг начин голема,соединението често се разградува при висока температура пред да се постигне точката на вриење. Друг фактор кој влијае на нормалната точка на вриење е поларноста на молекулите. Кога поларноста на комплексот од молекули се зголемува, нормалната точка на вриење се зголемува, останатите фактори остануваат исти.Тесно поврзана е можноста на молекулата да формира водородна врска (во течна состојба), што прави молекулите потешко да ја напуштат течната состојба, а со тоа се зголемува точката на вриење на смесата. Едноставна карбооксилна киселина димерзира со формирање на водородни врски меѓу молекулите. Моларниот фактор кој ќе влијае на точките на вриење е со облик на молекула. Се прави покомпактен облик на молекулата за да се намали точката на вриење во споредба со истата молекула со поголема површина.
| Споредба на точките на вриење на изомерите на бутан | ||
| Заедничко име | n-бутан | изобутан |
| Хемиско име | бутан | 2-метилпропан |
| Молекуларна форма |

|
|
| Точка на вриење (°C) | –0.5 | –11.7 |
| Споредба на точките на вриење на изомерите на пентан | |||
| Заедничко име | n-пентан | изопентан | неопентан |
| Хемиско име | пентан | 2-метилбутан | 2,2-диметилпропан |
| Молекуларна форма |

|

|

|
| Точка на вриење (°C) | 36.0 | 27.7 | 9.5 |
Повеќето испарливи соединенија (било каде во близина на надворешната температура) одат преку средно течна фаза додека со загравањето од цврста форма на крајот преминуваат во гас. Во споредба со вриењето, сублимацијата е физичка трансформација во која од цврста, директно преминува во гас, ова се случува во неколку случаи, како на пример кај јагледор диоксид на атмосферски притисок. За таквите соединенија, точката на сублимација е температура на која од цврста директно преоѓаат во пареа и имаат парен притисок еднаков со надворешниот притисок.
Нечистотии и соединенија
[уреди | уреди извор]Во претходните делови, беа опфатени точките на вриење кај чисти соединенија. Парниот притисок и точките на вриење на супстанците можат да бидат погодени од пристувство на растворени нечистотии (раствори) или некои други измешани соединенија, степенот на ефектот зависи од концентрацијата на нечистотии и соединенија. Присуството на не спарливи нечистотии како солите или нестабилните соедниненија, далеку е помал од главната компонента на соединението и ја намалува моларната фракција и нестабилноста на растворот, а со тоа се зголемува нормална точка на вриење пропорционално на концентрацијата на растворени материи. Овој ефект е наречен висина на точката на вриење. Како пример, солената вода врие на повисока температура отколку чистата вода.
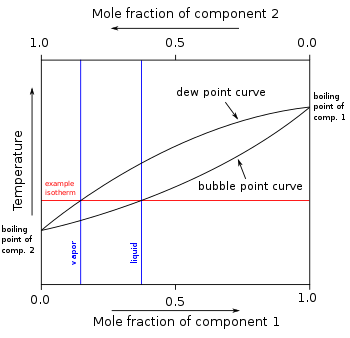
Во други мешани соединенија (компоненти), може да има две или повеќе компоненти со различна нестабилност, и секоја ќе има своја чиста компонента со точка на вриење на било кој даден притисок. Присуството на други испарливи компоненти во смесите, влијае врз парниот притисок и точката на вриење и точката на росење на сите компоненти во смесата. Точка на росење е температура на која пареата се кондензира во течност.Исто така, на било која температура, составот на пареата е различен од составот на течноста во повеќето случаи. Со цел да се илустрираат овие ефекти помеѓу испарливите компоненти во смесата, се употребува дијаграмот за точки на вриење. Дестилација е процес на вриење и кондензирање која нуди надминување на разликите во составот на течноста и парниот притисок.
Наводи
[уреди | уреди извор]- ↑ Goldberg, David E. (1988). 3,000 Solved Problems in Chemistry (1. изд.). McGraw-Hill. section 17.43, p. 321. ISBN 0-07-023684-4.
- ↑ Theodore, Louis; Dupont, R. Ryan and Ganesan, Kumar, уред. (1999). Pollution Prevention: The Waste Management Approach to the 21st Century. CRC Press. section 27, p. 15. ISBN 1-56670-495-2.CS1-одржување: повеќе имиња: список на уредници (link)
- ↑ General Chemistry Glossary Purdue University website page
- ↑ Reel, Kevin R.; Fikar, R. M.; Dumas, P. E.; Templin, Jay M. and Van Arnum, Patricia (2006). AP Chemistry (REA) – The Best Test Prep for the Advanced Placement Exam (9. изд.). Research & Education Association. section 71, p. 224. ISBN 0-7386-0221-3.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ 5,0 5,1 Cox, J. D. (1982). „Notation for states and processes, significance of the word standard in chemical thermodynamics, and remarks on commonly tabulated forms of thermodynamic functions“. Pure and Applied Chemistry. 54 (6). doi:10.1351/pac198254061239 (неактивно 2024-12-02).
- ↑ Standard Pressure IUPAC defines the "standard pressure" as being 105 Pa (which amounts to 1 bar).
- ↑ Appendix 1: Property Tables and Charts (SI Units), Scroll down to Table A-5 and read the temperature value of 99.61 °C at a pressure of 100 kPa (1 bar). Obtained from McGraw-Hill's Higher Education website.
- ↑ West, J. B. (1999). „Barometric pressures on Mt. Everest: New data and physiological significance“. Journal of Applied Physiology. 86 (3): 1062–6. doi:10.1152/jappl.1999.86.3.1062. PMID 10066724.
- ↑ Perry, R.H. and Green, D.W. (Editors) (1997). Perry's Chemical Engineers' Handbook (7. изд.). McGraw-Hill. ISBN 0-07-049841-5.CS1-одржување: повеќе имиња: список на автори (link) CS1-одржување: излишен текст: список на автори (link)
- ↑ DeVoe, Howard (2000). Thermodynamics and Chemistry (1. изд.). Prentice-Hall. ISBN 0-02-328741-1.
Надворешни врски
[уреди | уреди извор]
| ||||||||||||||||||||||||||||||||||||









