Бензен
| |||
 Просторно пополнувачки модел
| |||
Други називи Бензол (historic/German) | |||
| Назнаки | |||
|---|---|---|---|
| 71-43-2 | |||
| ChEBI | CHEBI:16716 | ||
| ChEMBL | ChEMBL277500 | ||
| ChemSpider | 236 | ||
| EC-број | 200-753-7 | ||
| 3Д-модел (Jmol) | Слика | ||
| KEGG | C01407 | ||
| PubChem | 241 | ||
| RTECS-бр. | CY1400000 | ||
| |||
| UNII | J64922108F | ||
| Својства | |||
| Хемиска формула | |||
| Моларна маса | 0 g mol−1 | ||
| Изглед | Безбојна течност | ||
| Мирис | сладок ароматичен | ||
| Густина | 0.8765(20) g/cm3[2] | ||
| Точка на топење | |||
| Точка на вриење | |||
| 1.53 g/L (0 °C) 1.81 g/L (9 °C) 1.79 g/L (15 °C)[3][4][5] 1.84 g/L (30 °C) 2.26 g/L (61 °C) 3.94 g/L (100 °C) 21.7 g/kg (200 °C, 6.5 MPa) 17.8 g/kg (200 °C, 40 MPa)[6] | |||
| Растворливост | Растворлив во алкохол, CHCl3, CCl4, диетил етер, ацетон, оцетна киселина[6] | ||
| Растворливост во етандиол | 5.83 g/100 g (20 °C) 6.61 g/100 g (40 °C) 7.61 g/100 g (60 °C)[6] | ||
| Растворливост во ethanol | 20 °C, раствор во етанол: 1.2 mL/L (20% v/v)[7] | ||
| Растворливост во acetone | 20 °C, раствор во ацетон: 7.69 mL/L (38.46% v/v) 49.4 mL/L (62.5% v/v)[7] | ||
| Растворливост во диетилен гликол | 52 g/100 g (20 °C)[6] | ||
| log P | 2.13 | ||
| Парен притисок | 12.7 kPa (25 °C) 24.4 kPa (40 °C) 181 kPa (100 °C)[8] | ||
| Конјуг. киселина | Бензениум[9] | ||
| Конјуг. база | Бензидин[10] | ||
| UV-vis (λmax) | 255 nm | ||
| −54.8·10−6 cm3/mol | |||
| Показател на прекршување (nD) | 1.5011 (20 °C) 1.4948 (30 °C)[6] | ||
| Вискозност | 0.7528 cP (10 °C) 0.6076 cP (25 °C) 0.4965 cP (40 °C) 0.3075 cP (80 °C) | ||
| Структура | |||
| Геометрија на молекулата | Планарано тригонална | ||
| Диполен момент | 0 D | ||
| Термохемија | |||
| Ст. енталпија на формирање ΔfH |
48.7 kJ/mol | ||
| Ст. енталпија на согорување ΔcH |
-3267.6 kJ/mol[8] | ||
| Стандардна моларна ентропија S |
173.26 J/mol·K[8] | ||
| Специфичен топлински капацитет, C | 134.8 J/mol·K | ||
| Опасност | |||
| Безбедност при работа: | |||
Главни опасности
|
потенцијално канцероген, запалив | ||
| GHS-ознаки: | |||
Пиктограми
|
     [11] [11]
| ||
Сигнални зборови
|
Опасност | ||
Изјави за опасност
|
H225, H302, H304, H305, H315, H319, H340, H350, H372, H410[11] | ||
Изјави за претпазливост
|
P201, P210, P301+P310, P305+P351+P338, P308+P313, P331[11] | ||
| NFPA 704 | |||
| Температура на запалување | {{{value}}} | ||
| 497.78 °C (928.00 °F; 770.93 K) | |||
| Граници на запалливост | 1.2–7.8% | ||
| Смртоносна доза или концентрација: | |||
LD50 (средна доза)
|
80,8 mg/kg (стаорец, орално)[13] | ||
LCLo (најниска објавена)
|
44,000 ppm (rabbit, 30 min) 44,923 ppm (dog) 52,308 ppm (cat) 20,000 ppm (human, 5 min)[14] | ||
| NIOSH (здравствени граници во САД): | |||
PEL (дозволива)
|
TWA 1 ppm, ST 5 ppm[12] | ||
REL (препорачана)
|
Ca TWA 0.1 ppm ST 1 ppm[12] | ||
IDLH (непосредна опасност)
|
500 ppm[12] | ||
| Безбедносен лист | HMDB | ||
| Дополнителни податоци | |||
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |||
| Наводи | |||
Бензен е органско хемиско соединение со молекулска формула C6H6. Молекулата на бензенот е составена од шест јаглеродни атоми споени во рамен прстен со по еден атом на водород прикачен на секој. Бидејќи содржи само атоми на јаглерод и водород, бензенот е класифициран како јаглеводород.[15]
Бензенот е природна состојка на нафтата и е една од елементарните петрохемикалии. Поради цикличните континуирани пи врски помеѓу јаглеродните атоми, бензенот е класифициран како ароматичен јаглеводород. Бензенот е безбојна и многу запалива течност со сладок мирис и делумно е одговорен за аромата на бензинот. Се користи првенствено како прекурсор за производство на хемикалии со посложена структура, како што се етилбензен и кумен, од кои годишно се произведуваат милијарди килограми. Иако бензенот е главна индустриска хемикалија, тој наоѓа ограничена употреба во производите за широка потрошувачка поради неговата токсичност.
Историја[уреди | уреди извор]
Откритие[уреди | уреди извор]
Зборот „бензен“ потекнува од „гума бензоин“ (бензоинска смола), ароматична смола позната уште од античко време во Југоисточна Азија; а подоцна и на европските фармацевти и парфимерии во 16 век преку трговските патишта.[16] Киселиот материјал бил извлечен од бензоин со сублимација и наречен „цвеќиња на бензоин“ или бензоева киселина. Јаглеводородот добиен од бензоева киселина на тој начин го добил името бензин, бензол или бензен.[17] Мајкл Фарадеј прв го изолирал и идентификувал бензенот во 1825 година од маслениот остаток добиен од производството на осветлувачки гас, давајќи му го името бикарбура од водород.[18][19] Во 1833 година, Еилхард Мичерлих го произведе со дестилирање на бензоева киселина (од гума за бензоин) и вар. На соединението му го дал името бензин.[20] Во 1836 година, францускиот хемичар Огист Лоран ја нарекол супстанцијата „фене“;[21] овој збор стана корен на англискиот збор „фенол“, кој е хидроксилиран бензен и „фенил“, радикалот формиран со апстракција на водороден атом (слободен радикал H•) од бензен.
Во 1845 година, Чарлс Блахфорд Менсфилд, работејќи под Август Вилхелм фон Хофман, изолирал бензен од катран од јаглен.[22] Четири години подоцна, Менсфилд го започна првото индустриско производство на бензен, врз основа на методот на јаглен-катран.[23][24] Постепено, меѓу хемичарите се развило чувството дека голем број супстанции се хемиски поврзани со бензенот, што опфаќа различно хемиско семејство. Во 1855 година, Хофман го употребил зборот „ароматичен“ за да го означи овој семеен однос, по карактеристичното својство на многу негови членови.[25] Во 1997 година, бензенот беше откриен во длабоката вселена.[26]
Прстенеста формула[уреди | уреди извор]
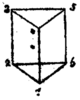
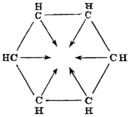
| Историски предлози на бензен структури | |||||
|---|---|---|---|---|---|

|

|
| |||
| Од Адолф Карл Лудвиг Клаус (1867)[27] | Од Џејмс Девар (1869)[28] | Од Алберт Ладенбург (1869)[29] | |||

| |||||
| Од Август Кекуле (1865/1872)[30][31] | |||||
|

|

| |||
| Од Хенри Едвард Армстронг (1887)[32][33] | Од Адолф фон Баер (1888)[34] | Од Фридрих Карл Јоханес Тиеле (1899)[35] | |||
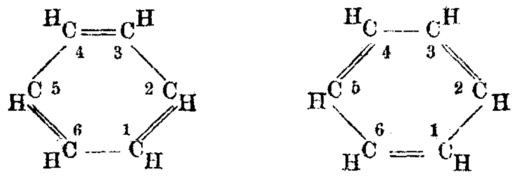
Емпириската формула за бензен беше одамна позната, но неговата високо полинезаситена структура, со само еден водороден атом за секој јаглероден атом, беше предизвик да се утврди. Арчибалд Скот Купер во 1858 година и Јохан Јозеф Лошмит во 1861 година[36] предложија можни структури кои содржеа повеќе двојни врски или повеќе прстени, но тогаш беа достапни премалку докази за да им помогнат на хемичарите да одлучат за одредена структура.
Во 1865 година, германскиот хемичар Фридрих Август Кекуле објави труд на француски (затоа што тогаш предаваше во франкофонска Белгија) сугерирајќи дека структурата содржи прстен од шест јаглеродни атоми со наизменични единечни и двојни врски. Следната година објавил многу подолг труд на германски јазик на истата тема.[30][37] Кекуле користел докази што се акумулирале во изминатите години - имено, дека секогаш се чинеше дека има само еден изомер од кој било монодериват на бензенот и дека секогаш се чинеше дека има точно три изомери од секој дисупституиран дериват - сега се разбира дека одговара на орто , мета и пара шеми на замена на арен - да се аргументира во поддршка на неговата предложена структура.[38] Симетричниот прстен на Кекуле може да ги објасни овие чудни факти, како и односот јаглерод-водород на бензен 1:1.
Новото разбирање на бензенот, а со тоа и на сите ароматични соединенија, се покажа како толку важно и за чистата и за применетата хемија што во 1890 година Германското хемиско друштво организираше елаборирана благодарност во чест на Кекуле, прославувајќи ја дваесет и петгодишнината од неговата прва публикација од бензен. Овде Кекуле зборуваше за создавањето на теоријата. Тој рече дека ја открил формата на прстенот на молекулата на бензенот откако видел на сон како змија си ја гризе сопствената опашка (ова е вообичаен симбол во многу древни култури познати како Ouroboros или бескраен јазол).[39] Оваа визија, рече тој, му дошла по долгогодишно проучување на природата на врските јаглерод-јаглерод. Ова беше седум години откако тој го реши проблемот како атомите на јаглерод можат да се поврзат со четири други атоми во исто време. Интересно е што сличен, хумористичен приказ на бензенот се појавил во 1886 година во памфлетот со наслов Berichte der Durstigen Chemischen Gesellschaft (Весник на жедното хемиско друштво), пародија на Berichte der Deutschen Chemischen Gesellschaft, а само во секој од другите имало пародија круг, наместо змии како во анегдотата на Кекуле.[40] Некои историчари сугерираат дека пародијата била лампун на анегдота за змијата, веројатно веќе добро позната преку усно пренесување, дури и ако сè уште не била објавена во печатена форма.[17] Говорот на Кекуле од 1890 година[41] во кој се појави оваа анегдота е преведен на англиски јазик.[42] Ако анегдотата е сеќавање на вистински настан, околностите споменати во приказната сугерираат дека тоа мора да се случило рано во 1862 година.[43]
Во 1929 година, цикличната природа на бензенот конечно беше потврдена од кристалографот Кетлин Лонсдејл користејќи методи на дифракција на Х-зраци.[44][45] Користејќи големи кристали на хексаметилбензен, дериват на бензен со исто јадро од шест јаглеродни атоми, Лонсдејл добил шеми на дифракција. Преку пресметување на повеќе од триесет параметри, Лонсдејл покажа дека бензенскиот прстен не може да биде ништо друго освен рамен шестоаголник и обезбеди точни растојанија за сите јаглерод-јаглерод врски во молекулата.[46]
Номенклатура[уреди | уреди извор]
Германскиот хемичар Вилхелм Кернер ги предложил префиксите орто-, мета-, пара- за да се разликуваат ди-супституираните деривати на бензен во 1867 година; сепак, тој не ги користел префиксите за да ги разликува релативните позиции на супституентите на бензен прстен.[47][48] Германскиот хемичар Карл Грабе, во 1869 година, прв ги употребил префиксите орто-, мета-, пара- за да означи специфични релативни локации на супституентите на ди-супституиран ароматичен прстен (т.е. нафталин).[49] Во 1870 година, германскиот хемичар Виктор Мајер прв ја применил номенклатурата на Грабе на бензен.[50]
Рани апликации[уреди | уреди извор]
Во 19-тиот и почетокот на 20-тиот век, бензенот се користел како лосион за после бричење поради неговиот пријатен мирис. Како што стана очигледна неговата токсичност, бензенот беше заменет со други растворувачи, особено толуен (метилбензен), кој има слични физички својства, но не е толку канцероген.
Во 1903 година, Лудвиг Роселиус ја популаризирал употребата на бензен за декофеинизирање на кафето. Ова откритие доведе до производство на Санка. Овој процес подоцна беше прекинат. Бензенот историски се користел како значајна компонента во многу производи за широка потрошувачка, како што се течен клуч, неколку отстранувачи за боја, гумени цементи, отстранувачи на дамки и други производи. Производството на некои од овие формулации кои содржат бензен престана во околу 1950 година, иако Liquid Wrench продолжи да содржи значителни количини на бензен до крајот на 1970-тите.[51]
Појава[уреди | уреди извор]
Количините во трагови на бензен се наоѓаат во нафтата и јагленот. Тоа е нуспроизвод на нецелосно согорување на многу материјали. За комерцијална употреба, до Втората светска војна, голем дел од бензенот се добиваше како нуспроизвод од производството на кокс (или „лесно масло од печка за кокс“) за челичната индустрија. Меѓутоа, во 1950-тите, зголемената побарувачка за бензен, особено од растечката индустрија за полимери, наложи производство на бензен од нафта. Денес, најголемиот дел од бензенот доаѓа од петрохемиската индустрија, при што само мал дел се произведува од јаглен.[52] На Марс се откриени молекули на бензен.[53][54][55]
Структура[уреди | уреди извор]

Дифракцијата на Х-зраци покажува дека сите шест јаглерод-јаглерод врски во бензенот се со иста должина, на 140 пикометри (pm).[56] Должините на врската C-C се поголеми од двојна врска (135 pm), но пократки од единечна врска (147 pm). Ова средно растојание е предизвикано од делокализацијата на електроните: електроните за C=C врзувањето се распределуваат подеднакво помеѓу секој од шесте јаглеродни атоми. Бензенот има 6 атоми на водород, помалку од соодветниот матичен алкан, хексан, кој има 14. Бензенот и циклохексанот имаат слична структура, само прстенот на делокализирани електрони и загубата на еден водород по јаглерод го разликува од циклохексан. Молекулата е рамна.[57] Описот на молекуларната орбитала вклучува формирање на три делокализирани π орбитали кои ги опфаќаат сите шест јаглеродни атоми, додека описот на валентната врска вклучува суперпозиција на резонантни структури.[58][59][60][61] Многу е веројатно дека оваа стабилност придонесува за чудните молекуларни и хемиски својства познати како ароматичност. За точно да се одрази природата на поврзувањето, бензенот често се прикажува со круг во хексагонален распоред на атоми на јаглерод.
Дериватите на бензенот се појавуваат доволно често како компонента на органските молекули, толку многу што конзорциумот на Уникод доделил симбол во Различниот технички блок со шифра U+232C (⌬) за да го претстави со три двојни врски,[62] и U+23E3 (⏣) за делокализирана верзија.[63]
Деривати на бензен[уреди | уреди извор]
Многу важни хемиски соединенија се добиени од бензен со замена на еден или повеќе од неговите водородни атоми со друга функционална група. Примери на едноставни деривати на бензен се фенол, толуен и анилин, скратено PhOH, PhMe и PhNH2, соодветно. Поврзувањето на бензенските прстени дава бифенил, C6H5–C6H5. Понатамошното губење на водород дава „споени“ ароматични јаглеводороди, како што се нафталин, антрацен, фенантрен и пирен. Границата на процесот на фузија е алотропот на јаглеродот без водород, графитот.
Во хетероциклите, атомите на јаглерод во бензенскиот прстен се заменуваат со други елементи. Најважните варијации содржат азот. Со замена на еден CH со N се добива соединението пиридин, C5H5N. Иако бензенот и пиридинот се структурно поврзани, бензенот не може да се претвори во пиридин. Замената на втората CH врска со N дава, во зависност од локацијата на вториот N, пиридазин, пиримидин или пиразин.[64]
Производство[уреди | уреди извор]
Четири хемиски процеси придонесуваат за индустриското производство на бензен: каталитичко реформирање, толуен хидродеалкилација, диспропорција на толуен и крекинг со пареа итн. Според ATSDR токсиколошкиот профил за бензен, помеѓу 1978 и 1981 година, каталитичките реформати сочинуваат приближно 44-50% од вкупното производство на бензен во САД.[52]
Каталитичко реформирање[уреди | уреди извор]
При каталитичко реформирање, мешавина од јаглеводороди со точки на вриење помеѓу 60 и 200 °C се меша со водороден гас, а потоа се изложува на бифункционален катализатор на платина хлорид или рениум хлорид на 500 – 525 °C и притисоци кои се движат од 8 – 50 atm. Под овие услови, алифатичните јаглеводороди формираат прстени и губат водород за да станат ароматични јаглеводороди. Ароматичните производи од реакцијата потоа се одвојуваат од реакционата смеса (или реформатираат) со екстракција со кој било од голем број растворувачи, вклучувајќи диетилен гликол или сулфолан, а бензенот потоа се одвојува од другите ароматици со дестилација. Чекорот на екстракција на ароматичните материи од реформатот е дизајниран да произведува ароматици со најниски неароматични компоненти. Обновувањето на ароматиката, вообичаено наречено BTX (бензен, толуен и ксиленски изомери), вклучува такви чекори на екстракција и дестилација.
На сличен начин како оваа каталитичка реформа, UOP и BP комерцијализираа метод од ТНГ (главно пропан и бутан) до ароматични материи.
Хидродеалкилација на толуен[уреди | уреди извор]
Хидродеалкилацијата на толуен го претвора толуенот во бензен. Во овој водородно-интензивен процес, толуенот се меша со водородот, а потоа се пренесува преку катализатор на хром, молибден или платина оксид на 500 – 650 °C и притисок од 20 – 60 atm. Понекогаш наместо катализатор се користат повисоки температури (при слична состојба на реакција). Под овие услови, толуенот се подложува на делкилација во бензен и метан:
Оваа неповратна реакција е придружена со рамнотежна странична реакција која произведува бифенил (ака дифенил) на повисока температура:
- 2 C6H6
 H2 + C6H5–C6H5
H2 + C6H5–C6H5
Ако струјата на суровината содржи многу неароматични компоненти (парафини или нафтани), тие најверојатно се распаѓаат на пониски јаглеводороди како што е метан, што ја зголемува потрошувачката на водород.
Типичен принос на реакција надминува 95 %. Понекогаш, наместо толуен се користат ксилени и потешки ароматици, со слична ефикасност.
Ова често се нарекува „наменска“ методологија за производство на бензен, во споредба со конвенционалните процеси на екстракција на BTX (бензен-толуен-ксилен).
Непропорционалност на толуенот[уреди | уреди извор]
Толуенската диспропорција (TDP) е конверзија на толуен во бензен и ксилен.
Со оглед на тоа што побарувачката за пара-ксилен (p-ксилен) значително ја надминува побарувачката за други изомери на ксилен, може да се користи усовршување на процесот TDP наречен Селективен TDP (STDP). Во овој процес, ксиленскиот тек што излегува од единицата TDP е приближно 90 % p-ксилен. Во некои системи, дури и односот бензен-ксилени е изменет за да ги фаворизира ксилените.
Крекинг со пареа[уреди | уреди извор]
Крекинг со пареа е процес за производство на етилен и други алкени од алифатични јаглеводороди. Во зависност од суровината што се користи за производство на олефините, крекингот со пареа може да произведе течен нуспроизвод богат со бензен наречен пиролизен бензин. Пиролизниот бензин може да се помеша со други јаглеводороди како додаток на бензинот или да се префрли низ процес на екстракција за да се повратат ароматичните BTX (бензен, толуен и ксилени).
Други методи[уреди | уреди извор]
Иако нема комерцијално значење, постојат многу други патишта до бензенот. Фенолот и халобензените можат да се редуцираат со метали. Бензоевата киселина и нејзините соли се подложени на декарбоксилација во бензен. Од реакцијата на диазониум соединението добиено од анилин со хипофосфорна киселина се добива бензен. Алкинската тримеризација на ацетилен дава бензен. Целосна декарбоксилација на мелитинската киселина дава бензен.
Употреба[уреди | уреди извор]
Бензенот се користи главно како посредник за производство на други хемикалии, пред се етилбензен (и други алкилбензени), кумен, циклохексан и нитробензен. Во 1988 година беше објавено дека две третини од сите хемикалии на списоците на Американското хемиско друштво содржеле најмалку еден бензенов прстен.[65] Повеќе од половина од целокупното производство на бензен се преработува во етилбензен, прекурсор на стиренот, кој се користи за производство на полимери и пластика како полистирен. Околу 20 % од производството на бензен се користи за производство на кумен, кој е потребен за производство на фенол и ацетон за смоли и лепила. Циклохексан троши околу 10 % од светското производство на бензен; првенствено се користи во производството на најлонски влакна, кои се преработуваат во текстил и инженерска пластика. Помали количини бензен се користат за производство на некои видови гуми, лубриканти, бои, детергенти, лекови, експлозиви и пестициди. Во 2013 година, земја со најголем потрошувач на бензен беше Кина, а потоа САД. Производството на бензен моментално се шири на Блискиот Исток и во Африка, додека производствените капацитети во Западна Европа и Северна Америка стагнираат.[66]
Толуенот сега често се користи како замена за бензенот, на пример како додаток за гориво. Својствата на растворувачите на двете се слични, но толуенот е помалку токсичен и има поширок течен опсег. Толуенот исто така се преработува во бензен.[67]

Компонента на бензинот[уреди | уреди извор]
Како додаток на бензин, бензенот го зголемува бројот на октани и го намалува чукањето. Како последица на тоа, бензинот често содржел неколку проценти бензен пред 1950-тите, кога тетраетил олово го заменил како најшироко користен додаток против удари. Со глобалното исфрлање на оловниот бензин, бензенот се врати како додаток на бензинот во некои земји. Во Соединетите Американски Држави, загриженоста за неговите негативни здравствени ефекти и можноста бензенот да влезе во подземните води доведе до строго регулирање на содржината на бензен во бензинот, со граници обично околу 1 %.[68] Европските спецификации за бензин сега ја содржат истата граница од 1 % на содржината на бензен. Агенцијата за заштита на животната средина на САД воведе нови регулативи во 2011 година со кои се намали содржината на бензен во бензинот на 0,62 %.[69]
Во многу европски јазици, зборот за нафта или бензин е точно сроден на „бензен“.
Реакции[уреди | уреди извор]
Најчестите реакции на бензенот вклучуваат замена на протон со други групи.[70] Електрофилната ароматична супституција е општ метод за дериватизирање на бензенот. Бензенот е доволно нуклеофилен што е подложен на супституција со ацил јони и алкилни карбокатјони за да се добијат супституирани деривати.
Friedel-Crafts-ово алкилирање и ацилрање[уреди | уреди извор]
Во 1999 година беа произведени приближно 24.700.000 тони.[71] Високо поучно, но со многу помалку индустриско значење е Friedel-Crafts-ово алкилирање на бензенот (и многу други ароматични прстени) со користење на алкил халид во присуство на силен катализатор на Луисова киселина. Слично на тоа, Friedel-Crafts-ово ацилација е поврзан пример на електрофилна ароматична замена. Реакцијата вклучува ацилирање на бензен (или многу други ароматични прстени) со ацил хлорид со користење на силен катализатор на Луисова киселина, како што е алуминиум хлорид или железо (III) хлорид.


Сулфонирање, хлорирање, нитрирање[уреди | уреди извор]
Користејќи електрофилна ароматична супституција, многу функционални групи се воведуваат во рамката на бензен. Сулфонацијата на бензенот вклучува употреба на олеум, мешавина од сулфурна киселина со сулфур триоксид. Сулфонираните деривати на бензен се корисни детергенти. При нитрација, бензенот реагира со нитрониум јонот (NO2+), кој е силен електрофил кој се произведува со комбинирање на сулфурна и азотна киселина. Нитробензенот е прекурсор на анилин. Хлорирањето се постигнува со употреба на хлор за да се добие хлоробензен во присуство на катализатор на Луисова киселина како што е алуминиум трихлорид.



Хидрогенирање[уреди | уреди извор]
Преку хидрогенизација, бензенот и неговите деривати се претвораат во циклохексан и деривати. Оваа реакција се постигнува со употреба на високи притисоци на водород во присуство на хетерогени катализатори, како што е ситно поделен никел. Со оглед на тоа што алкените може да се хидрогенизираат во близина на собни температури, бензенот и сродните соединенија се поневолни супстрати, за кои се потребни температури > 100 °C. Оваа реакција се практикува во голем обем индустриски. Во отсуство на катализатор, бензенот е непропустлив за водород. Хидрогенизацијата не може да се запре за да се добијат циклохексен или циклохексадиени бидејќи тие се супериорни супстрати. Редукцијата на Бирч е некаталитички процес, но сепак селективно го хидрогенизира бензенот во диен.

Метални комплекси[уреди | уреди извор]

Бензенот е одличен лиганд во органометалната хемија на нисковалентните метали. Важни примери ги вклучуваат комплексите сендвич и полу-сендвич, соодветно, Cr(C6H6)2 и [RuCl2(C6H6)]2.
Здравствени ефекти[уреди | уреди извор]

Бензенот е класифициран како канцероген, кој го зголемува ризикот од рак и други болести, а исто така е позната причина за откажување на коскената срцевина. Значителни количини на епидемиолошки, клинички и лабораториски податоци го поврзуваат бензенот со апластична анемија, акутна леукемија, абнормалности на коскената срцевина и кардиоваскуларни болести.[72][73][74] Специфичните хематолошки малигни заболувања со кои е поврзан бензенот вклучуваат: акутна миелоидна леукемија (AML), апластична анемија, миелодиспластичен синдром (MDS), акутна лимфобластична леукемија (ALL) и хронична миелоидна леукемија (CML).[75]
Американскиот институт за нафта (API) во 1948 година изјавил дека „генерално се смета дека единствената апсолутно безбедна концентрација на бензен е нула“.[76] Нема безбедно ниво на изложеност; дури и мали количини може да предизвикаат штета.[77] Американското Министерство за здравство и човечки услуги (DHHS) го класифицира бензенот како човечки канцероген. Долготрајната изложеност на прекумерно ниво на бензен во воздухот предизвикува леукемија, потенцијално фатален рак на органите кои формираат крв. Особено, акутната миелоидна леукемија или акутна нелимфоцитна леукемија (AML & ANLL) е предизвикана од бензен.[78] IARC го оцени бензенот како „познат како канцероген за луѓето“ (Група 1).
Бидејќи бензенот е сеприсутен во бензинот и јаглеводородните горива кои се користат насекаде, изложеноста на човекот на бензен е глобален здравствен проблем. Бензенот ги таргетира црниот дроб, бубрезите, белите дробови, срцето и мозокот и може да предизвика прекин на нишката на ДНК и хромозомско оштетување. Бензенот предизвикува рак кај животните, вклучително и луѓето. Се покажа дека бензенот предизвикува рак кај двата пола на повеќе видови лабораториски животни изложени преку различни патишта.[79][80]
Изложеност на бензен[уреди | уреди извор]
Според Агенцијата за токсични супстанции и регистар на болести (ATSDR) (2007), бензенот е и синтетички направена и природна хемикалија од процеси кои вклучуваат: вулкански ерупции, диви пожари, синтеза на хемикалии како фенол, производство на синтетички влакна и производство на гуми, лубриканти, пестициди, лекови и бои. Главните извори на изложеност на бензен се тутунскиот чад, сервисните станици за автомобили, издувните гасови од моторните возила и индустриските емисии; сепак, голтање и дермална апсорпција на бензен може да се случи и преку контакт со контаминирана вода. Бензенот се метаболизира хепатално и се излачува во урината. Мерењето на нивото на воздухот и водата на бензенот се остварува преку собирање преку цевки со активен јаглен, кои потоа се анализираат со гасен хроматограф. Мерењето на бензенот кај луѓето може да се постигне преку тестови на урина, крв и здив; сепак, сите овие имаат свои ограничувања бидејќи бензенот брзо се метаболизира во човечкото тело.[81]
Изложеноста на бензен може прогресивно да доведе до апластична анемија, леукемија и мултипен миелом.[82]
OSHA ги регулира нивоата на бензен на работното место.[83] Максималната дозволена количина на бензен во воздухот во работната просторија за време на 8-часовен работен ден, 40-часовна работна недела е 1 ppm. Бидејќи бензенот може да предизвика рак, NIOSH препорачува сите работници да носат специјална опрема за дишење кога постои веројатност да бидат изложени на бензен на нивоа што ја надминуваат препорачаната (8-часовна) граница на изложеност од 0,1 ppm.[84]
Граници на изложеност на бензен[уреди | уреди извор]
Агенцијата за заштита на животната средина на Соединетите држави постави максимално ниво на загадувачи за бензен во водата за пиење на 0,0005 mg/L (5 ppb), како што е објавено преку американските национални регулативи за примарна вода за пиење.[85] Оваа регулатива се заснова на спречување на леукемогенезата на бензенот. Целта на максималното ниво на загадувачи (MCLG), неприменлива здравствена цел која би овозможила соодветна маргина на безбедност за спречување на негативни ефекти, е нулта концентрација на бензен во водата за пиење. ЕПА бара да се пријават истурање или случајно испуштање во околината на 10 lbs (4,5 kg) или повеќе бензен.
Управата за безбедност и здравје при работа на САД (OSHA) постави дозволена граница на изложеност од 1 дел бензен на милион делови воздух (1 ppm) на работното место за време на 8-часовен работен ден и 40-часовна работна недела. Краткорочното ограничување на изложеноста за бензенот во воздухот е 5 ppm за 15 минути.[86] Овие законски ограничувања беа засновани на студии кои покажуваат убедливи докази за ризик по здравјето на работниците изложени на бензен. Ризикот од изложеност на 1 ppm за работен век е проценет како 5 вишок смртни случаи од леукемија на 1.000 вработени изложени. (Оваа проценка не претпоставува праг за канцерогени ефекти на бензенот.) OSHA, исто така, воспостави акционо ниво од 0,5 ppm за да поттикне уште помала изложеност на работното место.[87]
Американскиот национален институт за безбедност и здравје при работа (NIOSH) ја ревидираше концентрацијата на бензен веднаш опасна по животот и здравјето (IDLH) на 500 ppm. Тековната дефиниција NIOSH за состојба IDLH, како што е дадена во логиката за избор на респиратори NIOSH, е онаа што претставува закана од изложеност на загадувачи во воздухот кога таа изложеност веројатно ќе предизвика смрт или непосредни или одложени трајни негативни здравствени ефекти или спречува бегство од таквa средина.[88] Целта на утврдувањето на вредноста на IDLH е (1) да се осигура дека работникот може да избега од дадена контаминирана средина во случај на откажување на опремата за респираторна заштита и (2) се смета за максимално ниво над кое само високо сигурен апарат за дишење може да осигура безбедност на работникот. Дозволено е обезбедување максимална заштита на работниците.[88][89] Во септември 1995 година, NIOSH издаде нова политика за развивање препорачани граници на изложеност (RELs) за супстанции, вклучително и канцерогени. Бидејќи бензенот може да предизвика рак, NIOSH препорачува сите работници да носат специјална опрема за дишење кога постои веројатност да бидат изложени на бензен на нивоа што ги надминуваат REL (10-час) од 0,1 ppm.[90] Границата на краткорочна изложеност на NIOSH (STEL – 15 мин) е 1 ppm.
Американската конференција на владини индустриски хигиеничари (ACGIH) ги усвои праговите гранични вредности (TLVs) за бензен со 0,5 ppm TWA и 2,5 ppm STEL.[се бара извор]
Токсикологија[уреди | уреди извор]
Биомаркери на изложеност[уреди | уреди извор]
Неколку тестови може да ја одредат изложеноста на бензен. Самиот бензен може да се мери во здив, крв или урина, но таквото тестирање обично е ограничено на првите 24 часа по изложувањето поради релативно брзото отстранување на хемикалијата со издишување или биотрансформација. Повеќето луѓе во развиените земји имаат мерливи основни нивоа на бензен и други ароматични нафтени јаглеводороди во крвта. Во телото, бензенот ензимски се претвора во серија производи на оксидација, вклучувајќи муконска киселина, фенилмеркаптурна киселина, фенол, катехол, хидрохинон и 1,2,4-трихидроксибензен. Повеќето од овие метаболити имаат одредена вредност како биомаркери на човековата изложеност, бидејќи тие се акумулираат во урината пропорционално на обемот и времетраењето на изложеноста и тие сè уште можат да бидат присутни неколку дена по престанокот на експозицијата. Тековните граници на биолошка изложеност на ACGIH за професионална изложеност се 500 μg/g креатинин за муконска киселина и 25 μg/g креатинин за фенилмеркаптурна киселина во примерок од урина на крајот на смената.[91][92][93][94]
Биотрансформации[уреди | уреди извор]
Дури и ако не е вообичаен супстрат за метаболизмот, бензенот може да се оксидира и од бактериите и од еукариотите. Кај бактериите, ензимот диоксигеназа може да додаде кислород во прстенот, а нестабилниот производ веднаш се редуцира (со NADH) до цикличен диол со две двојни врски, со што се крши ароматичноста. Следно, диолот е ново редуциран со NADH до катехол. Катехолот потоа се метаболизира до ацетил CoA и сукцинил CoA, кои се користат од организмите главно во циклусот на лимонска киселина за производство на енергија.
Патеката за метаболизмот на бензенот е сложена и започнува во црниот дроб. Вклучени се неколку ензими. Тие вклучуваат цитохром P450 2E1 (CYP2E1), кинин оксидоредуктаза (NQ01 или DT-дијафораза или NAD(P)H дехидрогеназа (хинон 1)), GSH и миелопероксидаза (MPO). CYP2E1 е вклучен во повеќе чекори: претворање на бензен во оксепин (бензен оксид), фенол во хидрохинон и хидрохинон и во бензентриол и во катехол. Хидрохинонот, бензентриолот и катехолот се претвораат во полифеноли. Во коскената срцевина, МПО ги претвора овие полифеноли во бензохинони. Овие посредници и метаболити индуцираат генотоксичност со повеќе механизми, вклучително и инхибиција на топоизомеразата II (која ја одржува структурата на хромозомот), нарушување на микротубулите (која ја одржува клеточната структура и организација), генерирање на слободни радикали на кислород (нестабилни видови) кои може да доведат до точкасти мутации, зголемување оксидативен стрес, индуцирање прекини на ДНК ланците и менување на метилацијата на ДНК (што може да влијае на експресијата на гените). NQ01 и GSH го поместуваат метаболизмот од токсичност. NQ01 го метаболизира бензохинонот кон полифенолите (се спротивставува на ефектот на МПО). GSH е вклучен во формирањето на фенилмеркаптурна киселина[75][95]
Генетските полиморфизми во овие ензими може да предизвикаат губење на функцијата или зголемување на функцијата. На пример, мутациите во CYP2E1 ја зголемуваат активноста и резултираат со зголемено генерирање на токсични метаболити. NQ01 мутациите резултираат со губење на функцијата и може да резултираат со намалена детоксикација. Мутациите на миелопероксидазата резултираат со губење на функцијата и може да резултираат со намалено создавање на токсични метаболити. GSH мутациите или бришењата резултираат со губење на функцијата и резултираат со намалена детоксикација. Овие гени може да бидат цели за генетски скрининг за подложност на токсичност на бензен.[96]
Молекуларна токсикологија[уреди | уреди извор]
Парадигмата на токсиколошка проценка на бензенот се менува кон доменот на молекуларната токсикологија бидејќи овозможува разбирање на основните биолошки механизми на подобар начин. Глутатионот се чини дека игра важна улога со тоа што штити од прекини на ДНК предизвикани од бензен и тој е идентификуван како нов биомаркер за изложеност и ефект.[97] Бензенот предизвикува хромозомски аберации во периферните крвни леукоцити и коскената срцевина, објаснувајќи ја поголемата инциденца на леукемија и мултипен миелом предизвикани од хронична изложеност. Овие аберации може да се следат со користење на флуоресцентна in situ хибридизација (FISH) со ДНК сонди за да се проценат ефектите на бензенот заедно со хематолошките тестови како маркери за хематотоксичност.[98] Метаболизмот на бензенот вклучува ензими кодирани од полиморфните гени. Истражувањата покажаа дека генотипот на овие локуси може да влијае на подложноста на токсичните ефекти од изложеноста на бензен. Поединци кои носат варијанта на NAD(P)H:хинон оксидоредуктаза 1 (NQO1), микрозомална епоксидна хидролаза (EPHX) и бришење на глутатион S-трансферазата T1 (GSTT1) покажаа поголема фреквенција на едноверижни прекини на ДНК.[99]
Биолошка оксидација и канцерогена активност[уреди | уреди извор]
Еден начин за разбирање на канцерогените ефекти на бензенот е со испитување на производите на биолошката оксидација. Чистиот бензен, на пример, оксидира во телото за да произведе епоксид, бензен оксид, кој не се излачува лесно и може да комуницира со ДНК за да произведе штетни мутации.
Патишта на изложеност[уреди | уреди извор]
Вдишување[уреди | уреди извор]
Надворешниот воздух може да содржи ниски нивоа на бензен од сервисните станици на автомобили, чад од дрво, чад од тутун, пренос на бензин, издувни гасови од моторни возила и индустриски емисии.[100] Околу 50 % од целата изложеност на бензен на национално ниво (Соединетите Американски Држави) е резултат од пушење тутун или од изложеност на чад од тутун.[101] Откако ќе испушел 32 цигари дневно, пушачот внесувал околу 1,8 милиграми (mg) бензен. Оваа количина е околу 10 пати поголема од просечниот дневен внес на бензен од непушачите.[102]
Вдишениот бензен првенствено се исфрла непроменет преку издишување. Во студија со луѓе, 16,4 до 41,6 % од задржаниот бензен бил елиминиран преку белите дробови во рок од пет до седум часа по два до три часа изложеност на 47 до 110 ppm и само 0,07 до 0,2 % од преостанатиот бензен бил излачен непроменет во урината. По изложување на 63 до 405 mg/m3 бензен во период од 1 до 5 часа, 51 до 87 % се излачувале во урината како фенол во период од 23 до 50 часа. Во друга човечка студија, 30 % од апсорбираниот кожен бензен, кој примарно се метаболизира во црниот дроб, се излачува како фенол во урината.[103]
Изложеност од безалкохолни пијалоци[уреди | уреди извор]
Под специфични услови и во присуство на други хемикалии бензоевата киселина (конзерванс) и аскорбинската киселина (витамин Ц) можат да комуницираат за да произведат бензен. Во март 2006 година, официјалната агенција за стандарди за храна во Обединетото Кралство спроведе истражување на 150 марки на безалкохолни пијалоци. Откри дека четири содржеле нивоа на бензен над границите на Светската здравствена организација. Засегнатите серии беа отстранети од продажба. Слични проблеми беа пријавени од ФДА во Соединетите Држави.[104]

Контаминација на водоснабдувањето[уреди | уреди извор]
Во 2005 година, водоснабдувањето на градот Харбин во Кина со население од речиси девет милиони луѓе, беше прекинато поради големата изложеност на бензен.[105] Бензенот истече во реката Сонгхуа, која го снабдува градот со вода за пиење, по експлозијата во фабриката на кинеската национална нафтена корпорација (CNPC) во градот Џилин на 13 ноември 2005 година.
Кога пластичните водоводни цевки се изложени на висока топлина, водата може да биде контаминирана со бензен.[106]
Геноцид[уреди | уреди извор]
Нацистите користеле бензен администриран преку инјектирање како еден од многуте методи за убивање.[107][108]
Наводи[уреди | уреди извор]
- ↑ 1,0 1,1 Favre, Henri A.; Powell, Warren H. (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. стр. 10, 22, 204, 494, 577. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ↑ Lide, D. R., уред. (2005). CRC Handbook of Chemistry and Physics (LXXXVI. изд.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ Arnold, D.; Plank, C.; Erickson, E.; Pike, F. (1958). „Solubility of Benzene in Water“. Industrial & Engineering Chemistry Chemical & Engineering Data Series. 3 (2): 253–256. doi:10.1021/i460004a016.
- ↑ Breslow, R.; Guo, T. (1990). „Surface tension measurements show that chaotropic salting-in denaturants are not just water-structure breakers“. Proceedings of the National Academy of Sciences of the United States of America. 87 (1): 167–9. Bibcode:1990PNAS...87..167B. doi:10.1073/pnas.87.1.167. PMC 53221. PMID 2153285.
- ↑ Coker, A. Kayode; Ludwig, Ernest E. (2007). Ludwig's Applied Process Design for Chemical And Petrochemical Plants. 1. Elsevier. стр. 114. ISBN 978-0-7506-7766-0. Архивирано од изворникот 2016-03-12. Посетено на 2012-05-31.
- ↑ 6,0 6,1 6,2 6,3 6,4 „Benzol“. Архивирано од изворникот 2014-05-29. Посетено на 2014-05-29.
- ↑ 7,0 7,1 Atherton Seidell; William F. Linke (1952). Solubilities of Inorganic and Organic Compounds: A Compilation of Solubility Data from the Periodical Literature. Supplement. Van Nostrand. Архивирано од изворникот 2020-03-11. Посетено на 2015-06-27.
- ↑ 8,0 8,1 8,2 Benzene in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD) (посетено на 2014-05-29)
- ↑ „Benzenium (CID 12533897“. PubChem. February 8, 2007. Посетено на September 18, 2022.
- ↑ „Benzenide (CID 5150480)“. PubChem. June 24, 2005. Посетено на September 18, 2022.
- ↑ 11,0 11,1 11,2 Sigma-Aldrich Co., Benzene Архивирано на 1 декември 2016 г.. Retrieved on 2014-05-29.
- ↑ 12,0 12,1 12,2 „Џебен водич за опасните хемиски материи #0049“. Национален институт за безбедност и здравје при работа (NIOSH). (англиски)
- ↑ Benzene, toxicity
- ↑ „Benzene“. Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ „Benzene - an overview | ScienceDirect Topics“. www.sciencedirect.com. Архивирано од изворникот 2021-02-08. Посетено на 2020-11-25.
- ↑ The word "benzoin" is derived from the Arabic expression "luban jawi", or "frankincense of Java". Morris, Edwin T. (1984). Fragrance: The Story of Perfume from Cleopatra to Chanel. Charles Scribner's Sons. стр. 101. ISBN 978-0684181950.
- ↑ 17,0 17,1 Rocke, A. J. (1985). „Hypothesis and Experiment in the Early Development of Kekule's Benzene Theory“. Annals of Science. 42 (4): 355–81. doi:10.1080/00033798500200411.
- ↑ Faraday, M. (1825). „On new compounds of carbon and hydrogen, and on certain other products obtained during the decomposition of oil by heat“. Philosophical Transactions of the Royal Society. 115: 440–466. doi:10.1098/rstl.1825.0022. JSTOR 107752. Архивирано од изворникот 2020-11-21. Посетено на 2012-01-15. On pages 443–450, Faraday discusses "bicarburet of hydrogen" (benzene). On pages 449–450, he shows that benzene's empirical formula is C6H6, although he doesn't realize it because he (like most chemists at that time) used the wrong atomic mass for carbon (6 instead of 12).
- ↑ Kaiser, R. (1968). „Bicarburet of Hydrogen. Reappraisal of the Discovery of Benzene in 1825 with the Analytical Methods of 1968“. Angewandte Chemie International Edition in English. 7 (5): 345–350. doi:10.1002/anie.196803451.
- ↑ Mitscherlich, E. (1834). „Über das Benzol und die Säuren der Oel- und Talgarten“ [On benzol and oily and fatty types of acids]. Annalen der Pharmacie. 9 (1): 39–48. doi:10.1002/jlac.18340090103. Архивирано од изворникот 2015-11-23. Посетено на 2015-06-27. In a footnote on page 43, Liebig, the journal's editor, suggested changing Mitscherlich's original name for benzene (namely, "benzin") to "benzol", because the suffix "-in" suggested that it was an alkaloid (e.g., Chinin (quinine)), which benzene isn't, whereas the suffix "-ol" suggested that it was oily, which benzene is. Thus on page 44, Mitscherlich states: "Da diese Flüssigkeit aus der Benzoësäure gewonnen wird, und wahrscheinlich mit den Benzoylverbindungen im Zusammenhang steht, so gibt man ihr am besten den Namen Benzol, da der Name Benzoïn schon für die mit dem Bittermandelöl isomerische Verbindung von Liebig und Wöhler gewählt worden ist." (Since this liquid [benzene] is obtained from benzoic acid and probably is related to benzoyl compounds, the best name for it is "benzol", since the name "benzoïn" has already been chosen, by Liebig and Wöhler, for the compound that's isomeric with the oil of bitter almonds [benzaldehyde].)
- ↑ Laurent, Auguste (1836) "Sur la chlorophénise et les acides chlorophénisique et chlorophénèsique," Annales de Chemie et de Physique, vol. 63, pp. 27–45, see p. 44 Архивирано на 20 март 2015 г.: "Je donne le nom de phène au radical fondamental des acides précédens (φαινω, j'éclaire), puisque la benzine se trouve dans le gaz de l'éclairage." (I give the name of "phène" (φαινω, I illuminate) to the fundamental radical of the preceding acids, because benzene is found in illuminating gas.)
- ↑ Hofmann, A. W. (1845). „Ueber eine sichere Reaction auf Benzol“ [On a reliable test for benzene]. Annalen der Chemie und Pharmacie (германски). 55 (2): 200–205, especially 204–205. doi:10.1002/jlac.18450550205. Архивирано од изворникот 2015-11-22.
- ↑ Mansfield Charles Blachford (1849). „Untersuchung des Steinkohlentheers“. Annalen der Chemie und Pharmacie. 69 (2): 162–180. doi:10.1002/jlac.18490690203. Архивирано од изворникот 2015-10-27. Посетено на 2015-06-27.
- ↑ Charles Mansfield filed for (November 11, 1847) and received (May 1848) a patent (no. 11,960) for the fractional distillation of coal tar.
- ↑ Hoffman, Augustus W. (1856). „On insolinic acid“. Proceedings of the Royal Society. 8: 1–3. doi:10.1098/rspl.1856.0002.
The existence and mode of formation of insolinic acid prove that to the series of monobasic aromatic acids, Cn2Hn2-8O4, the lowest known term of which is benzoic acid, … .
[Note: The empirical formulas of organic compounds that appear in Hofmann's article (p. 3) are based upon an atomic mass of carbon of 6 (instead of 12) and an atomic mass of oxygen of 8 (instead of 16).] - ↑ Cernicharo, José; и др. (1997), „Infrared Space Observatory's Discovery of C4H2, C6H2, and Benzene in CRL 618“, Astrophysical Journal Letters, 546 (2): L123–L126, Bibcode:2001ApJ...546L.123C, doi:10.1086/318871
- ↑ Claus, Adolph K.L. (1867) "Theoretische Betrachtungen und deren Anwendungen zur Systematik der organischen Chemie" (Theoretical considerations and their applications to the classification scheme of organic chemistry), Berichte über die Verhandlungen der Naturforschenden Gesellschaft zu Freiburg im Breisgau (Reports of the Proceedings of the Scientific Society of Freiburg in Breisgau), 4 : 116–381. In the section Aromatischen Verbindungen (aromatic compounds), pp. 315–347, Claus presents Kekulé's hypothetical structure for benzene (p. 317), presents objections to it, presents an alternative geometry (p. 320), and concludes that his alternative is correct (p. 326). See also figures on p. 354 or p. 379.
- ↑ Dewar James (1869). „On the oxidation of phenyl alcohol, and a mechanical arrangement adapted to illustrate structure in the non-saturated hydrocarbons“. Proceedings of the Royal Society of Edinburgh. 6: 82–86. doi:10.1017/S0370164600045387. Архивирано од изворникот 2015-11-24. Посетено на 2015-06-27.
- ↑ Ladenburg Albert (1869). „Bemerkungen zur aromatischen Theorie“ [Observations on the aromatic theory]. Berichte der Deutschen Chemischen Gesellschaft. 2: 140–142. doi:10.1002/cber.18690020171. Архивирано од изворникот 2015-11-22. Посетено на 2015-06-27.
- ↑ 30,0 30,1 Kekulé, F. A. (1865). „Sur la constitution des substances aromatiques“. Bulletin de la Société Chimique de Paris. 3: 98–110. Архивирано од изворникот 2015-11-14. Посетено на 2015-06-27. On p. 100, Kekulé suggests that the carbon atoms of benzene could form a "chaîne fermée" (a closed chain, a loop).
- ↑ Aug. Kekulé (1872), „Ueber einige Condensationsproducte des Aldehyds“ (PDF), Annalen der Chemie und Pharmacie (German), 162 (1), pp. 77–124, doi:10.1002/jlac.18721620110CS1-одржување: непрепознаен јазик (link)
- ↑ Armstrong Henry E (1887). „An explanation of the laws which govern substitution in the case of benzenoid compounds“. Journal of the Chemical Society. 51: 258–268 [264]. doi:10.1039/ct8875100258. Архивирано од изворникот 2015-10-22. Посетено на 2015-06-27.
- ↑ In his 1890 paper, Armstrong represented benzene nuclei within polycyclic benzenoids by placing inside the benzene nuclei a letter "C", an abbreviation of the word "centric". Centric affinities (i.e., bonds) acted within a designated cycle of carbon atoms. From p. 102: " … benzene, according to this view, may be represented by a double ring, in fact." See:
- Armstrong, H.E. (1890). „The structure of cycloid hydrocarbons“. Proceedings of the Chemical Society. 6: 101–105. Архивирано од изворникот 2021-11-16. Посетено на 2018-02-17.
- Armit, James Wilson; Robinson, Robert (1925). „Polynuclear heterocyclic aromatic types. Part II. Some anhydronium bases“. Journal of the Chemical Society, Transactions. 127: 1604–1618. doi:10.1039/ct9252701604.
- Balaban, Alexandru T.; Schleyer, Paul v. R.; Rzepa, Henry S. (2005). „Crocker, Not Armit and Robinson, Begat the Six Aromatic Electrons“. Chemical Reviews. 105 (10): 3436–3447. doi:10.1021/cr0300946. PMID 16218557.
- ↑ Adolf Baeyer (1888), „Über die Constitution des Benzols“, Justus Liebigs Annalen der Chemie (German), 245 (1–2), pp. 103–190, doi:10.1002/jlac.18882450110CS1-одржување: непрепознаен јазик (link)
- ↑ Thiele, Johannes (1899) "Zur Kenntnis der ungesättigten Verbindungen" (On our knowledge of unsaturated compounds), Justus Liebig’s Annalen der Chemie306: 87–142; see: "VIII. Die aromatischen Verbindungen. Das Benzol." (VIII. The aromatic compounds. Benzene.), pp. 125–129. Архивирано на 10 март 2020 г. See further: Thiele (1901) "Zur Kenntnis der ungesättigen Verbindungen," Архивирано на 26 декември 2021 г. Justus Liebig’s Annalen der Chemie, 319: 129–143.
- ↑ Loschmidt, J. (1861). Chemische Studien (германски). Vienna, Austria-Hungary: Carl Gerold's Sohn. стр. 30, 65. Архивирано од изворникот 2016-05-07. Посетено на 2015-06-27.
- ↑ Kekulé, F. A. (1866). „Untersuchungen über aromatische Verbindungen (Investigations of aromatic compounds)“. Liebigs Annalen der Chemie und Pharmacie. 137 (2): 129–36. doi:10.1002/jlac.18661370202. Архивирано од изворникот 2021-12-26. Посетено на 2021-12-25.
- ↑ Rocke, A. J. (2010). Image and Reality: Kekule, Kopp, and the Scientific Imagination. University of Chicago Press. стр. 186–227. ISBN 978-0226723358. Архивирано од изворникот 2020-07-27. Посетено на 2020-05-15.
- ↑ Read, John (1995). From alchemy to chemistry. New York: Dover Publications. стр. 179–180. ISBN 9780486286907.
- ↑ English translation Wilcox, David H.; Greenbaum, Frederick R. (1965). „Kekule's benzene ring theory: A subject for lighthearted banter“. Journal of Chemical Education. 42 (5): 266–67. Bibcode:1965JChEd..42..266W. doi:10.1021/ed042p266.
- ↑ Kekulé, F. A. (1890). „Benzolfest: Rede“. Berichte der Deutschen Chemischen Gesellschaft. 23: 1302–11. doi:10.1002/cber.189002301204. Архивирано од изворникот 2007-05-16. Посетено на 2007-03-12.
- ↑ Benfey O. T. (1958). „August Kekulé and the Birth of the Structural Theory of Organic Chemistry in 1858“. Journal of Chemical Education. 35 (1): 21–23. Bibcode:1958JChEd..35...21B. doi:10.1021/ed035p21.
- ↑ Gillis Jean (1966). „Auguste Kekulé et son oeuvre, réalisée à Gand de 1858 à 1867“. Mémoires de la Classe des Sciences - Académie Royale des Sciences, des Lettres et des Beaux-arts de Belgique. 37 (1): 1–40.
- ↑ Lonsdale, K. (1929). „The Structure of the Benzene Ring in Hexamethylbenzene“. Proceedings of the Royal Society. 123A (792): 494–515. Bibcode:1929RSPSA.123..494L. doi:10.1098/rspa.1929.0081.
- ↑ Lonsdale, K. (1931). „An X-Ray Analysis of the Structure of Hexachlorobenzene, Using the Fourier Method“. Proceedings of the Royal Society. 133A (822): 536–553. Bibcode:1931RSPSA.133..536L. doi:10.1098/rspa.1931.0166. Архивирано од изворникот 2021-03-19. Посетено на 2007-03-12.
- ↑ Ramos-Figueroa, Josseline (2021-05-21). „Meet Kathleen Lonsdale, the physicist and prison reformer who cracked benzene's code“. Massive Science. Посетено на 2022-03-01.
- ↑ Wilhelm Körner (1867) "Faits pour servir à la détermination du lieu chimique dans la série aromatique" Архивирано на 7 јули 2017 г. (Facts to be used in determining chemical location in the aromatic series), Bulletins de l'Académie royale des sciences, des lettres et des beaux-arts de Belgique, 2nd series, 24 : 166–185; see especially p. 169. From p. 169: "On distingue facilement ces trois séries, dans lesquelles les dérivés bihydroxyliques ont leurs terms correspondants, par les préfixes ortho-, para- et mêta-." (One easily distinguishes these three series – in which the dihydroxy derivatives have their corresponding terms – by the prefixes ortho-, para- and meta-.)
- ↑ Hermann von Fehling, ed., Neues Handwörterbuch der Chemie [New concise dictionary of chemistry] (Braunschweig, Germany: Friedrich Vieweg und Sohn, 1874), vol. 1, p. 1142.
- ↑ Graebe (1869) "Ueber die Constitution des Naphthalins" Архивирано на 28 ноември 2015 г. (On the structure of naphthalene), Annalen der Chemie und Pharmacie, 149 : 20–28; see especially p. 26.
- ↑ Victor Meyer (1870) "Untersuchungen über die Constitution der zweifach-substituirten Benzole" Архивирано на 23 октомври 2015 г. (Investigations into the structure of di-substituted benzenes), Annalen der Chemie und Pharmacie, 156 : 265–301; see especially pp. 299–300.
- ↑ Williams, P.R.D.; Knutsen, J.S.; Atkinson, C.; Madl, A.K.; Paustenbach, D.J. (2007). „Airborne Concentrations of Benzene Associated with the Historical Use of Some Formulations of Liquid Wrench“. Journal of Occupational and Environmental Hygiene. 4 (8): 547–561. doi:10.1080/15459620701446642. PMID 17558801. S2CID 32311057.
- ↑ 52,0 52,1 Hillis O. Folkins (2005). „Benzene“. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a03_475. ISBN 978-3527306732.
- ↑ Chang, Kenneth (June 7, 2018). „Life on Mars? Rover's Latest Discovery Puts It 'On the Table'“. The New York Times. Архивирано од изворникот May 28, 2019. Посетено на June 8, 2018.
The identification of organic molecules in rocks on the red planet does not necessarily point to life there, past or present, but does indicate that some of the building blocks were present.
- ↑ ten Kate, Inge Loes (June 8, 2018). „Organic molecules on Mars“. Science. 360 (6393): 1068–1069. Bibcode:2018Sci...360.1068T. doi:10.1126/science.aat2662. PMID 29880670. S2CID 46952468.
- ↑ Eigenbrode, Jennifer L.; и др. (June 8, 2018). „Organic matter preserved in 3-billion-year-old mudstones at Gale crater, Mars“ (PDF). Science. 360 (6393): 1096–1101. Bibcode:2018Sci...360.1096E. doi:10.1126/science.aas9185. PMID 29880683. S2CID 46983230. Архивирано (PDF) од изворникот August 25, 2021. Посетено на January 4, 2021.
- ↑ Bacon, G. E.; Curry, N.; Wilson, S. (May 12, 1964). „A Crystallographic Study of Solid Benzene by Neutron Diffraction“. Proceedings of the Royal Society of London, Series A. 279 (1376): 98–110. Bibcode:1964RSPSA.279...98B. doi:10.1098/rspa.1964.0092. ISSN 2053-9169. JSTOR 2414835. S2CID 94432897.
- ↑ Moran D, Simmonett AC, Leach FE, Allen WD, Schleyer PV, Schaefer HF (2006). „Popular Theoretical Methods Predict Benzene and Arenes To Be Nonplanar“. Journal of the American Chemical Society. 128 (29): 9342–3. doi:10.1021/ja0630285. PMID 16848464.
- ↑ Cooper, David L.; Gerratt, Joseph; Raimondi, Mario (1986). „The electronic structure of the benzene molecule“. Nature. 323 (6090): 699–701. Bibcode:1986Natur.323..699C. doi:10.1038/323699a0. S2CID 24349360.
- ↑ Pauling, Linus (1987). „Electronic structure of the benzene molecule“. Nature. 325 (6103): 396. Bibcode:1987Natur.325..396P. doi:10.1038/325396d0. S2CID 4261220.
- ↑ Messmer, Richard P.; Schultz, Peter A. (1987). „The electronic structure of the benzene molecule“. Nature. 329 (6139): 492. Bibcode:1987Natur.329..492M. doi:10.1038/329492a0. S2CID 45218186.
- ↑ Harcourt, Richard D. (1987). „The electronic structure of the benzene molecule“. Nature. 329 (6139): 491–492. Bibcode:1987Natur.329..491H. doi:10.1038/329491b0. S2CID 4268597.
- ↑ „Unicode Character 'BENZENE RING' (U+232C)“. fileformat.info. Архивирано од изворникот 2009-02-19. Посетено на 2009-01-16.
- ↑ „Unicode Character 'BENZENE RING WITH CIRCLE' (U+23E3)“. fileformat.info. Архивирано од изворникот 2009-07-03. Посетено на 2009-01-16.
- ↑ „Heterocyclic Chemistry: Heterocyclic Compounds“. Michigan State University, Department of Chemistry. Архивирано од изворникот 2016-04-06. Посетено на 2016-07-08.
- ↑ Browne, Malcolm W. (August 16, 1988), „A pervasive molecule is captured in a photograph“, The New York Times, Архивирано од изворникот August 12, 2021, Посетено на August 13, 2021
- ↑ „Market Study: Benzene (2nd edition), Ceresana, August 2014“. ceresana.com. Архивирано од изворникот 2017-12-21. Посетено на 2015-02-10.
- ↑ „Market Study: Toluene, Ceresana, January 2015“. ceresana.com. Архивирано од изворникот на 2017-04-29. Посетено на 2015-02-10.
- ↑ Kolmetz, Gentry, Guidelines for BTX Revamps, AIChE 2007 Spring Conference
- ↑ „Control of Hazardous Air Pollutants From Mobile Sources“. U.S. Environmental Protection Agency. 2006-03-29. стр. 15853. Архивирано од изворникот на 2008-12-05. Посетено на 2008-06-27.
- ↑ Stranks, D. R.; M. L. Heffernan; K. C. Lee Dow; P. T. McTigue; G. R. A. Withers (1970). Chemistry: A structural view. Carlton, Victoria: Melbourne University Press. стр. 347. ISBN 978-0-522-83988-3.
- ↑ Welch, Vincent A.; Fallon, Kevin J.; Gelbke, Heinz-Peter (2005). „Ethylbenzene“. Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a10_035.pub2. ISBN 3527306730.
- ↑ Kasper, Dennis L.et al. (2004) Harrison's Principles of Internal Medicine, 16th ed., McGraw-Hill Professional, p. 618, ISBN 0071402357.
- ↑ Merck Manual, Home Edition Архивирано на 29 септември 2011 г., "Overview of Leukemia".
- ↑ Bard, D (2014). „Traffic-related air pollution and the onset of myocardial infarction: disclosing benzene as a trigger? A small-area case-crossover study“. PLOS ONE. 9 (6): 6. Bibcode:2014PLoSO...9j0307B. doi:10.1371/journal.pone.0100307. PMC 4059738. PMID 24932584.
- ↑ 75,0 75,1 Smith, Martyn T. (2010). „Advances in understanding benzene health effects and susceptibility“. Annu Rev Public Health. 31: 133–48. doi:10.1146/annurev.publhealth.012809.103646. PMC 4360999. PMID 20070208.
- ↑ American Petroleum Institute, API Toxicological Review, Benzene, September 1948, Agency for Toxic Substances and Disease Registry, Department of Health and Human Services
- ↑ Smith, Martyn T. (2010-01-01). „Advances in Understanding Benzene Health Effects and Susceptibility“. Annual Review of Public Health. 31 (1): 133–148. doi:10.1146/annurev.publhealth.012809.103646. PMC 4360999. PMID 20070208.
- ↑ WHO. International Agency for Research on Cancer, IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Overall Evaluations of Carcinogenicity: An Updating of IARC Monographs Архивирано на 6 март 2008 г., Volumes 1 to 42, Supplement 7
- ↑ Huff J (2007). „Benzene-induced cancers: abridged history and occupational health impact“. Int J Occup Environ Health. 13 (2): 213–21. doi:10.1179/oeh.2007.13.2.213. PMC 3363002. PMID 17718179.
- ↑ Rana SV; Verma Y (2005). „Biochemical toxicity of benzene“. J Environ Biol. 26 (2): 157–68. PMID 16161967.
- ↑ Agency for Toxic Substances and Disease Registry. (2007) Benzene: Patient information sheet. Архивирано на 15 декември 2014 г.
- ↑ Yardley-Jones, A.; Anderson, D.; Parke, D. V. (1991). „The toxicity of benzene and its metabolism and molecular pathology in human risk assessment“. British Journal of Industrial Medicine. 48 (7): 437–44. doi:10.1136/oem.48.7.437. PMC 1035396. PMID 1854646.
- ↑ Occupational Safety and Health Standards, Toxic and Hazardous Substances, 1910.1028 Архивирано на 29 јуни 2015 г.. Osha.gov. Retrieved on 2011-11-23.
- ↑ Public Health Statement for Benzene, Agency for Toxic Substances and Disease Registry. (August 2007). Benzene: Patient information sheet Архивирано на 28 мај 2010 г.. Atsdr.cdc.gov (2011-03-03). Retrieved on 2011-11-23.
- ↑ „Drinking Water Contaminants | Organic Chemicals | Benzene“. United States Environmental Protection Agency (EPA). Архивирано од изворникот на February 2, 2015. Посетено на April 17, 2014.
- ↑ „Chemical Sampling Information Benzene“. Occupational Safety and Health Administration (OSHA). Архивирано од изворникот на June 29, 2015. Посетено на November 23, 2011.
- ↑ „Benzene Toxicity: Standards and Regulations“. Agency for Toxic Substances and Disease Registry (ATSDR); Environmental Medicine & Environmental Health Education – CSEM. June 30, 2000. Архивирано од изворникот на June 10, 2010. Посетено на October 9, 2010.
- ↑ 88,0 88,1 „NIOSH respirator selection logic“ (PDF). Cincinnati, Ohio: U.S. Department of Health and Human Services (DHHS), Public Health Service, Centers for Disease Control (CDC), National Institute for Occupational Safety and Health (NIOSH). October 2004. Архивирано од изворникот (PDF) на August 29, 2017. publication No. 2005-100.
- ↑ „Documentation for Immediately Dangerous to Life or Health Concentrations (IDLH): Introduction“. Centers for Disease Control (CDC). Архивирано од изворникот на April 1, 2019. Посетено на November 23, 2011.
- ↑ „Public Health Statement for Benzene“. Agency for Toxic Substances and Disease Registry. U.S. Department of Health and Human Services, Public Health Service, Centers for Disease Control, National Institute for Occupational Safety and Health. August 2007. Архивирано од изворникот 2012-01-20. Посетено на 2011-11-23 – преку Atsdr.cdc.gov.
- ↑ Ashley, DL; Bonin, MA; Cardinali, FL; McCraw, JM; Wooten, JV (1994). „Blood concentrations of volatile organic compounds in a nonoccupationally exposed US population and in groups with suspected exposure“ (PDF). Clinical Chemistry. 40 (7 Pt 2): 1401–4. doi:10.1093/clinchem/40.7.1401. PMID 8013127. Архивирано (PDF) од изворникот 2011-11-22. Посетено на 2010-08-25.
- ↑ Fustinoni S, Buratti M, Campo L, Colombi A, Consonni D, Pesatori AC, Bonzini M, Farmer P, Garte S, Valerio F, Merlo DF, Bertazzi PA (2005). „Urinary t,t-muconic acid, S-phenylmercapturic acid and benzene as biomarkers of low benzene exposure“. Chemico-Biological Interactions. 153–154: 253–6. doi:10.1016/j.cbi.2005.03.031. PMID 15935823.
- ↑ ACGIH (2009). 2009 TLVs and BEIs. American Conference of Governmental Industrial Hygienists, Cincinnati, Ohio.
- ↑ Baselt, R. (2008) Disposition of Toxic Drugs and Chemicals in Man, 8th edition, Biomedical Publications, Foster City, CA, pp. 144–148, ISBN 0962652377.
- ↑ Snyder, R; Hedli, C.C. (1996). „An overview of benzene metabolism“. Environ Health Perspect. 104 (Suppl 6): 1165–1171. doi:10.1289/ehp.96104s61165. PMC 1469747. PMID 9118888.
- ↑ Dougherty, D; Garte, S; Barchowsky, A; Zmuda, J; Taioli, E (2008). „NQO1, MPO, CYP2E1, GSTT1 and STM1 polymorphisms and biological effects of benzene exposure—a literature review“. Toxicology Letters. 182 (1–3): 7–17. doi:10.1016/j.toxlet.2008.09.008. PMID 18848868.
- ↑ Fracasso ME, Doria D, Bartolucci GB, Carrieri M, Lovreglio P, Ballini A, Soleo L, Tranfo G, Manno M (2010). „Low air levels of benzene: Correlation between biomarkers of exposure and genotoxic effects“. Toxicol Lett. 192 (1): 22–8. doi:10.1016/j.toxlet.2009.04.028. PMID 19427373.
- ↑ Eastmond, D.A.; Rupa, DS; Hasegawa, LS (2000). „Detection of hyperdiploidy and chromosome breakage in interphase human lymphocytes following exposure to the benzene metabolite hydroquinone using multicolor fluorescence in situ hybridization with DNA probes“. Mutat Res. 322 (1): 9–20. doi:10.1016/0165-1218(94)90028-0. PMID 7517507.
- ↑ Garte, S; Taioli, E; Popov, T; Bolognesi, C; Farmer, P; Merlo, F (2000). „Genetic susceptibility to benzene toxicity in humans“. J Toxicol Environ Health A. 71 (22): 1482–1489. doi:10.1080/15287390802349974. PMID 18836923. S2CID 36885673.
- ↑ ToxFAQs for Benzene, Agency for Toxic Substances and Disease Registry, Department of Health and Human Services Архивирано на 9 март 2008 г.
- ↑ ToxGuide for Benzene Архивирано на 28 мај 2010 г., Agency for Toxic Substances and Disease Registry, Department of Health and Human Services
- ↑ Public Health Statement. Benzene Архивирано на 27 мај 2010 г., Division of Toxicology and Environmental Medicine, August 2007
- ↑ Benzene, CASRN: 71-43-2 Архивирано на 22 октомври 2011 г.. Hazardous Substances Data Bank, U.S. National Library of Medicine. National Institutes of Health.
- ↑ "FDA: Too Much Benzene In Some Drinks" Архивирано на 18 февруари 2007 г., CBS News, May 19, 2006. Retrieved July 11, 2006.
- ↑ „100 tonnes of pollutants spilled into Chinese river“. The Guardian. 25 November 2005. Архивирано од изворникот 10 March 2020. Посетено на 7 January 2020.
- ↑ Isaacson, Kristofer P.; Proctor, Caitlin R.; Wang, Q. Erica; Edwards, Ethan Y.; Noh, Yoorae; Shah, Amisha D.; Whelton, Andrew J. (2021). „Drinking water contamination from the thermal degradation of plastics: Implications for wildfire and structure fire response“. Environmental Science: Water Research & Technology. 7 (2): 274–284. doi:10.1039/D0EW00836B.
- ↑ „Selections and lethal injections“. Auschwitz-Birkenau State Museum. Архивирано од изворникот May 9, 2020. Посетено на May 15, 2020.
- ↑ „A Former Nazi Labor Camp in Austria, Now Billed as a Tourist Site“. Haaretz. May 3, 2019. Архивирано од изворникот May 11, 2019. Посетено на May 11, 2019.
Надворешни врски[уреди | уреди извор]
| „Бензен“ на Ризницата ? |
- Benzene at The Periodic Table of Videos (University of Nottingham)
- International Chemical Safety Card 0015
- USEPA Summary of Benzene Toxicity
- NIOSH Pocket Guide to Chemical Hazards
- Benzene од PubChem
- Dept. of Health and Human Services: TR-289: Toxicology and Carcinogenesis Studies of Benzene
- Video Podcast of Sir John Cadogan giving a lecture on Benzene since Faraday, in 1991
- Substance profile
- NLM Hazardous Substances Databank – Benzene
| ||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
|