Двојна врска
Двојна врска — ковалентна врска меѓу два атома со четири врзани електрони наспроти два кај единечната врска. Овие врски најчесто се јавуваат меѓу два јаглеродни атома, како на пример кај алкените. Постојат многу двојни врски неѓу два различни елемента: на пример, кај карбонилната група, таа се јавува меѓу јаглероден и кислороден атом. Други почести двојни врски се присутни во азосоединенијата (N=N), имините (C=N) и сулфоксидите (S=O). Во скелетната формула, двојнаа врска се претстаува со две напоредни црти (=) или знак за равенство меѓу двата врзани атома.[1][2] Се смета дека овој начин на запишување го вовел рускиот хемичар Александар Бутлеров во XIX век.
Двојните врски на јаглеродот се посилни и покуси од единечните врски. Тие се богати со електрони, што ги прави потенцијално пореактивни во присуство на силен електронски прифатник (како додавачки реакции на халогените).
- Хемиски соединенија со двојни врски
-
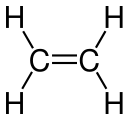
Јаглеродно-јаглеродна двојна врска на етиленот
-
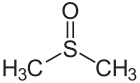
Јаглеродно-кислородна двојна врска на ацетонот
-
Сулфурно-кислородна двојна врска на диметил сулфоксидот
-
Азотно-азотна двојна врска на дијазенот
Двојни врски кај алкените[уреди | уреди извор]

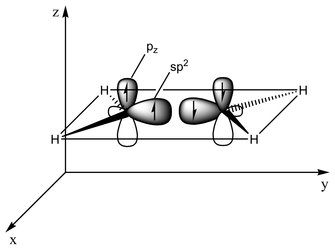
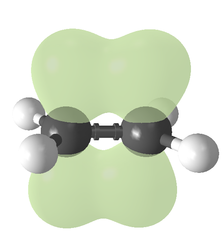
Овој вид на сврзување се должи на орбитална хибридизација. Кај етиленот секој јаглероден атом има три sp2-орбитали и една p-орбитала. Трите sp2-орбитали лежат на рамнина со агли ~120°. p-орбиталата е нормална на таа рамнина. Кога јаглеродните атоми ќе се доближат, две од sp2-орбиталите се преклопуваат образувајќи сигма-врска. Во исто време, двете p-орбитали се доближуваат (на истата рамнина) и заедно образуваат пи-врска. Најголем преклоп се јавува како p-орбиталите остануваат напоредни, и така станува невозможно вртењето околу средишна врска. Ова својство е причинител за цис-транс изомерија. Двојните врски се пократки од единечните бидејќи преклопот на p-орбиталите е доведен во најголема можна мера.
-
Две sp2-орбитали (вкупно 3 такви орбитали) се доближуваат образувајќи sp2-sp2 сигма-врска
-
Две p-орбитали се преклопуваат образувајќи пи-врска на рамнина напоредна на сигма-рамнината
Со должина од 133 пм, врската C=C на етиленот е покуса од C−C на етанот, чија должина изнесува 154 пм. Двојната врска исто така е посилна, со 636 kJ мол−1 наспроти 368 kJ мол−1 но не двапати повеќе отколку што пи-врската е послаба од сигма-врската поради помалку делотворниот пи-преклоп.
Со друг начин на претставување, двојната врска произлегува од две преклопени sp3-обритали как кај свиткана врска.[3]
Варијации[уреди | уреди извор]
Кај молекулите со наизменични двојни и единечни врски, преклопот на p-орбитали може да постои низ повеќе атоми во ланецот, што создава конјугиран систем. Конјугацијата се среќава во системи како диените и еноните. Во цикличните молекули, конјугацијата може да доведе до ароматичност. Кај кумулените, двете двојни врски се соседни.
Двојните врски се чести кај елементите од II периода како јаглеродот, азотот и кислородот, а поретки во елементи од повисоки периоди. Металите исто така можат да прават двојни врски — метално-лигандска повеќекратна врска.
Алкенски хомолози од групата 14[уреди | уреди извор]
Двојно сврзаните соединенија, алкенски хомолози, R2E=ER2 дене се познати за сите потешки елементи од групата 14. За разлика од алкените, овие соединенија не се рамнински, туку туку имаат искривени и/или транссвиткани структури. Овие ефекти стануваат поизразени кај потешките елементи. Дистаненот (Me3Si)2CHSn=SnCH(SiMe3)2 има калајно-калајна должина на врската само малку подолга од една врска, транссвиткана структура со пирамидална координација на секој калаен атом и лесно се раздвојува во раствор и образува (Me3Si)2CHSn: (стананедиил, карбенски аналог). Врзувањето се состои од две слаби давателско-прифатнички врски, а слободнниот пар на секој калаен атом се преклопува со празната p-орбитала на другиот.[4][5] За разлика од ова, кај дисилените секој силициумски атом има рамнинска координација, но заменителите се искривени, така што молекулата во целина не е рамнинска. Во плумбените, врската Pb=Pb може да биде подолга од мноштво споредливи единечни врски[5] Плумбените и станените во раствор обично се раздвојуваат на мономери со со врскаи чија енталпија е многукратно помала од споредливите единечни врски. Некои двојно врзани плумбени и стенени имаат слична јачина со водородните врски.[4] Карактерот на врзувањето може да се предвиди со Картер-Годард-Малрие-Тренкиевиот модел.[4]
Видови двојни врски меѓу атомите[уреди | уреди извор]
| C | O | N | S | Si | Ge | Sn | Pb | |
|---|---|---|---|---|---|---|---|---|
| C | алкен | карбонилна група | имин | тиокетон, тијал | ||||
| O | дикислород | нитрозно соединение | сулфоксид, сулфон, сулфинска киселина, сулфонска киселина | |||||
| N | азосоединение | |||||||
| S | дисулфур | |||||||
| Si | алкилиденсилани | силени | ||||||
| Ge | гермени | |||||||
| Sn | станени | |||||||
| Pb | плумбени |
Наводи[уреди | уреди извор]
- ↑ March, Jerry, 1929-1997. (1985). Advanced organic chemistry : reactions, mechanisms, and structure (3rd. изд.). New York: Wiley. ISBN 0-471-88841-9. OCLC 10998226.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ McMurry, John. Organic chemistry (9. изд.). Boston, MA, USA. ISBN 978-1-305-08048-5. OCLC 907259297.
- ↑ Carey, Francis A., 1937- (2007). Advanced organic chemistry. Sundberg, Richard J., 1938- (5. изд.). New York: Springer. ISBN 978-0-387-44897-8. OCLC 154040953.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ 4,0 4,1 4,2 Power, Philip P. (1999). „π-Bonding and the Lone Pair Effect in Multiple Bonds between Heavier Main Group Elements“. Chemical Reviews. 99 (12): 3463–3504. doi:10.1021/cr9408989. PMID 11849028.
- ↑ 5,0 5,1 Wang, Yuzhong; Robinson, Gregory H. (2009). „Unique homonuclear multiple bonding in main group compounds“. Chemical Communications. Royal Society of Chemistry (35): 5201–5213. doi:10.1039/B908048A. PMID 19707626.
- Pyykkö, Pekka; Riedel, Sebastian; Patzschke, Michael (2005). „Triple-Bond Covalent Radii“. Chemistry: A European Journal. 11 (12): 3511–20. doi:10.1002/chem.200401299. PMID 15832398.
Надворешни врски[уреди | уреди извор]
- Хемиски врски — „Е-хемија“ (македонски)
| ||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
|