Дијамантоид
Во хемијата, дијамантоидите се варијанти на молекулата на јаглерод во облик на кафез позната како адамантан (C 10 H 16 ), најмалата единица кафез структура на дијамантската кристална решетка . Дијамантоидите познати и како нанодијаманти или кондензирани адамантани може да вклучуваат еден или повеќе кафези (адамантан, дијамантан, триамантан и повисоки полимантани), како и бројни изомерни и структурни варијанти на адамантани и полимантани. Овие дијамантоиди природно се појавуваат во нафтените наслаги и се екстрахирани и прочистени во големи чисти кристали на молекули на полимантан кои имаат повеќе од десетина кафези од адамантан по молекула.[1] Овие видови се од интерес како молекуларни апроксимации на дијамантската кубна рамка, која завршува со C−H врски. Циклохексамантанот може да се смета како дијамант со големина на нанометар од приближно 5,6⋅10-22 грами.[2]
Примери[уреди | уреди извор]

Примерите вклучуваат:
- Адамантан (C 10 H 16 )
- Iceane (C 12 H 18 )
- BC-8 (C 14 H 20 )
- Дијамантан (C 14 H 20 ) исто така дијадамантан, два кафези споени со лице
- Триамантан (C 18 H 24 ), исто така, триадамантан . Дијамантанот има четири идентични страни на располагање за прицврстување на нова единица C 4 H 4 .
- Изотерамантан (C 22 H 28 ). Триамантанот има осум страни на кои може да се додаде нова единица C 4 H 4 што резултира со четири изомери . Еден од овие изомери покажува спирален пресврт и затоа е прохирален . Енантиомерите <i id="mwPw">P</i> и <i id="mwQA">M</i> се одвоени.
- Пентамантанот има девет изомери со хемиска формула C26H32 и уште еден пентамантан постои со хемиската формула C25H30
- Циклохексамантан (C26H30 )
- Супер-адамантан (C30H36 )
Еден тетрамантански изомер е најголемиот дијамантоид досега подготвен со органска синтеза со помош на кетокарбеноидна реакција за прицврстување на циклопентански прстени.[3] Подолги дијамантоиди се формирани од дијамантанска дикарбоксилна киселина.[4] Првата изолација на широк опсег на дијамантоиди од нафтата се случила по следните чекори:[1] вакуумска дестилација над 345 °C, еквивалентна атмосферска точка на вриење, потоа пиролиза на 400 до 450 °C со цел да се отстранат сите недијамантоидни соединенија (дијамантоидите се термодинамички многу стабилни и ќе ја преживеат оваа пиролиза), а потоа и серија техники за сепарација со течна хроматографија со високи перформанси.
Во една студија, соединението на тетрамантан е опремено со тиолски групи на позициите на мостовите.[5] Ова овозможува нивно прицврстување на златна површина и формирање на самосклопени еднослоеви (дијамант-на-злато). Дополнително, функционализираните дијамантоиди ( адамантани ) се предложени како молекуларни градежни блокови за самосклопени молекуларни кристали.[6][7][8]
Органската хемија на дијамантоидите се протега дури и до пентамантанот.[9] Медијалната положба (основата) во оваа молекула (изомерот [1(2,3)4]пентамантан) се пресметува за да се добие поповолнакарбокација од апикалната положба (горе) и едноставното бромирање на пентаман 1 со бром исклучиво го дава медијалниот бромо дериват 2 кој при хидролиза во вода и DMF го формира алкохолот 3 .
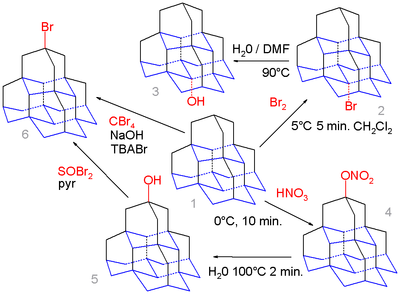
Спротивно на тоа, нитроксилацијата на 1 со азотна киселина го дава апикалниот нитрат 4 како посредник кој се хидролизира на апикалниот алкохол 5 поради поголемата стерична побарувачка на електрофилно активните NO−
2HNO+
3 видови. Овој алкохол може да реагира со тионил бромид до бромидот 6 и во серија чекори (не прикажани) со соодветниот тиол . Пентамантанот исто така може да реагира со тетрабромометан и тетра- <i id="mwiw">n</i> -бутиламониум бромид (TBABr) во реакција на слободните радикали на бромидот, но без селективност.
Потекло и појава[уреди | уреди извор]
Дијамантоидите се наоѓаат во зрели нафтени течности со висока температура (испарливи масла, кондензати и влажни гасови). Овие течности може да имаат до една лажица дијамантоиди по американски галон (3,78 литри). Преглед на Мело и Молдаван во 2005 година покажал дека иако јаглеродот во дијамантите не е од биолошко потекло, дијамантоидите пронајдени во нафтата се составени од јаглерод од биолошки извори. Ова било утврдено со споредување на односот на присутните јаглеродни изотопи.[10]
Оптички и електронски својства[уреди | уреди извор]
Оптичката апсорпција за сите дијамантоиди лежи длабоко во ултравиолетовиот спектрален регион со празнини во оптичкиот опсег околу 6 електронволти и повисоки.[11] Откриено е дека спектарот на секој дијамантоид ја одразува неговата индивидуална големина, форма и симетрија . Поради нивната добро дефинирана големина и структура, дијамантоидите служат и како модел систем за електронски пресметки на структурата.[12]
Многу од оптоелектронските својства на дијамантоидите се определени со разликата во природата на највисоките и најниските незафатени молекуларни орбитали: првата е масовна состојба, додека втората е површинска состојба. Како резултат на тоа, енергијата на најниската неокупирана молекуларна орбитала е приближно независна од големината на дијамантоидот.[13][14]
Откриено е дека дијамантоидите покажуваат негативен афинитет на електрони, што ги прави потенцијално корисни во уредите за емисија на електрони .[13][15]
Наводи[уреди | уреди извор]
- ↑ 1,0 1,1 Dahl, J. E.; Liu, S. G.; Carlson, R. M. K. (3 January 2003). „Isolation and Structure of Higher Diamondoids, Nanometer-Sized Diamond Molecules“. Science. 299: 96–99. doi:10.1126/science.1078239. PMID 12459548.
- ↑ Dahl, J. E. P.; Moldowan, J. M.; Peakman, T. M.; Clardy, J. C.; Lobkovsky, E.; Olmstead, M. M.; May, P. W.; Davis, T. J.; Steeds, J. W. (2003). „Isolation and Structural Proof of the Large Diamond Molecule, Cyclohexamantane (C26H30)“. Angewandte Chemie International Edition. 42 (18): 2040–2044. doi:10.1002/anie.200250794. PMID 12746817.
- ↑ Burns, W.; McKervey, M. A.; Mitchell, T. R.; Rooney, J. J. (1978). „A New Approach to the Construction of Diamondoid Hydrocarbons. Synthesis of anti-Tetramantane“. Journal of the American Chemical Society. 100 (3): 906–911. doi:10.1021/ja00471a041.
- ↑ Zhang, J.; Zhu, Z.; Feng, Y.; Ishiwata, H.; Miyata, Y.; Kitaura, R.; Dahl, J. E.; Carlson, R. M.; Fokina, N. A. (Mar 25, 2013). „Evidence of diamond nanowires formed inside carbon nanotubes from diamantane dicarboxylic acid“. Angewandte Chemie International Edition. 52 (13): 3717–3721. doi:10.1002/anie.201209192. PMID 23418054.
- ↑ Tkachenko, Boryslav A.; Fokina, Natalie A.; Chernish, Lesya V.; Dahl, Jeremy E. P.; Liu, Shenggao; Carlson, Robert M. K.; Fokin, Andrey A.; Schreiner, Peter R. (2006). „Functionalized Nanodiamonds Part 3: Thiolation of Tertiary/Bridgehead Alcohols“. Organic Letters. 8 (9): 1767–70. doi:10.1021/ol053136g. PMID 16623546.
- ↑ Markle, R. C. (2000). „Molecular building blocks and development strategies for molecular nanotechnology“. Nanotechnology. 11 (2): 89. Bibcode:2000Nanot..11...89M. doi:10.1088/0957-4484/11/2/309.
- ↑ García, J. C.; Justo, J. F.; Machado, W. V. M.; Assali, L. V. C. (2009). „Functionalized adamantane: building blocks for nanostructure self-assembly“. Physical Review B. 80 (12): 125421. arXiv:1204.2884. Bibcode:2009PhRvB..80l5421G. doi:10.1103/PhysRevB.80.125421.
- ↑ Garcia, J. C.; Assali, L. V. C.; Machado, W. V. M.; Justo, J. F. (2010). „Crystal engineering using functionalized adamantane“. J. Phys.: Condens. Matter. 22 (31): 315303. arXiv:1204.2863. Bibcode:2010JPCM...22E5303G. doi:10.1088/0953-8984/22/31/315303. PMID 21399359.
- ↑ Fokin, Andrey A.; Schreiner, Peter R.; Fokina, Natalie A.; Tkachenko, Boryslav A.; Hausmann, Heike; Serafin, Michael; Dahl, Jeremy E. P.; Liu, Shenggao; Carlson, Robert M. K. (2006). „Reactivity of [1(2,3)4]Pentamantane (Td-Pentamantane): A Nanoscale Model of Diamond“. The Journal of Organic Chemistry. 71 (22): 8532–8540. doi:10.1021/jo061561x. PMID 17064030.
- ↑ Mello, M. R.; Moldowan, J. M. (2005). „Petroleum: To Be Or Not To Be Abiogenic“. Search and Discovery.
- ↑ Landt, L.; Klünder, K.; Dahl, J. E.; Carlson, R. M. K.; Möller, T.; Bostedt, C. (2009). „Optical Response of Diamond Nanocrystals as a Function of Particle Size, Shape, and Symmetry“. Physical Review Letters. 103 (4): 047402. Bibcode:2009PhRvL.103d7402L. doi:10.1103/PhysRevLett.103.047402. PMID 19659398.
- ↑ Vörös, M.; Gali, A. (2009). „Optical absorption of diamond nanocrystals from ab initio density-functional calculations“. Physical Review B. 80 (16): 161411. Bibcode:2009PhRvB..80p1411V. doi:10.1103/PhysRevB.80.161411.
- ↑ 13,0 13,1 Drummond, N. D.; Williamson, A. J.; Needs, R. J.; Galli, G. (2005). „Electron emission from diamondoids: a diffusion quantum Monte Carlo study“. Physical Review Letters. 95 (9): 096801–096804. arXiv:0801.0381. Bibcode:2005PhRvL..95i6801D. doi:10.1103/PhysRevLett.95.096801. PMID 16197235.
- ↑ Willey, T. M.; Bostedt, C.; van Buuren, T.; Dahl, J. E.; Liu, S. G.; Carlson, R. M. K.; Terminello, L. J.; Möller, T. (2005). „Molecular Limits to the Quantum Confinement Model in Diamond Clusters“. Physical Review Letters (Submitted manuscript). 95 (11): 113401–113404. Bibcode:2005PhRvL..95k3401W. doi:10.1103/PhysRevLett.95.113401. PMID 16197003.
- ↑ Yang, W. L.; Fabbri, J. D.; Willey, T. M.; Lee, J. R. I.; Dahl, J. E.; Carlson, R. M. K.; Schreiner, P. R.; Fokin, A. A.; Tkachenko, B. A. (2007). „Monochromatic Electron Photoemission from Diamondoid Monolayers“ (PDF). Science. 316 (5830): 1460–1462. Bibcode:2007Sci...316.1460Y. doi:10.1126/science.1141811. PMID 17556579.
Надворешни врски[уреди | уреди извор]
- Група за истражување на кластери и нанокристали, Technische Universität Berlin
- Molecular Diamond Technologies, Chevron Texaco
- Нанотехнологијата и доаѓањето на дијамантската ера
- Ласерска Раманска спектроскопија и моделирање на дијамантоиди
- Електронски и оптички својства на дијамантоидите (бесплатно преземање)
- Дијамантоидни молекули: со апликации во биомедицината, науката за материјали, нанотехнологијата и науката за нафта
- Дијамантоидно функционализирани златни нанопразни како сензори за природни, мутирани и епигенетски модифицирани нуклеотиди на ДНК
