Фенол
| |||
| |||

| |||
| Систематско име | Бензенол | ||
Други називи
| |||
| Назнаки | |||
|---|---|---|---|
| 108-95-2 | |||
| ChEBI | CHEBI:15882 | ||
| ChEMBL | ChEMBL14060 | ||
| ChemSpider | 971 | ||
| DrugBank | DB03255 | ||
| |||
| 3Д-модел (Jmol) | Слика | ||
| KEGG | D00033 | ||
| PubChem | 996 | ||
| RTECS-бр. | SJ3325000 | ||
| |||
| UNII | 339NCG44TV | ||
| Својства | |||
| Хемиска формула | |||
| Моларна маса | 0 g mol−1 | ||
| Изглед | Безбојна кристална супстанца | ||
| Мирис | Слатко и катранасто | ||
| Густина | 1,07 g/cm3 | ||
| Точка на топење | |||
| Точка на вриење | |||
| 8,3 g/100 mL (20 °C) | |||
| log P | 1.48[2] | ||
| Парен притисок | 0,4 mmHg (20 °C)[3] | ||
| Киселост (pKa) |
| ||
| Конјуг. база | Феноксид | ||
| UV-vis (λmax) | 270,75 nm[5] | ||
| Диполен момент | 1,224 D | ||
| Pharmacology | |||
| ATC код | C05BB05 D08, N01, R02 | ||
| Опасност | |||
| GHS-ознаки: | |||
Пиктограми
|
   [6] [6]
| ||
Изјави за опасност
|
H301, H311, H314, H331, H341, H373[6] | ||
Изјави за претпазливост
|
P261, P280, P301+P310, P305+P351+P338, P310[6] | ||
| NFPA 704 | |||
| Температура на запалување | {{{value}}} | ||
| Граници на запалливост | 1.8–8.6%[3] | ||
| Смртоносна доза или концентрација: | |||
LD50 (средна доза)
|
| ||
LDLo (најниска објавена)
|
| ||
LC50 (средна концентрација)
|
| ||
| NIOSH (здравствени граници во САД): | |||
PEL (дозволива)
|
TWA 5 ppm (19 mg/m3) [кожа][3] | ||
REL (препорачана)
|
| ||
IDLH (непосредна опасност)
|
250 ppm[3] | ||
| Безбедносен лист | [2] | ||
| Дополнителни податоци | |||
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |||
| Наводи | |||
Фенол (систематски именуван како Бензенол, исто така наречен карболна киселина или фенолна киселина) е органско ароматично соединение со молекулска формула C
6H
5OH. Тоа е бела кристална цврста материја која е испарлива. Молекулата се состои од фенилна група (–C
6H
5) врзана за хидроксилна група (–OH). Слабо кисела и бара внимателно ракување бидејќи може да предизвика хемиски изгореници.
Фенолот најпрво бил извлечен од катран од јаглен, но денес се произведува во голем обем (околу 7 милијарди kg/годишно) од суровини добиени од нафта. Тоа е важна индустриска стока како прекурсор на многу материјали и корисни соединенија.[8] Примарно се користи за синтеза на пластика и сродни материјали. Фенолот и неговите хемиски деривати се неопходни за производство на поликарбонати, епоксиди, бакелит, најлон, детергенти, хербициди како што се фенокси хербициди и бројни фармацевтски лекови.
Својства[уреди | уреди извор]
Фенолот е органско соединение значително растворливо во вода, со околу 84,2 g растворливо во 1000 mL (0,895 M). Можни се хомогени мешавини на фенол и вода во однос на масата фенол кон вода од ~ 2,6 и повисоки. Натриумовата сол на фенолот, натриум феноксид, е многу повеќе растворлива во вода.
Киселост[уреди | уреди извор]
Фенолот е слаба киселина. Во воден раствор во pH опсег од околу 8 - 12 е во рамнотежа со фенолатниот анјон C
6H
5O−
(исто така наречен феноксид или карболат):[9]

Фенолот е покисел од алифатичните алкохоли. Разликата во pKa се припишува на резонантната стабилизација на феноксидниот анјон. На овој начин, негативниот полнеж на кислородот се делокализира на орто и пара јаглеродните атоми преку пи системот.[10] Алтернативно објаснување ја вклучува рамката на сигма, постулирајќи дека доминантен ефект е индукцијата од поелектронегативните sp2 хибридизирани јаглероди; релативно помоќното индуктивно повлекување на густината на електроните што го обезбедува системот sp2 во споредба со системот sp3 и овозможува голема стабилизација на оксијанот. Во прилог на второто објаснување pKa на енолот на ацетон во вода е 10,9, што го прави само малку помалку кисел од фенолот (pKa 10,0).[11] Така, поголемиот број на резонантни структури достапни за феноксидот во споредба со ацетонскиот енолат се чини дека придонесува многу малку за неговата стабилизација. Меѓутоа, ситуацијата се менува кога се исклучуваат ефектите на растворање. Една неодамнешна in silico споредба на киселоста на гасната фаза на винилогите на фенол и циклохексанол во конформации кои дозволуваат или исклучуваат стабилизација на резонанца доведува до заклучок дека околу 1⁄3 од зголемената киселост на фенолот се припишува на индуктивните ефекти, со преостанатата сметкa за резонанца за преостанатата разлика.[12]
Водородно поврзување[уреди | уреди извор]
Во растворувачите на јаглерод тетрахлорид и алкани, фенол водородните врски се поврзуваат со широк опсег на Луисови бази, како што се пиридин, диетил етер и диетил сулфид. Проучени се енталпиите на формирањето на адуктот и поместувањата на фреквенцијата на –OH IR кои го придружуваат формирањето на адуктот.[13] Фенолот е класифициран како тврда киселина која е компатибилна со односот C/E на моделот ECW со EA = 2.27 и CA = 1.07. Релативната јачина на прифаќање на фенолот кон серија бази, наспроти другите Луисови киселини, може да се илустрира со C-B графиците.[14][15]
Феноксиден анјон[уреди | уреди извор]
Феноксидниот анјон е силен нуклеофил со нуклеофилност споредлива со онаа на карбанјони или терциерни амини.[16] Може да реагира и на местата на кислород или на јаглерод како амбидентен нуклеофил (види HSAB теорија). Општо земено, нападот со кислород на анјоните на феноксидот е кинетички фаворизиран, додека нападот со јаглерод е термодинамички претпочитан (види Термодинамичка контрола наспроти кинетичка реакција). Мешан напад на кислород/јаглерод и со тоа обично се забележува губење на селективноста ако брзината на реакцијата достигне контрола на дифузијата.[17]
Тавтомеризам[уреди | уреди извор]

Фенолот покажува кето-енол тавтомеризам со неговиот нестабилен кето тавтомер циклохексадиенон, но само мал дел од фенол постои како кето форма. Константата на рамнотежа за енолизација е приближно 10−13, што значи дека само една од секои десет трилиони молекули е во кето форма во секој момент.[18] Малата количина на стабилизација добиена со размена на врска C=C за врска C=O е повеќе од неутрализирана со големата дестабилизација што произлегува од губењето на ароматичноста. Затоа, фенолот во суштина постои целосно во форма на енол.[19] 4,4' супституираниот циклохексадиенон може да претрпи преуредување диенон-фенол во кисели услови и да формира стабилен 3,4-дисупституиран фенол.[20]
Феноксидите се енолати стабилизирани со ароматичноста. Во нормални околности, феноксидот е пореактивен на позицијата на кислород, но позицијата на кислород е „тврд“ нуклеофил, додека алфа-јаглеродните позиции имаат тенденција да бидат „меки“.[21]
Реакции[уреди | уреди извор]

Фенолот е многу реактивен кон електрофилна ароматична супституција. Зголемената нуклеофилност се припишува на донацијата на пи електронската густина од О во прстенот. Многу групи може да се прикачат на прстенот, преку халогенација, ацилација, сулфонација и сродни процеси. Прстенот на фенол е толку силно активиран што бромирањето и хлорирањето лесно доведуваат до полисупституција.[22] Фенолот реагира со разредена азотна киселина на собна температура за да добие мешавина од 2-нитрофенол и 4-нитрофенол додека со концентрирана азотна киселина се воведуваат дополнителни нитро групи, на пр. да се даде 2,4,6-тринитрофенол.
Водните раствори на фенол се слабо кисели и го претвораат синиот лакмус малку до црвено. Фенолот се неутрализира со натриум хидроксид, формирајќи натриум фенат или фенолат, но бидејќи е послаб од јаглеродната киселина, не може да се неутрализира со натриум бикарбонат или натриум карбонат за да се ослободи јаглерод диоксид.
Кога мешавина од фенол и бензоил хлорид се протресуваат во присуство на разреден раствор на натриум хидроксид, се формира фенил бензоат. Ова е пример за реакцијата Шотен-Бауман:
Фенолот се редуцира во бензен кога се дестилира со цинкова прашина или кога неговата пареа се пренесува преку гранули цинк на 400 °C:[23]
Кога фенолот се третира со диазометан во присуство на бор трифлуорид (BF
3), се добива анизол како главен производ и азотен гас како нуспроизвод.
Кога фенолот реагира со раствор на железо(III) хлорид, се формира интензивно виолетов раствор.
Производство[уреди | уреди извор]
Поради комерцијалното значење на фенолот, развиени се многу методи за негово производство, но процесот на кумен е доминантна технологија.
Куменски процес[уреди | уреди извор]
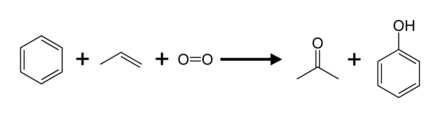
Сметката за 95 % од производството (2003) е куменскиот процес, исто така наречен Hock процес. Тој вклучува делумна оксидација на куменот (изопропилбензен) преку преуредувањето на Хок:[8] Во споредба со повеќето други процеси, процесот на кумен користи релативно благи услови и релативно евтини суровини. За процесот да биде економичен, мора да се бараат и фенолот и нуспроизводот на ацетон.[24][25] Во 2010 година, светската побарувачка за ацетон беше приближно 6,7 милиони тони, од кои 83 проценти беа задоволни со ацетон произведен со процесот на кумен.
Патека аналогна на процесот на кумен започнува со циклохексилбензен. Се оксидира до хидропероксид, слично на производството на кумен хидропероксид. Преку Hock преуредувањето, циклохексилбензен хидропероксид се расцепува и дава фенол и циклохексанон. Циклохексанонот е важен прекурсор на некои најлони.[26]
Оксидација на бензен и толуен[уреди | уреди извор]
Директната оксидација на бензенот (C
6H
6) е теоретски можен и од голем интерес, но не е комерцијализиран:
Азотниот оксид е потенцијално „зелен“ оксидант кој е посилен оксидант од O2. Сепак, правците за генерирање на азотен оксид остануваат неконкурентни.[24][26][27]
Електросинтезата која користи наизменична струја дава фенол од бензен.[28]
Оксидацијата на толуенот, развиена од Dow Chemical, вклучува бакар-катализирана реакција на стопениот натриум бензоат со воздух:
Реакцијата се предлага да продолжи преку формирање на бензиолсалицилат.[8]
Постари методи[уреди | уреди извор]
Раните методи се потпираа на екстракција на фенол од деривати на јаглен или хидролиза на деривати на бензен.
Хидролиза на бензенсулфонска киселина[уреди | уреди извор]
Рана комерцијална рута, развиена од Баер и Монсанто во раните 1900-ти, започнува со реакција на силна база со бензенсулфонска киселина. Конверзијата е претставена со оваа идеализирана равенка:[29]
Хидролиза на хлоробензен[уреди | уреди извор]
Хлоробензенот може да се хидролизира до фенол користејќи база (Дау процес) или пареа (процес Рашиг-Хукер):[25][26][30]
Овие методи страдаат од цената на хлоробензенот и потребата за отстранување на хлоридот по производ.
Пиролиза на јаглен[уреди | уреди извор]
Фенолот е исто така повратен нуспроизвод од пиролиза на јаглен.[30] Во Лумус процесот, оксидацијата на толуен во бензоева киселина се спроведува посебно.
Miscellaneous methods[уреди | уреди извор]

Фенилдиазониум солите се хидролизираат до фенол. Методот не е од комерцијален интерес бидејќи прекурсорот е скап.[31]
Салицилна киселина декарбоксилира до фенол.[32]
Употреба[уреди | уреди извор]
Главните употреби на фенолот, кои трошат две третини од неговото производство, вклучуваат негова конверзија во прекурсори за пластика. Кондензацијата со ацетон дава бисфенол-А, клучен прекурсор на поликарбонати и епоксидни смоли. Кондензацијата на фенол, алкилфеноли или дифеноли со формалдехид дава фенолни смоли, чиј познат пример е бакелит. Делумна хидрогенизација на фенолот дава циклохексанон, прекурсор на најлон. Нејонските детергенти се произведуваат со алкилација на фенол за да се добијат алкилфеноли, на пример, нонилфенол, кои потоа се подложени на етоксилација.[8]
Фенолот е исто така разновиден прекурсор на голема колекција на лекови, особено аспирин, но и многу хербициди и фармацевтски лекови.
Фенолот е компонента во техниката на течно-течна фенол-хлороформ екстракција што се користи во молекуларната биологија за добивање на нуклеински киселини од ткива или примероци од клеточна култура. Во зависност од рН на растворот може да се екстрахира или ДНК или РНК.
Медицински[уреди | уреди извор]
Фенолот е широко користен како антисептик. Неговата употреба беше пионер од Џозеф Листер.
Од раните 1900-ти до 1970-тите се користеше во производството на карболичен сапун. Концентрираните фенолни течности најчесто се користат за траен третман на враснати нокти на прстите, процедура позната како хемиска матриксектомија. Процедурата првпат беше опишана од Ото Бол во 1945 година. Оттогаш таа стана хемикалија од избор за хемиски матриксектомии што ги изведуваат лекари-подијатри.
Концентрираниот течен фенол може да се користи локално како локален анестетик за отолошки процедури, како што се миринготомија и поставување туба за тимпанотомија, како алтернатива на општата анестезија или други локални анестетици. Исто така, има хемостатички и антисептички квалитети што го прават идеален за оваа употреба.
Спреј со фенол, обично со 1,4 % фенол како активна состојка, медицински се користи за лекување на болки во грлото.[33] Тоа е активна состојка во некои орални аналгетици како што се Chloraseptic спреј, TCP и Carmex.[34]
Други употреби[уреди | уреди извор]
Фенолот е толку евтин што привлекува многу мали употреби. Тоа е компонента на индустриски стриптизери за боја што се користат во воздухопловната индустрија за отстранување на епоксидни, полиуретански и други хемиски отпорни премази.[35]
Дериватите на фенол се користат во подготовката на козметички производи, вклучувајќи креми за сончање,[36] бои за коса и препарати за осветлување на кожата.[37] Сепак, поради загриженост за безбедноста, фенолот е забранет за употреба во козметичките производи во Европската унија[38][39] и Канада.[40][41]
Историја[уреди | уреди извор]
Фенолот бил откриен во 1834 година од Фридлиб Фердинанд Рунге, кој го извадил (во нечиста форма) од катран од јаглен.[42] Рунге го нарекувал фенол „Karbolsäure“ (јаглен-масло-киселина, карболна киселина). Јаглениот катран остана примарен извор до развојот на петрохемиската индустрија. Францускиот хемичар Огист Лоран извлече фенол во чиста форма, како дериват на бензен, во 1841 година.[43]
Во 1836 година, Огист Лоран го измислил името „phène“ за бензен;[44] ова е коренот на зборот „фенол“ и „фенил“. Во 1843 година, францускиот хемичар Чарлс Герхард го измислил името „фенол“.[45]
Антисептичките својства на фенолот ги користел Сер Џозеф Листер (1827–1912) во неговата пионерска техника на антисептичка хирургија. Листер одлучи дека самите рани мораат темелно да се исчистат. Потоа ги покри раните со парче партал или влакненца покриена со карболна киселина (фенол).[46] Иритацијата на кожата предизвикана од континуираната изложеност на фенол на крајот доведе до воведување на асептични (без микробни) техники во хирургијата.
Џозеф Листер бил студент на Универзитетскиот колеџ во Лондон под водство на Роберт Листон, а подоцна се искачил на ранг на хирург во Кралската амбуланта во Глазгов. Листер експериментирал со ткаенини покриени со карболна киселина откако ги проучувал делата и експериментите на неговиот современик Луј Пастер во стерилизирање на различни биолошки медиуми. Листер бил инспириран да се обиде да најде начин да ги стерилизира живите рани, што не можело да се направи со топлината што ја бараат експериментите на Пастер. Во испитувањето на истражувањето на Пастер, Листер почна да ја спојува својата теорија: дека пациентите ги убиваат бактериите. Тој теоретизираше дека ако микробите можат да бидат убиени или спречени, нема да дојде до инфекција. Листер образложил дека може да се користи хемикалија за уништување на микроорганизмите кои предизвикуваат инфекција.[47]
Во меѓувреме, во Карлајл, Англија, официјални лица експериментираа со третман на отпадни води со користење на карболна киселина за да го намалат мирисот на канализациони канали. Откако слушнал за овие случувања и откако претходно експериментирал со други хемикалии за антисептички цели без многу успех, Листер решил да проба карболна киселина како антисептик за рани. Првата шанса ја имал на 12 август 1865 година, кога примил пациент: единаесетгодишно момче со фрактура на коската на тибијата која му ја прободела кожата на потколеницата. Вообичаено, ампутација би била единственото решение. Сепак, Листер реши да проба карболна киселина. Откако ја наместил коската и ја поддржал ногата со шини, тој натопил чисти памучни крпи во неразредена карболна киселина и ги нанел на раната, покриена со слој лимена фолија, оставајќи ги четири дена. Кога ја проверил раната, Листер бил пријатно изненаден кога не нашол знаци на инфекција, само црвенило во близина на рабовите на раната од благо горење од карболната киселина. Повторно нанесувајќи свежи завои со разредена карболна киселина, момчето можело да оди дома по околу шест недели третман.[48]
До 16 март 1867 година, кога биле објавени првите резултати од работата на Листер во Лансет, тој лекувал вкупно единаесет пациенти користејќи го својот нов антисептички метод. Од нив, само еден умрел и тоа поради компликација што немала никаква врска со техниката на облекување на рани на Листер. Сега, за прв пат, пациентите со сложени фрактури веројатно ќе ја напуштат болницата со сите нивни екстремитети непроменети
- — Ричард Холингем, Крв и црева: Историја на хирургијата, стр. 62[48]
Пред да се воведат антисептички операции во болницата, имаше шеснаесет смртни случаи во триесет и пет хируршки случаи. Скоро еден од секои двајца пациенти починал. По воведувањето на антисептичката операција во летото 1865 година, имало само шест смртни случаи во четириесет случаи. Стапката на смртност падна од речиси 50 проценти на околу 15 проценти. Тоа беше извонредно достигнување
- — Ричард Холингем, Крв и црева: Историја на хирургијата, стр. 63[49]
Фенолот беше главната состојка на Carbolic Smoke Ball, неефикасна направа продадена во Лондон во 19 век како заштита од грип и други заболувања и предмет на познатиот законски случај Carlill v Carbolic Smoke Ball Company.
Втора светска војна[уреди | уреди извор]
Токсичниот ефект на фенолот врз централниот нервен систем, дискутиран подолу, предизвикува ненадеен колапс и губење на свеста и кај луѓето и кај животните; состојба на грчеви им претходи на овие симптоми поради моторната активност контролирана од централниот нервен систем.[50] Инјекциите на фенол биле користени како средство за поединечно погубување од нацистичка Германија за време на Втората светска војна.[51] Првично беше користен од нацистите во 1939 година како дел од програмата за евтаназија на Aktion T4.[52] Германците дознаа дека истребувањето на помалите групи е поекономично со инјектирање на фенол на секоја жртва. Инјекциите на фенол беа дадени на илјадници луѓе. Максимилијан Колбе исто така беше убиен со инјекција со фенол откако преживеа двенеделна дехидрација и глад во Аушвиц кога доброволно се пријави да умре наместо некој странец. Приближно еден грам е доволен за да предизвика смрт.[53]
Појави[уреди | уреди извор]
Фенолот е нормален метаболички производ, кој се излачува во количини до 40 mg/L во човечка урина.[50]
Секрецијата на темпоралната жлезда на машките слонови покажа присуство на фенол и 4-метилфенол за време на мустата.[54][55]
Тоа е исто така едно од хемиските соединенија кои се наоѓаат во кастореумот. Ова соединение се внесува од растенијата што ги јаде дабарот.[56]
Појава во вискито[уреди | уреди извор]
Фенолот е мерлива компонента во аромата и вкусот на препознатливото шкотско виски Islay,[57] gгенерално ~ 30 ppm, но може да биде над 160 ppm во сладниот јачмен што се користи за производство на виски.[58] Оваа количина е различна и веројатно повисока од количината во дестилатот.[57]
Биоразградување[уреди | уреди извор]
Cryptanaerobacter phenolicus е вид на бактерија која произведува бензоат од фенол преку 4-хидроксибензоат.[59] Rhodococcus phenolicus е вид на бактерија способна да го разградува фенолот како единствен извор на јаглерод.[60]
Токсичност[уреди | уреди извор]
Фенолот и неговите пареи се корозивни за очите, кожата и респираторниот тракт.[61] Нејзиното корозивно дејство врз кожата и мукозните мембрани се должи на дегенерирачкиот ефект на белковините. Повторениот или продолжениот контакт на кожата со фенол може да предизвика дерматитис, па дури и изгореници од втор и трет степен.[62] Вдишување на пареа на фенол може да предизвика едем на белите дробови.[61] Супстанцијата може да предизвика штетни ефекти врз централниот нервен систем и срцето, што резултира со дисритмија, напади и кома.[63] Може да бидат засегнати и бубрезите. Долготрајното или повеќекратното изложување на супстанцијата може да има штетни ефекти врз црниот дроб и бубрезите.[64] Нема докази дека фенолот предизвикува рак кај луѓето.[65] Покрај неговите хидрофобни ефекти, друг механизам за токсичност на фенолот може да биде формирањето на феноксилни радикали.[66]
Бидејќи фенолот релативно брзо се апсорбира преку кожата, може да се појави и системско труење покрај локалните каустични изгореници.[50] Ресорптивното труење со големо количество фенол може да се појави дури и со само мала површина на кожата, што брзо доведува до парализа на централниот нервен систем и силен пад на телесната температура. LD50 за орална токсичност е помала од 500 mg/kg за кучиња, зајаци или глувци; минималната смртоносна доза за луѓе беше наведена како 140 mg/kg.[50] Агенцијата за токсични супстанции и регистар на болести (ATSDR), американското Министерство за здравство и човечки услуги наведува дека фаталната доза за ингестија на фенол е од 1 до 32 g.[67]
Хемиските изгореници од изложеност на кожата може да се деконтаминираат со миење со полиетилен гликол,[68] изопропил алкохол,[69] или можеби дури и обилни количини вода.[70] Потребно е отстранување на контаминираната облека, како и итно болничко лекување за големи прскања. Ова е особено важно ако фенолот се меша со хлороформ (вообичаена смеса во молекуларната биологија за прочистување на ДНК и РНК). Фенолот е исто така репродуктивен токсин кој предизвикува зголемен ризик од спонтан абортус и мала родилна тежина што укажува на забавен развој во матката.[71]
Феноли[уреди | уреди извор]
Зборот фенол исто така се користи за да се однесува на кое било соединение кое содржи шестчлен ароматичен прстен, директно поврзан со хидроксилна група (-OH). Така, фенолите се класа на органски соединенија од кои фенолот дискутиран во овој напис е наједноставниот член.
Поврзано[уреди | уреди извор]
Наводи[уреди | уреди извор]
- ↑ „Front Matter“. Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. стр. 690. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
Only one name is retained, phenol, for C6H5-OH, both as a preferred name and for general nomenclature.
- ↑ „Phenol_msds“.
- ↑ 3,0 3,1 3,2 3,3 3,4 „Џебен водич за опасните хемиски материи #0493“. Национален институт за безбедност и здравје при работа (NIOSH). (англиски)
- ↑ Kütt, Agnes; Movchun, Valeria; Rodima, Toomas; Dansauer, Timo; Rusanov, Eduard B.; Leito, Ivo; Kaljurand, Ivari; Koppel, Juta; Pihl, Viljar; Koppel, Ivar; Ovsjannikov, Gea; Toom, Lauri; Mishima, Masaaki; Medebielle, Maurice; Lork, Enno; Röschenthaler, Gerd-Volker; Koppel, Ilmar A.; Kolomeitsev, Alexander A. (2008). „Pentakis(trifluoromethyl)phenyl, a Sterically Crowded and Electron-withdrawing Group: Synthesis and Acidity of Pentakis(trifluoromethyl)benzene, -toluene, -phenol, and -aniline“. The Journal of Organic Chemistry. 73 (7): 2607–20. doi:10.1021/jo702513w. PMID 18324831.
- ↑ „Phenol“. Архивирано од изворникот на 2018-10-08. Посетено на 2023-03-01.
- ↑ 6,0 6,1 6,2 Sigma-Aldrich Co., Phenol. Посетено на 2022-02-15.
- ↑ 7,0 7,1 7,2 „Phenol“. Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ 8,0 8,1 8,2 8,3 Weber, Manfred; Weber, Markus; Kleine-Boymann, Michael (2004), „Phenol“, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a19_299.pub2
- ↑ Предлошка:March6th
- ↑ Organic Chemistry 2nd Ed. John McMurry ISBN 0-534-07968-7
- ↑ „Архивиран примерок“ (PDF). Архивирано од изворникот (PDF) на 2013-01-30. Посетено на 2007-03-14.
- ↑ Pedro J. Silva (2009). „Inductive and Resonance Effects on the Acidities of Phenol, Enols, and Carbonyl α-Hydrogens“. J. Org. Chem. 74 (2): 914–916. doi:10.1021/jo8018736. hdl:10284/3294. PMID 19053615.(Solvation effects on the relative acidities of acetaldehyde enol and phenol described in the Supporting Information)
- ↑ Drago, R S. Physical Methods For Chemists, (Saunders College Publishing 1992), ISBN 0-03-075176-4
- ↑ Laurence, C. and Gal, J-F. Lewis Basicity and Affinity Scales, Data and Measurement, (Wiley 2010) pp 50-51 ISBN 978-0-470-74957-9
- ↑ Cramer, R. E.; Bopp, T. T. (1977). „Graphical display of the enthalpies of adduct formation for Lewis acids and bases“. Journal of Chemical Education. 54: 612–613. doi:10.1021/ed054p612. The plots shown in this paper used older parameters. Improved E&C parameters are listed in ECW model.
- ↑ [1]. Mayr’s Database of Reactivity Parameters. Retrieved July 10, 2019.
- ↑ Mayer, Robert J.; Breugst, Martin; Hampel, Nathalie; Ofial, Armin R.; Mayr, Herbert (2019-06-26). „Ambident Reactivity of Phenolate Anions Revisited: A Quantitative Approach to Phenolate Reactivities“. Journal of Organic Chemistry. 84 (14): 8837–8858. doi:10.1021/acs.joc.9b01485. PMID 31241938. S2CID 195696760.
- ↑ Capponi, Marco; Gut, Ivo G.; Hellrung, Bruno; Persy, Gaby; Wirz, Jakob (1999). „Ketonization equilibria of phenol in aqueous solution“. Can. J. Chem. 77 (5–6): 605–613. doi:10.1139/cjc-77-5-6-605.
- ↑ Предлошка:Clayden
- ↑ Arnold, Richard T.; Buckley, Jay S. (1 May 1949). „The Dienone-Phenol Rearrangement. II. Rearrangement of 1-Keto-4-methyl-4-phenyl-1,4-dihydronaphthalene“. J. Am. Chem. Soc. 71 (5): 1781. doi:10.1021/ja01173a071.
- ↑ David Y. Curtin; Allan R. Stein (1966). „2,6,6-Trimethyl-2,4-Cyclohexadione“. Organic Syntheses. 46: 115. doi:10.15227/orgsyn.046.0115. Архивирано од изворникот на 2011-06-05. Посетено на 2010-03-31. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ François Muller, Liliane Caillard (2011), „Chlorophenols“, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a07_001.pub2CS1-одржување: користи параметар authors (link)
- ↑ Roscoe, Henry (1891). A treatise on chemistry, Volume 3, Part 3. London: Macmillan & Co. стр. 23.
- ↑ 24,0 24,1 „Phenol -- The essential chemical industry online“. 2017-01-11. Посетено на 2018-01-02.
- ↑ 25,0 25,1 „Direct Routes to Phenol“. Архивирано од изворникот на 2007-04-09. Посетено на 2007-04-09.
- ↑ 26,0 26,1 26,2 Plotkin, Jeffrey S. (2016-03-21). „What's New in Phenol Production?“. American Chemical Society. Архивирано од изворникот на 2019-10-27. Посетено на 2018-01-02.
- ↑ Parmon, V. N.; Panov, G. I.; Uriarte, A.; Noskov, A. S. (2005). „Nitrous oxide in oxidation chemistry and catalysis application and production“. Catalysis Today. 100 (2005): 115–131. doi:10.1016/j.cattod.2004.12.012.
- ↑ Lee, Byungik; Naito, Hiroto; Nagao, Masahiro; Hibino, Takashi (9 July 2012). „Alternating-Current Electrolysis for the Production of Phenol from Benzene“. Angewandte Chemie International Edition. 51 (28): 6961–6965. doi:10.1002/anie.201202159. PMID 22684819.
- ↑ Wittcoff, H.A., Reuben, B.G. Industrial Organic Chemicals in Perspective. Part One: Raw Materials and Manufacture. Wiley-Interscience, New York. 1980.
- ↑ 30,0 30,1 Franck, H.-G., Stadelhofer, J.W. Industrial Aromatic Chemistry. Springer-Verlag, New York. 1988. pp. 148-155.
- ↑ 31,0 31,1 Kazem-Rostami, Masoud (2017). „Amine to phenol conversion“. Synlett. 28 (13): 1641–1645. doi:10.1055/s-0036-1588180. S2CID 99294625.
- ↑ Kaeding, Warren W. (1 September 1964). „Oxidation of Aromatic Acids. IV. Decarboxylation of Salicylic Acids“. The Journal of Organic Chemistry. 29 (9): 2556–2559. doi:10.1021/jo01032a016.
- ↑ „Phenol spray“. drugs.com.
- ↑ „How Does Our Lip Balm Work“. Carmex. Архивирано од изворникот на 18 February 2015. Посетено на 18 February 2015.
- ↑ „CH207 Aircraft paintstripper, phenolic, acid“ (PDF). Callington. 14 October 2009. Архивирано од изворникот (PDF) на 23 September 2015. Посетено на 25 August 2015.
- ↑ A. Svobodová; J. Psotová; D. Walterová (2003). „Natural Phenolics in the Prevention of UV-Induced Skin Damage. A Review“. Biomed. Papers. 147 (2): 137–145. doi:10.5507/bp.2003.019. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ DeSelms, R. H.; UV-Active Phenol Ester Compounds; Enigen Science Publishing: Washington, DC, 2008. Архивирано на 3 октомври 2011 г.
- ↑ „Prohibited substances in cosmetic product (Annex II, #1175, Phenol) - European Commission“. ec.europa.eu (англиски). Посетено на 2018-07-06.
- ↑ „CosIng - Cosmetics - GROWTH - European Commission“. ec.europa.eu (англиски). Посетено на 2018-07-06.
- ↑ Canada, Health (2004-06-18). „Cosmetic Ingredient Hotlist - Canada.ca“. www.canada.ca (англиски). Посетено на 2018-07-06.
- ↑ Canada, Health (2004-06-18). „Cosmetic Ingredient Hotlist: Prohibited and Restricted Ingredients - Canada.ca“. www.canada.ca (англиски). Посетено на 2018-07-06.
- ↑ F. F. Runge (1834) "Ueber einige Produkte der Steinkohlendestillation" (On some products of coal distillation), Annalen der Physik und Chemie, 31: 65-78. On page 69 of volume 31, Runge names phenol "Karbolsäure" (coal-oil-acid, carbolic acid). Runge characterizes phenol in: F. F. Runge (1834) "Ueber einige Produkte der Steinkohlendestillation," Annalen der Physik und Chemie, 31: 308-328.
- ↑ Auguste Laurent (1841) "Mémoire sur le phényle et ses dérivés" (Memoir on benzene and its derivatives), Annales de Chimie et de Physique, series 3, 3: 195-228. On page 198, Laurent names phenol "hydrate de phényle" and "l'acide phénique".
- ↑ Auguste Laurent (1836) "Sur la chlorophénise et les acides chlorophénisique et chlorophénèsique," Annales de Chemie et de Physique, vol. 63, pp. 27–45, see p. 44: Je donne le nom de phène au radical fondamental des acides précédens (φαινω, j'éclaire), puisque la benzine se trouve dans le gaz de l'éclairage. (I give the name of "phène" (φαινω, I illuminate) to the fundamental radical of the preceding acid, because benzene is found in illuminating gas.)
- ↑ Gerhardt, Charles (1843) "Recherches sur la salicine," Annales de Chimie et de Physique, series 3, 7: 215-229. Gerhardt coins the name "phénol" on page 221.
- ↑ Lister, Joseph (1867). „Antiseptic Principle Of The Practice Of Surgery“.
- ↑ Hollingham, Richard (2008). Blood and Guts: A History of Surgery. BBC Books - Random House. стр. 61. ISBN 9781407024530.
- ↑ 48,0 48,1 Hollingham, Richard (2008). Blood and Guts: A History of Surgery. BBC Books - Random House. стр. 62. ISBN 9781407024530.
- ↑ Hollingham, Richard (2008). Blood and Guts: A History of Surgery. BBC Books - Randomhouse. стр. 63. ISBN 9781407024530.
- ↑ 50,0 50,1 50,2 50,3 „Phenol“. Ullmann's Encyclopedia of Industrial Chemistry. 25. Wiley-VCH. 2003. стр. 589–604.
- ↑ The Experiments by Peter Tyson. NOVA
- ↑ The Nazi Doctors Архивирано на 22 октомври 2017 г., Chapter 14, Killing with Syringes: Phenol Injections. By Dr. Robert Jay Lifton
- ↑ „Killing through phenol injection“. Auschwitz: Final Station Extermination. Linz, Austria: Johannes Kepler University. Архивирано од изворникот на 2006-11-12.
- ↑ Rasmussen, L.E.L; Perrin, Thomas E (1999). „Physiological Correlates of Musth“. Physiology & Behavior. 67 (4): 539–49. doi:10.1016/S0031-9384(99)00114-6. PMID 10549891. S2CID 21368454.
- ↑ Musth in elephants. Deepa Ananth, Zoo's print journal, 15(5), pages 259-262 (article)
- ↑ The Beaver: Its Life and Impact. Dietland Muller-Schwarze, 2003, page 43 (book at google books)
- ↑ 57,0 57,1 „Peat, Phenol and PPM, by Dr P. Brossard“ (PDF). Посетено на 2008-05-27.
- ↑ „Bruichladdich“. Bruichladdich. BDCL. Архивирано од изворникот на 21 April 2016. Посетено на 8 August 2015.
- ↑ Juteau, P.; Côté, V; Duckett, MF; Beaudet, R; Lépine, F; Villemur, R; Bisaillon, JG (2005). „Cryptanaerobacter phenolicus gen. nov., sp. nov., an anaerobe that transforms phenol into benzoate via 4-hydroxybenzoate“. International Journal of Systematic and Evolutionary Microbiology. 55 (Pt 1): 245–50. doi:10.1099/ijs.0.02914-0. PMID 15653882.
- ↑ Rehfuss, Marc; Urban, James (2005). „Rhodococcus phenolicus sp. nov., a novel bioprocessor isolated actinomycete with the ability to degrade chlorobenzene, dichlorobenzene and phenol as sole carbon sources“. Systematic and Applied Microbiology. 28 (8): 695–701. doi:10.1016/j.syapm.2005.05.011. PMID 16261859.
- ↑ 61,0 61,1 Budavari, S, уред. (1996). „The Merck Index: An Encyclopedia of Chemical, Drugs, and Biologicals“. Whitehouse Station, NJ: Merck. Наводот journal бара
|journal=(help) - ↑ Lin TM, Lee SS, Lai CS, Lin SD (June 2006). „Phenol burn“. Burns: Journal of the International Society for Burn Injuries. 32 (4): 517–21. doi:10.1016/j.burns.2005.12.016. PMID 16621299.
- ↑ Warner, MA; Harper, JV (1985). „Cardiac dysrhythmias associated with chemical peeling with phenol“. Anesthesiology. 62 (3): 366–7. doi:10.1097/00000542-198503000-00030. PMID 2579602.
- ↑ World Health Organization/International Labour Organization: International Chemical Safety Cards, http://www.inchem.org/documents/icsc/icsc/eics0070.htm
- ↑ U.S. Department of Health and Human Services. „How can phenol affect my health?“ (PDF). Toxicological Profile for Phenol: 24.
- ↑ Hanscha, Corwin; McKarns, Susan C; Smith, Carr J; Doolittle, David J (June 15, 2000). „Comparative QSAR evidence for a free-radical mechanism of phenol-induced toxicity“. Chemico-Biological Interactions. 127 (1): 61–72. doi:10.1016/S0009-2797(00)00171-X. PMID 10903419.
- ↑ „Medical Management Guidelines for Phenol (C6H6O)“. Agency for Toxic Substances and Disease Registry. U.S. Department of Health and Human Services. October 21, 2014. Посетено на 8 August 2015.
- ↑ Brown, VKH; Box, VL; Simpson, BJ (1975). „Decontamination procedures for skin exposed to phenolic substances“. Archives of Environmental Health. 30 (1): 1–6. doi:10.1080/00039896.1975.10666623. PMID 1109265.
- ↑ Hunter, DM; Timerding, BL; Leonard, RB; McCalmont, TH; Schwartz, E (1992). „Effects of isopropyl alcohol, ethanol, and polyethylene glycol/industrial methylated spirits in the treatment of acute phenol burns“. Annals of Emergency Medicine. 21 (11): 1303–7. doi:10.1016/S0196-0644(05)81891-8. PMID 1416322.
- ↑ Pullin, TG; Pinkerton, MN; Johnston, RV; Kilian, DJ (1978). „Decontamination of the skin of swine following phenol exposure: a comparison of the relative efficacy of water versus polyethylene glycol/industrial methylated spirits“. Toxicol Appl Pharmacol. 43 (1): 199–206. doi:10.1016/S0041-008X(78)80044-1. PMID 625760.
- ↑ PubChem. „Phenol“. pubchem.ncbi.nlm.nih.gov (англиски). Посетено на 2019-03-19.
Надворешни врски[уреди | уреди извор]
- International Chemical Safety Card 0070
- Phenol Material Safety Data Sheet
- National Pollutant Inventory: Phenol Fact Sheet
- NIOSH Pocket Guide to Chemical Hazards
- CDC - Phenol - NIOSH Workplace Safety and Health Topic
- IARC Monograph: "Phenol"
- Arcane Radio Trivia outlines competing uses for Phenol circa 1915
|