Рубидиум
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Општи својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име и симбол | рубидиум (Rb) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изглед | сиво-бела | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рубидиумот во периодниот систем | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски број | 37 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандардна атомска тежина (±) (Ar) | 85,4678(3)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категорија | алкален метал | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Група и блок | група 1 (алкални), s-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Периода | V периода | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електронска конфигурација | [Kr] 5s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
по обвивка | 2, 8, 18, 8, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физички својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза | цврста | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка на топење | 312,45 K (39,30 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка на вриење | 961 K (688 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Густина близу с.т. | 1,532 г/см3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| кога е течен, при т.т. | 1,46 г/см3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тројна точка | 312,41 K, ? kPa[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Критична точка | 2093 K, 16 MPa (екстраполирана)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлина на топење | 2,19 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлина на испарување | 69 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Моларен топлински капацитет | 31,060 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
парен притисок
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Оксидациони степени | +1, −1 (силна базичен оксид) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електронегативност | Полингова скала: 0,82 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Енергии на јонизација | I: 403 kJ/mol II: 2.632,1 kJ/mol II: 3.859,4 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски полупречник | емпириски: 248 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентен полупречник | 220±9 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ван дер Валсов полупречник | 303 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Разни податоци | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристална структура | телоцентрирана коцкеста (тцк) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Брзина на звукот тенка прачка | 1.300 м/с (при 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлинско ширење | 90 µм/(m·K)[3] (при с.т.) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлинска спроводливост | 58,2 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електрична отпорност | 128 nΩ·m (при 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнетно подредување | парамагнетно[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул на растегливост | 2,4 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул на збивливост | 2,5 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мосова тврдост | 0,3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бринелова тврдост | 0,216 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-број | 7440-17-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Историја | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Откриен | Роберт Бунсен и Густав Кирхоф (1861) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Првпат издвоен | Ѓерѓ де Хевеши | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Најстабилни изотопи | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Рубидиум — хемиски елемент со симбол Rb и атомски број 37. Рубидиумот е мек, сребрено-бел метален елемент од алкалнометалната група, со стандардна атомска тежина од 85.4678. Елементарниот рубидиум е високо реактивен, со својства слични на други алкални метали, вклучувајќи ја и брзата оксидација во воздухот. На Земјата, природниот рубидиум се состои од два изотопи: 72% е стабилен изотоп, 85Rb; 28% е малку радиоктивен 87Rb, со полуживот од 49 милиони години— трипати повеќе од проценетата старост на универзумот.
Германските хемичари Роберт Бунзен и Густав Кирхов го откриле рубидиумот во 1861 од ново развиената техника, пламена спектроскопија.
Рубидиумските соединенија имаат различни хемиски и електронски употреби. Металот рубидиум лесно испарува и има пригоден спектрален опсег на апсорпција, што ја прави честа цел за ласерска манипулација на атомите.
Рубидиумот не е позната хранлива материја за сите живи организми. Сепак, јоните на рубидиумот го имаат истиот полнеж како и калиумовите јони и активно се земаат и третираат како животински клетки на слични начини.
Особености[уреди | уреди извор]

Рубидиумот е многу мек, растеглив, сребрено-бел метал.[5] Тој е вториот електропозитивен елемент од стабилните алкални метали и се топи на температура од 39.3 °C (102.7 °F). Како и другите алкални метали, рубидиумот реагира експлозивно со вода. Како и со калиум (што е малку помалку реактивен) и цезиум (што е малку повеќе реактивен), оваа реакција е обично доволно енергична за да го запали водородниот гас што го произведува. Исто така рубидиумот може да се запали спонтано во воздух.[5] Формира амалгами со жива и легури со злато, железо, цезиум, натриум, и калиум, но не и со литиум (иако рубидиум и литиум се во иста група).[6]

Рубидиумот има многу ниска јонизациона енергија од само 406 kJ/mol.[7] Рубидиум и калиум покажуваат многу слична виолетова боја во испитувањето на пламенот, а разликата меѓу двата елементи бара пософистицирана анализа, како што е спектроскопијата.
Соединенија[уреди | уреди извор]
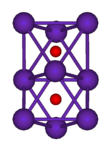
Рубидиум хлорид (RbCl) е веројатно најраспространетото соединение на рубидиум: меѓу неколку други хлориди, се користи за да ги поттикне живите клетки да земат ДНК; исто така се користи како биомаркер бидејќи во природата се наоѓа само во мали количини во живите организми и кога е присутен го заменува калиумот. Други познати рубидиумски соединенија се рубидиум хидроксид (RbOH), почетниот материјал за хемиски процеси кои се засноваат на рубидиум; рубидиум карбонат (Rb2CO3), користен во некои оптички очила и рубидиум бакар сулфат, Rb2SO4•CuSO4•6H2O.Рубидиум сребрен јодид (RbAg4I5) има највисока спроводливост на собна температура од било кој познат јонски кристал, својство искористено во тенки батерии и други примени.[8][9]
Рубидиум формира голем број на оксиди кога е изложен на воздух, вклучувајќи го и рубидиум моноксидот (Rb2O), Rb6O, и Rb9O2; рубидиумот во вишок кислород дава супероксид RbO2. Рубидиумот формира соли со халиди, кои произведуваат рубидиум флуорид, рубидиум хлорид, рубидиум бромид, и рубидиум јодид.
Изотопи[уреди | уреди извор]
Иако рубидиумот е моноизотопски, рубидиумот во Земјината кора е составен од два изотопа: стабилен 85Rb (72.2%) и радиоактивен 87Rb (27.8%).[10] Природниот рубидиум е радиоактивен, со специфична активност од околу 670 Bq/g, доволно за да се изложува фотографски филм за 110 дена.[11][12]
Дваесет и четири дополнителни рубидиумови изотопи се синтетизирани со полуживот од помалку од 3 месеци; повеќето се високо радиоактивни и имаат мала употреба.
Рубидиум-87 има полуживот од 48,8⋅109 години, што е повеќе од трипати од староста на универзумот (13,799 ± 0,021)⋅109 години,[13] што го прави првобитен нуклид. Тој лесно го заменува калиумот во минерали и затоа е прилично раширен. Rb е широко користен во датираните карпи; 87Rb бета распаѓање до стабилен 87Sr. За време на фракциона кристализација, Sr има тенденција да се концентрира во плагиоклаза, оставајќи го Rb во течна состојба. Оттука, односот Rb / Sr во резидуалната магма може да се зголеми со текот на времето, а прогресивната диференцијација резултира во карпи со покачени Rb / Sr односи. Највисоките стапки (10 или повеќе) се јавуваат кај пегматитите. Ако почетната количина на Sr е позната или може да се екстраполира, тогаш возраста може да се определи со мерење на концентрациите Rb и Sr и на односот 87Sr/86Sr.
Рубидиум-82, еден од не природните изотопи на елементот, е произведен со распаѓање на електрони од стронциум-82 со полуживот од 25.36 дена. Со полуживот од 76 секунди, рубидиум-82 се распаѓа со позитронска емисија во стабилен криптон-82.[10]
Појава[уреди | уреди извор]
Рубидиумот е дваесет и третиот најзастапен елемент во Земјината кора, приближно богат како цинк и прилично почест од бакар.[14] Се јавува природно во минералите леуцит, поллуцит, карналит, и цинвалдит, кои содржат колку што е 1% рубидиум оксид. Лепидолитот содржи помеѓу 0,3% и 3,5% рубидиум, и е комерцијален извор на елементот.[15] Некои калиум минерали и калиум хлориди исто така го содржат елементот во комерцијално значајни количини.[16]
Морската вода содржи просечно 125 µg/L од рубидиумот во споредба со многу повисоката вредност за калиумот од 408 mg/L и многу пониската вредност од 0.3 µg/L за цезиум.[17]
Поради големиот јонски полупречник, рубидиумот е еден од "некомпатибилните елементи".[18] За време на магма кристализацијат, рубидиумот е концентриран заедно со својот потежок аналоген цезиум во течна фаза и последен кристализира. Затоа, најголемите депозити на рубидиум и цезиум се зони од пегматитски руда формирани со овој процес на збогатување. Бидејќи рубидиумот го заменува калиумот во магма кристализацијата, збогатувањето е далеку помалку ефикасно од оној на цезиумот. Зонските пегматитски рудави тела, кои содржат минерални количини на цезиум како поллуцит или литиумски минерали лепидолит, исто така, се извор на рубидиум како нуспроизвод.[14]
Два значајни извори на рубидиумот се богатите депозити на поллуцитите на Берничкото Езеро, Манитоба, Канада и рубикла ((Rb,K)AlSi3O8) кои се наоѓаат како нечистотии во поллуцитите на италијанскиот остров Елба, со содржина на рубидиум од 17.5%.[19] И двата од овие депозити се исто така извори на цезиумот.
Производство[уреди | уреди извор]
Иако рубидиумот е повеќе изобилен во Земјината кора од цезиумот, ограничените апликации и недостатокот на минерали богати со рубидиум го ограничуваат производството на рубидиум соединенија на 2-4 тони годишно.[14] Постојат неколку методи за одделување на калиум, рубидиум и цезиум. Фракционата кристализација на рубидиумот и цезиумската стипса (Cs,Rb)Al(SO4)2•12H2O дава по 30 последователни чекори чист рубидиум стипс. Други два други методи се: процесот на хлоростанат и процесот на фероцијанид.[14][20]
Неколку години во 1950-тите и 1960-тите години, нуспроизвод на производство на калиум наречен Алкарб беше главен извор на рубидиум. Алкарб содржи 21% рубидиум, а остатокот е калиум и мала количина на цезиум.[21] Денес најголемите производители на цезиум, како што е рудникот Танко, Манитоба, Канада, произведуваат рубидиум како нуспроизвод од поллуцит.[14]

Историја[уреди | уреди извор]

Рубидиумот бил откриен во 1861 година од страна на Роберт Бансен и Густав Кирхоф, во Хајделберг, Германија преку спектроскопија. Поради светло-црвените линии во својот спектар на емисии, тие избрале име што произлегува од латинскиот збор rubidus, што значи "длабоко црвено".[22][23]
Рубидиум е мала компонента во лепидолитот. Кирхоф и Бунсен преработувале 150 кг лепидолит кој содржи само 0,24% рубидиум оксид(Rb2O). Калиумот и рубидиумот формираат нерастворливи соли со хлороплатинска киселина, но тие соли покажуваат мала разлика во растворливоста во топла вода. Затоа, растворливиот рубидиум хексахлороплатинат (Rb2PtCl6) може да се добие со фракциона кристализација. По редукција на хексахлороплатина со водород, процесот дава 0,51 грама рубидиум хлорид за понатамошни студии.Предлошка:Clarify Бунсен и Кирхоф ја започнаа својата прва голема изолација на соединенија на цезиум и рубидиум со 44.000 литри минерална вода, што резултираше со 7.3 грама цезиум хлорид и 9.2 грама рубидиум хлорид.[22][23] Рубидиумот беше втор елемент, непосредно по цезиум, кој беше откриен со спектроскопија, само една година по откривањето на спектроскопот од страна на Бунсен и Кирхоф.[24]
Двајцата научници го користеле рубидиум хлоридот за да проценат дека атомската тежина на новиот елемент е 85,36 (моментално прифатената вредност е 85,47).[22] Тие се обиделе да генерираат елементарен рубидиум со електролиза на растопен рубидиум хлорид, но наместо метал, добиле сина хомогена супстанца која "ниту под голо око ниту под микроскоп не покажала најмала трага од метална супстанца". Тие претпоставуваа дека тоа е подхлорид (Rb2Cl); сепак производот е веројатно колоидна мешавина од метал и рубидиум хлорид.[25] Во вториот обид да се произведе метален рубидиум, Бунсен можеше да го намали рубидиумот со загревање на јагленизиран рубидиум тартрат. Иако дестилираниот рубидиум беше пирофорен, тие можеа да ја одредат густината и точката на топење. Квалитетот на ова истражување во 1860-тите може да се процени со фактот дека нивната определена густина се разликува помалку од 0.1 g/cm3 и точката на топење за помалку од 1 °C од моментално прифатените вредности.[26]
Малата радиоактивност на рубидиумот била откриена во 1908 година, но тоа било пред да се воспостави теоријата на изотопи во 1910 година, а ниското ниво на активност (полуживот поголем од 1010 години) направил сложеност на толкувањето. Докажаното распаѓање на 87Rb до стабилен 87Sr преку бета распаѓање сè уште беше предмет на дискусија кон крајот на 1940-тите.[27][28]
Рубидиумот имал минимална индустриска вредност пред 1920-тите години.[29] Оттогаш, најважната употреба на рубидиумот е истражување и развој, главно во хемиски и електронски апликации. Во 1995 година, рубидиум-87 се користел за производство на кондензат Бозе-Ајнштајн,[30] за кој откривачите, Ерик Алин Корнел, Карл Едвин Виман и Волфганг Кетерле, ја добиле Нобеловата награда за физика во 2001 година.[31]
Примена[уреди | уреди извор]

Рубидиумовите соединенија понекогаш се користат во огномети за да им се даде виолетова боја.[32] Рубидиумот исто така се употребува во термоелектричен генератор со користење на магнетохидродинамичен принцип, каде што топлите рубидиумови јони се пренесуваат преку магнетно поле.[33] Тие спроведуваат електрична енергија и делуваат како арматура на генератор, со што генерираат електрична струја. Рубидиумот, особено испарениот 87Rb е еден од најчесто користените атомски видови кои се користат за ласерско ладење и Бозе-Ајнштајнова кондензација. Нејзините пожелни одлики за оваа употреба ја вклучуваат подготвената достапност на евтино диодно ласерско светло на соодветната бранова должина и умерени температури потребни за да се добијат значителни притисоци на пареа.[34][35]
Рубидиумот се користи за поларизација на 3He,произведувајќи ги волумените на магнетизираниот 3He гас, при што јадрените вртења се усогласуваат. Рубидиумската пареа е оптички пумпана од ласер, а поларизираниот Rb го поларизира 3He преку хиперфинската интеракција.[36] Таквите спин-поларизирани 3He клетки се корисни за мерењата на неутрални поларизации и за производство на поларизирани неутронски греди за други цели.[37]
Резонантниот елемент во атомските часовници ја користи хиперфинската структура на нивоата на рубидиумот, а рубидиумот е корисен за висока прецизност при мерење. Се користи како главна компонента на секундарните наводи (осцилатори на рубидиум) во предаватели на мобилни места и друга електронска опрема за пренос, мрежно поврзување и тестирање. Овие рубидиумови стандарди често се користат со ГПС за да се произведе "стандард на примарна честота" кој има поголема прецизност и е поевтин од цезиумските стандарди.[38][39] Таквите стандарди за рубидиумот честопати се масовно произведени за телекомуникациската индустрија.[40]
Други потенцијални или тековни начини на употреба на рубидиумот вклучуваат работна течност во турбините на пареа, како гајтер во вакуумски цевки и како компонента на фотоелементот.[41] Рубидиумот исто така се користи како состојка во специјални видови стакло, во производството на супероксид со горење во кислород, во изучувањето на калиумовите јонски канали во биологијата и како пареа во атомски магнетометри.[42]
Рубидиум-82 се користи за позитронска емисиона томографија. Рубидиумот е многу сличен на калиум и ткива со висока содржина на калиум, исто така, ќе го акумулира радиоактивниот рубидиум. Една од главните употреби е миокардна перфузионна слика. Како резултат на промените во крвно-мозочната бариера кај туморите на мозокот, рубидиумот собира повеќе во тумори на мозокот отколку во нормалното мозочно ткиво, овозможувајќи користење на радиоизотоп рубидиум-82 во јадрената медицина за да се лоцираат и да се изразат тумори на мозокот.[43] Рубидиум-82 има многу краток полуживот од 76 секунди, а производството од распаѓање на стронциум-82 мора да се направи блиску до пациентот.[44]
Рубидиум бил тестиран за влијанието врз маничната депресија и депресијата.[45][46] Пациентите со дијализа кои страдаат од депресија покажуваат осиромашување на рубидиум и затоа додатокот може да помогне при депресија.[47] Во некои тестови, рубидиумот се администрирал како рубидиум хлорид до 720 mg дневно во тек на 60 дена.[48][49]
Мерки на претпазливост и биолошки ефекти[уреди | уреди извор]
Рубидиум реагира насилно со вода и може да предизвика пожари. За да се обезбеди сигурност и чистота, овој метал обично се чува под суво минерално масло или запечатено во стаклена ампула во инертна атмосфера. Рубидиумот формира пероксиди при експозиција дури и до мала количина на воздух дифузен во маслото, а складирањето е предмет на слични мерки на претпазливост како складирање на метален калиум.[50]
Рубидиум, како што е натриум и калиум, речиси секогаш има оксидациона состојба +1 кога се раствора во вода, дури и во биолошки контексти. Човечкото тело има тенденција да ги третира Rb+ јоните како да се калиумови јони и затоа концентрира рубидиум во внатреклеточната течност на телото (т.е. внатре во клетките).[51] Јоните не се особено токсични; 70 кг човек содржи во просек 0.36 г рубидиум, а зголемувањето на оваа вредност од 50 до 100 пати не покажало негативни ефекти кај лицата кои се испитуваале.[52] Биолошкиот полуживот на рубидиумот кај луѓето изнесува 31-46 дена.[45] Иако е можна делумна супституција на калиум со рубидиум, кога повеќе од 50% од калиумот во мускулното ткиво на стаорци е заменет со рубидиум, стаорците починале.[53][54]
Поврзано[уреди | уреди извор]
Наводи[уреди | уреди извор]
- ↑ Standard Atomic Weights 2013. Commission on Isotopic Abundances and Atomic Weights
- ↑ 2,0 2,1 Haynes, William M., уред. (2011). CRC Handbook of Chemistry and Physics (XCII. изд.). Boca Raton, FL: CRC Press. стр. 4.122. ISBN 1439855110.
- ↑ http://www.owlnet.rice.edu/~msci301/ThermalExpansion.pdf
- ↑ Magnetic susceptibility of the elements and inorganic compounds, in Lide, D. R., уред. (2005). CRC Handbook of Chemistry and Physics (LXXXVI. изд.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ 5,0 5,1 Ohly, Julius (1910). „Rubidium“. Analysis, detection and commercial value of the rare metals. Mining Science Pub. Co.
- ↑ Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). „Vergleichende Übersicht über die Gruppe der Alkalimetalle“. Lehrbuch der Anorganischen Chemie (германски) (91–100. изд.). Walter de Gruyter. стр. 953–955. ISBN 3-11-007511-3.
- ↑ Moore, John W; Stanitski, Conrad L; Jurs, Peter C (2009). Principles of Chemistry: The Molecular Science. стр. 259. ISBN 978-0-495-39079-4.
- ↑ Smart, Lesley; Moore, Elaine (1995). „RbAg4I5“. Solid state chemistry: an introduction. CRC Press. стр. 176–177. ISBN 978-0-7487-4068-0.
- ↑ Bradley, J. N.; Greene, P. D. (1967). „Relationship of structure and ionic mobility in solid MAg4I5“. Trans. Faraday Soc. 63: 2516. doi:10.1039/TF9676302516.
- ↑ 10,0 10,1 Audi, Georges; Bersillon, O.; Blachot, J.; Wapstra, A. H. (2003). „The NUBASE Evaluation of Nuclear and Decay Properties“. Nuclear Physics A. Atomic Mass Data Center. 729 (1): 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- ↑ Strong, W. W. (1909). „On the Possible Radioactivity of Erbium, Potassium and Rubidium“. Physical Review. Series I. 29 (2): 170–173. Bibcode:1909PhRvI..29..170S. doi:10.1103/PhysRevSeriesI.29.170.
- ↑ Lide, David R; Frederikse, H. P. R (June 1995). CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data. стр. 4–25. ISBN 978-0-8493-0476-7.
- ↑ Planck Collaboration (2015). „Planck 2015 results. XIII. Cosmological parameters (See Table 4 on page 31 of pfd)“. Astronomy & Astrophysics. 594: A13. arXiv:1502.01589. Bibcode:2016A&A...594A..13P. doi:10.1051/0004-6361/201525830.
- ↑ 14,0 14,1 14,2 14,3 14,4 Butterman, William C.; Brooks, William E.; Reese, Jr., Robert G. (2003). „Mineral Commodity Profile: Rubidium“ (PDF). United States Geological Survey. Посетено на 2010-12-04.
- ↑ Wise, M. A. (1995). „Trace element chemistry of lithium-rich micas from rare-element granitic pegmatites“. Mineralogy and Petrology. 55 (13): 203–215. Bibcode:1995MinPe..55..203W. doi:10.1007/BF01162588.
- ↑ Norton, J. J. (1973). „Lithium, cesium, and rubidium—The rare alkali metals“. Во Brobst, D. A.; Pratt, W. P. (уред.). United States mineral resources. Paper 820. U.S. Geological Survey Professional. стр. 365–378. Архивирано од изворникот на 2010-07-21. Посетено на 2010-09-26.
- ↑ Bolter, E.; Turekian, K.; Schutz, D. (1964). „The distribution of rubidium, cesium and barium in the oceans“. Geochimica et Cosmochimica Acta. 28 (9): 1459. Bibcode:1964GeCoA..28.1459B. doi:10.1016/0016-7037(64)90161-9.
- ↑ McSween Jr., Harry Y; Huss, Gary R (2010). Cosmochemistry. стр. 224. ISBN 978-0-521-87862-3.
- ↑ Teertstra, David K.; Cerny, Petr; Hawthorne, Frank C.; Pier, Julie; Wang, Lu-Min; Ewing, Rodney C. (1998). „Rubicline, a new feldspar from San Piero in Campo, Elba, Italy“. American Mineralogist. 83 (11–12 Part 1): 1335–1339. Bibcode:1998AmMin..83.1335T. doi:10.2138/am-1998-11-1223.
- ↑ bulletin 585. United States. Bureau of Mines. 1995.
- ↑ „Cesium and Rubidium Hit Market“. Chemical & Engineering News. 37 (22): 50–56. 1959. doi:10.1021/cen-v037n022.p050.
- ↑ 22,0 22,1 22,2 Kirchhoff, G.; Bunsen, R. (1861). „Chemische Analyse durch Spectralbeobachtungen“. Annalen der Physik und Chemie. 189 (7): 337–381. Bibcode:1861AnP...189..337K. doi:10.1002/andp.18611890702. hdl:2027/hvd.32044080591324.
- ↑ 23,0 23,1 Weeks, Mary Elvira (1932). „The discovery of the elements. XIII. Some spectroscopic discoveries“. Journal of Chemical Education. 9 (8): 1413–1434. Bibcode:1932JChEd...9.1413W. doi:10.1021/ed009p1413.
- ↑ Ritter, Stephen K. (2003). „C&EN: It's Elemental: The Periodic Table – Cesium“. American Chemical Society. Посетено на 2010-02-25.
- ↑ Zsigmondy, Richard (2007). Colloids and the Ultra Microscope. Read books. стр. 69. ISBN 978-1-4067-5938-9. Посетено на 2010-09-26.
- ↑ Bunsen, R. (1863). „Ueber die Darstellung und die Eigenschaften des Rubidiums“. Annalen der Chemie und Pharmacie. 125 (3): 367–368. doi:10.1002/jlac.18631250314.
- ↑ Lewis, G. M. (1952). „The natural radioactivity of rubidium“. Philosophical Magazine. Series 7. 43 (345): 1070–1074. doi:10.1080/14786441008520248.
- ↑ Campbell, N. R.; Wood, A. (1908). „The Radioactivity of Rubidium“. Proceedings of the Cambridge Philosophical Society. 14: 15.
- ↑ Butterman, W. C.; Reese, Jr., R. G. „Mineral Commodity Profiles Rubidium“ (PDF). United States Geological Survey. Посетено на 2010-10-13.
- ↑ „Press Release: The 2001 Nobel Prize in Physics“. Посетено на 2010-02-01.
- ↑ Levi, Barbara Goss (2001). „Cornell, Ketterle, and Wieman Share Nobel Prize for Bose-Einstein Condensates“. Physics Today. 54 (12): 14–16. Bibcode:2001PhT....54l..14L. doi:10.1063/1.1445529.
- ↑ Koch, E.-C. (2002). „Special Materials in Pyrotechnics, Part II: Application of Caesium and Rubidium Compounds in Pyrotechnics“. Journal Pyrotechnics. 15: 9–24. Архивирано од изворникот на 2011-07-13. Посетено на 2019-02-14.
- ↑ Boikess, Robert S; Edelson, Edward (1981). Chemical principles. стр. 193. ISBN 978-0-06-040808-4.
- ↑ Eric Cornell; и др. (1996). „Bose-Einstein condensation (all 20 articles)“. Journal of Research of the National Institute of Standards and Technology. 101 (4): 419–618. doi:10.6028/jres.101.045. PMC 4907621. PMID 27805098. Архивирано од изворникот на 2011-10-14. Посетено на 2015-09-14.
- ↑ Martin, J. L.; McKenzie, C. R.; Thomas, N. R.; Sharpe, J. C.; Warrington, D. M.; Manson, P. J.; Sandle, W. J.; Wilson, A. C. (1999). „Output coupling of a Bose-Einstein condensate formed in a TOP trap“. Journal of Physics B: Atomic, Molecular and Optical Physics. 32 (12): 3065. arXiv:cond-mat/9904007. Bibcode:1999JPhB...32.3065M. doi:10.1088/0953-4075/32/12/322.
- ↑ Gentile, T. R.; Chen, W. C.; Jones, G. L.; Babcock, E.; Walker, T. G. (2005). „Polarized 3He spin filters for slow neutron physics“ (PDF). Journal of Research of the National Institute of Standards and Technology. 110 (3): 299–304. doi:10.6028/jres.110.043. PMC 4849589. PMID 27308140. Архивирано од изворникот (PDF) на 2016-12-21. Посетено на 2019-02-14.
- ↑ „Neutron spin filters based on polarized helium-3“. NIST Center for Neutron Research 2002 Annual Report. Посетено на 2008-01-11.
- ↑ Eidson, John C (2006-04-11). „GPS“. Measurement, control, and communication using IEEE 1588. стр. 32. ISBN 978-1-84628-250-8.
- ↑ King, Tim; Newson, Dave (1999-07-31). „Rubidium and crystal oscillators“. Data network engineering. стр. 300. ISBN 978-0-7923-8594-3.
- ↑ Marton, L (1977-01-01). „Rubidium Vapor Cell“. Advances in electronics and electron physics. ISBN 978-0-12-014644-4.
- ↑ Mittal (2009). Introduction To Nuclear And Particle Physics. стр. 274. ISBN 978-81-203-3610-0.
- ↑ Li, Zhimin; Wakai, Ronald T.; Walker, Thad G. (2006). „Parametric modulation of an atomic magnetometer“. Applied Physics Letters. 89 (13): 23575531–23575533. Bibcode:2006ApPhL..89m4105L. doi:10.1063/1.2357553. PMC 3431608. PMID 22942436.
- ↑ Yen, C. K.; Yano, Y.; Budinger, T. F.; Friedland, R. P.; Derenzo, S. E.; Huesman, R. H.; O'Brien, H. A. (1982). „Brain tumor evaluation using Rb-82 and positron emission tomography“. Journal of Nuclear Medicine. 23 (6): 532–7. PMID 6281406.
- ↑ Jadvar, H.; Anthony Parker, J. (2005). „Rubidium-82“. Clinical PET and PET/CT. стр. 59. ISBN 978-1-85233-838-1.
- ↑ 45,0 45,1 Paschalis, C.; Jenner, F. A.; Lee, C. R. (1978). „Effects of rubidium chloride on the course of manic-depressive illness“. J R Soc Med. 71 (9): 343–352. PMC 1436619. PMID 349155.
- ↑ Malekahmadi, P.; Williams, John A. (1984). „Rubidium in psychiatry: Research implications“. Pharmacology Biochemistry and Behavior. 21: 49–50. doi:10.1016/0091-3057(84)90162-X.
- ↑ Canavese, Caterina; Decostanzi, Ester; Branciforte, Lino; Caropreso, Antonio; Nonnato, Antonello; Sabbioni, Enrico (2001). „Depression in dialysis patients: Rubidium supplementation before other drugs and encouragement?“. Kidney International. 60 (3): 1201–2. doi:10.1046/j.1523-1755.2001.0600031201.x. PMID 11532118.
- ↑ Lake, James A. (2006). Textbook of Integrative Mental Health Care. New York: Thieme Medical Publishers. стр. 164–165. ISBN 978-1-58890-299-3.
- ↑ Torta, R.; Ala, G.; Borio, R.; Cicolin, A.; Costamagna, S.; Fiori, L.; Ravizza, L. (1993). „Rubidium chloride in the treatment of major depression“. Minerva Psichiatrica. 34 (2): 101–10. PMID 8412574.
- ↑ Martel, Bernard; Cassidy, Keith (2004-07-01). „Rubidium“. Chemical risk analysis: a practical handbook. стр. 215. ISBN 978-1-903996-65-2.
- ↑ Relman, A. S. (1956). „The Physiological Behavior of Rubidium and Cesium in Relation to That of Potassium“. The Yale Journal of Biology and Medicine. 29 (3): 248–62. PMC 2603856. PMID 13409924.
- ↑ Fieve, Ronald R.; Meltzer, Herbert L.; Taylor, Reginald M. (1971). „Rubidium chloride ingestion by volunteer subjects: Initial experience“. Psychopharmacologia. 20 (4): 307–14. doi:10.1007/BF00403562. PMID 5561654.
- ↑ Meltzer, H. L. (1991). „A pharmacokinetic analysis of long-term administration of rubidium chloride“. Journal of Clinical Pharmacology. 31 (2): 179–84. doi:10.1002/j.1552-4604.1991.tb03704.x. PMID 2010564. Архивирано од изворникот на 2012-07-09.
- ↑ Follis, Richard H., Jr. (1943). „Histological Effects in rats resulting from adding Rubidium or Cesium to a diet deficient in potassium“. AJP: Legacy. 138 (2): 246. Архивирано од изворникот на 2012-07-11. Посетено на 2019-02-14.CS1-одржување: повеќе имиња: список на автори (link)
Дополнителна литература[уреди | уреди извор]
- Meites, Louis (1963). Handbook of Analytical Chemistry (New York: McGraw-Hill Book Company, 1963)
- Steck, Daniel A. „Rubidium-87 D Line Data“ (PDF). Los Alamos National Laboratory (technical report LA-UR-03-8638). Архивирано од изворникот (PDF) на 2013-11-02. Посетено на 2019-02-14.
Надворешни врски[уреди | уреди извор]
 . Encyclopædia Britannica. 23 (11. изд.). 1911. стр. 809.
. Encyclopædia Britannica. 23 (11. изд.). 1911. стр. 809.- Rubidium at The Periodic Table of Videos (University of Nottingham)
| Периоден систем на елементите | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| I | H | He | |||||||||||||||||||||||||||||||
| II | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| III | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| IV | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| V | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| VI | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| VII | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||
| ||||||
|


