Манган
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Општи својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име и симбол | манган (Mn) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изглед | металик сребрена | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Манганот во периодниот систем | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски број | 25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандардна атомска тежина (±) (Ar) | 54.938044(3)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категорија | преоден метал | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Група и блок | група 7, d-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Периода | IV периода | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електронска конфигурација | [Ar] 3d5 4s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
по обвивка | 2, 8, 13, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физички својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза | цврста | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка на топење | 1.519 K (1.246 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка на вриење | 2.334 K (2.061 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Густина близу с.т. | 7,21 г/см3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| кога е течен, при т.т. | 5,95 г/см3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлина на топење | 12,91 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлина на испарување | 221 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Моларен топлински капацитет | 26,32 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
парен притисок
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Оксидациони степени | 7, 6, 5, 4, 3, 2, 1, −1, −2, −3 киселински, базичен или амфотерен оксид; во зависност од оксидационата сосотојба | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електронегативност | Полингова скала: 1,55 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Енергии на јонизација | I: 717,3 kJ/mol II: 1.509,0 kJ/mol II: 3.248 kJ/mol (повеќе) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски полупречник | емпириски: 127 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентен полупречник | Слаб спин: 139±5 pm силен спин: 161±8 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Разни податоци | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристална структура | телоцентрирана коцкеста (тцк) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Брзина на звукот тенка прачка | 5.150 м/с (при 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлинско ширење | 21,7 µм/(m·K) (при 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлинска спроводливост | 7,81 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електрична отпорност | 1,44 µΩ·m (при 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнетно подредување | парамагнетно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул на растегливост | 198 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул на збивливост | 120 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мосова тврдост | 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бринелова тврдост | 196 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-број | 7439-96-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Историја | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Откриен | Торбен Олоф Бергман (1770) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Првпат издвоен | Јохан Готлиб Ган (1774) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Најстабилни изотопи | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Манган е хемиски елемент со симбол Mn и атомски број 25.Во природата не е пронајден како слободни елемент , но често може да се најде во минерали кои се во комбинација со железо. Манганот е метал со важни индустриски метални легури , особено во не’рѓосувачките челици.
Историски,манганот е именуван за пиролузит и други црни минерали од регионот на Магнезија во Грција, кој пак го дал своето име за магнезиум и магнетит од железна руда . До средината на 18 век, шведско-германскиот хемичар Карл Вилхелм Шеле го користел пиролузитот за да произведе хлор. Шеле и другите биле свесни дека пиролузитот (сега познат како манган диоксид) содржел нов елемент, но тие не можеле да го изолираат. Јохан Готлиб Ган бил првиот кој изолирал нечист примерок на манганов метал во 1774, што тој го постигнал со намалување на диоксидот со јаглерод.
Манган фосфатот се користи за заштита од ' рѓа и корозија на челик. Јонизираниот манган се користи индустриски како пигмент од различни бои, кои зависат од оксидационата состојба на јоните. Перманганите на алкалните и земноалканите метали се моќни оксидирачи. Манган диоксидот се користи како катоден (електронски акцептор) материјал во цинк-јаглеродот и алкалните батерии.
Во биологијата, јоните на манган(II) функционираат како кофактори за голем број различни ензими со многу функции.[2] Мангановите ензими се особено неопходни при детоксикација на слободните радикали на супероксид во организмите кои мора да се справат со елементарениот кислород. Манганот, исто така функционира во кислород -развивачкиот комплекс на фотосинтетичните растенија. Додека елементот е потребен траен минерал за сите познати живи организми, тој, исто така делува како невротоксин во поголеми количини. Особено преку вдишување, може да предизвика манганизам, состојба кај цицачите што доведува до невролошки оштетувања, кои понекогаш се неповратни.
Особености[уреди | уреди извор]
Физички својства[уреди | уреди извор]

Манганот е сребрено-сив метал кој личи на железо.Тој е тежок и многу кршлив, тешко се соединува ,но лесно оксидира.[3] Манганот и неговите заеднички јони се парамагнети.[4] Полека се распаѓа во воздухот и оксидира ("рѓосува") како што железото во вода содржи растворен кислород.
Изотопи[уреди | уреди извор]
Природниот манган е составен од еден стабилен изотоп, 55Mn. Осумнаесет радиоизотопи се изолирани и опишани, почнувајќи со атомска тежина од 46 u (46Mn) до 65 u (65Mn). Најстабилните се 53Mn со полуживот од 3.7 милиони години, 54Mn со полуживот од 312.3 дена, и 52Mn со полуживот од 5.591 дена. Сите останати радиоактивни изотопи имаат полуживотот помал од три часа, а поголемиот дел помал од една минута. Основниот режим на распаѓање пред најзастапениот стабилен изотопот, 55Mn, е фаќањето на електрони, а основните режим после е бета распаѓањето.[5] Манганот, исто така, има три мета состојби.[5]
Манганот е дел од железната група на елементи, за кои се смета дека се синтетизираат во големите ѕвезди непосредно пред супернова експлозијата. 53Mn се распаѓа на 53Cr со полуживот од 3.7 милиони години. Поради неговиот релативно краток полживот, 53Mn е релативно редок, произведен од страна на влијанието на космичките зраци врз железото.[6] Манганската изотопска содржината обично се комбинира со содржината на изотопите на хромот и притоа нашле примена во изотопската геохемија и радиометричко датирање. Mn–Cr изотопските односи ги зајакнуваат доказите од 26Ал и 107Pd за раната историја на сончевиот Систем. Варијациите во односите 53Cr/52Cr и Mn/Cr од неколку метеорити укажува на почетниот 53Mn/55Mn однос, што пак укажува на тоа дека Mn–Cr изотопскиот состав мора да произлезе од in situ распаѓањето на 53Mn во диференцираните планетарни тела. Оттука, 53Mn дава дополнителни докази за нуклеосинтетските процеси веднаш пред соединувањето на сончевиот Систем.[5]
Хемиски својства[уреди | уреди извор]

Најчестите состојби на оксидација на манганот се +2, +3, +4, +6, и +7, иако сите оксидациски состојби од -3 до +7 се забележани. Mn2+ често се натпреварува со Mg2+ во биолошките системи.Манганските соединенија каде што манганот е во оксидациона состојба +7, кои најчесто се ограничени на нестабилниот оксид Mn2O7, соединенијата на интензивно виолетовиот пармаганат анјон MnO4−, и неколку оксихариди (MnO3F и MnO3Cl), се моќни оксидирачки агенси.[3] Соединенијата со оксидациски состојби +5 (сина) и +6 (зелена), се силни оксидирачки агенси и се подложни на диспропорционализација.

Најстабилната состојба на оксидација за манган е +2, која има бледа розова боја, и се позати многу соединенија на манган(II) , како што се манган(II) сулфат (MnSO4) и манган(II) хлорид (MnCl2). Оваа оксидациона состојба исто така се среќава и во минералниот родохрозит (манган(II) карбонат). Манган(II) најчесто постои со висок спин, S = 5/2 основна состојба поради високата енергија за спарување на манган(II). Сепак, постојат неколку примери за низок спин како што е S =1/2 манган(II).[8][8] Не постојат прецизни d–d транзиции во манган(II), што пак објаснува зашто манган(II) соединенијата се обично бледи до безбојни.[9]
| Оксидациони состојби на манган [10] | |
|---|---|
| 0 | Mn2(CO)10 |
| +1 | MnC5H4CH3(CO)3 |
| +2 | MnCl2, MnCO3, MnO |
| +3 | MnF3, Mn(OAc)3, Mn2O3 |
| +4 | MnO2 |
| +5 | K3MnO4 |
| +6 | K2MnO4 |
| +7 | KMnO4, Mn2O7 |
Оксидационата состојба +3 е позната во соединенијата како манган(III) ацетат, но тие се доста моќни оксидирачки агенси кои исто така се склони кон диспропорционализација во растворот, формирајќи манган(II) и манган(IV). Цврстите соединенија на манган(III) се одликуваат со силна виолетово-црвена боја и предност за искривена октаедрична координација што произлегува од ефектот Јан-Телер.
Оксидациската состојба +5 може да се произведе со растворање на манган диоксид во стопен натриум нитрит.[11] Манганите (VI) солите можат да се произведат со растворање на Mn соединенија, како што е манган диоксид, во стопени алкали додека се изложени на воздух. Перманганат (оксидациска состојба +7 ) соединенијата се виолетови, и може да му дадат на стаклото виолетова боја. Калиум перманганатот, натриум перманганатот, и бариум перманганатот се моќни оксидирачи. Калиум перманганатот , исто така познат како кристали на Конди, е најчесто користен лабораториски реагенс поради неговите оксидирачки својства; се користи како актуелен лек (на пример, при третман на болести на риби). Растворите на калиум перманганатот биле помеѓу првите дамки и фиксативи кои се користени во подготовката на биолошки клетки и ткива за електронска микроскопија.[12]
Историја[уреди | уреди извор]
Потеклото на името манган е комплексенo. Во античките времиња, два црни минерали од Магнезија (сместена во рамките на модерна Грција) биле именувани како (magnes ) магнес од нивното место на потекло, но се разликувале по полот. Машкиот магнес (magnes) привлекувал железо, а железната руда сега позната како ловестон или магнетит, најверојатно ни го дала и терминот магнет. Женската магнес руда не привлекувала железо, но била користена за обезбојување на стаклото. Овој женски магнес подоцна бил наречен магнезија, позната сега во модерните времиња како пиролузит или манган диоксид. Ниту овој минерал ниту елементарениот манган се магнетни. Во 16 век, манган диоксидот бил наречен manganesum (забелешка на две ns наместо еден) од производителите на стакло, можеби како корупцијата и конкатенација на два збора, со оглед на тоа што алхемичарите и производителите на стакло на крајот морале да ја разликуваат магнезиската негра (црната руда) од магнезијата алба (бела руда од Магнезија исто така корисна за производство на стакло). Мишел Меркати ја нарекол магнезија negra manganesa, и најпосле металот изолиран од тоа станал познат како манган (германски: Mangan). Името магнезија на крајот било искористено само за бела магнезија алба (магнезиум оксид), кој го добил името магнезиум за слободни елемент кога бил изолиран многу подоцна.[13]

Неколку шарени оксиди на манган, како на пример манган диоксид, се во изобилство во природата и се користат како пигменти уште од камено доба. Пештерските цртежи во Гаргас кои се стари 30,000 до 24,000 години содржат мангански пигменти.[15]
Манганските соединенија ги користеле египетскате и римскате производители на стакло или за да додадат или за да отстранат боја од стаклото.[16] Употребата како "стакларски сапун" продолжила преку средниот век до модерните времиња и очигледно во стаклото од 14 век од Венеција.[17]

Бидејќи бил користен во производството на стакло, манган диоксидот бил достапен за експерименти од алхемичарите, првите хемичари. Игнатиус Готфрид Каим (1770) и Јохан Глаубер (17 век) откриле дека манган диоксидот може да се претвори во перманганат, корисен лабораториски реагенс .[18] До средината на 18 век, шведскиот хемичар Карл Вилхелм Шеле користел манган диоксид за произведство на хлор. Прво, хлороводородна киселина, или мешавина од разредена сулфурна киселина и натриум хлорид била направена за да реагира со манган диоксид, подоцна се користела хлороводородна киселина од процесот Лебланк и манган диоксидот бил рециклиран од процесот Велдон. Производството на хлор и агенсите за белење хипохлорит било голем потрошувач на мангановите руди.
Шеле и други хемичари биле свесни дека манган диоксидот содржел нов елемент, но тие не можеле да го изолираат. Јохан Готлиб Ган бил првиот кој изолирал нечист примерок од манган метал во 1774, со намалување на диоксидот со јаглерод.
Содржината на манган во некои железни руди што се користеле во Грција довеле до шпекулации дека челикот произведен од таа руда содржи дополнителни манган, што пак го прави спартанскиот челик исклучително тежок.[19] Околу почетокот на 19 век, манганот се користел во производството на челик и добиени се неколку патенти. Во 1816 година ,било документирано дека железо легирано со манган било потешко, но не и поцврсто. Во 1837, британски академик Џејмс Купер забележал поврзаност помеѓу големата изложеност на рударите на манган со форма на паркинсонова болест.[20] Во 1912 година, американските патенти биле доделени за заштита на огненото оружје против ' рѓа и корозија со електрохемиски преврски со манган фосфат, и процесот оттогаш се користи за широка употреба.[21]
Пронајдокот на Лекланшеовата ќелија во 1866 и понатамошното подобрување на батериите кои содржат манган диоксид како катоден деполаризатор ја зголемила побарувачката на манган диоксид. До развој на батериите со никел-кадмиум и литиум, повеќето батерии содржеле манган. Цинк-јаглеродната батеријата и алкалната батерија вообичаено користат индустриски произведен манган диоксид, бидејќи природниот манган диоксид содржи нечистотии. Во 20-от век, манган диоксидот бил широко користен како катод за комерцијални суви батерии за еднократна употреба како за стандардните (цинк-јаглеродни), така и за алкалните типови.[22]
Настанување и производство[уреди | уреди извор]
Манганот состои околу 1000 ppm (0.1%) од Земјината кора, дванаесеттиот најзастапен од елементите на кората.[23] Почвата содржи 7-9000 ппм на манган со просек од 440 ппм.[23] Морската вода има само 10 ppm манган и атмосферата содржи 0.01 µg/м3.[23] Манганот се јавува главно како пиролузит (MnO2), браунит, (Mn2+Mn3+6)(SiO12),[24] псимилелан (Ba,H2O)2Mn5Л10, и во помала мера како родохрозит (MnCO3).
 |
 |
 |
 |
 |
| Манганова руда | Псиломелан (манган руда) | Шпигелајзен е метална легура со содржина на манган околу 15% | Манган оксид дендрити на варовник од Солнхофен, Германија – еден вид на псевдофосил. Скалата е во мм | Минерален родохрозит(манган(II) карбонат) |

Најважната манганска руда е пиролузит (MnO2). Другите економски важни мангански руди обично покажуваат блиска просторна релација со железната руда.[3] Земните ресурси се големи, но нередовно дистрибуирани. Околу 80% од познатите светски ресурси за манган се во Јужна Африка; други важни депозити на манган се во Украина, Австралија, Индија, Кина, Габон и Бразил.[25] Според проценката од 1978 година, океанското дно има 500 милијарди тони манган нодули.[26] Обидите да се најдат економски одржливи методи за собирање на мангановите нодули биле оставени во 1970-тите.[27] ЦИА еднаш користела мини-мангански модули на океанското дно како приказна за покривање на потонатата Советскиот подморница.[28]
Во Јужна Африка, повеќето идентификувани депозити се наоѓаат во близина на Хотазел во провинцијата Северен Кејп , со проценка од 15 милијарди тони за 2011 година. Во 2011 година во Јужна Африка се произведени 3.4 милиони тони, што ги надмина сите други нации.[29]
Манганот е главно миниран во Јужна Африка, Австралија, Кина, Габон, Бразил, Индија, Казахстан, Гана, Украина и Малезија.[30] Американските извори на увоз (1998-2001) се : Манган руда: Габон, 70%; Јужна Африка, 10%; Австралија, 9%; Мексико, 5%; и други, 6%. Фероманган : Јужна Африка, 47%; Франција, 22%; Мексико, 8%; Австралија, 8%; и други, 15%. Манганот содржан во сите увози на манган: Јужна Африка, 31%; Габон, 21%; Австралија, 13%; Мексико, 8%; и други, 27%.[25][31]
За производството на фероманган, мангановата руда се меша со железни руда и јаглерод, а потоа се намалува или во високи печки или во електрична печка.[32] Добиениот фероманган има содржина на манган од 30 до 80%.[3] Чистиот манган кој се користи за производство на легури без железо е произведен со истекување на манганова руда со сулфурна киселина и последователен процес на електродеструкција .[33]
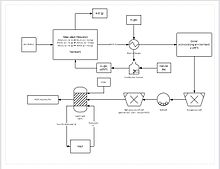
Попрогресивниот процес на екстракција вклучува директно намалување на мангановата руда во купишта исцедок. Ова се прави со пробивање на природен гас низ дното на купот; природниот гас ја обезбедува топлина (треба да биде најмалку 850 °C) и средството за намалување (јаглерод моноксид). Ова ја намалува целата манганска руда на манган оксид (MnO), што е исцедена форма.Рудата потоа патува низ грубо коло за да се намали големината на честички на рудата на помеѓу 150-250 µm, се зголемува површината со цел да помогне на истекувањето. Рудата потоа се додава во резервоарот за сушење на сулфурна киселина и црно железо (Fe2+) во 1.6:1 сооднос. Железото реагира со манган диоксид за да се формира железо хидроксид и елементарен манган. Овој процес дава околу 92% обновување на манганот. За понатамошно прочистување, манганот потоа може да се испрати во објект за електродеструкција .
Во 1972 година проектот Азоријан на ЦИА, преку милијардерот Хауард Хјуз, го нарачал бродот Хјуз Гломар Експлорер со приказната за покивање што се однесувала на манганските нодули од морското дно. Тоа предизвикало наплив на активност за собирање на манган нодули, што всушност не било практично. Вистинската мисија на Хјуз Гломар Експлорер била да се подигне потонатата Советска подморница, К-129, со цел да се добијат Советскиоте кодови.[34]
Употреби[уреди | уреди извор]
Манганот нема задоволителна замена во своите главни примени во металургијата.[25] Во помалите примени (како на пример, манган фосфат), цинкот, а понекогаш и ванадиумот претставуваат можни замени.
Челик[уреди | уреди извор]

Манганот е од суштинско значење за производството на железо и челик како резултат на неговите својства : сулфур-фиксирање, деоксидирање и легирање, што беше првично признаено од британскиот металург Роберт Фостер Мушет (1811-1891), кој во 1856 година го воведе елементот, во форма на Шпигелајзен ,притоа во челикот за специфична намена односно за отстранување на вишокот растворен кислород, сулфур и фосфор, со цел да се подобри неговата податливост.[35] Создавањето на челик ,[35] вклучувајќи ја и неговата компонента за производство на железо, има најголема побарувачка на манган, во опсег од 85% до 90% од вкупната побарувачка.[33] Манганот е клучна компонента на нискобуџетните не’рѓосувачки челици .[31][36] Често фероманганот (обично околу 80% манган) претставува средина во модерните процеси.
Мали количини на манган ја подобруваат обработливоста на челикот при високи температури со формирање на високотопен сулфид и со спречување на формирање на течен железен сулфид на границите меѓу зрната..Ако содржината на манган достигнува 4%, растревожувањето на челикот станува доминантна одлика. Растревожувањето се намалува при повисоки концентрации на манган и достигнува прифатливо ниво на 8%. Челикот кој содржи 8 до 15% манган има висока затегнувачка цврстина до 863 MPa.[37][38] Челикот со 12% манган бил откриен во 1882 година од страна на Роберт Хадфилд и сè уште е познат како челик Хадфилд (мангал) .Се користел за британските воени челични шлемови, а подоцна и за американската војска.[39]
Алуминиумски легури[уреди | уреди извор]
Втората најголема употреба на манганот е во алуминиумските легури. Алуминиумот со околу 1,5% манган ја зголемува отпорноста кон корозија преку зрна коишто ги апсорбираат нечистотиите што ќе доведат до галванска корозија .[40] Алуминиумските легури 3004 и 3104 (0,8 до 1,5% манган) кои се отпорни на корозија се користат за повеќето лименки за пијалаци. [41] Пред 2000 година биле користени повеќе од 1,6 милиони тони од овие легури; на 1% манган, ова троши 16.000 тони манган. [41]
Други употреби[уреди | уреди извор]
Метилциклопентадиенил манган трикарбонил се користи како додаток во безоловен бензин за да се зголеми октанскиот рејтинг и да се намали тропањето на моторот . Манганот во ова необично органометално соединение е во оксидациска состојба на +1.[42]
Манган (IV) оксидот (манган диоксид, MnO 2) се користи како реагенс во органската хемија за оксидација на бензилни алкохоли (каде што хидроксилната група е во непосредна близина на ароматичен прстен). Манган диоксидот се користи од антиката за оксидација и неутрализирање на зеленикавата нијанса во стаклото од трагите на железната контаминација.[17] MnO 2 исто така се користи во производството на кислород и хлор и во сушењето на црни бои.Во некои препарати, тој е кафеав пигмент за боја и е составен дел на природната сенка.
Манган (IV) оксидот се користел во оригиналниот тип на сува клеточна батерија како електронски акцептор од цинк, и е темен материјал во клетките од типот на јаглен-цинк .Манган диоксидот се намалува на манган оксид-хидроксид MnO (OH) за време на празнењето, спречувајќи формирање на водород на анодата на батеријата.[43]
- MnO 2 + H 2 O + e - → MnO (OH) + OH− </br>
Истиот материјал исто така функционира и во поновите алкални батерии (обични батерии), кои ја користат истата основна реакција, но различна мешавина на електролит. Во 2002 година, за оваа намена биле користени повеќе од 230.000 тони манган диоксид.[22][43]

Металот повремено се користи во монети; до 2000 година, единствената монета од САД која го користела манган била "воениот" никел од 1942 до 1945 година.[44] Легурата од 75% бакар и 25% никел традиционално се користела за производство на монети од никел. Меѓутоа, поради недостаток на никел за време на војната, тој бил заменет со повеќе достапните, сребро и манган, што резултирало со легура од 56% бакар, 35% сребро и 9% манган. Од 2000 година, монетите од долар , на пример, доларот Сакагавеи и претседателските монети од 1 долгар ,се направени од месинг кој содржи 7% манган со чисто бакарно јадро.[45] Во двата случаја на никел и долар, употребата на манган во монетата беше да ги дуплираат електромагнетните својства на претходната идентична големина и ценета монета во механизмите на продажните машини. Во случајот на подоцнежните монети од американскиот долар, легурата на манганот била наменета за дуплирање на својствата на бакарните / никлените легури кои се користеле во претходниот Сузан Б. Ентони долар .
Мангановите соединенија се користат како пигменти и за боење на керамика и стакло. Кафеавата боја на керамиката понекогаш е резултат на манганските соединенија.[46] Во индустријата за стакло, манганските соединенија се користат за два ефекти. Манган (III) реагира со железо (II) за да предизвика силна зелена боја во стаклото со формирање на помалку обоено железо (III) и малку розов манган (II), компензирајќи за остатокот на бојата на железото (III).[17] Поголеми количини на манган се користат за производство на розово стакло.
Тетравалентниот манган се користи како активатор во црвено емитувачките фосфори . Додека се познати многу соединенија кои покажуваат луминисценција ,[47] најголмеиот дел не се користи во комерцијална примена поради ниската ефикасност или длабоката црвена емисија.[48][49] Сепак, неколку Mn 4+ активирани флуориди се пријавени како потенцијални црвено емитувачки фосфори за топло белите LED диоди.[50][51] Но, до денес, само K 2 SiF 6 : Mn 4 + е комерцијално достапен за употреба во топло белите LED диоди .[52]
Манган оксидот исто така се користи во мешавините на Портланд цемент.[53]
Биолошка улога[уреди | уреди извор]

Манган е суштински човечки диететски елемент. Присутен е како коензим во неколку биолошки процеси, кои вклучуваат метаболизам на макронутриенти, формирање на коските, слободни радикални одбранбени системи. Тој е критична компонента во десетици белковини и ензими.[54] Човечкото тело содржи околу 12 мг манган, најмногу во коските. Остатокот од меки ткива е концентриран во црниот дроб и бубрезите.[23] Во човечкиот мозок, манганот е врзан за метабелковините , на манганот особено за глутамин синтетазата во астроцитите .[55]
Прекумерното изложување или внесувањето може да доведе до состојба позната како манганизам , невродегенеративно нарушување кое предизвикува допаминергична невронска смрт и симптоми слични на Паркинсонова болест .[23][56] Класите на ензими кои имаат мангански кофактори се големи и вклучуваат оксидоредуктази , трансфераза , хидролази , лиази , изомерази , лигази , лектини и интегрини . Обратните транскрипции на многу ретровируси (иако не се лентивируси како што е ХИВ ) содржат манган. Најпознатите полипептиди кои содржат манган може да бидат аргиназа , дифтерија токсин и супероксидна дисмутаза ( Mn-СОД ) .[57]
Mn-СОД е тип на СОД присутен во еукариотските митохондрии , а исто така и кај повеќето бактерии (овој факт е во согласност со теоријата на бактериско потекло на митохондриите). Ензимот Mn-СОД е веројатно еден од најстарите, за речиси сите организми кои живеат во присуство на кислород го користат за да се справат со токсичните ефекти на супероксидот (O−
2 ), формиран од 1-електронско намалување на кислородот. Исклучоците, кои се сите бактерии, вклучуваат Lactobacillus plantarum и сродни лактобацили , кои користат различен механизам, кој не ја вклучува активноста на ензимите ,со јони од манган (Mn 2+ ) комплексни со полифосфатот, што укажува на патот на еволуцијата за оваа функција во аеробниот живот.
Манганот е исто така важен во фотосинтетичката еволуција на кислородот во хлоропластите во растенијата. Комплексот што се развива со кислород (OEC) е дел од афотосистемот II содржан во тилакоидните мембрани на хлоропластите; тој е одговорен за терминалната фотооксидација на вода за време на светлосните реакции на фотосинтезата и има јадро на металоизим кое содржи четири атоми на манган.[58][59] За да се исполни ова барање, повеќето растителни ѓубрива од широк спектар содржат манган.
Диететски препораки[уреди | уреди извор]
| Мажјаци | Женски | ||
|---|---|---|---|
| Возраст | АI (mg / ден) | Возраст | АI (mg / ден) |
| 1-3 | 1.2 | 1-3 | 1.2 |
| 4-8 | 1.5 | 4-8 | 1.5 |
| 9-13 | 1.9 | 9-13 | 1.6 |
| 14-18 | 2.2 | 14-18 | 1.6 |
| 19+ | 2.3 | 19+ | 1.8 |
| бремена: 2 | |||
| лактација: 2.6 | |||
Американскиот институт за медицина (IOM) ги ажурираше Проценетите просечни барања (EARs) и препорачаните додатоци во исхраната (RDAs) за минерали во 2001 година.За манганот немало доволно информации за поставување на EAR и RDA, така што потребите се опишуваат како проценки за соодветни зафати (АI). Што се однесува до безбедноста, IOM поставува толерантни нивоа на доза (UL) за витамини и минерали кога доказот е доволен. Во случајот на манган, возрасниот UL е поставен на 11 mg / ден. Колективно, EAR, RDA, AI и UL се нарекуваат диететски референтни вредности (DRI).[60] Дефицитот на манган е редок.[61]
Европскиот орган за безбедност на храната (EFSA) се однесува на колективниот сет на информации како референтни вредности за исхраната, со референтниот внес на населението (PRI) наместо RDA, и просечниот услов наместо ЕАR. Аl и UL се дефинирани исто како и во САД. За луѓето на возраст од 15 и постари Аl е поставена на 3,0 mg / ден. AI за бременост и лактација е 3.0 mg / ден. За деца на возраст од 1-14 години, АI се зголемува со возраста од 0,5 до 2,0 mg / ден. Возрасните АI се повисоки од американските RDA.[62] EFSA го разгледа истото безбедносно прашање и одлучи дека нема доволно информации за поставување на UL.[63]
За целите на етикетирање на храна и додаток во исхраната во САД, износот во услугата е изразен како процент од дневна вредност (% DV). За целите на обележувањето на манганот, 100% од дневната вредност била 2,0 mg, но од 27 мај 2016 година беше ревидиран на 2,3 mg за да го усогласат со RDA.[64] Табела на старите и новите возрасни дневни вредности е дадена на референтниот дневен внес .Компаниите за храна и додатоци имаат рок до 1 јануари 2020 година да се усогласат со промената.[65]
Мерки на претпазливост[уреди | уреди извор]
| Опасност | |
|---|---|
| GHS-ознаки: | |
Пиктограми
|
none |
Сигнални зборови
|
none |
Изјави за опасност
|
H401 |
Изјави за претпазливост
|
P273, P501[66] |
| NFPA 704 | |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Манганските соединенијата се помалку токсични од оние на другите раширени метали, како што се никелот и бакар .[67] Меѓутоа, изложеноста на прашина и гасови од манган не треба да ја надминува горната вредност од 5 mg / m 3 дури и за кратки периоди поради нивото на токсичност.[68] Труењето со манган е поврзано со оштетените моторни вештини и когнитивни нарушувања.[69]
Перманганат покажува поголема токсичност од соединенијата на манган (II). Фаталната доза е околу 10 g и се случиле неколку фатални интоксикации. Силниот оксидативен ефект доведува до некроза на мукозната мембрана . На пример, езофагусот е зафатен ако пергаганатот се проголта. Само ограничената количина е апсорбирана од цревата, но оваа мала количина покажува сериозни ефекти врз бубрезите и врз црниот дроб.[70][71]
Манганското изложување во САД е регулирано од страна на Управата за безбедност и здравје при работа (OSHA).[72] Луѓето можат да бидат изложени на манган на работното место со тоа што го дишат или го голтаат. OSHA го постави законскиот лимит ( дозволена граница на изложеност ) за изложување на манган на работното место како 5 mg / m 3 во текот на 8-часовен работен ден.Националниот институт за безбедност и здравје при работа (NIOSH) постави препорачан лимит на изложеност (REL) од 1 mg / m 3 во текот на 8-часовен работен ден и краткорочна граница од 3 mg / m 3 . На ниво од 500 mg / m 3 , манганот е веднаш опасен за животот и здравјето .[73]
Манганското изложување во САД е регулирано од страна на Управата за безбедност и здравје при работа (OSHA). Луѓето можат да бидат изложени на манган на работното место со тоа што го дишат или го голтаат. OSHA го постави законскиот лимит (дозволена граница на изложеност) за изложување на манган на работното место како 5 mg / m3 во текот на 8-часовен работен ден. Националниот институт за безбедност и здравје при работа (NIOSH) утврди препорачана граница на изложеност (REL) од 1 mg / m3 во текот на 8-часовен работен ден и краткорочна граница од 3 mg / m3. На ниво од 500 mg / m3, манганот е веднаш опасен за животот и здравјето
Општо земено, изложеноста на амбиентна Mn концентрација на воздух поголема од 5 μg Mn / m3 може да доведе до Mn индуцирани симптоми. Зголемената експресија на феропортински белковини во клетките на човечкиот ембрионски бубрег (HEK293) е поврзана со намалената внатреклеточна Mn концентрација и атенуирана цитотоксичност ,а се одликува со пресврт на навлегувањето на глутамат со намален Mn и намалена истекување на лактат дехидрогеназата .[74]
Заштита на животната средина[уреди | уреди извор]
Манганот во водата за пиење[уреди | уреди извор]
Воден манган има поголема биорасположивост од диеталниот манган. Според резултатите на студијата од 2010 година,[75] повисоките нивоа на изложеност на манган во водата за пиење се поврзани со зголемено интелектуално оштетување и намалени разузнавачки количества кај децата на училишна возраст. Се претпоставува дека долгорочната изложеност поради вдишување на природниот манган во водата за туширање доведува до ризик на 8,7 милиони Американци.[76] Сепак, податоците покажуваат дека човечкото тело може да закрепне од одредени негативни ефекти од преголемата изложеност на манган ако изложеноста е запрена и телото може да го исчисти вишокот.[77]
Манганот во бензин[уреди | уреди извор]

Метилциклопентадиенил манган трикарбонил (ММТ) е бензински додаток кој се користи за замена на оловни соединенија за безоловен бензин за подобрување на октанскиот рејтинг на нискооктански нафтени дестилати. Го намалува притисокот на моторот преку дејството на карбонилните групи . Горивата што содржат манган имаат тенденција да формираат манган карбиди, кои ги оштетуваат издувните вентили . Во споредба со 1953 година, нивоата на манган во воздухот се намалија.[78] Многу тркачки натпревари конкретно забранија мангански соединенија во тркачките горива за коли и мини мотори. ММТ содржи 24,4-25,2% манган. Зголемените концентрации на атмосферскиот манган се силно поврзани со густината на сообраќајот. Нивото на манган емитиран од MMT горива се покажа дека е безбедно за општата популација и за ранливите групи, како што се доенчињата и старите лица, од страна на EPA и европските и канадските агенции за животна средина.
Манганот во тутунскиот чад[уреди | уреди извор]
Фабриката за тутун лесно ги апсорбира и акумулира тешките метали како манганот од околното тло во лисјата. Тие потоа се вдишуваат за време на пушењето тутун .[79] Додека манганот е составен дел на чадот од тутунот ,[80] студиите во голема мера заклучиле дека концентрациите не се опасни за здравјето на луѓето.[81]
Улога во невролошките нарушувања[уреди | уреди извор]
Манганизам[уреди | уреди извор]
Манганското прекумерно изложување е најчесто поврзано со манганизмот , ретко невролошко нарушување поврзано со прекумерно внесување на манган или инхалација. Историски гледано, лицата вработени во производството или преработката на легури на манган [82][83] се изложени на ризик за развој на манганизам; сепак, постојаните прописи за безбедност и здравје ги штитат работниците во развиените земји.[72] Ова нарушување првпат беше опишано во 1837 година од британскиот академик Џон Купер, кој студирал двајца пациенти кои биле мангански мелери.[20]
Манганизмот е бифазно нарушување. Во раните фази, затруеното лице може да доживее депресија, промени во расположението, компулсивно однесување и психоза. Раните невролошки симптоми го отстапуваат манганизмот во доцен стадиум, кој наликува на Паркинсонова болест . Симптомите вклучуваат слабост, монотон и забавен говор, лице без израз, треперење, нанапред потпомогнато одеало, неможност да се оди назад наназад без паѓање, ригидност и општи проблеми со умешност, одењето и рамнотежата.[20][84] За разлика од Паркинсоновата болест , манганизмот не е поврзан со губење на чувството за мирис, а пациентите обично не реагираат на третманот со L-DOPA .[85] Симптомите на манганизмот во доцната фаза стануваат потешки со текот на времето, дури и ако изворот на изложеност е отстранет и мозочните нивоа на манган се враќаат во нормала.[84]
Се покажало дека изложувањето на хронични мангани предизвикува болест слична на паркинсонизам, која се одликува со абнормалности на движењето.[86] Оваа состојба не одговара на типичните терапии кои се користат во третманот на ПД , што укажува на алтернативен пат од типичната допаминергична загуба во рамките на супстанцијата нигра .[86] Манганите можат да се акумулираат во базалните ганглии , што доведува до абнормални движења.[87] Мутацијата на генот SLC30A10, транспортер на мангенски ефлукс потребни за намалување на внатреклеточниот Mn, е поврзана со развојот на оваа болест слична на Паркинсонизмот.[88] Левиите карактеристични за ПД не се забележани кај Мn индуцираниот паркинсонизам.[87]
Експериментите со животни дадоа можност да ги испитаат последиците од преголема експозиција на манган во контролирани услови. Кај (неагресивните) стаорци, манганот предизвикал однесување за убивање на глувци.[89]
Растројства во развојот на детството[уреди | уреди извор]
Неколку неодамнешни истражувања се обиделе да ги испитаат ефектите врз детскиот развој од преголема екпозиција на хронична ниска доза манган .Најранита студија била спроведена во Кинеската провинција Шанкси. Водата за пиење била контаминирани преку неправилно наводнување со отпадни води и содржани 240-350 µg Mn/L .Иако Mn концентрации на или под 300 µg Mn/Л се сметале за безбедни за време на студијата од страна на ЕПА во САД и 400 µg Mn/L од страна на Светската Здравствена Организација, 92 деца (помеѓу 11 и 13-годишна возраст) од оваа провинција покажале пониски перформанси на тестовите за мануелна умешност и брзина, краткорочна меморија и визуелна идентификација, во споредба со децата од неконтаминираната област. Неодамна, една студија на 10-годишни деца во Бангладеш покажала врска помеѓу концентрација на Mn во добрата вода и намалени IQ резултати. Трета студија спроведена во Квебек ги испитувала ученици на возраст меѓу 6 и 15 години кои живееле во домови кои добивале вода од бунар што содржи 610 µg Mn/L; контролите живееле во домови кои добиле вода од 160 µg Mn/L . Децата во експерименталната група покажале зголемено хиперактивно и опозиционо однесување.[75]
Тековната максимална безбедна концентрација според правилата за EPA е 50 μg Mn / L.[90]
Невродегенеративни болести[уреди | уреди извор]
Една белковина наречена DMT1 е главниот транспортер во апсорпцијата на манган од цревата и може да биде главен транспортер на манган преку крвно-мозочната бариера . DMT1, исто така, го транспортира вдишаниот манган преку носниот епител. Предложениот механизам за токсичност на манган е дека дисрегулацијата води кон оксидативен стрес, митохондриска дисфункција, ексутоксичност посредувана од глутамат и агрегација на белковини.
Погледнете исто така[уреди | уреди извор]
- Список на земји со производство на манган
- Паркетирање
- Манган извозник , мембранска транспортна белковина
Наводи[уреди | уреди извор]
- ↑ Standard Atomic Weights 2013. Commission on Isotopic Abundances and Atomic Weights
- ↑ Roth, Jerome; Ponzoni, Silvia; Aschner, Michael (2013). Banci, Lucia (уред.). Metallomics and the Cell. Chapter 6 Manganese Homeostasis and Transport. Metal Ions in Life Sciences. 12. Springer. стр. 169–201. doi:10.1007/978-94-007-5561-1_6. ISBN 978-94-007-5560-4. PMID 23595673. electronic-book ISBN 978-94-007-5561-1
- ↑ 3,0 3,1 3,2 3,3 Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). Lehrbuch der Anorganischen Chemie. Mangan (германски) (91–100. изд.). Walter de Gruyter. стр. 1110–1117. ISBN 978-3-11-007511-3.
- ↑ Lide, David R. (2004). Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics (PDF). CRC press. ISBN 978-0-8493-0485-9. Архивирано од изворникот (PDF) на 2011-03-03.
- ↑ 5,0 5,1 5,2 Audi, Georges; Bersillon, O.; Blachot, J.; Wapstra, A. H. (2003). „The NUBASE Evaluation of Nuclear and Decay Properties“. Nuclear Physics A. 729 (1): 3–128. Bibcode:2003NuPhA.729....3A. CiteSeerX 10.1.1.692.8504. doi:10.1016/j.nuclphysa.2003.11.001.
- ↑ Schaefer, Jeorg; Faestermann, Thomas; Herzog, Gregory F.; Knie, Klaus; Korschinek, Gunther; Masarik, Jozef; Meier, Astrid; Poutivtsev, Michail; Rugel, Georg (2006). „Terrestrial manganese-53 – A new monitor of Earth surface processes“. Earth and Planetary Science Letters. 251 (3–4): 334–345. Bibcode:2006E&PSL.251..334S. doi:10.1016/j.epsl.2006.09.016.
- ↑ Shriver and Atkins' Inorganic Chemistry. Ch. 20. Oxford University Press. 2010. ISBN 978-0-19-923617-6.
- ↑ 8,0 8,1 Saha, Amrita; Majumdar, Partha; Goswami, Sreebrata (2000). „Low-spin manganese(II) and cobalt(III) complexes of N-aryl-2-pyridylazophenylamines: new tridentate N,N,N-donors derived from cobalt mediated aromatic ring amination of 2-(phenylazo)pyridine. Crystal structure of a manganese(II) complex“. Journal of the Chemical Society, Dalton Transactions (11): 1703–1708. doi:10.1039/a909769d.
- ↑ Rayner-Canham, Geoffrey and Overton, Tina (2003) Descriptive Inorganic Chemistry, Macmillan, p. 491, ISBN 0-7167-4620-4.
- ↑ Schmidt, Max (1968). Anorganische Chemie II. VII. Nebengruppe (германски). Wissenschaftsverlag. стр. 100–109.
- ↑ Temple, R. B.; Thickett, G. W. (1972). „The formation of manganese(v) in molten sodium nitrite“ (PDF). Australian Journal of Chemistry. 25 (3): 55. Bibcode:2005AJCh...58...69S. doi:10.1071/CH9720655.
- ↑ Luft, J. H. (1956). „Permanganate – a new fixative for electron microscopy“. Journal of Biophysical and Biochemical Cytology. 2 (6): 799–802. doi:10.1083/jcb.2.6.799. PMC 2224005. PMID 13398447.
- ↑ Calvert, J. B. (2003-01-24). „Chromium and Manganese“. Архивирано од изворникот на 31 December 2016. Посетено на 2009-04-30.
- ↑ Chalmin, Emilie; Menu, Michel; Vignaud, Colette (2003). „Analysis of rock art painting and technology of Palaeolithic painters“. Measurement Science and Technology. 14 (9): 1590–1597. doi:10.1088/0957-0233/14/9/310.
- ↑ Chalmin, E.; Vignaud, C.; Salomon, H.; Farges, F.; Susini, J.; Menu, M. (2006). „Minerals discovered in paleolithic black pigments by transmission electron microscopy and micro-X-ray absorption near-edge structure“ (PDF). Applied Physics A. 83 (12): 213–218. Bibcode:2006ApPhA..83..213C. doi:10.1007/s00339-006-3510-7.
- ↑ Sayre, E. V.; Smith, R. W. (1961). „Compositional Categories of Ancient Glass“. Science. 133 (3467): 1824–1826. Bibcode:1961Sci...133.1824S. doi:10.1126/science.133.3467.1824. PMID 17818999.
- ↑ 17,0 17,1 17,2 Mccray, W. Patrick (1998). „Glassmaking in renaissance Italy: The innovation of venetian cristallo“. JOM. 50 (5): 14–19. Bibcode:1998JOM....50e..14M. doi:10.1007/s11837-998-0024-0.
- ↑ Rancke-Madsen, E. (1975). „The Discovery of an Element“. Centaurus. 19 (4): 299–313. Bibcode:1975Cent...19..299R. doi:10.1111/j.1600-0498.1975.tb00329.x.
- ↑ Alessio, L.; Campagna, M.; Lucchini, R. (2007). „From lead to manganese through mercury: mythology, science, and lessons for prevention“. American Journal of Industrial Medicine. 50 (11): 779–787. doi:10.1002/ajim.20524. PMID 17918211.
- ↑ 20,0 20,1 20,2 Couper, John (1837). „On the effects of black oxide of manganese when inhaled into the lungs“. Br. Ann. Med. Pharm. Vital. Stat. Gen. Sci. 1: 41–42.
- ↑ Olsen, Sverre E.; Tangstad, Merete; Lindstad, Tor (2007). Production of Manganese Ferroalloys. History of omanganese. Tapir Academic Press. стр. 11–12. ISBN 978-82-519-2191-6.
- ↑ 22,0 22,1 Preisler, Eberhard (1980). „Moderne Verfahren der Großchemie: Braunstein“. Chemie in Unserer Zeit (германски). 14 (5): 137–148. doi:10.1002/ciuz.19800140502.
- ↑ 23,0 23,1 23,2 23,3 23,4 Emsley, John (2001). Nature's Building Blocks: An A-Z Guide to the Elements. Manganese. Oxford, UK: Oxford University Press. стр. 249–253. ISBN 978-0-19-850340-8.
- ↑ Bhattacharyya, P. K.; Dasgupta, Somnath; Fukuoka, M.; Roy Supriya (1984). „Geochemistry of braunite and associated phases in metamorphosed non-calcareous manganese ores of India“. Contributions to Mineralogy and Petrology. 87 (1): 65–71. Bibcode:1984CoMP...87...65B. doi:10.1007/BF00371403.
- ↑ 25,0 25,1 25,2 25,3 Corathers, Lisa A. (2009). „Mineral Commodity Summaries 2009: Manganese“ (PDF). United States Geological Survey. Посетено на 2009-04-30.
- ↑ Wang, X; Schröder, HC; Wiens, M; Schlossmacher, U; Müller, WEG (2009). „Manganese/polymetallic nodules: micro-structural characterization of exolithobiontic- and endolithobiontic microbial biofilms by scanning electron microscopy“. Micron. 40 (3): 350–358. doi:10.1016/j.micron.2008.10.005. PMID 19027306.
- ↑ United Nations Ocean Economics and Technology Office, Technology Branch, United Nations (1978). Manganese Nodules: Dimensions and Perspectives. Marine Geology. 41. Springer. стр. 343. Bibcode:1981MGeol..41..343C. doi:10.1016/0025-3227(81)90092-X. ISBN 978-90-277-0500-6.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ „The CIA secret on the ocean floor“. BBC News (англиски). 2018-02-19. Посетено на 2018-05-03.
- ↑ „Manganese Mining in South Africa – Overview“. MBendi.com. Архивирано од изворникот на 5 February 2016. Посетено на 2014-01-04.
- ↑ Elliott, R; Coley, K; Mostaghel, S; Barati, M (2018). „Review of Manganese Processing for Production of TRIP/TWIP Steels, Part 1: Current Practice and Processing Fundamentals“. JOM. 70 (5): 680–690. Bibcode:2018JOM...tmp...63E. doi:10.1007/s11837-018-2769-4.
- ↑ 31,0 31,1 Corathers, Lisa A. (June 2008). „2006 Minerals Yearbook: Manganese“ (PDF). Washington, D.C.: United States Geological Survey. Посетено на 2009-04-30.
- ↑ Corathers, L. A.; Machamer, J. F. (2006). Industrial Minerals & Rocks: Commodities, Markets, and Uses. Manganese (7. изд.). SME. стр. 631–636. ISBN 978-0-87335-233-8.
- ↑ 33,0 33,1 Zhang, Wensheng; Cheng, Chu Yong (2007). „Manganese metallurgy review. Part I: Leaching of ores/secondary materials and recovery of electrolytic/chemical manganese dioxide“. Hydrometallurgy. 89 (3–4): 137–159. doi:10.1016/j.hydromet.2007.08.010.
- ↑ „Project Azorian: The CIA's Declassified History of the Glomar Explorer“. National Security Archive at George Washington University. 2010-02-12. Посетено на 2013-09-18.
- ↑ 35,0 35,1 Verhoeven, John D. (2007). Steel metallurgy for the non-metallurgist. Materials Park, Ohio: ASM International. стр. 56–57. ISBN 978-0-87170-858-8.
- ↑ Dastur, Y. N.; Leslie, W. C. (1981). „Mechanism of work hardening in Hadfield manganese steel“. Metallurgical Transactions A. 12 (5): 749. Bibcode:1981MTA....12..749D. doi:10.1007/BF02648339.
- ↑ Stansbie, John Henry (2007). Iron and Steel. Read Books. стр. 351–352. ISBN 978-1-4086-2616-0.
- ↑ Brady, George S.; Clauser, Henry R.; Vaccari. John A. (2002). Materials Handbook: an encyclopedia for managers, technical professionals, purchasing and production managers, technicians, and supervisors. New York, NY: McGraw-Hill. стр. 585–587. ISBN 978-0-07-136076-0.
- ↑ Tweedale, Geoffrey (1985). „Sir Robert Abbott Hadfield F.R.S. (1858–1940), and the Discovery of Manganese Steel Geoffrey Tweedale“. Notes and Records of the Royal Society of London. 40 (1): 63–74. doi:10.1098/rsnr.1985.0004. JSTOR 531536.
- ↑ „Chemical properties of 2024 aluminum allow“. Metal Suppliers Online, LLC. Посетено на 2009-04-30.
- ↑ 41,0 41,1 Kaufman, John Gilbert (2000). Introduction to aluminum alloys and tempers. Applications for Aluminium Alloys and Tempers. ASM International. стр. 93–94. ISBN 978-0-87170-689-8.
- ↑ Leigh A. Graham; Alison R. Fout; Karl R. Kuehne; Jennifer L. White; Bhaskar Mookherji; Fred M. Marks; Glenn P. A. Yap; Lev N. Zakharov & Arnold L. Rheingold (2005). „Manganese(I) poly(mercaptoimidazolyl)borate complexes: spectroscopic and structural characterization of MnH–B interactions in solution and in the solid state“. Dalton Transactions (1): 171–180. doi:10.1039/b412280a. PMID 15605161.
- ↑ 43,0 43,1 Dell, R. M. (2000). „Batteries fifty years of materials development“. Solid State Ionics. 134: 139–158. doi:10.1016/S0167-2738(00)00722-0.
- ↑ Kuwahara, Raymond T.; Skinner III, Robert B.; Skinner Jr., Robert B. (2001). „Nickel coinage in the United States“. Western Journal of Medicine. 175 (2): 112–114. doi:10.1136/ewjm.175.2.112. PMC 1071501. PMID 11483555.
- ↑ „Design of the Sacagawea dollar“. United States Mint. Архивирано од изворникот на 2021-04-22. Посетено на 2009-05-04. Наводот journal бара
|journal=(help) - ↑ Shepard, Anna Osler (1956). Ceramics for the Archaeologist. Manganese and Iron–Manganese Paints. Carnegie Institution of Washington. стр. 40–42. ISBN 978-0-87279-620-1.
- ↑ Chen, Daquin; Zhou, Yang; Zhong, Jiasong (2016). „A review on Mn4+ activators in solids for warm white light-emitting diodes“. RSC Advances. 6 (89): 86285–86296. doi:10.1039/C6RA19584A.
- ↑ Baur, Florian; Jüstel, Thomas (2016). „Dependence of the optical properties of Mn4+ activated A2Ge4O9 (A=K,Rb) on temperature and chemical environment“. Journal of Luminescence. 177: 354–360. Bibcode:2016JLum..177..354B. doi:10.1016/j.jlumin.2016.04.046.
- ↑ Jansen, T.; Gorobez, J.; Kirm, M.; Brik, M. G.; Vielhauer, S.; Oja, M.; Khaidukov, N. M.; Makhov, V. N.; Jüstel, T. (2018-01-01). „Narrow Band Deep Red Photoluminescence of Y2Mg3Ge3O12:Mn4+,Li+ Inverse Garnet for High Power Phosphor Converted LEDs“. ECS Journal of Solid State Science and Technology. 7 (1): R3086–R3092. doi:10.1149/2.0121801jss.
- ↑ Jansen, Thomas; Baur, Florian; Jüstel, Thomas (2017). „Red emitting K2NbF7:Mn4+ and K2TaF7:Mn4+ for warm-white LED applications“. Journal of Luminescence. 192: 644–652. Bibcode:2017JLum..192..644J. doi:10.1016/j.jlumin.2017.07.061.
- ↑ Zhou, Zhi; Zhou, Nan; Xia, Mao; Yokoyama, Meiso; Hintzen, H. T. (Bert) (2016-10-06). „Research progress and application prospects of transition metal Mn4+-activated luminescent materials“. Journal of Materials Chemistry C. 4 (39): 9143–9161. Bibcode:2013JMCC....1.4300D. doi:10.1039/c6tc02496c.
- ↑ „TriGain LED phosphor system using red Mn4+-doped complex fluorides“ (PDF). GE Global Research. Посетено на 2017-04-28. Наводот journal бара
|journal=(help) - ↑ Rehsi, S.S. (1983-12-31), Magnesium Oxide in Portland Cement, стр. 467–483, ISBN 9780080286709, Посетено на 2018-08-24
- ↑ Erikson, Keith M.; Ascher, Michael (2019). Sigel, Astrid; Freisinger, Eva; Sigel, Roland K. O.; Carver, Peggy L. (Guest editor) (уред.). Essential Metals in Medicine:Therapeutic Use and Toxicity of Metal Ions in the Clinic. Chapter 10. Manganese: Its Role in Disease and Health. Metal Ions in Life Sciences. 19. Berlin: de Gruyter GmbH. стр. 253–266. doi:10.1515/9783110527872-016. ISBN 978-3-11-052691-2.
- ↑ Takeda, A. (2003). „Manganese action in brain function“. Brain Research Reviews. 41 (1): 79–87. doi:10.1016/S0165-0173(02)00234-5. PMID 12505649.
- ↑ Silva Avila, Daiana; Luiz Puntel, Robson; Aschner, Michael (2013). Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (уред.). Interrelations between Essential Metal Ions and Human Diseases. Chapter 7. Manganese in Health and Disease. Metal Ions in Life Sciences. 13. Springer. стр. 199–227. doi:10.1007/978-94-007-7500-8_7. ISBN 978-94-007-7499-5. PMID 24470093.
- ↑ Law, N.; Caudle, M.; Pecoraro, V. (1998). Manganese Redox Enzymes and Model Systems: Properties, Structures, and Reactivity. Advances in Inorganic Chemistry. 46. стр. 305. doi:10.1016/S0898-8838(08)60152-X. ISBN 9780120236466.
- ↑ Umena, Yasufumi; Kawakami, Keisuke; Shen, Jian-Ren; Kamiya, Nobuo (May 2011). „Crystal structure of oxygen-evolving photosystem II at a resolution of 1.9 Å“ (PDF). Nature. 473 (7345): 55–60. Bibcode:2011Natur.473...55U. doi:10.1038/nature09913. PMID 21499260.
- ↑ Празен навод (help)
- ↑ 60,0 60,1 Institute of Medicine (US) Panel on Micronutrients (2001). Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Chromium, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Chromium. Manganese. National Academy Press. стр. 394–419. ISBN 978-0-309-07279-3. PMID 25057538.
- ↑ See „Manganese“. Micronutrient Information Center. Oregon State University Linus Pauling Institute. 2014-04-23.
- ↑ „Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies“ (PDF). 2017.
- ↑ Tolerable Upper Intake Levels For Vitamins And Minerals (PDF), European Food Safety Authority, 2006
- ↑ „Federal Register May 27, 2016 Food Labeling: Revision of the Nutrition and Supplement Facts Labels. FR page 33982“ (PDF).
- ↑ "Промени во панелот за факти за исхрана - Датум на усогласување"
- ↑ https://www.sigmaaldrich.com/MSDS/MSDS/DisplayMSDSPage.do?country=US&language=en&productNumber=266167&brand=ALDRICH&PageToGoToURL=https%3A%2F%2Fwww.sigmaaldrich.com%2Fcatalog%2Fproduct%2Faldrich%2F266167%3Flang%3Den
- ↑ Hasan, Heather (2008). Manganese. The Rosen Publishing Group. стр. 31. ISBN 978-1-4042-1408-8.
- ↑ „Manganese Chemical Background“. Metcalf Institute for Marine and Environmental Reporting University of Rhode Island. April 2006. Архивирано од изворникот на 28 August 2006. Посетено на 2008-04-30.
- ↑ „Risk Assessment Information System Toxicity Summary for Manganese“. Oak Ridge National Laboratory. Посетено на 2008-04-23.
- ↑ Ong, K. L.; Tan, T. H.; Cheung, W. L. (1997). „Potassium permanganate poisoning – a rare cause of fatal self poisoning“. Emergency Medicine Journal. 14 (1): 43–45. doi:10.1136/emj.14.1.43. PMC 1342846. PMID 9023625.
- ↑ Young, R.; Critchley, J. A.; Young, K. K.; Freebairn, R. C.; Reynolds, A. P.; Lolin, Y. I. (1996). „Fatal acute hepatorenal failure following potassium permanganate ingestion“. Human & Experimental Toxicology. 15 (3): 259–61. doi:10.1177/096032719601500313. PMID 8839216.
- ↑ 72,0 72,1 „Safety and Health Topics: Manganese Compounds (as Mn)“. U.S. Occupational Safety and Health Administration. Архивирано од изворникот на 2017-08-01. Посетено на 2019-03-30.
- ↑ „NIOSH Pocket Guide to Chemical Hazards – Manganese compounds and fume (as Mn)“. Centers for Disease Control. Посетено на 2015-11-19.
- ↑ Yin, Z.; Jiang, H.; Lee, E. S.; Ni, M.; Erikson, K. M.; Milatovic, D.; Bowman, A. B.; Aschner, M. (2010). „Ferroportin is a manganese-responsive protein that decreases manganese cytotoxicity and accumulation“ (PDF). Journal of Neurochemistry. 112 (5): 1190–8. Bibcode:2006JNeur..26.9606G. doi:10.1111/j.1471-4159.2009.06534.x. PMC 2819584. PMID 20002294.
- ↑ 75,0 75,1 Bouchard, M. F; Sauvé, S; Barbeau, B; Legrand, M; Bouffard, T; Limoges, E; Bellinger, D. C; Mergler, D (2011). „Intellectual impairment in school-age children exposed to manganese from drinking water“. Environmental Health Perspectives. 119 (1): 138–143. doi:10.1289/ehp.1002321. PMC 3018493. PMID 20855239. Посетено на 2010-12-11.
- ↑ Barceloux, Donald; Barceloux, Donald (1999). „Manganese“. Clinical Toxicology. 37 (2): 293. doi:10.1081/CLT-100102427.
- ↑ Devenyi, A. G; Barron, T. F; Mamourian, A. C (1994). „Dystonia, hyperintense basal ganglia, and high whole blood manganese levels in Alagille's syndrome“. Gastroenterology. 106 (4): 1068–71. PMID 8143974.
- ↑ Агенција за токсични супстанции и регистар на болести (2012) 6. Потенцијал за изложеност на луѓе , во токсиколошки профил за манган [1] , Атланта, Џорџија: Американското Министерство за здравство и социјални услуги.
- ↑ Pourkhabbaz, A; Pourkhabbaz, H (2012). „Investigation of Toxic Metals in the Tobacco of Different Iranian Cigarette Brands and Related Health Issues“. Iranian Journal of Basic Medical Sciences. 15 (1): 636–644. PMC 3586865. PMID 23493960.
- ↑ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). „Hazardous Compounds in Tobacco Smoke“. International Journal of Environmental Research and Public Health. 8 (12): 613–628. doi:10.3390/ijerph8020613. PMC 3084482. PMID 21556207.
- ↑ Bernhard, David; Rossmann, Andrea; Wick, Georg (2005). „Metals in cigarette smoke“. IUBMB Life. 57 (12): 805–9. doi:10.1080/15216540500459667. PMID 16393783.
- ↑ Baselt, R. (2008) Disposition of Toxic Drugs and Chemicals in Man, 8th edition, Biomedical Publications, Foster City, CA, pp. 883–886, ISBN 0-9626523-7-7.
- ↑ Normandin, Louise; Hazell, A. S. (2002). „Manganese neurotoxicity: an update of pathophysiologic mechanisms“. Metabolic Brain Disease. 17 (4): 375–87. doi:10.1023/A:1021970120965. PMID 12602514.
- ↑ 84,0 84,1 Cersosimo, M. G.; Koller, W.C. (2007). „The diagnosis of manganese-induced parkinsonism“. NeuroToxicology. 27 (3): 340–346. doi:10.1016/j.neuro.2005.10.006. PMID 16325915.
- ↑ Lu, C. S.; Huang, C.C; Chu, N.S.; Calne, D.B. (1994). „Levodopa failure in chronic manganism“. Neurology. 44 (9): 1600–1602. doi:10.1212/WNL.44.9.1600. PMID 7936281.
- ↑ 86,0 86,1 „Manganese-Induced Parkinsonism Is Not Idiopathic Parkinson's Disease: Environmental and Genetic Evidence“. Toxicological Sciences (Review). 146 (2): 204–12. August 2015. doi:10.1093/toxsci/kfv099. PMC 4607750. PMID 26220508.
- ↑ 87,0 87,1 „Manganese-Induced Parkinsonism and Parkinson's Disease: Shared and Distinguishable Features“. Int J Environ Res Public Health (Review). 12 (7): 7519–40. July 2015. doi:10.3390/ijerph120707519. PMC 4515672. PMID 26154659.
- ↑ „Manganese-induced neurotoxicity: a review of its behavioral consequences and neuroprotective strategies“. BMC Pharmacology & Toxicology (Review). 17 (1): 57. November 2016. doi:10.1186/s40360-016-0099-0. PMC 5097420. PMID 27814772.
- ↑ Lazrishvili, I.; и др. (2016). „Manganese loading induces mouse-killing behaviour in nonaggressive rats“. Journal of Biological Physics and Chemistry. 16 (3): 137–141. doi:10.4024/31LA14L.jbpc.16.03.
- ↑ „Drinking Water Contaminants“. US EPA. Посетено на 2 February 2015.
Надворешни врски[уреди | уреди извор]
- Национален загадувач на загадувачки супстанции - Информативен лист за манган и соединенија
- Меѓународен институт за манган
- НИОШ манган тема Страница
- Манган во Периодниот систем на видеа (Универзитет во Нотингем)
| Периоден систем на елементите | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| I | H | He | |||||||||||||||||||||||||||||||
| II | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| III | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| IV | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| V | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| VI | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| VII | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
|



