Вирус
| Вируси | |
|---|---|

| |
| Ротавирус | |
| Класификација | |
| Група: | I–VII |
| Групи | |
|
I: двДНК вируси | |
Вирус (од лат. virus - „токсин“ или „отров“) е подмикроскопска честичка која не е способна да расте и да се размножува надвор од клетката домаќин. Вирусите можат да ги инфицираат сите животни форми, од животни и растенија до микроорганизми, вклучувајќи ги бактериите и археите.[1]
Од времето на објавувањето на научниот труд на Дмитриј Ивановски во 1892 година, во кој за првпат е опишан небактериски патоген кој го инфицира тутунот, и откривањето на вирусот на мозаичната болест на тутунот од Мартинус Бејеринк во 1898 година, околу 5.000 вирусни видови се детално опишани, иако постојат милиони типови.[2] Вирусите се наоѓаат речиси во секој екосистем на Земјата и се најзастапениот биолошки ентитет.[3][4] Науката за вируси е позната како вирологија и претставува супспецијалност на микробиологијата.
Додека не инфицираат одредена клетка, вирусите постојат во форма на независни честички. Овие вирални честички, познати и како вириони, се состојат од два или три дела: (1) генетски материјал составен од ДНК или РНК; (2) заштитна белковинска обвивка наречена капсид, која го опкружува и заштитува генетскиот материјал; а во одредени случаи (3) обвивка од липиди која го опкружува белковинскиот слој. Формите на вирусните честички варираат од едноставни, спирални или икосаедрични форми, до мошне комплексни структури. Повеќето вирусни видови имаат вириони кои се премногу мали за да можат да се видат со оптички микроскоп. Просечната големина на еден вирион е околу стоти дел од големината на просечната бактерија.
Потеклото на вирусите во еволуционата историја на животот на Земјата се нејасни: некои вируси можеби еволуирале од плазмиди (ДНК сегменти кои можат да се разменуваат помеѓу клетки), додека други можеби еволуирале од бактерии, со упростување на нивната структура. Во еволуцијата, вирусите се значаен посредник во хоризонталниот пренос на гени, процес кој ја зголемува генетската разновидност кај организмите.[5] Некои автори вирусите ги сметаат за форма на живот, бидејќи тие носат генетски материјал, се репродуцираат и еволуираат по пат на природна селекција.[6] Други, пак, не ги сметаат за форма на живот, бидејќи кај нив недостасуваат клучни одлики, како што е клеточната структура, кои се сметаат за основни обележја на животот. Бидејќи тие поседуваат неколку, но не сите, квалитети на жива материја, вирусите се опишани како „организми на работ на животот“,[7] и како репликатори.[8]
Вирусите се шират на многу различни начини; растителните вируси се пренесуваат од една до друга единка преку инсекти кои се хранат со растителните сокови, како што се растителните вошки; животинските вируси може да се пренесуваат преку паразитски инсекти кои цицаат крв. Ваквите организми кои пренесуваат болести се познати како вектори. Вирусите на грипот (инфлуенца) се пренесуваат од човек на човек преку кашлање и кивање. Норовирус и ротавирус, чести причинители на вирусниот гастроентеритис, се пренесуваат преку фекално-оралниот пат од човек на човек со контакт, влегувајќи во телото преку храна или вода. ХИВ е еден од неколкуте вируси кои се пренесуваат преку сексуален контакт и со изложување на крв од заразен поединец. Опсегот на клетки домаќини кои вирусот може да ги зарази се нарекува „опсег на домаќини“. Тој може да биде тесен, што значи дека вирусот е способен да инфицира само неколку видови на клетки, или широк, што значи дека вирусот е способен да инфицира многу видови на клетки.[9]
Вирусните инфекции доведуваат до тешки заболувања кај човекот, животните и растенијата, а може да предизвикаат сериозни оштетувања кај земјоделските култури. Вирусните инфекции кај домаќинот предизвикуваат активација на имунолошкиот одговор, чија функција е да го елиминира вирусот. Имунолошки реакции можат да индуцираат и вакцините, кои даваат вештачки стекнат имунитет кон специфична вирусна инфекција. Некои вирусни видови, вклучувајќи ги оние кои предизвикуваат СИДА и вирусен хепатит, се способни да ги избегнуваат имуните реакции на домаќинот, што резултира со хронични инфекции. Антибиотиците немаат никакво дејство врз вирусите, а развиени се неколку типови на антивирусни лекови. За некои посериозни вирусни заболувања се применува вакцинација, која може да обезбеди доживотна заштита.
Етимологија[уреди | уреди извор]
Зборот вирус потекнува од латинскиот збор vīrus кој во превод значи отров, смрдеа, слуз. Зборот има индоевропски корен кој е ист за: санскритскиот израз viṣa – отров, авестискиот израз vīša – отров, и старогрчкиот израѕ ἰός – отров.[10] Зборот, со ова значење, за првпат бил употребен на англиски јазик во 1398 година во преводот на Џон Тревиза на делото De Proprietatibus Rerum од Бартоломеј Англински. Терминот вирулентен, потекнува од латинскиот збор virulentus (отровен) и датира од околу 1400-тата година.[11] Со значењето на „агенс кој предизвикува инфективно заболување“ првпат се споменува во 1728 година,[10] многу пред откривањето на вирусите од страна на рускиот ботаничар и еден од основачите на вирологијата, Дмитриј Ивановски, во 1892 година. Етимолошки се користат уште и изведените изрази: придавката вирални, која е во употреба од 1948 година[12] и терминот virion (вирион) кој е во употреба од 1959 година[13] и се користи да опише стабилна, инфективна вирална честичка која е ослободена од клетка и е способна да инфицира друга истородна клетка.[14]
Историја[уреди | уреди извор]

Почетоците на вирологијата се тесно поврзани со откривањето на бактериските филтри. Луј Пастер, не можејќи да го најде предизвикувачот на беснило, шпекулирал дека патогениот агенс бил толку мал што не можел да се види со микроскоп.[15] Во 1884 година, францускиот микробиолог Шарл Шамберлан ги пронашол филтрите од груб порцелан, денес познати како Шамберланови или Пастер-Шамберланови филтри. Порите на овие филтри биле толку мали што бактериите не можеле да поминат низ нив, така што филтерот целосно ги отстранувал бактериите кои се наоѓале во растворот.[16] Овие филтри од порцелан и кременова земја (инфузориска или дијатомејска земја) значително помогнале во откривање на вирусите, дотогаш непознати причинители на неколку заразни болести. Во 1892 година, рускиот научник Димитриј Јосифович Ивановски го искористил овој филтер за да го проучи вирусот на мозаичната болест на тутунот. Неговите експерименти покажале дека екстрактите од инфицирани листови на тутун остануваат заразни и по филтрацијата, а во филтратот не можеле да се видат причинителите ни со тогашните најсовршени микроскопи.[16] Резултатите на Ивановски ги потврдил холандскиот микробиолог Мартинус Бејеринк во 1898 година. Тој, инфективните агенси кои поминувале низ филтрите, а не можеле да се видат под микроскоп, но можеле да се размножуваат во клетки кои се делат, ги нарекол contagium vivum fluidum (растворлив жив микроб) и повторно го вовел зборот вирус.[16] Бејеринк тврдел дека вирусите се со течна природа, а неговата теорија многу подоцна била побиена од Вендел Стенли, кој докажал дека вирусите се честички. Во 1898 година, германските бактериолози Фридрих Лефлер и Пол Фрош го откриле причинителот на шап и лигавка, без да го набљудуваат со микроскоп.[17]
Во почетокот на 20 век, англискиот бактериолог Фредерик Творт открил група на вируси кои инфицираат бактерии, кои сега се нарекуваат бактериофаги (фаги). Во бактериофагите се гледал потенцијал во терапијата на тешките заболувања, како што се колера и тифус, но со развојот на пеницилинот овие очекувања пропаднале. Проучувањето на фагите бил вовед во полето на изучување на механизмите за внесување на страни гени во бактериски клетки.
До крајот на 19 век, вирусите биле дефинирани во однос на нивната инфективност, способност да се филтрираат и нивното преживување само во жив домаќин. Тие биле култивирани само во растенија и животни. Во 1906 година, американскиот биолог Рос Гранвил Харисон пронашол метода за култивирање на ткива во лимфа, а во 1913 година, Е. Штајнхарт, В. Израел и Р. А. Ламберт го искористиле овој метод за култивирање на вирусот вакцинија, во делови од епидермално ткиво на морско прасе.[18] Во 1928 година, истиот вирус го култивирале Х. Б. Мајтленд и М. К. Мајтленд во суспензии од бубрежно ткиво на кокошки, но нивната метода не била широко прифатена сѐ до 1950-тите години, кога нашла примена во култивацијата на полиовирусот за производство на вакцини.
Вистинскиот пробив во култивирањето на вирусите настанал во 1931 година, кога американските лекари и виролози Ернест Вилијам Гудпастер и Алиса Мајлс Вудруф го култивирале вирусот на грип, и некои други вируси, во оплодено кокошкино јајце.[19] Во 1949 година, Џон Френклин Ендерс, Томас Велер и Фредерик Робинс го култивирале полиовирусот во клетки на човечки ембрион, прв вирус култивиран без употреба на животинско ткиво или јајца, за што во 1954 година добиле Нобелова награда. Токму овој напредок му овозможил на Џонас Салк да ја направи првата ефикасна полио вакцина.[20]
Првите слики на вирусите се добиени со откривањето на електронската микроскопија, во 1931 година, од германските инженери Ернст Руска и Макс Кнол.[21] Во 1935 година, американскиот биохемичар и виролог Вендел Мередит Стенли, испитувајќи го вирусот на мозаичната болест на тутунот, открил дека тој е претежно изграден од белковини.[22] Овој вирус е првиот кој бил кристализиран, а неговата структура била детално објаснета. Комплетната структура на вирусот ја одгатнала англиската хемичарка Розалинда Франклин во 1955 година.[23]
Втората половина на 20 век била златно доба на вирологијата. Тогаш биле откриени над 2.000 видови на вируси:[24] во 1957 година бил откриен артеривирус кај коњите и пестивирус, причинител на дијареја кај говедата; во 1963 година бил откриен вирусот на хепатит Б; во 1965 година бил опишан првиот ретровирус; во 1983 година бил изолиран ретровирус, наречен ХИВ, од тимот на Лук Монтањер во Пастеровиот институтот во Париз, Франција;[25] а во 1989 година бил откриен вирусот на хепатит Ц.[26][27]
Основни одлики[уреди | уреди извор]
Особини на жив организам[уреди | уреди извор]
Сѐ уште не постои консензус во науката дали вирусите се форма на живот или органски структури кои стапуваат во интеракција со живите организми.[8] Некои автори ги опишуваат како „организми на работ на животот“,[7] бидејќи поседуваат гени, еволуираат по пат на природна селекција[28] и способни се за репродукција. Сепак, тие немаат клеточна структура, која се смета за една од фундаменталните особини на животот. Тие немаат ниту свој метаболизам и потполно се зависни од метаболните процеси на клетката-домаќин, а поради ова не се способни самостојно да се репродуцираат надвор од клетката-домаќин.[29] Меѓутоа, некои бактерии, како што се рикециите и хламидиите, иако ги имаат истите репродуктивни ограничувања како и вирусите, сепак се сметаат за живи организми.[30][31] Признаените форми на живот користат клеточна делба за репродукција, додека вирусните честички спонтано се самоорганизираат во клетката. Тие се разликуваат од самоорганизирачките кристали, бидејќи наследуваат генетски мутации и се предмет на природна селекција. Вирусното самоорганизирање во клетките на домаќинот има импликации на проучувањето на потеклото на животот, бидејќи дава поддршка на хипотезата за почеток на животот со самоорганизирање на органски молекули во првобитниот океан.[1]
Градба[уреди | уреди извор]

Вирусите се среќаваат во разновидни облици и големини. Во принцип, тие се многу помали од бактериите и археите. Повеќето вируси кои досега биле проучувани имаат пречник помеѓу 20 и 300 нанометри. Најмалите вируси се парвовирусите кои можат да имаат пречник од само 25 нм. Некои филовируси, пак, имаат должина до 1400 нм, а нивниот пречник е околу 80 нм.[32] Најголемиот број на вируси се премногу мали за да можат да се видат со оптички микроскоп, затоа за нивно визуелизирање се користат скенирачки електронски микроскопи (SEM) и преносни електронски микроскопи (TEM).[33] Границата на резолуцијата на еден традиционален електронски микроскоп (ЕМ) е околу 5 нм. Со понапредните електронско-микроскопски техники (како криогенскиот ЕМ, при што испитуваниот примерок веднаш се смрзнува наместо да се фиксира со хемикалии), заедно со компјутерските техники, можат да се видат и помали структури, со величина до 1-2 нм. Рендгенската кристалографија е единствениот метод со кој може да се добие резолуција на атомско ниво. Малите вируси кои даваат униформни честички можат да се кристализираат. Првото набљудување на вирус на атомско ниво се случило во 1978 година. За да се зголеми контрастот помеѓу вирусите и позадината, се користат т.н. електронски густи „бои“, кои претставуваат соли на тешки метали, како што е волфрамот, а имаат улога да ги расејуваат електроните од регионите покриени со бојата. Кога вирионите се обложени со бојата (позитивно боење), фините детали на сликата не се забележливи. Негативното боење го надминува овој проблем со обојување само на позадината.[34]
Целосната вирусна честичка, наречена вирион, се состои од нуклеинска киселина (РНК или ДНК) во заштитна обвивка од белковински молекули наречена капсид.[33] Капсидот го градат идентични белковински подединици, наречени капсомери, а неговата форма служи како основа за морфолошка дистинкција на вирусите. Вирусите понекогаш може да поседуваат и липидна обвивка која потекнува од клеточната мембрана на домаќинот.[33] Белковините кои го градат капсидот се кодирани од вирусниот геном.[35][36] Овие белковински подединици самостојно се групираат и поврзуваат за да го формираат капсидот, а некои комплексни вируси кодираат и за дополнителни белковини кои помагаат во овој процес. Белковините кои се врзуваат за нуклеински киселини се познати како нуклеобелковини, а асоцијацијата на вирусните капсидни белковини со вирусната нуклеинска киселина се нарекува нуклеокапсид. Капсидната и севкупната вирусна структура, можат механички (физички) да се проучат со помош на микроскопија на атомски сили (анг. Atomic Force Microscope, AFM).[37][38] Во принцип, постојат четири основни типа на вирусна морфологија:
Стапчести (хеликални)[уреди | уреди извор]

Овие вируси се составени од еден тип на капсомери наредени околу централната оска со што формираат стапчеста структура, која може да има централна празнина (цевка). Ваквиот аранжман резултира со стапчести или филаментозни вириони, кои можат да бидат кратки и крути или долги и флексибилни. Генетскиот материјал, едноверижна РНК (евРНК) или едноверижна ДНК (евДНК), е сместен во централната празнина и се врзува за белковините со помош на електростатички заемодејства помеѓу негативните полнежи на нуклеинската киселина и позитивните полнежи на белковините. Обично, должината на стапчестиот капсид зависи од должината на нуклеинската киселина внатре во него, а пречникот зависи од големината и распоредот на капсомерите. Вирусот на мозаичната болест на тутунот е пример за стапчест вирус.[33]
Икосаедрични[уреди | уреди извор]
Повеќето животински вируси се икосаедрични или речиси сферични, со хирална икосаедрична симетрија. Икосаедарот е оптималната геометриска конфигурација за формирање на затворена школка, изградена од идентични подединици. Минималниот број на идентични капсомери потребни за формирање на секоја од триаголните страни на икосаедарот е три, што вкупно дава 60. Многу вируси, како што е ротавирусот, имаат повеќе од 60 капсомери и изгледаат сферични, иако ја задржуваат оваа симетрија. За да се постигне ова, капсомерите на врвовите се опкружени со пет други капсомери и се нарекуваат пентони. Капсомерите на триаголните површини се опкружени со шест други капсомери и се нарекуваат хексони. Хексоните се во суштина рамни, а пентоните, кои ги формираат дванаесетте оски, се закривени. Истata белковина може да ги гради подединиците на пентамерите и хексамерите, или, пак, тие можат да бидат изградени од различни белковини.[39]
Издолжени[уреди | уреди извор]
Оваа форма е икосаедар издолжен по петкратната оска. Често се среќава во градбата на главите на бактериофагите.[40]
Со мембранска обвивка[уреди | уреди извор]
Некои видови на вируси се обвиткуваат со изменета форма на една од клеточните мембрани на клетката-домаќин, или надворешната цитоплазматска мембрана или некоја од внатрешните мембрани на јадрото или органелите. Мембраната е обложена со белковини кодирани од вирусниот геном и геномот на домаќинот, а самиот липиден двослој и сите присутни јаглехидрати потекнуваат целосно од клетката домаќин. Повеќето мембрански-обвиени вируси, како што се вирусот на грипот и ХИВ, потполно се зависни од мембранската обвивка за нивната инфективност.[41][42]
Сложени[уреди | уреди извор]

Сложените вируси поседуваат капсид кој не е ниту чисто хеликален ниту чисто икосаедричен, а може да има и дополнителни структури, како што се белковински опашки или комплексен надворешен ѕид. Некои бактериофаги, како што е Enterobacteria phage T4, имаат комплексна структура која се состои од икосаедрична „глава“ поврзана за стапчеста (хеликална) „опашка“, која може да има шестаголна базална плоча, за која се врзани тенки белковински влакненца. Ваквата опашеста структура делува како молекуларен шприц; вирусот се прицврстува за клеточниот ѕид на бактеријата домаќин со помош на белковинските влакненца на базалната плоча, за потоа да го инјектира својот геном од главата преку опашката директно во цитоплазмата на домаќинот.[43]
Поксвирусите се големи, комплексни вируси кои имаат невообичаена морфологија. Вирусниот геном врзан со белковини гради централна плочеста структура, позната како нуклеоид. Нуклеоидот е обвиткан со мембрана и две странични телца со непозната функција. Врз неа се наоѓа дебел белковински слој кој ја чини површината на вирусот. Вирионот е малку плеоморфен, со форма која варира од тркалезна до форма на тула.[44] Мимивирусот е еден од најголемите карактеризирани вируси, со пречник од 400 нм и површински белковински филаменти долги околу 100 нм. Под електронски микроскоп капсидот на овој вирус изгледа шестаголно, па затоа најверојатно е икосаедричен.[45]
Во 2011 година, беше откриен најголемиот дотогаш познат вирус, во примероци на вода собрани од дното на океанот во близина на брегот на Лас Крусес, Чиле. Овој вирус, наречен Megavirus chilensis, може да се види низ обичен оптички микроскоп.[46] Во 2013 година, беше откриен нов род на вируси, наречен пандоравирус, чии претставници имаат геноми двапати поголеми од оние на мегавирусот и мимивирусот.[47] Филогенетските истражувања покажуваат дека ваквите „џиновски вируси“ претставуваат посебна форма на живот, која во далечното минато или коегзистирала или претходела на заедничкиот предок на археите, бактериите и еукариотите.[48]
Некои вируси кои ги инфицираат археите имаат комплексни структури кои не се слични со ниту една од горенаведените структури, на пример: структури со облик на вретено, структури кои личат на стап со кука, структури со форма на солза, структури со форма на шише итн. Други вируси кои инфицираат археи се слични на бактериофагите, со таа разлика што може да имаат повеќе опашки.[49]
Геном[уреди | уреди извор]
Кај вирусите постои огромна разновидност во структурата на геномот, поголема од онаа кај еукариотите, археите и бактериите. Постојат милиони различни типови на вируси,[2] иако детално се опишани само околу 5.000 типови. Заклучно со септември 2015 година, базата на податоци за вирусни геноми на Националниот Центар за Биотехнолошки Информации (анг. National Center for Biotechnology Information – NCBI) има повеќе од 75.000 комплетирани геномски секвенци.[50][51]
Вирусите имаат или ДНК или РНК-геном, па соодветно се нарекуваат ДНК вируси и РНК вируси. Повеќето вируси имаат РНК-геном. Растителните вируси обично имаат едноверижен РНК-геном, а бактериофагите обично имаат двоверижни ДНК-геноми.[52][53]
Вирусниот геном може да биде кружен, како кај полиомавирусите, или линеарен, како кај аденовирусите. Типот на нуклеинска киселина е ирелевантен за обликот на геномот. Кај РНК вирусите и одредени видови на ДНК вируси, геномот може да биде сегментиран, при што секој сегмент кодира само една белковина. За вирусот да биде заразен не е потребно сите сегменти да се наоѓаат во истиот вирион, како што е докажано кај вирусот на мозаичната болест на овесот и некои други растителни вируси.[54]
Вирусниот геном, независно од типот на нуклеинска киселина, е речиси секогаш или едноверижен или двоверижен. Исклучок се вирусните честички на припадниците на фамилијата Hepadnaviridae, кои содржат геном кој е делумно двоверижен и делумно едноверижен.[55]
Кај повеќето вируси со РНК-геном, и некои со едноверижен ДНК-геном, за единечните вериги се вели дека се или со позитивна смисла (наречени плус-вериги) или со негативна смисла (наречени минус-вериги), во зависност од тоа дали се комплементарни на вирусната информациска РНК молекула (иРНК). Вирусната РНК со позитивна смисла има иста насока со нејзината иРНК, па затоа барем дел од неа може веднаш да се искористи за транслација во клетката домаќин. Вирусната РНК со негативна смисла има спротивна насока со нејзината иРНК (т.е. тие се комплементарни), па затоа мора прво да се претвори во РНК со позитивна смисла од страна на РНК-зависната РНК-полимераза пред процесот на транслација. ДНК номенклатурата за вируси со едносмислена, едноверижна геномска ДНК е слична на РНК номенклатурата, на тој начин што водечката верига за вирусната иРНК е комплементарна со неа (-), а кодирачката верига е нејзина копија (+). Неколку видови на евДНК и евРНК вируси имаат двосмислени геноми кај кои транскрипцијата може да се одвива и во двете насоки со двоверижен репликативен посредник. Пример се Geminiviridae, кои се евДНК растителни вируси, и Arenaviridae, кои се евРНК животински вируси.[56]
Големината на геномот варира во голема мера меѓу различните видови вируси. Најмалиот вирусен геном (2 килобази - Кб) се среќава кај фамилијата Circoviridae, кои имаат една евДНК со гени за само две белковини.[57] Најголемиот геном (2 мегабази - Мб) се среќава кај пандоравирусите, со гени кои кодираат за околу 2500 белковини.[47] Вирусните гени ретко имаат интрони, а често така се наредени во геномот така што се преклопуваат.[58]

Величината на геномот кај РНК вирусите е помала од ДНК вирусите поради повисоката стапка на грешки во текот на репликацијата, и има горен лимит.[59] Теоретски, доколку величината на геномот го премине овој горен лимит, грешките во текот на репликацијата би биле толку чести што вирусот би станал сосема нефункционален. За надминување на овој проблем, РНК вирусите често имаат сегментирани геноми, со што се намалува можноста да при грешки се афектира и онеспособи целиот геном. Спротивно на нив, ДНК вирусите обично имаат поголеми геноми поради високиот степен на веродостојност во функционирањето на нивните ензими за репликација.[60]
Генетски мутации[уреди | уреди извор]
Вирусите подлежат на генетски промени преку неколку механизми. Еден од нив е процесот наречен антигенски дрифт, каде поединечни бази во ДНК или РНК-геномот биваат заменети со други бази. Повеќето од овие точкести мутации се „тивки“ (мутацијата на генот не влијае на белковината која ја кодира), но некои можат да дадат еволутивни предности, како, на пр., зголемена резистентност кон антивирусни лекови.[61][62] Антигенска промена (анг. аntigenic shift) настанува при голема промена во геномот на вирусот, која најчесто е резултат на рекомбинација или прераспределба (анг. reassortment). Кога ова промена се случува кај вирусите на грип, можат да се појават пандемии.[63] РНК вирусите често постојат како полувидови (анг. quasispecies) кои се примарна цел за природна селекција.[64]
Сегментираните геноми даваат еволутивни предности; различните соеви на вирусот со сегментиран геном можат да ги разменуваат и комбинираат своите гени и така што создаваат потомство со уникатни одлики. Ова појава се нарекува прераспределба (анг. reassortment).[65][66]
Генетската рекомбинација е процес при кој една од ДНК веригите се сече, а потоа се прилепува за крајот на друга молекула на ДНК. Ова може да се случи кога вирусите истовремено инфицираат клетка, што им дава можност да ги разменуваат своите гени. Кај досега проучуваните видови на вируси се покажало дека рекомбинацијата била честа појава во нивната еволуција.[67] Рекомбинацијата е заедничка за РНК и ДНК вирусите.[68][69]
Циклус на репликација[уреди | уреди извор]

За своето размножување вирусите ја користат клеточната машинерија и метаболизмот на клетката домаќин. Постојат шест основни фази во животниот циклус на вирусите:
- Прикачување - специфично врзување меѓу вирусните капсидни белковини и одредени рецептори на клеточната површина на домаќинот. Оваа специфичност го одредува опсегот на домаќини кои вирусот може да ги инфицира. На пример, ХИВ инфицира одредени типови на човечки леукоцити бидејќи неговата површинска белковина, gp120, стапува во специфична интеракција со CD4 молекулата (хемокински рецептор), која се наоѓа на површината на CD4 + Т-клетките. Поврзувањето за рецепторот индуцира промени во белковините на вирусната обвивка, што резултира со спојување на вирусната и клеточната мембрана или промени на површинските белковини кај безмембранските вируси кои му овозможуваат на вирусот да навлезе во клетката.
- Пенетрација - вирусите влегуваат во клетката домаќин преку ендоцитоза посредувана од рецептори или мембранско спојување. Процесот се разликува кај растителните и габичните клетки од оној кај животинските клетки, бидејќи тие имаат ригиден клеточен ѕид врз клеточната мембрана, изграден од целулоза кај растенијата, а хитин кај габите. Поради ова, растителните и габичните вируси можат да навлезат во клетката само после оштетување на клеточниот ѕид. Речиси сите растителни вируси можат да се движат директно од клетка во клетка преку посебни растителни меѓуклеточни канали наречени плазмодезми.[70] Бактериите, слично како габите и растенијата, имаат цврсти клеточни ѕидови кои вирусот мора некако да ги пробие за да ја инфицира клетката. Со оглед на тоа што ѕидовите на бактериските клетки се многу потенки од ѕидовите на растителните клетки, поради нивната многу помала величина, некои вируси имаат развиено механизми со кои директно го инјектираат својот геном во бактериската клетка низ клеточниот ѕид, додека капсидот останува надвор.[71]
- Отфрлање на обвивката - процес во кој се отстранува вирусниот капсид. Разградувањето на капсидот може да се изведе со помош на вирусни ензими, ензими на домаќинот, или, пак, со едноставна дисоцијација; крајниот резултат е ослободување на вирусната нуклеинска киселина во цитоплазмата на клетката домаќин.
- Репликација - клонирање на вирусниот геном. Вирусот зазема контрола врз клетката домаќин и ги искористува нејзините клеточните структури и биохемиски процеси за да се репродуцира себеси. Кај некои РНК вируси, самата геномска РНК служи како информациска РНК (иРНК), за која се врзуваат рибозоми и го започнуваат процесот на транслација за синтеза на вирусните белковини. Кај другите РНК вируси и сите ДНК вируси, прво мора да се изведе процесот на транскрипција со реверзна транскриптаза, а потоа на добиената иРНК се одвива процесот на транслација.
- Интеграција - Вирусните честички спонтано се склопуваат во цитоплазмата со самоорганизација на белковинските подединици во структурата на капсидот. Понекогаш по завршетокот на овој процес може да биде извршена одредена модификација на вирусните белковини, како што се случува кај ХИВ вирусот по неговото ослободување од клетката домаќин.[72]
- Ослободување - Новоформираните вируси ја напуштаат инфицираната клетка. Овој процес може да се одвива со лиза на клетката домаќин (литички процес) при што таа умира поради оштетување на нејзината мембрана и клеточен ѕид (доколку е присутен). На овој начин се однесуваат многу бактериски и некои животински вируси. Други вируси, пак, подлегнуваат на т.н. циклус на лизогенија, во кој вирусниот геном се инкорпорира со генетска рекомбинација на одредено место во хромозомот на домаќинот. Во овие случаи вирусниот геном е познат како „провирус“ или, во случај на бактериофагите, „профаг“.[73] При секоја делба на клетката-домаќин, вирусниот геном исто така се реплицира. После одреден период на латентност, провирусот или профагот може повторно да се трансформира во активен вирус кој се однесува литички.[74] Вирусите со мембранска обвивка (на пример, ХИВ) обично се ослободуваат од клетката-домаќин со процес на пупење. За време на овој процес, вирусот ја добива својата мембранска обвивка.[75]
Репликација на геномот[уреди | уреди извор]
Генетскиот материјал на вирусните честички, како и начинот на кој тој се реплицира, варира меѓу различните типови на вируси.
ДНК вируси[уреди | уреди извор]
Репликацијата на геномот на повеќето ДНК вируси се одвива во јадрото на клетката. Доколку клетката има соодветен рецептор на нејзината површина, овие вируси влегуваат во неа или преку непосредно спојување со клеточната мембрана (на пример, херпесвирус) или преку ендоцитоза посредувана од рецепторот. Повеќето ДНК вируси се целосно зависни од механизмите за синтезирање на ДНК и РНК молекулите во клетките на домаќинот и механизмите за обработка на РНК молекулите. Вирусите со поголеми геноми можат да кодираат голем дел од ензимите и белковините кои ја сочинуваат транскрипционата и транслационата машинерија. Во еукариотските клетки вирусниот геном мора прво да ја премине јадрената мембрана за да дојде до ДНК на домаќинот.[76]
РНК вируси[уреди | уреди извор]
Кај нив репликацијата обично се случува во цитоплазмата. РНК вирусите можат да се групираат во четири различни групи во зависност од механизмот на репликација. Поларноста (без разлика дали може или не може директно да се користи од рибозомите за синтеза на белковини) на вирусите со едноверижна РНК во голема мера го одредува механизмот на репликација; другиот критериум е дали генетскиот материјал е едноверижна или двоверижна нуклеинска киселина. Сите РНК вируси ги користат сопствените РНК репликази за копирање на своите геноми.[77]
Вируси со обратна транскрипција[уреди | уреди извор]
Овие вируси содржат едноверижна РНК (Retroviridae, Metaviridae, Pseudoviridae) или двоверижна ДНК (Caulimoviridae и Hepadnaviridae) како генетски материјал. Вирусите со обратна транскрипција кои поседуваат РНК-геном (ретровируси), користат ДНК посредник во нивната репликација, додека оние со ДНК-геном (параретровируси) користат РНК посредник. И двете групи користат реверзна транскриптаза или РНК-зависна ДНК-полимераза, за да ја извршат соодветната претворање на нуклеинската киселина. Ретровирусите ја интегрираат ДНК молекулата создадена со обратна транскрипција во геномот на домаќинот, во облик на провирус, како дел од нивниот процес на репликација. За разлика од нив параретровирусите обично не подлегнуваат на циклусот на лизогенија, иако некои растителни параретровируси се исклучок на ова правило.[78] Овие вируси се осетливи на антивирусните лекови кои го инхибираат ензимот реверзна транскриптаза, на пр. зидовудин и ламивудин. Пример за првиот тип е ХИВ, кој е ретровирус. Примери за вториот тип се Hepadnaviridae, кои го вклучуваат вирусот на хепатит Б.
Ефекти врз клетката домаќин[уреди | уреди извор]
Структурните и биохемиските ефекти кои вирусот ги има врз клетката домаќин се бројни и се нарекуваат цитопатични ефекти. Мнозинството вирусни инфекции резултираат со смрт на клетката домаќин. Причините за смрт вклучуваат клеточна лиза, структурни промени на клеточната мембрана и апоптоза.[79] Често смртта на клетката е предизвикана од прекинување на нејзините нормални активности поради супресија предизвикана од белковини специфични за вирусот, од кои не сите влегуваат во градба на вирусната честичка.[80]
Некои вируси не предизвикуваат очигледни промени во инфицираната клетка. Клетките во кои вирусот е латентен и неактивен покажуваат малку знаци за инфекција и често функционираат нормално.[81] Ова предизвикува перзистентни инфекции, а вирусот често може да е неактивен со месеци или години. Пример се инфекциите со херпесни вируси.[82][83] Некои вируси, како што е вирусот на Епштајн-Бар, можат да предизвикаат пролиферација на клетките без појава на малигнитет,[84] додека други, како што се папиломавирусите, се причинители на рак.[85]
Опсег на домаќини[уреди | уреди извор]
Вирусите се најзастапените биолошки ентитети на Земјата и ги надминуваат сите други организми заедно.[86] Тие ги инфицираат сите форми на клеточен живот, вклучувајќи ги животните, растенијата, габите, бактериите и археите.[87] Одделните видови на вируси можат да инфицираат само ограничен опсег на домаќини, а многу од нив се специфични само за видот кој го инфицираат. Некои, како што е вирусот на мали сипаници, можат да инфицираат само еден вид организам, во овој случај луѓето, и се вели дека имаат тесен опсег на домаќини. Други пак, како што е вирусот на беснило, можат да заразат неколку различни видови на цицачи, и се вели дека имаат широк опсег на домаќини. Вирусите кои ги инфицираат растенијата се безопасни за животните, а повеќето вируси кои ги инфицираат другите животински видови се безопасни за човекот.[88] Опсегот на домаќини на некои бактериофаги е ограничен на само еден вид бактерии и тие можат да се користат за следење на изворот на појава на инфекции со метод наречен типизација на фаги.[89]
Класификација[уреди | уреди извор]
Класификацијата се обидува да ја опише разновидноста на вирусите преку нивно именување и групирање врз основа на слични одлики. Во 1962 година, Андре Лавоф, Роберт Хорн и Пол Турниер беа првите кои развија метод за вирусна класификација, врз основа на хиерархискиот систем на Карл Лине.[90] Вирусите се групирани според нивните заеднички својства, меѓутоа не оние кои ги стекнуваат од домаќинот, и според типот на нуклеинската киселина која го чини нивниот геном.[91] Меѓународниот комитет за таксономија на вируси (анг. International Committee on Taxonomy of Viruses - ICTV) ја одобрува и организира таксономската класификација и номенклатурата на вирусите. Вирусите не се класифицираат во колена и класи, бидејќи нивниот мал геном и високата стапка на мутации го отежнуваат утврдувањето на нивното потекло надвор од редот како таксономски ранг. Класификацијата според Балтимор, развиена од Дејвид Балтимор, е друг систем за класификација на вирусите, кој ги групира вирусите во фамилии, во зависност од типот на нивниот геном (ДНК, РНК, едноверижна, двоверижна итн.), како и методот на репликација.
ICTV класификација[уреди | уреди извор]
Меѓународниот комитет за таксономија на вируси (ICTV) го има развиено актуелниот систем за класификација на вирусите и состави упатства кои ставаат поголем акцент на одредени вирусни особини за да се одржи униформноста на фамилијата како таксономски ранг. Деветтиот извештај на ICTV[92] го дефинира концептот на вид кај вирусите како најнизок таксон (група) во разгранувачката хиерархија на вирусните таксони.[93] До денес, изучен е само мал дел од вкупниот диверзитет на вирусите во природата. Генетските анализите на разни човечки примероци откриле дека околу 20% од добиените вирусни геномски секвенци претходно не биле познати, а анализите на примероци од животната средина (морска вода, почви, седименти итн.) заклучиле дека мноштвото на откриените вирусни секвенци се сосема нови и непознати во науката.[94]
Општата таксономска структура е:
- Ред (-virales)
- Фамилија (-viridae)
- Потсемејство (-virinae)
- Род (-virus)
- Вид (-virus)
- Род (-virus)
- Потсемејство (-virinae)
- Фамилија (-viridae)
Во актуелната (2017) таксономија на ICTV, постојат осум реда на вируси: Bunyavirales, Caudovirales, Herpesvirales, Ligamenvirales, Mononegavirales, Nidovirales, Picornavirales и Tymovirales; 135 фамилии, 35 потсемејства, 455 родови, околу 2827 видови и над 4000 типови кои сѐ уште не се класифицирани.[92][95] Официјално, комитетот не прави разлика помеѓу подвидови, видови и изолати.
Класификација според Балтимор[уреди | уреди извор]

Биологот Дејвид Балтимор, добитник на Нобелова награда, е пронаоѓач на алтернативен систем за класификација на вирусите наречен според него.[96][97] Во модерната класификација на вирусите неговиот систем се употребува заедно со системот на класификација на ICTV.[98][99][100]
Виралните геноми можат да се состојат од РНК или ДНК, со позитивна или негативна поларност, едноверижни или двоверижни (понекогаш и кружни) молекули или поделени на сегменти. Информациската РНК (иРНК) која директно може да се транслатира во белковина се смета дека има позитивна поларност. Исто така, ДНК со соодветната низа (кодирачката верига на двоверижната ДНК) е верига во позитивна смисла. Молекули на РНК или ДНК со реверзна (обратна) комплементарна секвенца на иРНК е верига во негативна смисла. Идентификувани се неколку вируси кои содржат еден или повеќе амбисмислени (двосмислени) геномски РНК сегменти кои имаат позитивен пол во еден дел од својата молекула (овој дел може директно да се преведе во белковина) и негативен пол (обратен комплемент на кодирачката низа) во друг дел од молекулата.
| Молекула | Секвенца | Поларност (смисла) |
|---|---|---|
| Комплементарна РНК | AUUGGGCUC | Негативна |
| Кодирачка верига на ДНК | TAACCCGAG | Позитивна |
| Комплементарна ДНК | ATTGGGCTC | Негативна |
| Информациска РНК (mRNA) | UAACCCGAG | Позитивна |
Класификацијата според Балтимор е прикажана во следната табела:
| Нуклеинска киселина | Поларност | Фамилија | Примери | Домаќин | Заболувања |
|---|---|---|---|---|---|
| едноверижна DNA | + | Parvoviridae | Парвовирус B19 | Луѓе | Erythema infectiosum (петтата зараза) |
| двоверижна DNA | +/- | Myoviridae | Бактериофаг Т4 | E. coli | Разградување на бактеријата |
| Papilomaviridae | ХПВ типови 2, 16, 18, 33 | Луѓе | Брадавици, цервикален и друг тип на рак | ||
| Herpesviridae | Херпес зостер вирус | Луѓе | Варичела, лош херпес (херпес зостер) | ||
| Poxviridae | Вариола вирус | Луѓе | Голема сипаница (вариола) | ||
| едноверижна RNA, несегмент. | + | Picornaviridae | Полиовирус, типови 1-3 | Луѓе | Полиомиелитис |
| Риновирус (100 + серотипови) | Луѓе | Настинка | |||
| Togaviridae | Коњски енцефалитичен вирус | Инсекти/Коњи | Заболување на ЦНС кај коњите и луѓето (енцефалит) | ||
| едноверижна RNA, несегмент. | - | Rhabdoviridae | Вирус на беснило | Цицачи | Беснило |
| Paramyxoviridae | Вирус на сипаници | Луѓе | Сипаници | ||
| едноверижна RNAt, сегментирана | - | Ортомиксовируси | Инфлуенца вирус | Цицачи, птици | грип (инфлуенца) |
| едноверижна RNA, сегментирана | - и/или амбиполарен | Bunyaviridae | Sin Nombre вирус | Глодачи | Ханта треска |
| Arenaviridae | Вирус на Ласа треска | Примати | Хеморагична треска | ||
| двоверижна RNA | +/- | Reoviridae | Џуџест вирус на оризот | Растенија | Скаменување |
| едноверижна RNA DNA rep. int. (репликативен интермедиер) |
+ | Retroviridae | ХИВ тип 1, 2 | Луѓе | СИДА |
| HTLV тип 1 | Луѓе | Возрасна Т-клеточна леукемија | |||
| двоверижна DNA RNA rep. int. | +/- | Hepadnaviridae | Вирус на хепатит B | Луѓе | Хепатит, хепатоцитен карцином |
Како пример за вирусна класификација, вирусот на пилешки порос, варичела зостер (VZV), спаѓа во редот Herpesvirales, фамилија Herpesviridae, потсемејство Alphaherpesvirinae и род Varicellovirus. VZV е во групата I од класификацијата според Балтимор, бидејќи е вирус со двДНК кој не користи реверзна транскриптаза.
Вкупниот диверзитет на вируси кои живеат во одреден организам или во одреден хабитат се нарекува виром; на пример, сите вируси во човечкиот организам го сочинуваат човечкиот виром.[101]
Потекло[уреди | уреди извор]
Вирусите се наоѓаат секаде каде што има живот, а најверојатно постоеле од времето на првобитната појава на живите клетки.[102] Потеклото на вирусите е сѐ уште тема на дебата во науката. Поради тоа што тие не формираат фосили, најкорисно средство за истражување на нивното потекло се молекуларните техники кои се засноваат на изучување на составот на нивниот генетски материјал (ДНК или РНК).[59] Покрај тоа, вирусниот генетски материјал повремено може да се интегрира во геномот на домаќинот, со што постои можност за вертикален пренос на потомците на домаќинот. Ова обезбедува непроценлив извор на информации за палеовиролозите за одредување на староста на одделните вирусни видови. Постојат три главни хипотези за потеклото на вирусите:[103][104]
Регресивна хипотеза[уреди | уреди извор]
Оваа хипотеза уште се нарекува и хипотеза на дегенерација, или редукциона хипотеза.[105] Според неа, вирусите во почетокот биле мали клетки кои паразитирале на поголеми клетки. Со тек на време, почнале да ги губат оние гени кои не им биле потребни за нивниот паразитски начин на живот. Рикециите и хламидиите се бактерии кои, како и вирусите, можат да се репродуцираат само во живи клетки на домаќинот. И кај нив внатрешноклеточниот паразитски начин на живот довел до упростување на клеточната градба.
Хипотеза на клеточно потекло[уреди | уреди извор]
Според оваа хипотеза, позната и како хипотеза на скитници, или хипотезата на бегство, вирусите еволуирале од мали ДНК или РНК сегменти кои се отцепиле од генетскиот материјал на некој поголем организам.[105] Отцепената нуклеинска киселина можеби потекнувала од плазмиди (екстрахромозомски ДНК молекули кај бактериите и археите) или транспозони (мобилни сегменти на ДНК кои се отцепуваат и преместуваат на различни позиции во рамките на еден хромозом). Транспозоните за првпат биле откриени во пченка, од страна на американскиот цитогенетичар Барбара Меклинток во 1950 година.[106] Тие порано се нарекувале „скокачки гени“, и по некои свои особини доста наликуваат на вирусите.
Хипотеза на коеволуција[уреди | уреди извор]
Оваа хипотеза се нарекува и хипотеза за првобитноста на вирусите и го предложува концептот за првична појава на вирусите во еволуцијата на животот, по пат на асоцијација на абиогено-синтетизирани молекули на белковини и нуклеински киселини во првобитниот океан. Вироидите се молекули на РНК кои не се класифицирани како вируси, бидејќи тие немаат белковинска обвивка. Тие поседуваат некои одлики кои се заеднички со вирусите, и често се нарекуваат субвирални агенси.[107] Вироидите се важни патогени на растенијата. Тие не кодираат белковини, но стапуваат во интеракција со клетката домаќин и ја искористуваат нејзината клеточна машинерија за сопствена репликација.[108] Вирусот на хепатит делта кај луѓето има РНК-геном сличен на вироидите, но има белковински слој добиен од вирусот на хепатит Б, кој самиот не може да го синтетизира. Значи, иако геномот на хепатит делта вирусот е способен независно да се реплицира еднаш во клетката домаќин, потребна му е „помош“ од вирусот на хепатит Б, кој му ја обезбедува белковинската обвивка за да може да инфицира нови клетки. На сличен начин, вирофагот спутник е зависен од мимивирусот, кој ја инфицира протозоата Acanthamoeba castellanii.[109] Ваквите вируси, кои се зависни од присуството на други вируси во клетката домаќин, се нарекуваат сателитски вируси и можно е да претставуваат преодна форма меѓу вироиди и вируси.
Сите горенаведени хипотези за потекло на вирусите имаат сериозни недостатоци: регресивната хипотеза не објаснува зошто и најмалиот клеточен паразит е далеку посложен од најсложениот вирус; хипотезата на бегство не може да го објасни присуството на капсиди и други структури на вирусни честички; а хипотезата за првобитноста на вирусите е во контрадикција со основната дефиниција за вирус, во смисла дека тој е облигатен внатрешноклеточен паразитски агенс. За вирусите, денес, владее мислењето дека се со старо потекло, кое датира пред дивергенцијата на животот во трите домени.[48]
Доказите за примордијален свет на РНК клетки и компјутерските анализи на вирусните ДНК секвенци и оние на нивните клетки домаќини придонесоа за подобро разбирање на еволутивните односи помеѓу различните вируси. До денес, овие анализи не утврдиле која од хипотезите за потекло на вирусите е точна. Се чини дека е малку веројатно да сите моментално познати вируси имаат заеднички предок, што би значело дека тие настанале повеќепати во минатото со еден или повеќе механизми.
Прионите се заразни белковински молекули кои не содржат нуклеински киселини.[110] Тие можат да предизвикаат инфекции како што се шап кај овците, спонгиформна енцефалопатија (кравјо лудило) кај добитокот и преносителна спонгиформна енцефалопатија кај елените и лосовите. Кај луѓето, прионски заболувања се Куру,[111] Кројцфелд-Јакобова болест[112] и синдром на Герстман-Штројслер-Шејнкер. Иако прионите се фундаментално различни од вирусите и вироидите, нивното откривање даде веродостојност на теоријата за потекло на вирусите од самореплицирачки молекули.[113]
Улога во заболувањата кај човекот[уреди | уреди извор]

Вирусите предизвикуваат низа болести кај човекот од обични, како што се: настинка, грип, сипаници, брадавици, херпесни инфекции, па до тешки заболувања со кои современата медицина тешко се справува како што се: ебола, СИДА, птичји грип и тежок акутен респираторен синдром (САРС). Денес сѐ уште се истражува за можната поврзаност на некои невролошки болести како што е мултиплекс склерозата и синдромот на хроничен замор со инфекција со вируси од групата на хуманиот херпесвирус 6 (HHV6).[114] Постојат и контроверзии за можна поврзаност на некои психијатриски болести кај човекот со борнавирусот кој е предизвикувач на невролошки болести кај коњите.[115]
Способноста на вирусот да предизвика болест се нарекува вирулентност. Вирусите имаат различни механизми за предизвикувања на патолошки промени (заболувања) кај човекот и тоа зависи во голема мера од видот на вирусот. На клеточно ниво тоа може да биде: клеточна лиза, распукување на клетката и последователна смрт.
Кај повеќеклеточните организми, зафаќањето на поголем број на клетки ќе резултира и со соодветен степен на оштетување. Некои вируси можат да опстојуваат во домаќинот долго време без да предизвикаат патолошки промени. Оваа состојба на латентност на вирусот[116] се среќава кај херпес вирусите, Епштајн-Баровиот вирус и варичела-зостер вирусот. Најголем дел од светската човечка популација го има барем еден од овие три вируса.[117] Овие латентни вируси понекогаш можат да бидат и придобивка за домаќинот, така што му ја зголемуваат отпорноста кон некои бактериски патогени видови, како на пример, кон Yersinia pestis (причинителот на чумата).[118]
Некои вируси се предизвикувачи на хронични болести во кои вирусот продолжува да се реплицира и покрај одбранбените механизми на домаќинот.[119] Пример за ова се инфекциите со вирусите на хепатит Б и хепатит Ц. Заболените, во овие случаи, се доживотни носители на вирусот и се резервоар за нови инфекции.[120] Доколку една популација има висок процент на клицоносители тогаш тие заболувања ги нарекуваме ендемски.[121]
Епидемиологија[уреди | уреди извор]
Епидемиологијата на вирусните заболувања е дел од медицинската наука која се занимава со проучување на преносот и контролата на вирусните инфекции кај човекот. Преносот на вирусот може да биде по вертикален пат, што значи од мајка на дете, или по хоризонтален пат, што значи од човек на човек. Пример за вертикална трансмисија на вирусот се заболувањата хепатит Б и ХИВ, кај кои бебето се раѓа веќе инфицирано со вирусот.[122] Друг, редок, пример за вертикален пренос е преносот на вирусот на варичела зостер, кој предизвикува релативно благи инфекции кај луѓето, но при вертикален пренос, инфекцијата може да биде фатална за фетусот или новороденото бебе.[123]
Хоризонталниот пренос е најчестиот начин на ширење на вирусните инфекции. Преносот може да биде со: телесни течности при сексуален чин, како кај ХИВ-вирусот; користење на контаминирани медицински материјали или апарати, како кај преносот на вирусот на хепатит Ц; размена на плунка преку уста, кај преносот на Епштејн-Баровиот вирус; преку консумирање на контаминирана храна и/или вода, кај преносот на норвовируси; со инхалација на аеросоли се пренесува вирусот на инфлуенца. Во преносот на вирусите можат да учествуваат и разни инсекти - вектори, како на пример: комарците го пренесуваат вирусот на денга, а некои видови на крлежи го пренесуваат вирусот кој предизвикува менинго-енцефалит. Брзината на пренесувањето на вирусните инфекции зависи од густината на населеноста, процентот на неимунизираните лица,[124] од квалитетот на здравствената заштита и од временските прилики.[125]
Епидемиологијата игра важна улога во прекинувањето на ланецот на инфекцијата при појава и епидемиско ширење на заразни болести во рамките на човечката популација.[126] При тоа се користат сите контролни мерки за спречување на ширењето на вирусот, пронаоѓањето на изворот на инфекцијата и идентификација на вирусот. После тоа следат сите санитарни мерки за дезинфекција, дезинсекција, дератизација и задолжително спроведување на вакцинација.[126] Заразените лица се изолираат од остатокот на заедницата, а оние кои биле изложени на вирусот, со можност на зараза, се ставаат во карантин. За да се спречи ширењето на некој вирус може да се користат и драстични мерки на убивање илјадници домашни животни или живина.
Како и кај сите други инфекции, и кај вирусните постои време на инкубација - време во кое инфекцијата е присутна, но не предизвикува никакви симптоми и знаци на болест. Инкубацијата може да е кратка, само неколку дена, па до повеќе недели.[127] Заразноста на заболената личност може да се јави и во време на инкубацијата, може да трае и со појавата на првите знаци на болеста, а може при некои хронични вирусни болести да биде и доживотна. Познавањето на времетраењето на заразноста е од големо значење за контрола на епидемиите. Под епидемија се подразбира висок процент на заразени поединци кај населението, а поимот пандемија подразбира ширење на заразна болест во светски рамки.[128]
Историја на вирусни епидемии и пандемии[уреди | уреди извор]

Во историјата на човечката популација познати се повеќе епидемии и пандемии кои биле со катастрофален исход.
Колонизирањето на американскиот континент од страна на Европејците во почетокот на 16 век донело многу нови заразни болести кај домородното население, но се претпоставува дека токму вирусот на големи сипаници бил погубен за најголемиот процент од домородната популација; и според некои проценки дури 70% од индијанското население настрадало.[129][130]
Голема пандемија на грип од 1918 година, која траела до 1919 година, била пандемија од 5-та категорија, предизвикана од смртоносниот вирус на грип А.[131] Жртвите биле претежно млади и здрави луѓе, што е обично спротивно на повеќето епидемии кои ги засегаат децата и старите лица. За тоа колку животи се изгубени во оваа пандемија постојат различни податоци: постарите проценки прикажуваат бројка од 40-50 милиони смртни случаи,[132] додека поновите процени сугерираат дека можеби бројот на смртните случаи изнесувал околу 100 милиони или околу 5% од светското население во 1918 година.[133]
На крајот на 20 век се случуваат неколку епидемии. ХИВ вирусот, за кој се верува дека потекнува од потсахарска Африка[134][135] се ширел брзо во последните децении на 20 век и сега е во пандемиски размери со околу 38,6 милиони заразени лица, а Светската здравствена организација (СЗО) проценува дека од почетокот на пандемијата во 1981 година починати се околу 25 милиони од последиците на оваа инфекција.[136] Во 2007 година имало 2.7 милиони нови ХИВ инфекции и 2 милиони смртни случаи поврзани со ХИВ инфекции.[137]
Ебола вирусот, кој за првпат бил идентификуван 1976 година, предизвикал неколку наизменични епидемии со висока стапка на смртност од кои најлошата е скорешната епидемија во западна Африка.[138][139]
Рак[уреди | уреди извор]
Докажано е дека некои видови вируси можат да предизвикаат рак кај луѓето и другите организми. Појавата на рак, сепак, се среќава кај малцинство од популацијата заразени од вируси. Вирусите кои предизвикуваат рак можат да бидат и од РНК и од ДНК видовите. Дали ќе се развие рак зависи од повеќе фактори како што се имунитетот на домаќинот[140] и мутации кај домаќинот.[141] Вируси кои можат да предизвикаат карцином се: некои генотипови на хуманиот папиломавирус (ХПВ), вирусот на хепатит Б, вирусот на хепатит Ц, Епштајн-Бар вирусот, херпесвирус асоциран со Капоши сарком и хуманиот Т-лимфотропен вирус. Скоро е откриен вирус наречен полиомавирус (анг. Merkel cell polyomavirus), кој е предизвикувач на ретка форма на рак на кожа наречен карцином на Меркелови клетки.[142] Хепатит вирусот, кој развива хронична вирусна инфекција кај човекот, може со време да доведе до развој на рак на црниот дроб.[143][144] Инфекција со хуманиот Т-лимфотропен вирус може да развие кај возрасните Т-клеточна леукемија.[145] Хуманиот папиломавирус (ХПВ) е причина за појава на рак на кожа, појава на карцином на грлото на матката, анусот и пенисот.[146] Епштајн-Баровиот вирус може да предизвика Буркитов лимфом, Хочкинов лимфом, Б-лимфопролиферативни нарушувања и назофарингеален карцином.[147]
Одбранбени механизми на домаќинот[уреди | уреди извор]
Прва линија на одбрана на организмот против вирусите е вродениот имунолошки систем. Преку својот клеточен и хуморален дел, тој го брани организмот од инфекција на неспецифичен начин. Тоа значи дека клетките на вродениот имунолошки систем го препознаваат и одговараат на патогениот агенс, и за разлика од стекнатиот имунитет, не даваат долготраен и заштитен имунитет на домаќинот.[148]
Кога организмот се инфицира со вирус, доаѓа до активација на стекнатиот имунитет и тој почнува да создава антитела кои го врзуваат вирусот и го прават неинфективен. За продукција на антитела е задолжен хуморалниот имунитет. Два типа на антитела се особено важни: едниот е IgM, кој брзо почнува да се продуцира и е мошне ефикасен во неутрализирањето на вируси, но се продуцира од клетките на имуниот систем само во тек на неколку недели; другиот е IgG, кој почнува да се продуцира подоцна и продукцијата трае неограничено време. Затоа присуството на IgM во крвта се користи за тестирање на акутни инфекции, додека присуството на IgG е доказ за инфекција која се случила во минатото.[149] Антителата продолжуваат да бидат ефикасен одбранбен механизам и кога вирусот ќе влезе во клетката на домаќинот. Тогаш се активира белковина во клетката, наречен TRIM21, кој може да прикачи антитела на површината од вирусната честичка. Ова резултира со уништување на вирусот од страна на ензимите на клеточниот протеозомски систем.[150]

Втората линија на одбрана кај ’рбетниците се нарекува клеточно-посредуван (медиран) имун систем и него го сочинуваат имуни клетки, познати како Т-лимфоцити. Тие функционираат така што препознаваат суспектни фрагменти на вирусни партикли на површината на клетката домаќин и тогаш ја уништуваат инфицираната клетка преку својата лоза на Т цитотоксични клетки, после што следи пролиферација на специфичните Т-лимфоцити, кои се специфични за дадениот вирус. Клетките, кои се специјализирани за препознавање на страни антигени на површината на клетки на домаќинот, се нарекуваат макрофаги.[151][152] Продукцијата на интерферон е, исто така, важен дел од одбранбениот механизам на домаќинот. Тоа е белковина која организмот го создава при вирусна инфекција и кој делува така што ја стопира репродукцијата на вирусот со убивање на инфицираната клетка и други клетки во нејзината непосредна близина.[153][154]
Не сите вируси го активираат имунолошкиот систем. ХИВ вирусот успешно го избегнува имунолошкиот одговор со константно менување на аминокиселинските секвенци во белковините на површината на вирусната честичка. Оваа појава на „мутација на избегнување“ оневозможува препознавање на виралните епитопи од страна на имунолошкиот систем на домаќинот. Овие опстојувачки (перзистентни) вируси ја избегнуваат контролата на имунитетот со: секвестрирање, блокада на антиген-презентација, резистенција на цитокини, избегнување на делувањето на Т цитотоксичните клетки, промена на антигените и избегнување на апоптоза.[155]
Други вируси кои успеваат да избегнат имунолошки одговор се невротропните вируси, кои тоа го прават така што се дисеминираат преку невроните. Примери се вирусот на јапонскиот енцефалит, вирусот на заушки, полиовирусот, варичела-зостер вирусот, вирусот на мали сипаници итн.[156]
Превенција и третман[уреди | уреди извор]
Вирусите тешко се елиминираат затоа што ги користат метаболните патишта на клетката домаќин за своја репликација. За нивно елиминирање се користат лекови кои имаат токсичен ефект и врз клетките на домаќинот. Ефикасни методи на лечење се: употребата на антивурисни лекови кои селективно интерферираат со вирусната репликација и, секако, најефикасен метод за заштита на пошироката популација е спроведување на вакцинација.
Вакцини[уреди | уреди извор]
Вакцинацијата е евтин и ефикасен начин за спречување на вирусни инфекции. Нејзиното воведување доведе до драстично намалување на морбидитетот и морталитетот на некои вирусни инфекции како што се: полио, сипаници, заушки и рубеола.[157][158] Вакцините кои се во употреба заштитуваат од преку 13 вирусни инфекции кај луѓето,[159][160] а многу се во употреба и за заштита на домашните животни.[161] Вакцините можат да содржат живи ослабнати (атенуирани) вируси, мртви вируси или вирусни антигени (белковини).[162] Живите вакцини, кои содржат ослабната форма на вирус, не можат да предизвикаат болест, но може да активираат имунолошки одговор. Овие вакцини можат да бидат опасни само во случаи кога се даваат на лица со ослабен имунитет (имунокомпромитирани лица) и кај нив наместо имунолошки одговор се јавува заболување.[163]
Денес, со биотехнологијата и генетското инженерство, направени се вакцини кои содржат само белковини од вирусниот капсид. Пример за ваква вакцина е вакцината за хепатит Б.[164] Ваквите субединични вакцини се безбедни дури и за имунокомпромитираните пациенти.[165] Една од најсигурните досега создадени вакцини е вакцината за вирусот на жолтата грозница, која содржи жив атенуиран вирус, наречен 17D.[166]
Антивирусни лекови[уреди | уреди извор]
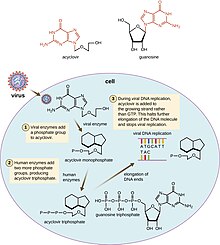
Антивирусните лекови се често нуклеозидни аналози (лажни ДНК мономери), кои вирусите по грешка ги инкорпорираат во својот геном при репликацијата.[167] На тој начин се запира животниот циклус на вирусот поради неактивноста на новосинтетизираната ДНК. Ова се јавува поради недостаток на хидроксилни групи, кои, заедно со фосфатните групи, се врзуваат меѓусебе за да го формираат скелетот на ДНК молекулата, и оваа појава се нарекува терминација на ДНК веригата.[168] Примери за нуклеозидни аналози се лековите ацикловир, за херпесните инфекции, и ламивудин, за ХИВ и хепатит Б инфекциите. Ацикловирот е еден од најстарите и најпрепишувани антивирусни лекови.[169]
Други антивирусни лекови целат на различни стадиуми од животниот циклус на вирусите. На пример, ХИВ вирусот зависи од протеолитичкиот ензим ХИВ-1 протеаза за да стане потполно инфективен, па затоа создадени се цела класа на лекови кои се протеаза инхибитори.[170]
Хепатит Ц е предизвикан од РНК вирус. Кај 80% од инфицираните поединци, болеста станува хронична и, без третман, тие остануваат инфицирани до крајот на својот живот. Денес постои ефикасен третман со рибаварин, нуклеозиден аналог кој се комбинира со интерферон.[171] Развиена е терапија за хроничните клицоносители на хепатит Б вирусот со употреба на ламивудин.[172]
Инфекции кај другите видови[уреди | уреди извор]
Општо гледано, вирусите се присутни секаде на планетата и можат да ги инфицираат сите форми на клеточен живот (бактерии, археи и еукариоти), сепак секој одделен вид на вирус поседува за него специфичен опсег на домаќини кои може да ги инфицира.
Животински вируси[уреди | уреди извор]
Вирусите се важни патогени агенси кај домашните животни. Болестите како шап и лигавка и син јазик се предизвикани од вируси.[173] Домашните животни како мачките, кучињата, коњите и други, доколку не се вакцинираат постои опасност да се заразат со тешки вирусни инфекции. Кучешкиот парвовирус, кој е мал ДНК вирус, е инфективен и често фатален за млади кученца.[174] Беснилото е тешка заразна болест од која може да заболи кој било цицач, вклучувајќи го и човекот.[175] Од него, сепак, најчесто заболуваат кучињата, волците, мачките и лисиците. Предизвикувачот е РНК вирус, од групата на рабдовируси, кој се наоѓа во плунката на заразените животни, и се пренесува со каснување.
И без׳рбетниците можат да бидат инфицирани од вируси, на пр., пчелите подлегнуваат на разни вирусни инфекции.[176] Многу вируси, сепак, коегзистираат со домаќинот без да предизвикаат болест.
Растителни вируси[уреди | уреди извор]

Постојат многу видови на растителни вируси. Тие можат да предизвикаат штети во земјоделскиот принос, но тие не се економски толку важни за да се преземаат заштитни мерки против нив. Растителните вируси се шират од една до друга единка најчесто преку вектори. Тоа се обично инсекти, но можат да бидат и габи, валчести црви или едноклеточни организми.[177] Во случај да, поради инфекција со вирус, има намален земјоделски принос (каков што е случајот кај овошките) мерките за сузбивање, обично, се однесуваат на ерадикација на векторите и пречистување на семенскиот материјал.[178] Растителните вируси не се патогени ниту за човекот ниту за животните, бидејќи може да се репродуцираат само во живи растителни клетки.
Растенијата поседуваат ефикасни одбранбени механизми против вирусите. Една од најефикасните одбрани е присуството на т.н. ген на резистентност (Р). Секој Р ген дава резистенција кон одреден вирус со таргетирање и убивање на клетките кои се наоѓаат околу инфицираните клетки, што доведува до макроскопски, видливи промени на листовите, со облик на големи дамки. Со ова се спречува ширењето на инфекцијата.[179] Растенијата, исто така, често продуцираат одредени вторични метаболити, како што се салицилна киселина, азот моноксид, реактивни кислородни видови, за одбрана од вирусите.[180]
Растителните вирусни партикли (ВЛПс) имаат употреба во биотехнологијата и нанотехнологијата. Капсидите на многу растителни вируси се едноставни и груби структури кои можат да бидат продуцирани во големи количини при инфекции на растенијата или со експресија во разни хетерологни системи. Партиклите на растителните вируси можат да бидат генетски изменети и хемиски инкапсулирани во туѓ материјал, и на тој начин вметнати во супермолекуларни структури кои се употребуваат во биотехнологијата.[181]
Бактериски вируси[уреди | уреди извор]

Бактериските вируси (бактериофаги) се разновидна група на вируси и се најзастапениот биолошки ентитет во водените животни средини. Во океаните има десет пати повеќе бактериофаги отколку бактериски клетки; на пример, во еден милилитар морска вода присутни се околу 250 милиони бактериофаги.[182][183] Овие вируси инфицираат одредени бактерии преку врзување за нивните површински рецептори, што им овозможува продор низ бактерискиот клеточен ѕид. За многу кратко време, најчесто само неколку минути, вирусните иРНК молекули почнуваат да се транслатираат во белковини. Овие белковини можат да бидат или градбени подединици на вирионот, или помошни белковини, кои помагаат во процесот на интеграција, или белковини кои учествуваат во лиза на клетката. Вирусните ензими предизвикуваат раскинување на клеточната мембрана и, како што е случај со Т4 фагите, за само 20 минути по влегувањето на вирусот во бактериската клетка се ослободуваат околу 300 нови фаги.[184][185]
Најчестиот одбранбен механизам кај бактериите против вирусни инфекции е со продукција на ензими кои ги уништуваат страните ДНК молекули. Овие ензими, наречени рестрикциони ендонуклеази, ја сечат вирусната ДНК молекула.[186] Друг одбранбен систем кај бактериите е со употреба на CRISPR (анг. Clustered Regularly Interspaced Short Palindromic Repeats) секвенците, во кои се чуваат фрагменти од вирусниот геном со кој бактеријата дошла во контакт во минатото. Овој генетски систем, всушност, претставува стекнат имунитет на бактеријата кон специфични вируси.[187][188][189]
Архејски вируси[уреди | уреди извор]
Вирусите кои ги инфицираат археите се најчесто двоверижни ДНК вируси, кои не се сродни со ниту една друга група на вируси, и имаат невообичаени форми, како шише, кукасти прачки или форма на солза.[3][49] Овие вируси во најголеми детали се проучени кај термофилните археи од редовите Sulfolobales и Thermoproteales.[190] Неодамна, беа изолирани две групи на едноверижни ДНК вируси кои инфицираат археи. Претставник на една од групите е Halorubrum pleomorphic virus 1 (Pleolipoviridae), кој ги инфицира халофилните археи,[191] а на другата е вирусот во облик на серпентина (Spiraviridae), кој инфицира хипертермофилен домаќин кој оптимално расте на температура од 90-95 °C.[192] Повеќето археи го поседуваат и користат CRISPR–Cas системот како адаптивен механизам за одбрана од вирусни инфекции.[193]
Улога во водните екосистеми[уреди | уреди извор]
Лажичка морска вода (~ 5 мл) содржи околу 50 милиони вируси,[194] кои имаат огромна генетска разновидност.[195] Повеќето од нив се бактериофаги кои инфицираат хетеротрофни бактерии и се од суштинско значење за регулирање на морските и слатководните екосистеми.[196] Морските вируси се исто така важни причинители на смртност на фитопланктонот, кој ја претставува основата на синџирот на исхрана во водените екосистеми. Покрај тоа, со инфицирање и уништување на бактериите во водните микробиолошки заедници, тие претставуваат еден од најважните механизми за рециклирање на јаглеродот, азотот и другите биолошки елементи во морските средини. Органските молекули, ослободени од мртвите бактериски клетки, стимулираат нов бактериски и алгински раст, во процес познат како вирален шант.[197][198] Вирусната активност, исто така влијае на т.н. биолошка пумпа, процес со кој атмосферскиот јаглерод се секвестрира и заробува во океанските длабочини и седименти.[199]
Микроорганизмите сочинуваат повеќе од 90% од биомасата во морето. Се проценува дека вирусите секој ден убиваат околу 20% од оваа биомаса и дека има 10 до 15 пати повеќе вируси во океаните одошто бактерии и археи.[200]
Улога во еволуцијата[уреди | уреди извор]
Вирусите се важен природен начин за пренесување на гените помеѓу различните видови организми, што придонесува за зголемување на генетската разновидност и влијае на еволуцијата. Се смета дека вирусите играле централна улога во раната еволуција, пред диверзификацијата на бактериите, археите и еукариотите, во времето на последниот универзален заеднички предок на животот на Земјата.[201][202] Вирусите сѐ уште се една од најголемите резервоари на неистражена генетска разновидност на Земјата.
Значење во индустријата и технологијата[уреди | уреди извор]
Биолошки и медицински науки[уреди | уреди извор]
Вирусите се важни во изучувањето на молекуларната и клеточната биологија, бидејќи обезбедуваат едноставни системи кои можат да се користат за манипулирање и испитување на функциите на клетките. Проучувањата и употребата на вирусите дале вредни информации во клеточната биологија.[203] Вирусите биле корисни во изучувањето на генетиката и придонеле во разбирањето на основните механизми на молекуларната генетика, како што се репликацијата на ДНК, транскрипцијата, обработката на РНК, транслацијата, белковинскиот транспорт и имунологијата.
Генетичарите често ги користат вирусите како вектори за да воведат гени во клетките кои ги проучуваат. Тие се користат за стимулирање на клетката да произведе страна супстанца или да се проучи ефектот на инкорпорација на нов ген во геномот. На сличен начин, виротерапијата користи вируси како вектори за лекување на разни болести, бидејќи тие можат специфично да целат на одредени клетки и ДНК, што може да се искористи во лекувањето на ракот и во генската терапија. Источноевропските научници веќе некое време ја користат терапијата со фаги како алтернатива на антибиотиците, а интересот за овој пристап се зголемува, поради високиот степен на резистенција кон антибиотици, што се среќава кај некои патогени бактерии.[204] Експресијата на хетерологните белковини од вирусите е основа за произведување на разни белковини, како што се антигени за вакцини и антитела.
Наука за материјали и нанотехнологија[уреди | уреди извор]
Тековните трендови во нанотехнологијата ветуваат поразновидна употреба на вирусите во иднината. Од гледна точка на научникот за материјали, вирусите се органски наночестички. Нивната површина носи специфични структури кои му служат на вирусот да ги премине бариерите на клетката домаќин. Големината и обликот на вирусите, како и бројот и природата на функционалните групи на нивната површина, е точно дефиниран. Како такви, вирусите најчесто се користат во науката за материјали како скеле за ковалентно-поврзани површински модификации. Една од корисните особини на вирусите е можноста тие да бидат изменети со насочена еволуција.[205][206][207]
Синтетички вируси[уреди | уреди извор]
Многу вируси можат да се синтетизираат de novo, а првиот синтетички вирус е создаден во 2002 година.[208] Целата вирусна честичка не се синтетизира, туку само нејзиниот ДНК-геном. Кај многу вирусни фамилии, голиот, синтетички-добиен ДНК-геном е заразен кога се воведува во клетка. Оваа технологија сега се користи за истражување на новите стратегии за вакцинирање.[209] Почнувајќи од ноември 2017 година, целосните геномски секвенци на 7.454 различни вируси, вклучувајќи го и вирусот на големите сипаници, се јавно достапни на мрежната база на податоци која ја одржуваат Националните институти за здравје на САД (анг. National Institutes of Health).[210]
Вирусот како мотив во популарната култура[уреди | уреди извор]
- „Валкан мал вирус“ (англиски: Dirty Little Virus) - песна на американскиот рок-музичар Иги Поп од 2020 година.[211]
Поврзано[уреди | уреди извор]
Наводи[уреди | уреди извор]
- ↑ 1,0 1,1 Koonin, Eugene V.; Senkevich, Tatiana G.; Dolja, Valerian V. (2006-09-19). „The ancient Virus World and evolution of cells“. Biology Direct. 1: 29. doi:10.1186/1745-6150-1-29. ISSN 1745-6150. PMC 1594570. PMID 16984643.CS1-одржување: PMC-формат (link)
- ↑ 2,0 2,1 Breitbart, Mya; Rohwer, Forest (June 2005). „Here a virus, there a virus, everywhere the same virus?“. Trends in Microbiology. 13 (6): 278–284. doi:10.1016/j.tim.2005 април 003 Проверете ја вредноста
|doi=(help). ISSN 0966-842X. PMID 15936660. - ↑ 3,0 3,1 Lawrence, C. Martin; Menon, Smita; Eilers, Brian J.; Bothner, Brian; Khayat, Reza; Douglas, Trevor; Young, Mark J. (2009-05-08). „Structural and functional studies of archaeal viruses“. The Journal of Biological Chemistry. 284 (19): 12599–12603. doi:10.1074/jbc.R800078200. ISSN 0021-9258. PMC 2675988. PMID 19158076.CS1-одржување: PMC-формат (link)
- ↑ Edwards, Robert A.; Rohwer, Forest (June 2005). „Viral metagenomics“. Nature Reviews. Microbiology. 3 (6): 504–510. doi:10.1038/nrmicro1163. ISSN 1740-1526. PMID 15886693.
- ↑ Canchaya, Carlos; Fournous, Ghislain; Chibani-Chennoufi, Sandra; Dillmann, Marie Lise; Brüssow, Harald (August 2003). „Phage as agents of lateral gene transfer“. Current Opinion in Microbiology. 6 (4): 417–424. ISSN 1369-5274. PMID 12941415.
- ↑ „Study: Viruses Are Living Entities, Not Machines | Biology | Sci-News.com“. Breaking Science News | Sci-News.com (англиски). Посетено на 2018-06-13.
- ↑ 7,0 7,1 Rybicki, EP. (1990). „The classification of organisms at the edge of life, or problems with virus systematics“. South African Journal of Science. 86: 182–186.
- ↑ 8,0 8,1 Koonin, Eugene V.; Starokadomskyy, Petro (October 2016). „Are viruses alive? The replicator paradigm sheds decisive light on an old but misguided question“. Studies in History and Philosophy of Biological and Biomedical Sciences. 59: 125–134. doi:10.1016/j.shpsc.2016 февруари 016 Проверете ја вредноста
|doi=(help). ISSN 1879-2499. PMC 5406846. PMID 26965225.CS1-одржување: PMC-формат (link) - ↑ „Viral Host Range - Causative Agent - ALPF Medical Research“. www.alpfmedical.info (англиски). Посетено на 2018-02-22.
- ↑ 10,0 10,1 „virus | Origin and meaning of virus by Online Etymology Dictionary“. www.etymonline.com (англиски). Посетено на 2018-02-22.
- ↑ „virulent | Origin and meaning of virulent by Online Etymology Dictionary“. www.etymonline.com (англиски). Посетено на 2018-02-22.
- ↑ „viral | Origin and meaning of viral by Online Etymology Dictionary“. www.etymonline.com (англиски). Посетено на 2018-02-22.
- ↑ „virion | Origin and meaning of virion by Online Etymology Dictionary“. www.etymonline.com (англиски). Посетено на 2018-02-22.
- ↑ Casjens, S. (2010). In: Mahy BWJ and Van Regenmortel MHV. Desk Encyclopedia of General Virology. Boston: Academic Press. стр. 167. ISBN 0-12-375146-2.
- ↑ Bordenave, Guy (May 2003). „Louis Pasteur (1822-1895)“. Microbes and Infection. 5 (6): 553–560. ISSN 1286-4579. PMID 12758285.
- ↑ 16,0 16,1 16,2 Horzinek, Marian C. (1997-02-01). „The birth of virology“. Antonie van Leeuwenhoek (англиски). 71 (1–2): 15–20. doi:10.1023/A:1000197505492. ISSN 0003-6072.
- ↑ Fenner, F (2009). In: Mahy B. W. J. and Van Regenmortal M. H. V.. Desk Encyclopedia of General Virology. Oxford: Oxford, UK: Academic Press. стр. 15. ISBN 0-12-375146-2.
- ↑ Steinhardt, E.; Israeli, C.; Lambert, R. A. (1913-09-01). „Studies on the Cultivation of the Virus of Vaccinia“. Journal of Infectious Diseases (англиски). 13 (2): 294–300. doi:10.1093/infdis/13 февруари 294 Проверете ја вредноста
|doi=(help). ISSN 0022-1899. - ↑ Goodpasture, E. W.; Woodruff, A. M.; Buddingh, G. J. (1931-10-09). „THE CULTIVATION OF VACCINE AND OTHER VIRUSES IN THE CHORIOALLANTOIC MEMBRANE OF CHICK EMBRYOS“. Science (New York, N.Y.). 74 (1919): 371–372. doi:10.1126/science.74.1919.371. ISSN 0036-8075. PMID 17810781.
- ↑ Rosen, Fred S. (2004-10-07). „Isolation of poliovirus--John Enders and the Nobel Prize“. The New England Journal of Medicine. 351 (15): 1481–1483. doi:10.1056/NEJMp048202. ISSN 1533-4406. PMID 15470207.
- ↑ Browne, Malcolm W. (1988-05-31). „Ernst Ruska, a German Nobel Winner, Dies at 81“. The New York Times (англиски). ISSN 0362-4331. Посетено на 2018-02-22.
- ↑ Stanley, W. M.; Loring, H. S. (1936-01-24). „THE ISOLATION OF CRYSTALLINE TOBACCO MOSAIC VIRUS PROTEIN FROM DISEASED TOMATO PLANTS“. Science (New York, N.Y.). 83 (2143): 85. doi:10.1126/science.83.2143.85. ISSN 0036-8075. PMID 17756690.
- ↑ Creager, Angela N. H.; Morgan, Gregory J. (June 2008). „After the double helix: Rosalind Franklin's research on Tobacco mosaic virus“. Isis; an International Review Devoted to the History of Science and Its Cultural Influences. 99 (2): 239–272. ISSN 0021-1753. PMID 18702397.
- ↑ Norrby, Erling (2008). „Nobel Prizes and the emerging virus concept“. Archives of Virology. 153 (6): 1109–1123. doi:10.1007/s00705-008-0088-8. ISSN 0304-8608. PMID 18446425.
- ↑ Barré-Sinoussi, F.; Chermann, J. C.; Rey, F.; Nugeyre, M. T.; Chamaret, S.; Gruest, J.; Dauguet, C.; Axler-Blin, C.; Vézinet-Brun, F. (1983-05-20). „Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS)“. Science (New York, N.Y.). 220 (4599): 868–871. ISSN 0036-8075. PMID 6189183.
- ↑ Choo, Q. L.; Kuo, G.; Weiner, A. J.; Overby, L. R.; Bradley, D. W.; Houghton, M. (1989-04-21). „Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome“. Science (New York, N.Y.). 244 (4902): 359–362. ISSN 0036-8075. PMID 2523562.
- ↑ Houghton, Michael (November 2009). „The long and winding road leading to the identification of the hepatitis C virus“. Journal of Hepatology. 51 (5): 939–948. doi:10.1016/j.jhep.2009 август 004 Проверете ја вредноста
|doi=(help). ISSN 1600-0641. PMID 19781804. - ↑ Holmes, Edward C. (2007-10-02). „Viral evolution in the genomic age“. PLoS biology. 5 (10): e278. doi:10.1371/journal.pbio.0050278. ISSN 1545-7885. PMC 1994994. PMID 17914905.CS1-одржување: PMC-формат (link)
- ↑ Wimmer, Eckard; Mueller, Steffen; Tumpey, Terrence M.; Taubenberger, Jeffery K. (December 2009). „Synthetic viruses: a new opportunity to understand and prevent viral disease“. Nature Biotechnology. 27 (12): 1163–1172. doi:10.1038/nbt.1593. ISSN 1546-1696. PMC 2819212. PMID 20010599.CS1-одржување: PMC-формат (link)
- ↑ Horn, Matthias (2008). „Chlamydiae as symbionts in eukaryotes“. Annual Review of Microbiology. 62: 113–131. doi:10.1146/annurev.micro.62.081307.162818. ISSN 0066-4227. PMID 18473699.
- ↑ Ammerman, Nicole C.; Beier-Sexton, Magda; Azad, Abdu F. (November 2008). „Laboratory maintenance of Rickettsia rickettsii“. Current Protocols in Microbiology. Chapter 3: Unit 3A.5. doi:10.1002/9780471729259.mc03a05s11. ISSN 1934-8533. PMC 2725428. PMID 19016440.CS1-одржување: PMC-формат (link)
- ↑ Kiley, M. P.; Bowen, E. T.; Eddy, G. A.; Isaäcson, M.; Johnson, K. M.; McCormick, J. B.; Murphy, F. A.; Pattyn, S. R.; Peters, D. (1982). „Filoviridae: a taxonomic home for Marburg and Ebola viruses?“. Intervirology. 18 (1–2): 24–32. doi:10.1159/000149300. ISSN 0300-5526. PMID 7118520.
- ↑ 33,0 33,1 33,2 33,3 Madigan; и др. (2017). Brock Biology of Microorganisms (15th ed.). London: Pearson. стр. 16–18. ISBN 0134261925.
- ↑ Kiselev, N. A.; Sherman, M. B.; Tsuprun, V. L. (1990). „Negative staining of proteins“. Electron Microscopy Reviews. 3 (1): 43–72. ISSN 0892-0354. PMID 1715774.
- ↑ Caspar, D. L.; Klug, A. (1962). „Physical principles in the construction of regular viruses“. Cold Spring Harbor Symposia on Quantitative Biology. 27: 1–24. ISSN 0091-7451. PMID 14019094.
- ↑ Crick, F. H.; Watson, J. D. (1956-03-10). „Structure of small viruses“. Nature. 177 (4506): 473–475. ISSN 0028-0836. PMID 13309339.
- ↑ Falvo, M. R.; Washburn, S.; Superfine, R.; Finch, M.; Brooks, F. P.; Chi, V.; Taylor, R. M. (March 1997). „Manipulation of individual viruses: friction and mechanical properties“. Biophysical Journal. 72 (3): 1396–1403. doi:10.1016/S0006-3495(97)78786-1. ISSN 0006-3495. PMC 1184522. PMID 9138585.CS1-одржување: PMC-формат (link)
- ↑ Kuznetsov, Y. G.; Malkin, A. J.; Lucas, R. W.; Plomp, M.; McPherson, A. (September 2001). „Imaging of viruses by atomic force microscopy“. The Journal of General Virology. 82 (Pt 9): 2025–2034. doi:10.1099/0022-1317-82-9-2025. ISSN 0022-1317. PMID 11514711.
- ↑ Wilson, David P. (2016). „Protruding Features of Viral Capsids Are Clustered on Icosahedral Great Circles“. PloS One. 11 (4): e0152319. doi:10.1371/journal.pone.0152319. ISSN 1932-6203. PMC 4821576. PMID 27045511.CS1-одржување: PMC-формат (link)
- ↑ Casens, S. (2009). Desk Encyclopedia of General Virology. Boston: Academic Press. стр. 167–174. ISBN 0-12-375146-2.
- ↑ Sun, Xiangjie; Whittaker, Gary R. (2003-12-01). „Role for Influenza Virus Envelope Cholesterol in Virus Entry and Infection“. Journal of Virology (англиски). 77 (23): 12543–12551. doi:10.1128/JVI.77.23.12543-12551.2003. ISSN 0022-538X. PMID 14610177. Архивирано од изворникот на 2018-06-02. Посетено на 2018-02-22.
- ↑ Morizono, Kouki; Chen, Irvin S. Y. (2014-04-15). „Role of Phosphatidylserine Receptors in Enveloped Virus Infection“. Journal of Virology (англиски). 88 (8): 4275–4290. doi:10.1128/JVI.03287-13. ISSN 0022-538X. PMID 24478428. Архивирано од изворникот на 2018-06-02. Посетено на 2018-02-22.
- ↑ Rossmann, Michael G.; Mesyanzhinov, Vadim V.; Arisaka, Fumio; Leiman, Petr G. (April 2004). „The bacteriophage T4 DNA injection machine“. Current Opinion in Structural Biology. 14 (2): 171–180. doi:10.1016/j.sbi.2004 февруари 001 Проверете ја вредноста
|doi=(help). ISSN 0959-440X. PMID 15093831. - ↑ Long, G. W.; Nobel, J.; Murphy, F. A.; Herrmann, K. L.; Lourie, B. (September 1970). „Experience with electron microscopy in the differential diagnosis of smallpox“. Applied Microbiology. 20 (3): 497–504. ISSN 0003-6919. PMID 4322005.
- ↑ Suzan-Monti, M.; La Scola, B.; Raoult, D. (April 2006). „Genomic and evolutionary aspects of Mimivirus“. Virus Research. 117 (1): 145–155. doi:10.1016/j.virusres.2005 јули 011 Проверете ја вредноста
|doi=(help). ISSN 0168-1702. PMID 16181700. - ↑ Arslan, Defne; Legendre, Matthieu; Seltzer, Virginie; Abergel, Chantal; Claverie, Jean-Michel (2011-10-18). „Distant Mimivirus relative with a larger genome highlights the fundamental features of Megaviridae“. Proceedings of the National Academy of Sciences of the United States of America. 108 (42): 17486–17491. doi:10.1073/pnas.1110889108. ISSN 1091-6490. PMC 3198346. PMID 21987820.CS1-одржување: PMC-формат (link)
- ↑ 47,0 47,1 Philippe, Nadège; Legendre, Matthieu; Doutre, Gabriel; Couté, Yohann; Poirot, Olivier; Lescot, Magali; Arslan, Defne; Seltzer, Virginie; Bertaux, Lionel (2013-07-19). „Pandoraviruses: amoeba viruses with genomes up to 2.5 Mb reaching that of parasitic eukaryotes“. Science (New York, N.Y.). 341 (6143): 281–286. doi:10.1126/science.1239181. ISSN 1095-9203. PMID 23869018.
- ↑ 48,0 48,1 Nasir, Arshan; Kim, Kyung Mo; Caetano-Anolles, Gustavo (2012-08-24). „Giant viruses coexisted with the cellular ancestors and represent a distinct supergroup along with superkingdoms Archaea, Bacteria and Eukarya“. BMC Evolutionary Biology. 12: 156. doi:10.1186/1471-2148-12-156. ISSN 1471-2148.
- ↑ 49,0 49,1 Prangishvili, David; Forterre, Patrick; Garrett, Roger A. (November 2006). „Viruses of the Archaea: a unifying view“. Nature Reviews. Microbiology. 4 (11): 837–848. doi:10.1038/nrmicro1527. ISSN 1740-1534. PMID 17041631.
- ↑ Pennisi, Elizabeth (2011-03-25). „Microbiology. Going viral: exploring the role of viruses in our bodies“. Science (New York, N.Y.). 331 (6024): 1513. doi:10.1126/science.331.6024.1513. ISSN 1095-9203. PMID 21436418.
- ↑ Shi, Mang; Lin, Xian-Dan; Tian, Jun-Hua; Chen, Liang-Jun; Chen, Xiao; Li, Ci-Xiu; Qin, Xin-Cheng; Li, Jun; Cao, Jian-Ping (2016-11-23). „Redefining the invertebrate RNA virosphere“. Nature. doi:10.1038/nature20167. ISSN 1476-4687. PMID 27880757.
- ↑ Saxena, Pooja; Lomonossoff, George P. (2014). „Virus infection cycle events coupled to RNA replication“. Annual Review of Phytopathology. 52: 197–212. doi:10.1146/annurev-phyto-102313-050205. ISSN 1545-2107. PMID 24906127.
- ↑ Hatfull, Graham F.; Hendrix, Roger W. (2011-10-01). „Bacteriophages and their Genomes“. Current opinion in virology. 1 (4): 298–303. doi:10.1016/j.coviro.2011 јуни 009 Проверете ја вредноста
|doi=(help). ISSN 1879-6257. PMC 3199584. PMID 22034588.CS1-одржување: PMC-формат (link) - ↑ French, R.; Ahlquist, P. (July 1988). „Characterization and engineering of sequences controlling in vivo synthesis of brome mosaic virus subgenomic RNA“. Journal of Virology. 62 (7): 2411–2420. ISSN 0022-538X. PMID 3373573.
- ↑ „Hepadna Viral Family“. web.stanford.edu. Посетено на 2018-02-22.
- ↑ Virology: principles and applications. Chichester: John Wiley & Sons. 2007. стр. 72. ISBN 0-470-02387-2.
- ↑ Belyi, Vladimir A.; Levine, Arnold J.; Skalka, Anna Marie (December 2010). „Sequences from ancestral single-stranded DNA viruses in vertebrate genomes: the parvoviridae and circoviridae are more than 40 to 50 million years old“. Journal of Virology. 84 (23): 12458–12462. doi:10.1128/JVI.01789-10. ISSN 1098-5514. PMC 2976387. PMID 20861255.CS1-одржување: PMC-формат (link)
- ↑ Brandes, Nadav; Linial, Michal (2016-05-21). „Gene overlapping and size constraints in the viral world“. Biology Direct. 11: 26. doi:10.1186/s13062-016-0128-3. ISSN 1745-6150.
- ↑ 59,0 59,1 Sanjuán, Rafael; Nebot, Miguel R.; Chirico, Nicola; Mansky, Louis M.; Belshaw, Robert (October 2010). „Viral mutation rates“. Journal of Virology. 84 (19): 9733–9748. doi:10.1128/JVI.00694-10. ISSN 1098-5514. PMC 2937809. PMID 20660197.CS1-одржување: PMC-формат (link)
- ↑ Pressing, J.; Reanney, D. C. (1984). „Divided genomes and intrinsic noise“. Journal of Molecular Evolution. 20 (2): 135–146. ISSN 0022-2844. PMID 6433032.
- ↑ Sandbulte, Matthew R.; Westgeest, Kim B.; Gao, Jin; Xu, Xiyan; Klimov, Alexander I.; Russell, Colin A.; Burke, David F.; Smith, Derek J.; Fouchier, Ron A. M. (2011-12-20). „Discordant antigenic drift of neuraminidase and hemagglutinin in H1N1 and H3N2 influenza viruses“. Proceedings of the National Academy of Sciences of the United States of America. 108 (51): 20748–20753. doi:10.1073/pnas.1113801108. ISSN 1091-6490. PMC 3251064. PMID 22143798.CS1-одржување: PMC-формат (link)
- ↑ Moss, Ronald B.; Davey, Richard T.; Steigbigel, Roy T.; Fang, Fang (June 2010). „Targeting pandemic influenza: a primer on influenza antivirals and drug resistance“. The Journal of Antimicrobial Chemotherapy. 65 (6): 1086–1093. doi:10.1093/jac/dkq100. ISSN 1460-2091. PMID 20375034.
- ↑ Hampson, Alan W.; Mackenzie, John S. (2006-11-20). „The influenza viruses“. The Medical Journal of Australia. 185 (10 Suppl): S39–43. ISSN 0025-729X. PMID 17115950.
- ↑ Metzner, Karin J. (December 2006). „Detection and significance of minority quasispecies of drug-resistant HIV-1“. Journal of HIV therapy. 11 (4): 74–81. ISSN 1462-0308. PMID 17578210.
- ↑ Steel, John; Lowen, Anice C. (2014). „Influenza A virus reassortment“. Current Topics in Microbiology and Immunology. 385: 377–401. doi:10.1007/82_2014_395. ISSN 0070-217X. PMID 25007845.
- ↑ Vijaykrishna, Dhanasekaran; Mukerji, Reshmi; Smith, Gavin J. D. (2015-07-09). „RNA Virus Reassortment: An Evolutionary Mechanism for Host Jumps and Immune Evasion“. PLOS Pathogens (англиски). 11 (7): e1004902. doi:10.1371/journal.ppat.1004902. ISSN 1553-7374.
- ↑ Worobey, M.; Holmes, E. C. (October 1999). „Evolutionary aspects of recombination in RNA viruses“. The Journal of General Virology. 80 ( Pt 10): 2535–2543. doi:10.1099/0022-1317-80-10-2535. ISSN 0022-1317. PMID 10573145.
- ↑ Lukashev, Alexander N. (May 2005). „Role of recombination in evolution of enteroviruses“. Reviews in Medical Virology. 15 (3): 157–167. doi:10.1002/rmv.457. ISSN 1052-9276. PMID 15578739.
- ↑ Umene, K. (July 1999). „Mechanism and application of genetic recombination in herpesviruses“. Reviews in Medical Virology. 9 (3): 171–182. ISSN 1052-9276. PMID 10479778.
- ↑ Boevink, Petra; Oparka, Karl J. (August 2005). „Virus-host interactions during movement processes“. Plant Physiology. 138 (4): 1815–1821. doi:10.1104/pp.105.066761. ISSN 0032-0889. PMC 1183373. PMID 16172094.CS1-одржување: PMC-формат (link)
- ↑ Orlova, Elena V (2009-04-08). „How viruses infect bacteria?“. The EMBO Journal. 28 (7): 797–798. doi:10.1038/emboj.2009.71. ISSN 0261-4189. PMC 2670874. PMID 19352408.CS1-одржување: PMC-формат (link)
- ↑ Barman, S.; Ali, A.; Hui, E. K.; Adhikary, L.; Nayak, D. P. (September 2001). „Transport of viral proteins to the apical membranes and interaction of matrix protein with glycoproteins in the assembly of influenza viruses“. Virus Research. 77 (1): 61–69. ISSN 0168-1702. PMID 11451488.
- ↑ „Difference Between Prophage and Provirus l Prophage vs Provirus“. www.differencebetween.com (англиски). Посетено на 2018-02-22.
- ↑ Benkirane, Monsef; Chun, Rene F.; Xiao, Hua; Ogryzko, Vasily V.; Howard, Bruce H.; Nakatani, Yoshihiro; Jeang, Kuan-Teh (1998-09-18). „Activation of Integrated Provirus Requires Histone Acetyltransferase p300 AND P/CAF ARE COACTIVATORS FOR HIV-1 Tat“. Journal of Biological Chemistry (англиски). 273 (38): 24898–24905. doi:10.1074/jbc.273.38.24898. ISSN 0021-9258. PMID 9733796.
- ↑ Sundquist, Wesley I.; Kräusslich, Hans-Georg (2012-7). „HIV-1 Assembly, Budding, and Maturation“. Cold Spring Harbor Perspectives in Medicine. 2 (7). doi:10.1101/cshperspect.a006924. ISSN 2157-1422. PMC 3385941. PMID 22762019. Проверете ги датумските вредности во:
|date=(help)CS1-одржување: PMC-формат (link) - ↑ „DNA Virus Replication“. www.microbiologybook.org. Посетено на 2018-02-22.
- ↑ „RNA Virus Replication“. www.microbiologybook.org. Посетено на 2018-02-22.
- ↑ Staginnus, Christina; Richert-Pöggeler, Katja R. (October 2006). „Endogenous pararetroviruses: two-faced travelers in the plant genome“. Trends in Plant Science. 11 (10): 485–491. doi:10.1016/j.tplants.2006 август 008 Проверете ја вредноста
|doi=(help). ISSN 1360-1385. PMID 16949329. - ↑ Roulston, A.; Marcellus, R. C.; Branton, P. E. (1999). „Viruses and apoptosis“. Annual Review of Microbiology. 53: 577–628. doi:10.1146/annurev.micro.53 јануари 577 Проверете ја вредноста
|doi=(help). ISSN 0066-4227. PMID 10547702. - ↑ Alwine, J. C. (2008). „Modulation of host cell stress responses by human cytomegalovirus“. Current Topics in Microbiology and Immunology. 325: 263–279. ISSN 0070-217X. PMID 18637511.
- ↑ Sinclair, John (March 2008). „Human cytomegalovirus: Latency and reactivation in the myeloid lineage“. Journal of Clinical Virology: The Official Publication of the Pan American Society for Clinical Virology. 41 (3): 180–185. doi:10.1016/j.jcv.2007 ноември 014 Проверете ја вредноста
|doi=(help). ISSN 1386-6532. PMID 18164651. - ↑ Jordan, M. C.; Jordan, G. W.; Stevens, J. G.; Miller, G. (June 1984). „Latent herpesviruses of humans“. Annals of Internal Medicine. 100 (6): 866–880. ISSN 0003-4819. PMID 6326635.
- ↑ Sissons, J. G. P.; Bain, M.; Wills, M. R. (February 2002). „Latency and reactivation of human cytomegalovirus“. The Journal of Infection. 44 (2): 73–77. doi:10.1053/jinf.2001.0948. ISSN 0163-4453. PMID 12076064.
- ↑ Barozzi, Patrizia; Potenza, Leonardo; Riva, Giovanni; Vallerini, Daniela; Quadrelli, Chiara; Bosco, Raffaella; Forghieri, Fabio; Torelli, Giuseppe; Luppi, Mario (December 2007). „B cells and herpesviruses: a model of lymphoproliferation“. Autoimmunity Reviews. 7 (2): 132–136. doi:10.1016/j.autrev.2007 февруари 018 Проверете ја вредноста
|doi=(help). ISSN 1568-9972. PMID 18035323. - ↑ Subramanya, Deepthi; Grivas, Petros D. (November 2008). „HPV and cervical cancer: updates on an established relationship“. Postgraduate Medicine. 120 (4): 7–13. doi:10.3810/pgm.2008 ноември 1928 Проверете ја вредноста
|doi=(help). ISSN 1941-9260. PMID 19020360. - ↑ Crawford, Dorothy H. (2011). Viruses: A Very Short Introduction. Oxford University Press. стр. 16. ISBN 0-19-957485-5.
- ↑ „Does Common Architecture Reveal a Viral Lineage Spanning All Three Domains of Life?“. Molecular Cell (англиски). 16 (5): 673–685. 2004-12-03. doi:10.1016/j.molcel.2004 ноември 016 Проверете ја вредноста
|doi=(help). ISSN 1097-2765. - ↑ „Overview of Viruses | Boundless Microbiology“. courses.lumenlearning.com. Посетено на 2018-02-22.
- ↑ Baggesen, D. L.; Sørensen, G.; Nielsen, E. M.; Wegener, H. C. (2010-01-28). „Phage typing of Salmonella Typhimurium - is it still a useful tool for surveillance and outbreak investigation?“. Euro Surveillance: Bulletin Europeen Sur Les Maladies Transmissibles = European Communicable Disease Bulletin. 15 (4): 19471. ISSN 1560-7917. PMID 20122382.
- ↑ Lwoff, A.; Horne, R. W.; Tournier, P. (1962-06-13). „[A virus system]“. Comptes Rendus Hebdomadaires Des Seances De l'Academie Des Sciences. 254: 4225–4227. ISSN 0001-4036. PMID 14467544.
- ↑ Lwoff, A.; Horne, R.; Tournier, P. (1962). „A system of viruses“. Cold Spring Harbor Symposia on Quantitative Biology. 27: 51–55. ISSN 0091-7451. PMID 13931895.
- ↑ 92,0 92,1 King, Lefkowitz, Adams, Carstens (2011). Virus Taxonomy: Ninth Report of the International Committee on Taxonomy of Viruses. Elsevier. стр. 6. ISBN 0-12-384684-6.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ Adams, M. J.; Lefkowitz, E. J.; King, A. M. Q.; Carstens, E. B. (December 2013). „Recently agreed changes to the International Code of Virus Classification and Nomenclature“. Archives of Virology. 158 (12): 2633–2639. doi:10.1007/s00705-013-1749-9. ISSN 1432-8798. PMID 23836393.
- ↑ Delwart, Eric L. (March 2007). „Viral metagenomics“. Reviews in Medical Virology. 17 (2): 115–131. doi:10.1002/rmv.532. ISSN 1052-9276. PMID 17295196.
- ↑ „Taxonomy“. International Committee on Taxonomy of Viruses (ICTV) (англиски). Посетено на 2018-02-22.
- ↑ Temin, H. M.; Baltimore, D. (1972). „RNA-directed DNA synthesis and RNA tumor viruses“. Advances in Virus Research. 17: 129–186. ISSN 0065-3527. PMID 4348509.
- ↑ Baltimore, D. (1974–1975). „The strategy of RNA viruses“. Harvey Lectures. 70 Series: 57–74. ISSN 0073-0874. PMID 4377923.CS1-одржување: датумски формат (link)
- ↑ van Regenmortel, Marc H. V.; Mahy, Brian W. J. (January 2004). „Emerging issues in virus taxonomy“. Emerging Infectious Diseases. 10 (1): 8–13. doi:10.3201/eid1001.030279. ISSN 1080-6040. PMC 3322749. PMID 15078590.CS1-одржување: PMC-формат (link)
- ↑ Mayo, M. A. (1999). „Developments in plant virus taxonomy since the publication of the 6th ICTV Report. International Committee on Taxonomy of Viruses“. Archives of Virology. 144 (8): 1659–1666. ISSN 0304-8608. PMID 10486120.
- ↑ de Villiers, Ethel-Michele; Fauquet, Claude; Broker, Thomas R.; Bernard, Hans-Ulrich; zur Hausen, Harald (2004-06-20). „Classification of papillomaviruses“. Virology. 324 (1): 17–27. doi:10.1016/j.virol.2004 март 033 Проверете ја вредноста
|doi=(help). ISSN 0042-6822. PMID 15183049. - ↑ Parker, Michael T. (9 2016). „An Ecological Framework of the Human Virome Provides Classification of Current Knowledge and Identifies Areas of Forthcoming Discovery“. The Yale Journal of Biology and Medicine. 89 (3): 339–351. ISSN 1551-4056. PMC 5045143. PMID 27698618. Проверете ги датумските вредности во:
|date=(help)CS1-одржување: PMC-формат (link) - ↑ Iyer, Lakshminarayan M.; Balaji, S.; Koonin, Eugene V.; Aravind, L. (April 2006). „Evolutionary genomics of nucleo-cytoplasmic large DNA viruses“. Virus Research. 117 (1): 156–184. doi:10.1016/j.virusres.2006 јануари 009 Проверете ја вредноста
|doi=(help). ISSN 0168-1702. PMID 16494962. - ↑ „Origin of Viruses“. www.nature.com (англиски). Посетено на 2018-02-22. Text " Learn Science at Scitable" ignored (help)
- ↑ Forterre, Patrick; Krupovic, Mart (2012). Viruses: Essential Agents of Life (англиски). Springer, Dordrecht. стр. 43–60. doi:10.1007/978-94-007-4899-6_3. ISBN 9789400748989.
- ↑ 105,0 105,1 „Once upon a time: The possible story of viruses | Student Voices | Learn Science at Scitable“. www.nature.com (англиски). Посетено на 2018-02-22.
- ↑ McCLINTOCK, B. (June 1950). „The origin and behavior of mutable loci in maize“. Proceedings of the National Academy of Sciences of the United States of America. 36 (6): 344–355. ISSN 0027-8424. PMC 1063197. PMID 15430309.CS1-одржување: PMC-формат (link)
- ↑ „Viroids, Virusoids, and Prions | Microbiology“. courses.lumenlearning.com. Посетено на 2018-02-22.
- ↑ Tsagris, Efthimia Mina; Martínez de Alba, Ángel Emilio; Gozmanova, Mariyana; Kalantidis, Kriton (2008-11-01). „Viroids“. Cellular Microbiology (англиски). 10 (11): 2168–2179. doi:10.1111/j.1462-5822.2008.01231.x. ISSN 1462-5822.
- ↑ La Scola, Bernard; Desnues, Christelle; Pagnier, Isabelle; Robert, Catherine; Barrassi, Lina; Fournous, Ghislain; Merchat, Michèle; Suzan-Monti, Marie; Forterre, Patrick (2008-09-04). „The virophage as a unique parasite of the giant mimivirus“. Nature. 455 (7209): 100–104. doi:10.1038/nature07218. ISSN 1476-4687. PMID 18690211.
- ↑ Liberski, Paweł P. (2008). „Prion diseases: a riddle wrapped in a mystery inside an enigma“. Folia Neuropathologica. 46 (2): 93–116. ISSN 1641-4640. PMID 18587704.
- ↑ Alpers, Michael P. (March 2007). „A history of kuru“. Papua and New Guinea Medical Journal. 50 (1–2): 10–19. ISSN 0031-1480. PMID 19354007.
- ↑ Liberski, Paweł P. (2012). Neurodegenerative Diseases. Advances in Experimental Medicine and Biology (англиски). Springer, New York, NY. стр. 128–137. doi:10.1007/978-1-4614-0653-2_10. ISBN 9781461406525.
- ↑ Lupi, Omar; Dadalti, Paula; Cruz, Eduardo; Goodheart, Clyde (2007). „Did the first virus self-assemble from self-replicating prion proteins and RNA?“. Medical Hypotheses. 69 (4): 724–730. doi:10.1016/j.mehy.2007 март 031 Проверете ја вредноста
|doi=(help). ISSN 0306-9877. PMID 17512677. - ↑ Komaroff, Anthony L. (December 2006). „Is human herpesvirus-6 a trigger for chronic fatigue syndrome?“. Journal of Clinical Virology: The Official Publication of the Pan American Society for Clinical Virology. 37 Suppl 1: S39–46. doi:10.1016/S1386-6532(06)70010-5. ISSN 1386-6532. PMID 17276367.
- ↑ Chen, C. H.; Chiu, Y. L.; Wei, F. C.; Koong, F. J.; Liu, H. C.; Shaw, C. K.; Hwu, H. G.; Hsiao, K. J. (January 1999). „High seroprevalence of Borna virus infection in schizophrenic patients, family members and mental health workers in Taiwan“. Molecular Psychiatry. 4 (1): 33–38. ISSN 1359-4184. PMID 10089006.
- ↑ Margolis, Todd P.; Elfman, Fred L.; Leib, David; Pakpour, Nazzy; Apakupakul, Kathleen; Imai, Yumi; Voytek, Cindy (October 2007). „Spontaneous reactivation of herpes simplex virus type 1 in latently infected murine sensory ganglia“. Journal of Virology. 81 (20): 11069–11074. doi:10.1128/JVI.00243-07. ISSN 0022-538X. PMC 2045564. PMID 17686862.CS1-одржување: PMC-формат (link)
- ↑ Whitley, R. J.; Roizman, B. (2001-05-12). „Herpes simplex virus infections“. Lancet (London, England). 357 (9267): 1513–1518. doi:10.1016/S0140-6736(00)04638-9. ISSN 0140-6736. PMID 11377626.
- ↑ Barton, Erik S.; White, Douglas W.; Cathelyn, Jason S.; Brett-McClellan, Kelly A.; Engle, Michael; Diamond, Michael S.; Miller, Virginia L.; Virgin, Herbert W. (2007-05-17). „Herpesvirus latency confers symbiotic protection from bacterial infection“. Nature. 447 (7142): 326–329. doi:10.1038/nature05762. ISSN 1476-4687. PMID 17507983.
- ↑ Bertoletti, Antonio; Gehring, Adam (October 2007). „Immune response and tolerance during chronic hepatitis B virus infection“. Hepatology Research: The Official Journal of the Japan Society of Hepatology. 37 Suppl 3: S331–338. doi:10.1111/j.1872-034X.2007.00221.x. ISSN 1386-6346. PMID 17931183.
- ↑ Rodrigues, C.; Deshmukh, M.; Jacob, T.; Nukala, R.; Menon, S.; Mehta, A. (July 2001). „Significance of HBV DNA by PCR over serological markers of HBV in acute and chronic patients“. Indian Journal of Medical Microbiology. 19 (3): 141–144. ISSN 0255-0857. PMID 17664817.
- ↑ Nguyen, Van Thi-Thuy; McLaws, Mary-Louise; Dore, Gregory J. (December 2007). „Highly endemic hepatitis B infection in rural Vietnam“. Journal of Gastroenterology and Hepatology. 22 (12): 2093–2100. doi:10.1111/j.1440-1746.2007.05010.x. ISSN 0815-9319. PMID 17645465.
- ↑ Fowler, Mary Glenn; Lampe, Margaret A.; Jamieson, Denise J.; Kourtis, Athena P.; Rogers, Martha F. (September 2007). „Reducing the risk of mother-to-child human immunodeficiency virus transmission: past successes, current progress and challenges, and future directions“. American Journal of Obstetrics and Gynecology. 197 (3 Suppl): S3–9. doi:10.1016/j.ajog.2007 јуни 048 Проверете ја вредноста
|doi=(help). ISSN 1097-6868. PMID 17825648. - ↑ Sauerbrei, A.; Wutzler, P. (December 2000). „The congenital varicella syndrome“. Journal of Perinatology: Official Journal of the California Perinatal Association. 20 (8 Pt 1): 548–554. ISSN 0743-8346. PMID 11190597.
- ↑ Garnett, Geoffrey P. (2005-02-01). „Role of herd immunity in determining the effect of vaccines against sexually transmitted disease“. The Journal of Infectious Diseases. 191 Suppl 1: S97–106. doi:10.1086/425271. ISSN 0022-1899. PMID 15627236.
- ↑ Platonov, A. E. (2006). „[The influence of weather conditions on the epidemiology of vector-borne diseases by the example of West Nile fever in Russia]“. Vestnik Rossiiskoi Akademii Meditsinskikh Nauk (2): 25–29. ISSN 0869-6047. PMID 16544901.
- ↑ 126,0 126,1 „WHO | Epidemiology“. www.who.int. Посетено на 2018-02-22.
- ↑ „Summit Medical Group“. www.summitmedicalgroup.com (англиски). Посетено на 2018-02-22.
- ↑ Hays (2005). Epidemics and Pandemics: Their Impacts on Human History. USA: ABC-CLIO. ISBN 1851096582.
- ↑ Patterson, Kristine B.; Runge, Thomas (April 2002). „Smallpox and the Native American“. The American Journal of the Medical Sciences. 323 (4): 216–222. ISSN 0002-9629. PMID 12003378.
- ↑ Ranlet, P. (2000). „The British, the Indians, and smallpox: what actually happened at Fort Pitt in 1763?“. Pennsylvania History. 67 (3): 427–441. ISSN 0031-4528. PMID 17216901.
- ↑ „The Influenza Epidemic of 1918“. www.archives.gov. Посетено на 2018-02-22.
- ↑ Patterson, K. D.; Pyle, G. F. (1991). „The geography and mortality of the 1918 influenza pandemic“. Bulletin of the History of Medicine. 65 (1): 4–21. ISSN 0007-5140. PMID 2021692.
- ↑ Johnson, Niall P. A. S.; Mueller, Juergen (2002). „Updating the accounts: global mortality of the 1918-1920 "Spanish" influenza pandemic“. Bulletin of the History of Medicine. 76 (1): 105–115. ISSN 0007-5140. PMID 11875246.
- ↑ Gao, F.; Bailes, E.; Robertson, D. L.; Chen, Y.; Rodenburg, C. M.; Michael, S. F.; Cummins, L. B.; Arthur, L. O.; Peeters, M. (1999-02-04). „Origin of HIV-1 in the chimpanzee Pan troglodytes troglodytes“. Nature. 397 (6718): 436–441. doi:10.1038/17130. ISSN 0028-0836. PMID 9989410.
- ↑ Sharp, Paul M.; Hahn, Beatrice H. (2011-9). „Origins of HIV and the AIDS Pandemic“. Cold Spring Harbor Perspectives in Medicine. 1 (1). doi:10.1101/cshperspect.a006841. ISSN 2157-1422. PMC 3234451. PMID 22229120. Проверете ги датумските вредности во:
|date=(help)CS1-одржување: PMC-формат (link) - ↑ Mawar, Nita; Saha, Seema; Pandit, Apoorvaa; Mahajan, Uma (December 2005). „The third phase of HIV pandemic: social consequences of HIV/AIDS stigma & discrimination & future needs“. The Indian Journal of Medical Research. 122 (6): 471–484. ISSN 0971-5916. PMID 16517997.
- ↑ „Wayback Machine“ (PDF). 2015-11-22. Архивирано од изворникот на 2015-11-22. Посетено на 2018-02-22.CS1-одржување: бот: непознат статус на изворната URL (link)
- ↑ „2014-2016 Ebola Outbreak in West Africa | Ebola Hemorrhagic Fever | CDC“. www.cdc.gov (англиски). Посетено на 2018-02-22.
- ↑ „Ebola: Mapping the outbreak“. BBC News (англиски). 2016. Посетено на 2018-02-23.
- ↑ Einstein, Mark H.; Schiller, John T.; Viscidi, Raphael P.; Strickler, Howard D.; Coursaget, Pierre; Tan, Tina; Halsey, Neal; Jenkins, David (June 2009). „Clinician's guide to human papillomavirus immunology: knowns and unknowns“. The Lancet. Infectious Diseases. 9 (6): 347–356. doi:10.1016/S1473-3099(09)70108-2. ISSN 1474-4457. PMID 19467474.
- ↑ Shuda, Masahiro; Feng, Huichen; Kwun, Hyun Jin; Rosen, Steven T.; Gjoerup, Ole; Moore, Patrick S.; Chang, Yuan (2008-10-21). „T antigen mutations are a human tumor-specific signature for Merkel cell polyomavirus“. Proceedings of the National Academy of Sciences of the United States of America. 105 (42): 16272–16277. doi:10.1073/pnas.0806526105. ISSN 1091-6490. PMC 2551627. PMID 18812503.CS1-одржување: PMC-формат (link)
- ↑ Pulitzer, Melissa P.; Amin, Bijal D.; Busam, Klaus J. (2009-05-01). „Merkel Cell Carcinoma: Review“. Advances in Anatomic Pathology (англиски). 16 (3). doi:10.1097/PAP.0b013e3181a12f5a. ISSN 1072-4109.
- ↑ Koike, Kazuhiko (June 2007). „Hepatitis C virus contributes to hepatocarcinogenesis by modulating metabolic and intracellular signaling pathways“. Journal of Gastroenterology and Hepatology. 22 Suppl 1: S108–111. doi:10.1111/j.1440-1746.2006.04669.x. ISSN 0815-9319. PMID 17567457.
- ↑ Hu, Jianming; Ludgate, Laurie (2007). „HIV-HBV and HIV-HCV coinfection and liver cancer development“. Cancer Treatment and Research. 133: 241–252. ISSN 0927-3042. PMID 17672044.
- ↑ Bellon, Marcia; Nicot, Christophe (January 2007). „Telomerase: a crucial player in HTLV-I-induced human T-cell leukemia“. Cancer Genomics & Proteomics. 4 (1): 21–25. ISSN 1109-6535. PMID 17726237.
- ↑ Schiffman, Mark; Castle, Philip E.; Jeronimo, Jose; Rodriguez, Ana C.; Wacholder, Sholom (2007-09-08). „Human papillomavirus and cervical cancer“. Lancet (London, England). 370 (9590): 890–907. doi:10.1016/S0140-6736(07)61416-0. ISSN 1474-547X. PMID 17826171.
- ↑ Klein, E.; Kis, L. L.; Klein, G. (2007-02-26). „Epstein-Barr virus infection in humans: from harmless to life endangering virus-lymphocyte interactions“. Oncogene. 26 (9): 1297–1305. doi:10.1038/sj.onc.1210240. ISSN 0950-9232. PMID 17322915.
- ↑ Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, and Peter Walter (2002). Molecular Biology of the Cell; Fourth Edition. New York and London: Garland Science. ISBN 0-8153-3218-1.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ Greer, S.; Alexander, G. J. (December 1995). „Viral serology and detection“. Bailliere's Clinical Gastroenterology. 9 (4): 689–721. ISSN 0950-3528. PMID 8903801.
- ↑ Mallery, Donna L.; McEwan, William A.; Bidgood, Susanna R.; Towers, Greg J.; Johnson, Chris M.; James, Leo C. (2010-11-16). „Antibodies mediate intracellular immunity through tripartite motif-containing 21 (TRIM21)“. Proceedings of the National Academy of Sciences of the United States of America. 107 (46): 19985–19990. doi:10.1073/pnas.1014074107. ISSN 1091-6490. PMC 2993423. PMID 21045130.CS1-одржување: PMC-формат (link)
- ↑ Elhelu, Mohamed A. (March 1983). „The Role of Macrophages in Immunology“. Journal of the National Medical Association. 75 (3): 314–317. ISSN 0027-9684. PMC 2561478. PMID 6343621.CS1-одржување: PMC-формат (link)
- ↑ Cascalho, Marilia; Platt, Jeffrey L. (2007). „Novel functions of B cells“. Critical Reviews in Immunology. 27 (2): 141–151. ISSN 1040-8401. PMID 17725500.
- ↑ Sonnenfeld, Gerald; Merigan, Thomas C. (1979-10-01). „The role of interferon in viral infections“. Springer Seminars in Immunopathology (англиски). 2 (3): 311–338. doi:10.1007/BF00198722. ISSN 0344-4325.
- ↑ Le Page, C.; Génin, P.; Baines, M. G.; Hiscott, J. (2000). „Interferon activation and innate immunity“. Reviews in Immunogenetics. 2 (3): 374–386. ISSN 1398-1714. PMID 11256746.
- ↑ Hilleman, Maurice R. (2004-10-05). „Strategies and mechanisms for host and pathogen survival in acute and persistent viral infections“. Proceedings of the National Academy of Sciences of the United States of America. 101 Suppl 2: 14560–14566. doi:10.1073/pnas.0404758101. ISSN 0027-8424. PMID 15297608.
- ↑ Ludlow, Martin; Kortekaas, Jeroen; Herden, Christiane; Hoffmann, Bernd; Tappe, Dennis; Trebst, Corinna; Griffin, Diane E.; Brindle, Hannah E.; Solomon, Tom (2016). „Neurotropic virus infections as the cause of immediate and delayed neuropathology“. Acta Neuropathologica. 131: 159–184. doi:10.1007/s00401-015-1511-3. ISSN 0001-6322. PMC 4713712. PMID 26659576.CS1-одржување: PMC-формат (link)
- ↑ Asaria, Perviz; MacMahon, Eithne (2006-10-28). „Measles in the United Kingdom: can we eradicate it by 2010?“. BMJ (Clinical research ed.). 333 (7574): 890–895. doi:10.1136/bmj.38989.445845.7C. ISSN 1756-1833. PMC 1626346. PMID 17068034.CS1-одржување: PMC-формат (link)
- ↑ Lane, J. M. (2006). „Mass vaccination and surveillance/containment in the eradication of smallpox“. Current Topics in Microbiology and Immunology. 304: 17–29. ISSN 0070-217X. PMID 16989262.
- ↑ Arvin, Ann M.; Greenberg, Harry B. (2006-01-05). „New viral vaccines“. Virology. 344 (1): 240–249. doi:10.1016/j.virol.2005 септември 057 Проверете ја вредноста
|doi=(help). ISSN 0042-6822. PMID 16364754. - ↑ García-Sastre, Adolfo; Mena, Ignacio (April 2013). „Novel vaccine strategies against emerging viruses“. Current Opinion in Virology. 3 (2): 210–216. doi:10.1016/j.coviro.2013 февруари 001 Проверете ја вредноста
|doi=(help). ISSN 1879-6265. PMC 3644304. PMID 23477832.CS1-одржување: PMC-формат (link) - ↑ Pastoret, P. P.; Schudel, A. A.; Lombard, M. (August 2007). „Conclusions--future trends in veterinary vaccinology“. Revue Scientifique Et Technique (International Office of Epizootics). 26 (2): 489–494, 495–501, 503–509. ISSN 0253-1933. PMID 17892169.
- ↑ Palese, Peter (January 2006). „Making better influenza virus vaccines?“. Emerging Infectious Diseases. 12 (1): 61–65. doi:10.3201/eid1201.051043. ISSN 1080-6040. PMC 3291403. PMID 16494719.CS1-одржување: PMC-формат (link)
- ↑ Thomssen, R. (1975). „Live attenuated versus killed virus vaccines“. Monographs in Allergy. 9: 155–176. ISSN 0077-0760. PMID 1090805.
- ↑ McLean, A. A. (July 1986). „Development of vaccines against hepatitis A and hepatitis B“. Reviews of Infectious Diseases. 8 (4): 591–598. ISSN 0162-0886. PMID 3018891.
- ↑ Casswall, Thomas H.; Fischler, Björn (October 2005). „Vaccination of the immunocompromised child“. Expert Review of Vaccines. 4 (5): 725–738. doi:10.1586/14760584 април 5.725 Проверете ја вредноста
|doi=(help). ISSN 1744-8395. PMID 16221073. - ↑ Barnett, Elizabeth D.; Wilder-Smith, Annelies; Wilson, Mary E. (July 2008). „Yellow fever vaccines and international travelers“. Expert Review of Vaccines. 7 (5): 579–587. doi:10.1586/14760584.7 мај 579 Проверете ја вредноста
|doi=(help). ISSN 1744-8395. PMID 18564013. - ↑ Tuset, Montse; Martín-Conde, M. Teresa; Miró, José M.; Del Cacho, Elena; Alberdi, Aintzane; Codina, Carles; Ribas, Josep (October 2003). „[Characteristics of antiviral drugs]“. Enfermedades Infecciosas Y Microbiologia Clinica. 21 (8): 433–457, quiz 458, 467. ISSN 0213-005X. PMID 14525709.
- ↑ Magden, Julia; Kääriäinen, Leevi; Ahola, Tero (March 2005). „Inhibitors of virus replication: recent developments and prospects“. Applied Microbiology and Biotechnology. 66 (6): 612–621. doi:10.1007/s00253-004-1783-3. ISSN 0175-7598. PMID 15592828.
- ↑ Mindel, A.; Sutherland, S. (September 1983). „Genital herpes - the disease and its treatment including intravenous acyclovir“. The Journal of Antimicrobial Chemotherapy. 12 Suppl B: 51–59. ISSN 0305-7453. PMID 6355051.
- ↑ Lv, Zhengtong; Chu, Yuan; Wang, Yong (2015-04-08). „HIV protease inhibitors: a review of molecular selectivity and toxicity“. HIV/AIDS (Auckland, N.Z.). 7: 95–104. doi:10.2147/HIV.S79956. ISSN 1179-1373. PMC 4396582. PMID 25897264.CS1-одржување: PMC-формат (link)
- ↑ Witthöft, Th; Möller, B.; Wiedmann, K. H.; Mauss, St; Link, R.; Lohmeyer, J.; Lafrenz, M.; Gelbmann, C. M.; Hüppe, D. (November 2007). „Safety, tolerability and efficacy of peginterferon alpha-2a and ribavirin in chronic hepatitis C in clinical practice: The German Open Safety Trial“. Journal of Viral Hepatitis. 14 (11): 788–796. doi:10.1111/j.1365-2893.2007.00871.x. ISSN 1352-0504. PMC 2156112. PMID 17927615.CS1-одржување: PMC-формат (link)
- ↑ Rudin, Dan; Shah, Sooraj M.; Kiss, Alexander; Wetz, Robert V.; Sottile, Vincent M. (November 2007). „Interferon and lamivudine vs. interferon for hepatitis B e antigen-positive hepatitis B treatment: meta-analysis of randomized controlled trials“. Liver International: Official Journal of the International Association for the Study of the Liver. 27 (9): 1185–1193. doi:10.1111/j.1478-3231.2007.01580.x. ISSN 1478-3223. PMC 2156150. PMID 17919229.CS1-одржување: PMC-формат (link)
- ↑ Goris, Nesya; Vandenbussche, Frank; De Clercq, Kris (April 2008). „Potential of antiviral therapy and prophylaxis for controlling RNA viral infections of livestock“. Antiviral Research. 78 (1): 170–178. doi:10.1016/j.antiviral.2007 октомври 003 Проверете ја вредноста
|doi=(help). ISSN 0166-3542. PMID 18035428. - ↑ Carmichael, L. E. (September 2005). „An annotated historical account of canine parvovirus“. Journal of Veterinary Medicine. B, Infectious Diseases and Veterinary Public Health. 52 (7–8): 303–311. doi:10.1111/j.1439-0450.2005.00868.x. ISSN 0931-1793. PMID 16316389.
- ↑ Drew, WL (2004). Sherris Medical Microbiology. McGraw Hill. стр. 597–600. ISBN 978-0-8385-8529-0.
- ↑ Chen, Yanping; Zhao, Yan; Hammond, John; Hsu, Hei-ti; Evans, Jay; Feldlaufer, Mark (October 2004). „Multiple virus infections in the honey bee and genome divergence of honey bee viruses“. Journal of Invertebrate Pathology. 87 (2–3): 84–93. doi:10.1016/j.jip.2004 јули 005 Проверете ја вредноста
|doi=(help). ISSN 0022-2011. PMID 15579317. - ↑ Plant Viral Vectors | Kenneth E. Palmer | Springer (англиски).
- ↑ „All you wanted to know about plant virus control“. Trends in Plant Science (англиски). 3 (12): 490. 1998-12-01. doi:10.1016/S1360-1385(98)01341-7. ISSN 1360-1385.
- ↑ Dinesh-Kumar, S. P.; Tham, W. H.; Baker, B. J. (2000-12-19). „Structure-function analysis of the tobacco mosaic virus resistance gene N“. Proceedings of the National Academy of Sciences of the United States of America. 97 (26): 14789–14794. doi:10.1073/pnas.97.26.14789. ISSN 0027-8424. PMID 11121079.
- ↑ Soosaar, Jennifer L. M.; Burch-Smith, Tessa M.; Dinesh-Kumar, Savithramma P. (October 2005). „Mechanisms of plant resistance to viruses“. Nature Reviews. Microbiology. 3 (10): 789–798. doi:10.1038/nrmicro1239. ISSN 1740-1526. PMID 16132037.
- ↑ Lomonossoff, GP (2011). "Virus Particles and the Uses of Such Particles in Bio- and Nanotechnology" in Recent Advances in Plant Virology. Caister Academic Press. ISBN 978-1-904455-75-2.
- ↑ Wommack, K. E.; Colwell, R. R. (March 2000). „Virioplankton: viruses in aquatic ecosystems“. Microbiology and molecular biology reviews: MMBR. 64 (1): 69–114. ISSN 1092-2172. PMID 10704475.
- ↑ Bergh, O.; Børsheim, K. Y.; Bratbak, G.; Heldal, M. (1989-08-10). „High abundance of viruses found in aquatic environments“. Nature. 340 (6233): 467–468. doi:10.1038/340467a0. ISSN 0028-0836. PMID 2755508.
- ↑ Miller, Eric S.; Kutter, Elizabeth; Mosig, Gisela; Arisaka, Fumio; Kunisawa, Takashi; Rüger, Wolfgang (2003-3). „Bacteriophage T4 Genome“. Microbiology and Molecular Biology Reviews. 67 (1): 86–156. doi:10.1128/MMBR.67 јануари 86-156.2003 Проверете ја вредноста
|doi=(help). ISSN 1092-2172. PMID 12626685. Проверете ги датумските вредности во:|date=(help) - ↑ Yap, Moh Lan; Rossmann, Michael G (2014-10). „Structure and function of bacteriophage T4“. Future microbiology. 9: 1319–1327. doi:10.2217/fmb.14.91. ISSN 1746-0913. PMC 4275845. PMID 25517898. Проверете ги датумските вредности во:
|date=(help)CS1-одржување: PMC-формат (link) - ↑ Bickle, T. A.; Krüger, D. H. (June 1993). „Biology of DNA restriction“. Microbiological Reviews. 57 (2): 434–450. ISSN 0146-0749. PMID 8336674.
- ↑ Barrangou, Rodolphe; Fremaux, Christophe; Deveau, Hélène; Richards, Melissa; Boyaval, Patrick; Moineau, Sylvain; Romero, Dennis A.; Horvath, Philippe (2007-03-23). „CRISPR provides acquired resistance against viruses in prokaryotes“. Science (New York, N.Y.). 315 (5819): 1709–1712. doi:10.1126/science.1138140. ISSN 1095-9203. PMID 17379808.
- ↑ Brouns, Stan J. J.; Jore, Matthijs M.; Lundgren, Magnus; Westra, Edze R.; Slijkhuis, Rik J. H.; Snijders, Ambrosius P. L.; Dickman, Mark J.; Makarova, Kira S.; Koonin, Eugene V. (2008-08-15). „Small CRISPR RNAs guide antiviral defense in prokaryotes“. Science (New York, N.Y.). 321 (5891): 960–964. doi:10.1126/science.1159689. ISSN 1095-9203. PMID 18703739.
- ↑ Mojica, Francisco J. M.; Rodriguez-Valera, Francisco (9 2016). „The discovery of CRISPR in archaea and bacteria“. The FEBS journal. 283 (17): 3162–3169. doi:10.1111/febs.13766. ISSN 1742-4658. PMID 27234458. Проверете ги датумските вредности во:
|date=(help) - ↑ Prangishvili, D.; Garrett, R. A. (April 2004). „Exceptionally diverse morphotypes and genomes of crenarchaeal hyperthermophilic viruses“. Biochemical Society Transactions. 32 (Pt 2): 204–208. doi:10.1042/ Проверете ја вредноста
|doi=(help). ISSN 0300-5127. PMID 15046572. - ↑ Pietilä, Maija K.; Roine, Elina; Paulin, Lars; Kalkkinen, Nisse; Bamford, Dennis H. (April 2009). „An ssDNA virus infecting archaea: a new lineage of viruses with a membrane envelope“. Molecular Microbiology. 72 (2): 307–319. doi:10.1111/j.1365-2958.2009.06642.x. ISSN 1365-2958. PMID 19298373.
- ↑ Mochizuki, Tomohiro; Krupovic, Mart; Pehau-Arnaudet, Gérard; Sako, Yoshihiko; Forterre, Patrick; Prangishvili, David (2012-08-14). „Archaeal virus with exceptional virion architecture and the largest single-stranded DNA genome“. Proceedings of the National Academy of Sciences of the United States of America. 109 (33): 13386–13391. doi:10.1073/pnas.1203668109. ISSN 1091-6490. PMC 3421227. PMID 22826255.CS1-одржување: PMC-формат (link)
- ↑ van der Oost, John; Westra, Edze R.; Jackson, Ryan N.; Wiedenheft, Blake (July 2014). „Unravelling the structural and mechanistic basis of CRISPR-Cas systems“. Nature Reviews. Microbiology. 12 (7): 479–492. doi:10.1038/nrmicro3279. ISSN 1740-1534. PMC 4225775. PMID 24909109.CS1-одржување: PMC-формат (link)
- ↑ Suttle, Curtis A. (2005-09-15). „Viruses in the sea“. Nature. 437 (7057): 356–361. doi:10.1038/nature04160. ISSN 1476-4687. PMID 16163346.
- ↑ Suttle, Curtis A. (2013-10-01). „Viruses: unlocking the greatest biodiversity on Earth“. Genome. 56 (10): 542–544. doi:10.1139/gen-2013-0152. ISSN 0831-2796.
- ↑ „An Ocean of Viruses“. The Scientist. Посетено на 2018-02-23.
- ↑ Wilhelm, Steven W.; Suttle, Curtis A. (1999-10-01). „Viruses and Nutrient Cycles in the Sea“. BioScience (англиски). 49 (10): 781–788. doi:10.2307/1313569. ISSN 0006-3568.
- ↑ Shelford, E. J.; Suttle, C. A. (2018-02-09). „Virus-mediated transfer of nitrogen from heterotrophic bacteria to phytoplankton“. Biogeosciences. 15 (3): 809–819. doi:10.5194/bg-15-809-2018. ISSN 1726-4189.
- ↑ Suttle, Curtis A. (October 2007). „Marine viruses--major players in the global ecosystem“. Nature Reviews. Microbiology. 5 (10): 801–812. doi:10.1038/nrmicro1750. ISSN 1740-1534. PMID 17853907.
- ↑ Wigington, Charles H.; Sonderegger, Derek; Brussaard, Corina P. D.; Buchan, Alison; Finke, Jan F.; Fuhrman, Jed A.; Lennon, Jay T.; Middelboe, Mathias; Suttle, Curtis A. (2016-01-25). „Re-examination of the relationship between marine virus and microbial cell abundances“. Nature Microbiology. 1: 15024. doi:10.1038/nmicrobiol.2015.24. ISSN 2058-5276. PMID 27572161.
- ↑ Forterre, P.; Philippe, H. (June 1999). „The last universal common ancestor (LUCA), simple or complex?“. The Biological Bulletin. 196 (3): 373–375, discussion 375–377. doi:10.2307/1542973. ISSN 0006-3185. PMID 11536914.
- ↑ Malik, Shahana S.; Azem-E-Zahra, Syeda; Kim, Kyung Mo; Caetano-Anollés, Gustavo; Nasir, Arshan (2017). „Do Viruses Exchange Genes across Superkingdoms of Life?“. Frontiers in Microbiology. 8: 2110. doi:10.3389/fmicb.2017.02110. ISSN 1664-302X. PMC 5671483. PMID 29163404.CS1-одржување: PMC-формат (link)
- ↑ Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James (2000). „Viruses: Structure, Function, and Uses“ (англиски). Наводот journal бара
|journal=(help) - ↑ Matsuzaki, Shigenobu; Rashel, Mohammad; Uchiyama, Jumpei; Sakurai, Shingo; Ujihara, Takako; Kuroda, Masayuki; Ikeuchi, Masahiko; Tani, Toshikazu; Fujieda, Mikiya (October 2005). „Bacteriophage therapy: a revitalized therapy against bacterial infectious diseases“. Journal of Infection and Chemotherapy: Official Journal of the Japan Society of Chemotherapy. 11 (5): 211–219. doi:10.1007/s10156-005-0408-9. ISSN 1341-321X. PMID 16258815.
- ↑ Fischlechner, Martin; Donath, Edwin (2007). „Viruses as building blocks for materials and devices“. Angewandte Chemie (International Ed. in English). 46 (18): 3184–3193. doi:10.1002/anie.200603445. ISSN 1433-7851. PMID 17348058.
- ↑ Soto, Carissa M.; Blum, Amy Szuchmacher; Vora, Gary J.; Lebedev, Nikolai; Meador, Carolyn E.; Won, Angela P.; Chatterji, Anju; Johnson, John E.; Ratna, Banahalli R. (2006-04-19). „Fluorescent signal amplification of carbocyanine dyes using engineered viral nanoparticles“. Journal of the American Chemical Society. 128 (15): 5184–5189. doi:10.1021/ja058574x. ISSN 0002-7863. PMID 16608355.
- ↑ Blum, Amy Szuchmacher; Soto, Carissa M.; Wilson, Charmaine D.; Brower, Tina L.; Pollack, Steven K.; Schull, Terence L.; Chatterji, Anju; Lin, Tianwei; Johnson, John E. (July 2005). „An engineered virus as a scaffold for three-dimensional self-assembly on the nanoscale“. Small (Weinheim an Der Bergstrasse, Germany). 1 (7): 702–706. doi:10.1002/smll.200500021. ISSN 1613-6829. PMID 17193509.
- ↑ Cello, Jeronimo; Paul, Aniko V.; Wimmer, Eckard (2002-08-09). „Chemical synthesis of poliovirus cDNA: generation of infectious virus in the absence of natural template“. Science (New York, N.Y.). 297 (5583): 1016–1018. doi:10.1126/science.1072266. ISSN 1095-9203. PMID 12114528.
- ↑ Coleman, J. Robert; Papamichail, Dimitris; Skiena, Steven; Futcher, Bruce; Wimmer, Eckard; Mueller, Steffen (2008-06-27). „Virus attenuation by genome-scale changes in codon pair bias“. Science (New York, N.Y.). 320 (5884): 1784–1787. doi:10.1126/science.1155761. ISSN 1095-9203. PMC 2754401. PMID 18583614.CS1-одржување: PMC-формат (link)
- ↑ „Complete genomes: Viruses“. www.ncbi.nlm.nih.gov. Посетено на 2018-02-23.
- ↑ YouTube, Iggy Pop - Dirty Little Virus (Official Audio) (пристапено на 10.1.2021)
Литература[уреди | уреди извор]
- Atlas RM (1995). Principles of microbiology. St. Louis: Mosby. ISBN 0-8016-7790-4.
- Collier L, Balows A, Sussman M (1998). Topley and Wilson's Microbiology and Microbial Infections ninth edition, Volume 1, Virology, volume editors: Mahy B and Collier L. Arnold. ISBN 0-340-66316-2.
- Knipe DM, Howley PM, Griffin DE, Lamb RA, Martin MA, Roizman B, Straus SE (2001) Fundamental Virology (4th ed.). LWW. ISBN 0781718333
- Alcamo IE (2001). Fundamentals of microbiology. Boston: Jones and Bartlett. ISBN 0-7637-1067-9.
- Dimmock NJ, Easton AJ, Leppard K (2007). Introduction to Modern Virology (6th ed.). Blackwell Publishing. ISBN 1-4051-3645-6
- Flint SJ, Enquist LW, Racaniello VR, Skalka AM (2008) Principles of Virology (2 Volume Set) (3rd ed.). ASM Press. ISBN 1555814433
- Shors T (2008). Understanding Viruses. Jones and Bartlett Publishers. ISBN 0-7637-2932-9
- Hull R (2009) Comparative Plant Virology (2nd ed.). Academic Press. ISBN 0123741548
- Louten J (2016) Essential Human Virology. Academic Press. ISBN 0128009470
- Ryu W-S (2016) Molecular Virology of Human Pathogenic Viruses. Academic Press. ISBN 0128008385
- Weaver SC, Denison M, Roossinck M, Vignuzzi M (2016) Virus Evolution: Current Research and Future Directions. Caister Academic Press. ISBN 1910190233
- Madigan MT, Bender KS, Buckley DH, Sattley WM, Stahl DA (2017). Brock Biology of Microorganisms (15th ed.). London: Pearson. ISBN 0134261925.
Надворешни врски[уреди | уреди извор]
- ViralZone - Швајцарски институт за биоинформатика, со податоци за сите вирусни фамилии и општи молекуларни и епидемиолошки информации. (на анг.)
- Семрежен семинар на Дејвид Балтимор: „Вовед во вируси и ХИВ“ (на анг.)
- A Gazillion Tiny Avatars - статија за вируси на Оливија Џадсон, NY Times, 2009 година. (на анг.)
- Видео лекции за вируси на Кан академијата. (на анг.)
- Тридимензионални структури на вируси од Банка на електронско-микроскопски податоци (EMDB) Архивирано на 18 март 2018 г. (на анг.)
- Virus-Host DB - база на податоци за односи меѓу вирусот и домаќинот. (на анг.)
- Потекло на вирусите - епизода за потекло на вирусите на PBS Eons (на анг.)
|
| Статијата „Вирус“ е избрана статија. Ве повикуваме и Вас да напишете и предложите избрана статија (останати избрани статии). |
