Борна киселина
| |||

| |||
Назив според МСЧПХ Борна киселина | |||
| Систематско име | Бор хидроксид | ||
Други називи Ортоборна киселина, Борацинска киселина, Сасолит, Борофакс, Трихидроксиборан, Борантриол, Водород борат | |||
| Назнаки | |||
|---|---|---|---|
| 10043-35-3 | |||
| ChEBI | CHEBI:33118 | ||
| ChEMBL | ChEMBL42403 | ||
| ChemSpider | 7346 | ||
| EC-број | 233-139-2 | ||
| |||
| 3Д-модел (Jmol) | Слика Слика | ||
| KEGG | D01089 | ||
| PubChem | 7628 | ||
| |||
| UNII | R57ZHV85D4 | ||
| Својства | |||
| Хемиска формула | |||
| Моларна маса | 0 g mol−1 | ||
| Изглед | Бело кристално цврсто | ||
| Густина | 1.435 g/cm3 | ||
| Точка на топење | |||
| Точка на вриење | |||
| 2.52 g/100 mL (0 °C) 4.72 g/100 mL (20 °C) 5.7 g/100 mL (25 °C) 19.10 g/100 mL (80 °C) 27.53 g/100 mL (100 °C) | |||
| Растворливост во други растворувачи | Растворлив во пониски алкохоли умерено растворлив во пиридин многу малку растворлив во ацетон | ||
| log P | -0.29 | ||
| Киселост (pKa) | 9.24, 12.4, 13.3 | ||
| Конјуг. база | Борат | ||
| -34.1·10−6 cm3/mol | |||
| Структура | |||
| Геометрија на молекулата | Тригонална рамнина | ||
| Диполен момент | Zero | ||
| Pharmacology | |||
| ATC код | S02AA03 D08 | ||
| Опасност | |||
| GHS-ознаки: | |||
Пиктограми
|

| ||
| NFPA 704 | |||
| Температура на запалување | {{{value}}} | ||
| Смртоносна доза или концентрација: | |||
LD50 (средна доза)
|
2660 mg/kg, oral (rat) | ||
| Дополнителни податоци | |||
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |||
| Наводи | |||
Борна киселина или ортоборна киселина — соединение од бор, кислород и водород со формула B(OH)
3. Може да се нарече и водородборат, бор хидроксид или борна киселина. Обично се среќава како безбоен кристал или бел прав, кој се раствора во вода и се јавува во природата како минерал сасолит. Тоа е слаба киселина која дава различни боратни анјони и соли и може да реагира со алкохоли за да формира боратни естри.
Боринската киселина често се користи како антисептик, инсектицид, отпорник на пламен, апсорбер на неутрони или претходник на други соединенија на бор.
Терминот „борна киселина“ исто така се користи генерички за која било оксокиселина на бор, како што е метаборната киселина HBO
2 и тетраборна киселина H
2B
4O
7.
Историја[уреди | уреди извор]
Ортоборната киселина првпат била подготвена од Вилхелм Хомберг (1652-1715) од борат, со дејство на минерални киселини, и го добила името sal sedativum Hombergi ("седативна сол на Хомберг"). Сепак, борната киселина и боратите се користеле уште од времето на старите Грци за чистење, зачувување храна и други активности.[1]
Молекуларна и кристална структура[уреди | уреди извор]
Трите атоми на кислород формираат тригонална рамна геометрија околу борот. Должината на BO е 136 pm, а OH е 97 pm. Групата на молекуларна точка е C3h [2]
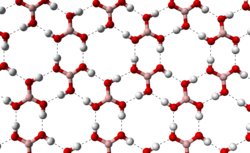
Познати се две кристални форми на ортоборна киселина: триклинска и хексагонална. Првиот е најчест; вториот, кој е малку постабилен термодинамички, може да се добие со посебен метод на подготовка.[3]
Триклиник[уреди | уреди извор]
Триклинската форма на борна киселина се состои од слоеви наB(OH)
3 молекули се држат заедно со водородни врски со должина од 272 pm. Растојанието помеѓу два соседни слоја е 318 пм.[4]
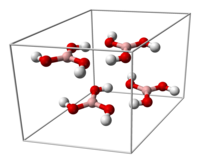 |
 |
The unit cell of boric acid
|
hydrogen bonding (dashed lines)
allows boric acid molecules to form parallel layers in the solid state |
Подготовка[уреди | уреди извор]
Борна киселина може да се подготви со реакција на борат (натриум тетраборат декахидрат) со минерална киселина, како што е хлороводородна киселина:
- Na
2B
4O
7·10H
2O + 2 HCl → 4 B(OH)
3 + 2 NaCl + 5 H
2O
Исто така, се формира како нус-производ на хидролиза на трихалиди на бор и диборан:[5]
- B
2H
6 + 6 H
2O → 2 B(OH)
3 + 6 H
2
- BX
3 + 3 H
2O → B(OH)
3 + 3 HX (X = Cl, Br, I)
Реакции[уреди | уреди извор]
Пиролиза[уреди | уреди извор]
Кога се загрева, ортоборната киселина се подложува на тристепена дехидрација. Пријавените преодни температури значително се разликуваат од извор до извор.
Кога се загрева над 140 °C, ортоборната киселина дава метаборна киселина (HBO
2) со губење на една молекула на вода:[6][7]
- B(OH)
3 → HBO
2 + H
2O
Загревање на метаборна киселина над околу 180 °C елиминира друга молекула на вода која формира тетраборна киселина, исто така наречена пироборна киселина (H
2B
4O
7):[6][7]
- 4HBO
2 →H
2B
4O
7 +H
2O
Дополнително загревање (до околу 530 °C) доведува до бор триоксид:[6][7][8]
- H
2B
4O
7 → 2 B
2O
3 + H
2O
Воден раствор[уреди | уреди извор]
Кога ортоборната киселина се раствора во вода, таа делумно се дисоцира и дава метаборна киселина:
- B(OH)
3 ⇌ HBO
2 + H
2O
Растворот е благо кисел поради јонизација на киселините:
- B(OH)
3 + H
2O ⇌ [BO(OH)
2]−
+ H
3O+ - HBO
2 + H
2O ⇌ [BO
2]−
+ H
3O+
Сепак, Рамановата спектроскопијата на силно алкални раствори покажала присуство на <span data-cx="[{"adapted":true,"partial":false,"targetExists":true,"mandatoryTargetParams":[],"optionalTargetParams":[]}]" data-mw="{"parts":[{"template":{"target":{"wt":"Хем2","href":"./Предлошка:Хем2"},"params":{"1":{"wt":"[B(OH)4]−"}},"i":0}}]}" data-ve-no-generated-contents="true" id="mw5Q" typeof="mw:Transclusion"> </span> јони,[9] и наведува некои да заклучат дека киселоста се должи исклучиво на апстракцијата на OH−
од вода:[9]
- B(OH)
3 + HO−
⇌ B(OH)−
4
Еквивалентно,
- B(OH)
3 + H
2O ⇌ B(OH)−
4 + H+ (K = 7.3×10−10; pK = 9.14)
Или, поточно,
- B(OH)
3 + 2 H
2O ⇌ B(OH)−
4 + H
3O+
Оваа реакција се јавува во два чекори, со неутрален комплекс акватрихидроксибор B(OH)
3(OH
2) како посредник:[10]
- B(OH)
3 + H
2O → B(OH)
3(OH
2) - B(OH)
3(OH
2) + H
2O + HO−
→ [B(OH)
4]−
+ H
3O+
Оваа реакција може да се одликува како Луисова киселост на бор кон [HO]−
, наместо како бренстедова киселост.[11][12][13] Сепак, дел од неговото однесување кон некои хемиски реакции сугерираат дека тоа е трибазна киселина и во бронстовска смисла.
Борна киселина, измешана со борат Na
2B
4O
7 · 10H2O (поправилно Na
2B
4O
5(OH)
4 · 8H2O ) во тежински сооднос од 4:5, е многу растворлива во вода, иако тие не се толку растворливи одделно.[14]
Раствор на сулфурна киселина[уреди | уреди извор]
Борна киселина исто така се раствора во безводна сулфурна киселина според равенката [4]
- B(OH)
3 + 6 H
2SO
4 → [B(SO
4H)
4]−
+ 2 [HSO
4]−
+ 3 H
3O+
Естерификација[уреди | уреди извор]
Борна киселина реагира со алкохоли за да формира боратни естри, B(OR)
3 каде што R е алкил или арил. Реакцијата обично е поттикната од средство за дехидрација, како што е концентрирана сулфурна киселина:[15]
- B(OH)
3 + 3 ROH → B(OR)
3 + 3 H
2O
Со вицинални диоли[уреди | уреди извор]
Киселоста на растворите на борна киселина е значително зголемена во присуство на цис - вицинални диоли (органски соединенија кои содржат слично ориентирани хидроксилни групи во соседните јаглеродни атоми,(R
1,R
2)=C(OH)–C(OH)=(R
3,R
4) ) како што се глицерол и манитол.[4][16]
Тетрахидроксиборатниот анјон формиран при растворање спонтано реагира со овие диоли за да формира релативно стабилни анјонски естри кои содржат еден или два петчлени–B–O–C–C–O– прстени. На пример, реакцијата со манитол H(HCOH)
6H, чии два средни хидроксили се во cis ориентација, може да се запише како
- B(OH)
3 + H
2O ⇌ [B(OH)
4]−
+ H+ - [B(OH)
4]−
+ H(HCOH)
6H ⇌ [B(OH)
2(H(HCOH)
2(HCO–)
2(HCOH)
2H)]−
+ 2 H
2O - [B(OH)
2(H(HCOH)
2(HCO–)
2(HCOH)
2H)]−
+ H(HCOH)
6H ⇌ [B(H(HCOH)
2(HCO–)
2(HCOH)
2H)
2]−
+ 2 H
2O
Давање на целокупната реакција
- B(OH)
3 + 2 H(HCOH)
6H ⇌ [B(H(HCOH)
2(HCO–)
2(HCOH)
2H)
2]−
+ 3 H
2O + H+
Стабилноста на овие естерски анјони на манитоборат ја поместува рамнотежата на десната страна и на тој начин ја зголемува киселоста на растворот за 5 реда на големина во споредба со онаа на чист борен оксид, намалувајќи го p K a од 9 на под 4 за доволна концентрација на манитол.[4][16] Добиениот раствор е наречен манитоборна киселина.
Додавањето на манитол во првично неутрален раствор кој содржи борна киселина или едноставни борати ја намалува неговата pH доволно за да може да се титрира со силна база како NaOH, вклучително и со автоматизиран потенциометриски титратор. Ова својство се користи во аналитичката хемија за да се одреди содржината на борати во водените раствори, на пример за следење на исцрпувањето на борната киселина од неутроните во водата од примарното коло на реакторот светлина-вода кога соединението се додава како неутронски отров за време на полнење гориво. операции.[4]
Токсикологија[уреди | уреди извор]
Врз основа на рејтингот на средна смртоносна доза кај цицачите (LD 50) од 2.660 mg/kg телесна маса, борната киселина е отровна само ако се зема внатрешно или се вдишува во големи количини. Четиринаесеттото издание на Мерк индексот покажува дека LD 50 на борната киселина е 5,14 g/kg за орални дози дадени на стаорци, и тоа од 5 до 20 g/kg предизвика смрт кај возрасни луѓе. За 70 кг возрасен, на долната граница од 5 g, 350 g може да предизвика смрт кај луѓето. За споредба, LD 50 на солта е пријавена дека е 3,75 g/kg кај стаорци според Мерковиот индекс. Според Агенцијата за токсични материи и регистар на болести, „Минималната смртоносна доза на проголтан бор (како борна киселина) беше пријавена дека е 2–3 g кај доенчиња, 5-6 g кај деца и 15-20 g кај возрасни. [. . . ] Сепак, преглед на 784 човечки труења со борна киселина (10-88 g) не објави смртни случаи, при што 88% од случаите се асимптоматски.“ [17]
Долготрајната изложеност на борна киселина може да биде позагрижувачка, предизвикувајќи оштетување на бубрезите и евентуално откажување на бубрезите (видете ги врските подолу). Иако се чини дека не е канцероген, студиите кај кучиња пријавиле атрофија на тестисите по изложување на 32 mg/kg телесна тежина/ден во тек на 90 дена. Ова ниво, кога би било применливо за луѓе во иста доза, би било еднакво на кумулативна доза од 202 g во текот на 90 дена за 70 kg возрасен, не многу понизок од горенаведениот LD50 .[18]
Според извештајот на CLH за борна киселина објавен од Бирото за хемиски супстанции во Лоѓ, Полска, борната киселина во високи дози покажува значителна развојна токсичност и тератогеност кај фетусите на зајаци, стаорци и глувци, како и кардиоваскуларни дефекти, скелетни варијации и благи бубрези лезии.[19] Како последица на 30-тата АТП на директивата на ЕУ 67/548/ЕЕЗ од август 2008 година, Европската комисија одлучила да ја измени својата класификација како репротоксична категорија 2 и да ги примени фразите за ризик R60 (може да ја наруши плодноста) и R61 (може да предизвика штета на нероденото дете).[20][21][22][23]
На состанокот на Европската асоцијација за производство на дијагностика (EDMA) во 2010 година, биле дискутирани неколку нови дополнувања на списокот на кандидати за Супстанција со многу висока загриженост (SVHC) во однос на Регулативата за регистрација, евалуација, овластување и ограничување на хемикалиите од 2007 година (REACH). По регистрацијата и прегледот завршени како дел од REACH, класификацијата на борна киселина CAS 10043-35-3 / 11113-50-1 е наведена од 1 декември 2010 година е H360FD (може да ја оштети плодноста. Може да го оштети нероденото дете.) [24][25]
Употреба[уреди | уреди извор]
Индустрија[уреди | уреди извор]
Примарната индустриска употреба на борната киселина е во производството на монофиламентни фиберглас кои обично се нарекува текстилен фиберглас. Текстилниот фиберглас се користи за зајакнување на пластиката во апликации кои се движат од чамци, до индустриски цевки до компјутерски кола.[26]
Во индустријата за накит, борната киселина често се користи во комбинација со денатуриран алкохол за да се намали површинската оксидација и на тој начин формирање на огнот на металите за време на операциите на жарење и лемење.
Борната киселина се користи во производството на стакло во LCD рамни екрани.
Во галванизацијата, борната киселина се користи како дел од некои сопственички формули. Една таква позната формула бара околу 1 до 10 однос на H3BO3 до <span about="#mwt419" class="chemf nowrap" data-cx="[{"adapted":true,"partial":false,"targetExists":true,"mandatoryTargetParams":[],"optionalTargetParams":[]}]" data-mw="{"parts":[{"template":{"target":{"wt":"Хем","href":"./Предлошка:Хем"},"params":{"1":{"wt":"NiSO"},"2":{"wt":"4"}},"i":0}}]}" data-ve-no-generated-contents="true" id="mwAfw" typeof="mw:Transclusion">NiSO<span style="display:inline-block;margin-bottom:-0.3em;vertical-align:-0.4em;line-height:1em;font-size:80%;text-align:left"><br><br><br><br></span></span>, многу мал дел од натриум лаурил сулфат и мал дел од H2SO4.
Растворот на ортоборна киселина и борат во сооднос 4:5 се користи како средство за забавување на пожарот на дрво со импрегнација.[27]
Исто така се користи во производството на забивачка маса, фин прав што содржи силициум диоксид кој се користи за производство на облоги на индукционите печки и керамика.
Борна киселина се додава во борат за употреба како флукс за заварување од страна на ковачите.[28]
Борна киселина, во комбинација со поливинил алкохол (PVA) или силиконско масло, се користи за производство на Silly Putty.[29]
Борна киселина е присутна и во списокот на хемиски адитиви кои се користат за хидраулично фрактурирање (фрактура).[30] Често се користи заедно со гуарната гума како средство за вкрстено поврзување и желатинирање за контролирање на вискозноста и реологијата на течноста за фракинг инјектирана под висок притисок во бунарот. Важно е да се контролира вискозноста на течноста за да се држат во суспензија на долги транспортни растојанија зрната на средствата за потпора насочени кон одржување на пукнатините во шкрилците доволно отворени за да се олесни извлекувањето на гасот откако ќе се намали хидрауличниот притисок.[31][32][33] Реолошките својства на хидрогелот со вкрстено поврзана гуарска гума со бора главно зависат од pH вредноста.[34]
Боринската киселина се користи во некои електрични осигурувачи од типот на исфрлање како средство за дејонизација/гаснење.[35] За време на електричен дефект во осигурувачот од типот на исфрлање, се создава плазма лак со распаѓање и брзо раздвојување со пружина на топливиот елемент, што е типично специјализирана метална прачка која минува низ компримирана маса на борна киселина во склопот на осигурувачите. Високотемпературната плазма предизвикува борната киселина брзо да се распаѓа на водена пареа и борен анхидрид, а производите на испарување пак ја дејонизираат плазмата, помагајќи да се прекине електричната грешка.[36]
Медицина[уреди | уреди извор]
Боринската киселина може да се користи како антисептик за помали изгореници или исекотини и понекогаш се користи во салфетки и облоги, како што е борната влакненца. Борна киселина се нанесува во многу разреден раствор како миење очи. Разредената борна киселина може да се користи како вагинален туш за лекување на бактериска вагиноза поради прекумерна алкалност,[37] како и кандидијаза поради не-албиканска кандида.[38] Борната киселина во голема мера ги поштедува лактобацилите во вагината.[39] Како TOL-463, тој е во развој како интравагинален лек за третман на бактериска вагиноза и вулвовагинална кандидијаза.[40][41][42] Како антибактериско соединение, борната киселина може да се користи и како третман на акни. Се користи и како превенција од спортско стапало, со ставање пудра во чорапите. Различни препарати може да се користат за лекување на некои видови на otitis externa (инфекција на увото) и кај луѓето и кај животните.[43] Конзервансот во шишињата со примероци од урина во Обединетото Кралство е борна киселина.[44]
Растворите на борна киселина што се користат како миење очи или на абрадирана кожа се познати како токсични, особено за доенчињата, особено по повторна употреба; ова е поради неговата бавна стапка на елиминација.[45]
Борната киселина е една од најчесто користените супстанции што може да се спротивстави на штетните ефекти на реактивната флуороводородна киселина (HF) по случаен контакт со кожата. Работи со присилување на слободното F−
анјони во инертниот тетрафлуороборат анјон. Овој процес ја победува екстремната токсичност на флуороводородната киселина, особено нејзината способност да издвојува јонски калциум од крвниот серум што може да доведе до срцев удар и распаѓање на коските; таков настан може да се случи од само мал контакт со кожата со СС.[46]
Инсектициди[уреди | уреди извор]
Боринската киселина за прв пат била регистрирана во САД како инсектицид во 1948 година за контрола на лебарки, термити, огнени мравки, болви, сребрени риби и многу други инсекти. Производот генерално се смета за безбеден за употреба во кујните за домаќинство за контрола на лебарки и мравки. Дејствува како стомачен отров што влијае на метаболизмот на инсектите, а сувиот прав е абразивен за егзоскелетите на инсектите.[47][48][49] Боринската киселина, исто така, има репутација како „подарок кој продолжува да убива“ со тоа што бубашвабите кои поминуваат низ областите со лесно прашина не умираат веднаш, туку дека ефектот е како парчиња стакло што ги сечат. Ова често му дозволува да се врати во гнездото каде што наскоро умира. Лебарките, бидејќи се канибалисти, јадат други убиени со контакт или консумирање на борна киселина, консумирајќи го прашокот заробен во мртвата лебарк и убивајќи ги исто така.
Зачувување[уреди | уреди извор]
Во комбинација со неговата употреба како инсектицид, борната киселина го спречува и уништува постоечкото влажно и суво гниење на дрвата. Може да се користи во комбинација со носач на етилен гликол за третирање на надворешното дрво против напад на габи и инсекти. Можно е да се купат шипки импрегнирани со борати за вметнување во дрво преку дупки за дупчење каде што се знае дека влагата и влагата се собираат и седат. Достапен е во форма на гел и форма на паста за инјектирање за третирање на дрво погодено од гниење без потреба од замена на дрвото. Концентратите на третмани базирани на борати може да се користат за да се спречи растот на лигите, мицелиумот и алгите, дури и во морските средини.
Борната киселина се додава во солта за лекување на говеда, теле и овчи кожи. Ова помага да се контролира развојот на бактериите и помага да се контролираат инсектите.
pH пуфер[уреди | уреди извор]


Борната киселина во рамнотежа со својата конјугирана база широко се користи борат јонот (во опсегот на концентрација 50-100 ppm еквиваленти на бор) како примарен или дополнителен pH пуфер систем во базените. Борната киселина е слаба киселина, со p Ka (pH во која пуферирањето е најсилно бидејќи слободната киселина и борат јон се во еднакви концентрации) од 9,24 во чиста вода на 25 °C. Но, очигледниот p Ka е значително a во водите на базените или океаните поради интеракциите со разни други молекули во растворот. Ќе биде околу 9,0 во базен со солена вода. Без разлика која форма на растворлив бор е додадена, во рамките на прифатливиот опсег на pH и концентрација на бор за базени, борната киселина е доминантна форма во воден раствор, како што е прикажано на придружната слика. Системот борна киселина-борат може да биде корисен како примарен тампон систем (замена за бикарбонатниот систем со p Ka a1 = 6,0 и p K a2 = 9,4 при типични услови на базен со солена вода) во базени со генератори на хлор со солена вода кои имаат тенденција да покажат нагорно поместување на pH од работен опсег од pH 7,5–8,2. Капацитетот на пуферот е поголем против зголемувањето на pH (кон pKa околу 9,0), како што е илустрирано на придружниот график. Употребата на борна киселина во овој опсег на концентрации не дозволува какво било намалување на концентрацијата на слободната HOCl потребна за санитација на базенот, но може малку да додаде на фото-заштитните ефекти на цијануричната киселина и да даде други придобивки преку антикорозивна активност или согледана мекост на водата., во зависност од целокупниот состав на растворената супстанца во базенот.[50]
Лубрикант[уреди | уреди извор]
Колоидните суспензии на наночестички борна киселина растворени во нафта или растително масло можат да формираат извонреден лубрикант на керамички или метални површини [51] со коефициент на триење на лизгање што се намалува со зголемување на притисокот до вредност во опсег од 0,10 до 0,02. B(OH)
3 произлегуваат од спонтана хемиска реакција помеѓу молекулите на водата и B
2O
3 во влажна средина. Во рефус, постои инверзна врска помеѓу коефициентот на триење и херциовиот контактен притисок предизвикан од применетото оптоварување.
Борната киселина се користи за подмачкување на таблите од каром и новоус, што овозможува побрза игра.[52]
Јадрена енергија[уреди | уреди извор]
Боринската киселина се користи во некои атомски централи како неутронски отров. Борот во борната киселина ја намалува веројатноста за топлинско цепење со апсорпција на некои термички неутрони. Синџирните реакции на цепење генерално се водени од веројатноста слободните неутрони да резултираат со цепење и се одредуваат од материјалните и геометриските својства на реакторот. Природниот бор се состои од приближно 20% изотопи бор-10 и 80% бор-11. Борот-10 има висок пресек за апсорпција на нискоенергетски (термички) неутрони. Со зголемување на концентрацијата на борна киселина во течноста за ладење на реакторот, веројатноста дека неутронот ќе предизвика цепење се намалува. Промените во концентрацијата на борната киселина можат ефикасно да ја регулираат стапката на цепење што се случува во реакторот. Борна киселина се користи само во реактори за вода под притисок (PWR), додека реакторите за врела вода (BWR) користат шема на контролна шипка и проток на течноста за ладење за контрола на моќноста. BWR користат воден раствор на борна киселина и борат или натриум пентаборат за систем за итно исклучување. Борна киселина може да се раствори во базени за потрошено гориво што се користат за складирање на елементите на потрошеното гориво . Концентрацијата е доволно висока за да се одржи множењето на неутроните на минимум. Борна киселина била фрлена над реакторот 4 на атомската централа Чернобил по неговото топење за да се спречи појава на друга реакција.
Пиротехника[уреди | уреди извор]
Борот се користи во пиротехниката за да се спречи реакцијата на формирање на амид помеѓу алуминиум и нитрати. Мала количина на борна киселина се додава во составот за да се неутрализираат алкалните амиди кои можат да реагираат со алуминиумот.
Боринската киселина може да се користи како боја за да се направи огнот зелен. На пример, кога се раствора во метанол, популарно се користи од жонглери и огнени вртења за да се создаде длабок зелен пламен многу посилен од бакар сулфат.[53]
Земјоделство[уреди | уреди извор]
Борна киселина се користи за лекување или спречување на недостаток на бор во растенијата. Се користи и за зачувување на житарки како ориз и пченица.[54]
Понатамошно читање[уреди | уреди извор]
- Jolly, W. L. (1991). Modern Inorganic Chemistry (2. изд.). New York: McGraw-Hill. ISBN 978-0-07-112651-9.
- Goodman, L.; Gilman, A.; Brunton, L.; Lazo, J.; Parker, K. (2006). Goodman & Gilman's The Pharmacological Basis of Therapeutics. New York: McGraw Hill.
- Cordia JA, Bal EA, Mak WA and Wils ERJ (2003), Determination of some physico-chemical properties of Optibor EP. Rijswijk, The Netherlands: TNO Prins Maurits Laboratory, report PML 2002-C42rr, GLP, Unpublished, confidential data provided by Bor ax Europe Limited
Наводи[уреди | уреди извор]
- ↑ Ronald Eisler (2007). Eisler's Encyclopedia of Environmentally Hazardous Priority Chemicals. Elsevier. стр. 59. ISBN 9780080547077.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. изд.). Butterworth-Heinemann. стр. 1291. ISBN 0080379419.
- ↑ Andrei Rotaru (2017): "Thermal and kinetic study of hexagonal boric acid versus triclinic boric acid in air flow." Journal of Thermal Analysis and Calorimetry, volume 127, pages 755–763. doi:10.1007/s10973-016-5583-7
- ↑ 4,0 4,1 4,2 4,3 4,4 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. изд.). Butterworth-Heinemann. ISBN 0080379419.
- ↑ Housecroft, C. E.; Sharpe, A. G. (2008). „Chapter 13: The Group 13 Elements“. Inorganic Chemistry (3rd. изд.). Pearson. стр. 340. ISBN 978-0-13-175553-6.
- ↑ 6,0 6,1 6,2 Gurwinder Kaur, Shagun Kainth, Rohit Kumar, Piyush Sharma and O. P. Pandey (2021): "Reaction kinetics during non-isothermal solid-state synthesis of boron trioxide via boric acid dehydration." Reaction Kinetics, Mechanisms and Catalysis, volume 134, pages 347–359. doi:10.1007/s11144-021-02084-8
- ↑ 7,0 7,1 7,2 Siavash Aghili, Masoud Panjepour, and Mahmood Meratian (2018): "Kinetic analysis of formation of boron trioxide from thermal decomposition of boric acid under non-isothermal conditions." Journal of Thermal Analysis and Calorimetry, volume 131, pages 2443–2455. doi:10.1007/s10973-017-6740-3
- ↑ Balci, Suna; Sezgi, Naime; Eren, Esin (2012). „Boron Oxide Production Kinetics Using Boric Acid as Raw Material“. Industrial & Engineering Chemistry Research. 51 (34): 11091–11096. doi:10.1021/ie300685x.
- ↑ 9,0 9,1 Jolly, W. L. (1984). Modern Inorganic Chemistry. McGraw-Hill. стр. 198.
- ↑ Masanori Tachikawa (2004): "A density functional study on hydrated clusters of orthoboric acid, B(OH)3(H2O)n (n=1–5)". Journal of Molecular Structure: THEOCHEM, volume 710, issues 1–3, pages 139-150. doi:10.1016/j.theochem.2004.09.008
- ↑ Housecroft, C.E.; Sharpe, A.G. (2005). Inorganic Chemistry (2. изд.). Pearson Prentice-Hall. стр. 314–5.
- ↑ MHE. Comprehensive Chemistry for JEE Advanced 2014. Tata McGraw-Hill Education. стр. 15.5. ISBN 9781259064265 – преку Google Books.
- ↑ Darpan, Pratiyogita (1 May 2000). Competition Science Vision. Pratiyogita Darpan – преку Internet Archive.
- ↑ Tsuyumoto, I.; Oshio, T.; Katayama, K. (2007). „Preparation of highly concentrated aqueous solution of sodium borate“. Inorganic Chemistry Communications. 10 (1): 20–22. doi:10.1016/j.inoche.2006.08.019.
- ↑ Brown, Herbert C.; Mead, Edward J.; Shoaf, Charles J. (1956). „Convenient procedures for the preparation of alkyl borate esters“. J. Am. Chem. Soc. 78 (15): 3613–3614. doi:10.1021/ja01596a015.
- ↑ 16,0 16,1 NIST Special Publication. U.S. Government Printing Office. 1969.
- ↑ HHS, Public Health Service, Agency for Toxic Substances and Disease Registry (November 2010), Toxicological Profile for Boron (PDF), стр. 11CS1-одржување: користи параметар authors (link)
- ↑ Office of Prevention, Pesticides and Toxic Substances (2006). „Report of the Food Quality Protection Act (FQPA) Tolerance Reassessment Eligibility Decision (TRED) for Boric Acid/Sodium Borate Salts“ (PDF). United States Environmental Protection Agency. Архивирано од изворникот (PDF) на 2006-10-06. Посетено на 2008-04-21. Наводот journal бара
|journal=(help) - ↑ „CLH report for boric acid – Proposal for Harmonised Classification and Labelling“. Bureau for Chemical Substances. 23 April 2018. Посетено на 18 October 2018.
- ↑ „Boric acid, ACC# 03260 MSDS“ (PDF). 11 February 2008. Архивирано од изворникот (PDF) на 16 December 2011. Посетено на 2009-09-24.
- ↑ Ishii, Y.; Fujizuka, N.; Takahashi, T.; и др. (1993). „A fatal case of acute boric acid poisoning“. Clinical Toxicology. 31 (2): 345–352. doi:10.3109/15563659309000402. PMID 8492348.
- ↑ Restuccio, A.; Mortensen, M. E.; Kelley, M. T. (1992). „Fatal ingestion of boric acid in an adult“. American Journal of Emergency Medicine. 10 (6): 545–547. doi:10.1016/0735-6757(92)90180-6. PMID 1388380.
- ↑ NSW Food Authority. „Borax and boric acid“. Australia: New South Wales Government. Архивирано од изворникот на 15 October 2009. Посетено на 2009-09-24.
- ↑ „Boric acid as a substance of very high concern because of its CMR properties“ (PDF). ECHA Document library. Архивирано од изворникот (PDF) на 2016-05-18. Посетено на 2023-02-25.
- ↑ Regulation (EC) No 1272/2008 of the European Parliament and of the Council, 16 December 2008
- ↑ Kistler, R. B.; Helvaci, C. (1994). „Boron and Borates“. Во Carr, D. D. (уред.). Industrial Minerals and Rocks (6. изд.). Littleton, CO: SME. стр. 171–186.
- ↑ Tsuyumoto, I.; Oshio, T. (2009). „Development of fire resistant laminated wood using concentrated sodium polyborate aqueous solution“. Journal of Wood Chemistry and Technology. 29 (4): 277–285. doi:10.1080/02773810903033721.
- ↑ Dempsey, Jock (2009) [1998]. „Borax“. Dempsey's Forge. Посетено на 2010-07-23.
- ↑ Prager, Felice. „Science Becomes a Toy – Silly Putty“. Loti.com. Rewind the Fifites. Архивирано од изворникот на 2013-05-12. Посетено на 2013-06-07.
- ↑ „Chemicals used by hydraulic fracturing companies in pennsylvania for surface and hydraulic fracturing activities“ (PDF). Pennsylvania Department of Environmental Protection, Bureau of Oil and Gas Management. 30 June 2010.
- ↑ Fink, Johannes (2015). „Fracturing fluids“. Petroleum Engineer's Guide to Oil Field Chemicals and Fluids. стр. 567–651. doi:10.1016/B978-0-12-803734-8.00017-5. ISBN 9780128037348.
- ↑ Bishop, Maximilienne; Shahid, Naureen; Yang, Jianzhong; Barron, Andrew R. (2004). „Determination of the mode and efficacy of the cross-linking of guar by borate using MAS11B NMR of borate cross-linked guar in combination with solution11B NMR of model systems“. Dalton Trans. (17): 2621–2634. doi:10.1039/B406952H. ISSN 1477-9226. PMID 15514744.
- ↑ „European Patent EP3004279A1. Concentrated borate crosslinking solutions for use in hydraulic fracturing operations“. European Patent Office. Посетено на 27 October 2019.
- ↑ Wang, Shibin; Tang, Hongbiao; Guo, Jianchun; Wang, Kunjie (2016). „Effect of pH on the rheological properties of borate crosslinked hydroxypropyl guar gum hydrogel and hydroxypropyl guar gum“. Carbohydrate Polymers. 147: 455–463. doi:10.1016/j.carbpol.2016.04.029. ISSN 0144-8617. PMID 27178952.
- ↑ Electrical Sector Solutions Product Overview (PDF). 14: Fuses. Eaton Corporation. 2011.
- ↑ Strom, A. P.; Rawlins, H. L. (December 1932). „The Boric Acid Fuse“. Transactions of the American Institute of Electrical Engineers. 51 (4): 1020–1025. doi:10.1109/T-AIEE.1932.5056215. ISSN 0096-3860.
- ↑ Abercrombie, P. (2010). „Vaginitis“. Во Maizes, V.; Low Dog, T. (уред.). Integrative Women's Health. New York, NY: Oxford University Press. стр. 192. ISBN 978-0-19-537881-8.
- ↑ „Boric acid for recurrent vulvovaginal candidiasis: the clinical evidence“. J Womens Health (Larchmt). 20 (8): 1245–55. August 2011. doi:10.1089/jwh.2010.2708. PMID 21774671.
- ↑ „Current and emerging pharmacotherapy for recurrent bacterial vaginosis“. Expert Opin Pharmacother. 22 (12): 1593–1600. August 2021. doi:10.1080/14656566.2021.1904890. PMID 33750246 Проверете ја вредноста
|pmid=(help). - ↑ „TOL 463 – AdisInsight“.
- ↑ „Vulvovaginal Candidiasis: A Review of the Evidence for the 2021 Centers for Disease Control and Prevention of Sexually Transmitted Infections Treatment Guidelines“. Clin Infect Dis. 74 (Suppl_2): S162–S168. April 2022. doi:10.1093/cid/ciab1057. PMID 35416967 Проверете ја вредноста
|pmid=(help). - ↑ „Safety and Efficacy of a Novel Vaginal Anti-infective, TOL-463, in the Treatment of Bacterial Vaginosis and Vulvovaginal Candidiasis: A Randomized, Single-blind, Phase 2, Controlled Trial“. Clin Infect Dis. 68 (5): 803–809. February 2019. doi:10.1093/cid/ciy554. PMC 6376090. PMID 30184181.
- ↑ Adriztina, I.; Adenin, L. I.; Lubis, Y. M. (January 2018). „Efficacy of Boric Acid as a Treatment of Choice for Chronic Suppurative Otitis Media and Its Ototoxicity“. Korean J Fam Med. 39 (1): 2–9. doi:10.4082/kjfm.2018.39.1.2. PMC 5788841. PMID 29383205.
- ↑ UK standards for microbiology investigations (PDF). Public Health England. 2017-08-07.
- ↑ Harvey, S. C. (1980). „Antiseptics and Disinfectants; Fungicides; Ectoparasiticides“. Во Gilman, A. G.; Goodman, L. S.; Gilman, A. (уред.). Goodman & Gillman's The Pharmacological Basis of Therapeutics (6. изд.). стр. 971. ISBN 978-0-02-344720-4.
- ↑ „Method 3052 microwave assisted acid digestion of siliceous and organically based matrices“ (PDF). US EPA. 2015-06-22.
- ↑ „Borates in Pesticides | AMERICAN BORATE COMPANY“.
- ↑ Boone, C.; Bond, C.; Stone, D. (2012). „Boric Acid General Fact Sheet“. National Pesticide Information Center, Oregon State University Extension Services.CS1-одржување: користи параметар authors (link)
- ↑ „R.E.D. Facts – Boric Acid“ (PDF). United States Environmental Protection Agency. Архивирано од изворникот (PDF) на 23 December 2021. Посетено на 2 April 2022.
- ↑ Birch, Robert G (2013). „Boric acid as a swimming pool buffer“ (PDF). The University of Queensland. Посетено на 30 November 2013.
- ↑ Düzcükoğlu, H.; Acaroğlu, M. (2009). „Lubrication Properties of Vegetable Oils Combined with Boric Acid and Determination of Their Effects on Wear“. Energy Sources, Part A: Recovery, Utilization, and Environmental Effects. 32 (3): 275–285. doi:10.1080/15567030802606053.
- ↑ Singh, Harpreet. „Standard equipments“. Punjab State Carrom Association. Архивирано од изворникот на 2007-03-14. Посетено на 2009-09-24.
- ↑ Weingart, George (1947). Pyrotechnics. Chemical Publishing Company. ISBN 978-0820601120.
- ↑ „Use of Boric Acid and Borax in Food“. cfs.gov.hk. Посетено на 2019-05-22.
Надворешни врски[уреди | уреди извор]
 Борна киселина на Ризницата ?
Борна киселина на Ризницата ?- Boric Acid Technical Fact Sheet – National Pesticide Information Center
- Boric Acid General Fact Sheet – National Pesticide Information Center
- International Chemical Safety Card 0991
- US EPA Pesticide Reregistration Eligibility Decision
- National Pollutant Inventory – Boron and compounds
- Boric acid at ChemicalLand21
- European Chemicals Agency (ECHA)"New Public Consultation on Eight Potential Substances of Very High Concern" – includes Boric Acid. Closes 22 April 2010
- ChemSub Online: Boric acid
| ||||||||||||||||||||||||||||||
| ||||||||||||||



