Хемиска реакција


Хемиска реакција — процес во кој едни хемиски соединенија се претвораат во други,[1] односно процес во кој доаѓа до изменување на составот на определена супстаницја.[2] Во реакција можат да стапат и хемиски елементи. Хемиските реакции обично вклучуваат промени во хемиските врски во молекулите или кристалите. За време на една хемиска реакција се менуваат својствата на производите (производи) добиени од таа реакција во однос на реактантите кои влегувале во реакцијата. Реактантите и производите се учесниците во хемиската реакција. За хемиски реакции не се сметаат физичките процеси при кои доаѓа до промена само на физичката состојба, како на пример топење или испарување, дифузија, мешање на чисти супстанци и смеси во јадрените реакции, при кои елементите се трансформираат едни во други.
При секоја хемиска реакција, количеството на некоја супстанција (или на неколку супстанции) се намалува, а количеството на друга супстанција (или супстанции) се зголемува. Притоа, ако се намалува количеството само на една супстанција, таа се нарекува реактант, а ако пак тоа се случува со повеќе супстанции, тогаш во реакцијата посотјат повеќе реактанти. Слично, ако во реакцијата се зголемува количеството само на една супстанција, таа се нарекува продукт на реакцијата, а ако се зголемуваат количествата на неколку супстанции, тогаш постојат повеќе продукти на реакцијата. Кога ќе престане изменувањето на количествата на учесниците во реакцијата, тоа го означува крајот на хемиската реакција.[3]
Обично реакциите се состојат од многу сложена последователност на поединечни чекори, т.н. елементарни реакции, кои сите заедно ја образуваат целосната реакција. Информациите за целосната последователност на чекорите го чинат механизмот на реакцијата. За опишување на хемиските реакции се користи хемиска равенка при што реактантите, производите и понекогаш важните меѓупроизводи се претставуваат графички и се поврзуваат со реакциона стрелка.
Елементарните реакции и механизмите на реакцијата можат да се поделат на различни групи. Елементарните реакции го опишуваат распадот на една молекула на две или обратно, синтеза на два атома или молекули во едно. Механизмите на реакција обично се делат според типот на промената на супстанците кои стапуваат во реакција. Ако се менува оксидациониот број, тогаш зборуваме за оксидација и редукција.
Степенот до кој се одвива дадена реакција меѓу два или повеќе учесници зависи од тоа колку е голема разликата меѓу енталпијата и ентропијата кои ја сочинуваат Гибсовата слободна енергија на реактантите и производите. При негативни вредности, реакционата рамнотежа лежи на страната на производите.
Историја
[уреди | уреди извор]
Хемиските реакции како согорувањето во оган, ферментацијата и редукцијата на рудите до метали биле познати уште од древноста. Првичните теории за претворањето на материите биле развиени од страна на грчките филозофи, на пример, теоријата на четири елементи на Емпедокле, која вели дека секоја супстанца е составена од четирите основни елементи - оган, вода, воздух и земја. Во средниот век, хемиските претворања биле проучувани во рамките на алхемијата. Притоа, алхемичарите се обидувале да го претворат оловото во злато, за што користеле реакции на оловото и оловно-цинкови легури со сулфур.[4]
Производството на хемиски супстанци кои најчесто се среќаваат во природата се пробувало уште одамна, како синтезата на сулфурна и азотна киселина, процес кој му се припишувал на контроверзниот алхемичар Џабир ибн Хајан. Процесот вклучувал загревање на сулфатни и нитратни минерали од типот на бакар сулфат, стипса и шалитра. Во 17-от век, Јохан Рудолф Глаубер произвел хлороводородна киселина и натриум сулфат со реагирање на сулфурна киселина и натриум хлорид. Со развитокот на одредени техники во 1746 година што дозволуваат производство на големи количини сулфурна киселина и натриум карбонат, хемиските реакции се имплементирале во индустријата. Натамошната оптимизација на технологијата за производство на сулфурна киселина резултирала во контактниот процес во 1880-тите години,[5] а Хаберовиот процес бил развиен во 1909–1910 за синтеза на амонијак.[6]
Од 16 век, истражувачите меѓу кои и Јан Батист ван Хелмонт, Роберт Бојл и Исак Њутн се обиделе да воспостават теории за експериментално набљудуваните хемиски претворања. Флогистонската теорија била предложена во 1667 од страна на Јохан Јоаким Бехер. Таа го постулирала постоењето на огненолик елемент наречен „флогистон“ кој се содржел во согорливите тела и се испуштал за време на согорувањето. Ова било побиено во 1785 година од страна на Антоан Лавоазје, кој го пронашол точното објаснување за согорувањето како реакција со кислородот од воздухот.[7]
Жозеф Луј Геј-Лисак забележал во 1808 година дека гасовите секогаш реагираат во одреден однос меѓусебно. Врз основа на оваа идеја и атомската теорија на Џон Далтон, Жозеф Пруст го развил законот за постојани односи на масите, кој потоа резултирал во концептите на стехиометријата и хемиските равенки.[8]
Што се однесува до органската хемија, долго време се верувало дека соединенијата добиени од живите организми биле премногу сложени за да се добијат по синтетички пат. Според концептот на витализмот, органската материја била под владение од „животна сила“ и се разликувала од неорганските материи. Меѓутоа, оваа поделба завршила со синтезата на уреа од неоргански претходници од страна на Фридрих Велер во 1828 година. Други хемичари кои придонеле во развитокот на органската хемија се Александар Вилијам Вилијамсон со неговата синтеза на етри и Кристофер Келк Инголд кој, меѓу останатите истражувачи, ги воспоставил механизмите на супституциските реакции.
Спонтано течење на хемиските реакции
[уреди | уреди извор]И кај хемиските реакции важат двата опши критериума за насоката на течењето на процесите: постигнување што е можно пониска енергија и што е можно поголем степен на неред. Така, до крајот ќе течат хемиските реакции во кои се ослободува големо количество енергија (егзотермни реакции) и кај нив крајната состојба (во кои постојат производи на реакцијата) е со значително помала енергија од почетната (кога биле присутни реактантите), така што во тој случај не е важно колкав е степенот на неред. Од друга страна, по престанувањето на животните процеси настануваат хемиски реакции на разградување на организмот во кои големите молекули се разложуваат на помали, со што од состојба на поголем ред се поминува во состојба на поголем неред. Според тоа, кај овие реакции преовладува ефектот на постигнување поголем степен на неред. Оттука, хемиските реакции течат во насока којашто претставува компромис меѓу тенденцијата за постигнувањето што е можно помала енергија и тенденцијата за постигнување што е можно поголем степен на неред.[9]
Равенки
[уреди | уреди извор]Хемиските равенки се користат за графичко илустрирање на хемиските реакции. Тие се состојат од хемиски или структурни формули на реактантите на левата и на производите на десната страна. Реактантите и производите се одделени со стрелка (→) која го означува правецот и типот на реакција. Врвот на стрелката е во насока на која се одвива реакцијата. Двојната стрелка (![]() ) која покажува кон спротивните насоки се користи кај рамнотежните реакции. Реакциите треба да се израмнети според стехиометријата, бројот на атоми на секој вид на супстанца треба да биде ист на двете страни од равенката. Ова се постигнува со подредување на бројот на инволвирани молекули (A, B, C и D во шематскиот пример подолу) со соодветните променливи a, b, c и d.[10][11]
) која покажува кон спротивните насоки се користи кај рамнотежните реакции. Реакциите треба да се израмнети според стехиометријата, бројот на атоми на секој вид на супстанца треба да биде ист на двете страни од равенката. Ова се постигнува со подредување на бројот на инволвирани молекули (A, B, C и D во шематскиот пример подолу) со соодветните променливи a, b, c и d.[10][11]
Посложените реакции се претставуваат со реакциски шеми, кои покрај почетните реактанти и производи, покажуваат појава на важни меѓупроизводи (интермедиери) или транзициски состојби. Исто така, некои релативно мали додатоци во реакцијата можат да се означат над реакционата стрелка; примери за вакви додатоци се вода, топлина, светлина, катализатор и сл. Слично, одредени (релативно) незначителни производи може да се напишат под стрелката, често со знак минус.
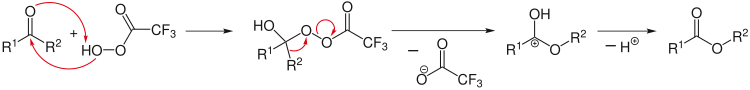
Ретросинтетичката анализа може да се користи за добивање на комплексна синтетичка реакција. Притоа, анализата започнува од производите, на пример, со разделување на одредени хемиски врски, за да се дојде до посакуваните првични реактанти. При овие реакции се користи посебна стрелка (⇒).[12]
Елементарни реакции
[уреди | уреди извор]Елементарната реакција е најмалиот дел до кој може да се разложи една хемиска реакција, при што отсуствуваат меѓупроизводи.[13] Повеќето реакции кои се експериментално набљудувани се состојат од мноштво на елементарни реакции кои се одвиваат паралелно или последователно. Дадена секвенца од поединечните елементарни реакции се нарекува реакциски механизам. Во елементарната реакција влегуваат неколку молекули, обично една до две, поради малата веројатност за тоа неколку молекули да се сретнат во одредено време.[14]

Најважните елементарни реакции се едномолекуларни и двомолекуларни. Во едномолекуларна (унимолекуларна) реакција влегува само една молекула; таа се претвора по пат на изомеризација или дисоцијација во една или две други молекули. За ваква реакција е потребна енергија во форма на топлина или светлина. Типичен пример за унимолекуларна реакција е цис-транс изомеризацијата, при која цис-формата на соединението се претвора во транс-формата и обратно.[15]
При една типична дисоцијациска реакција, една врска во молекулата се цепи, што дава две молекуларни фрагменти. Цепењето може да биде хомолитичко или хетеролитичко. Во првиот случај, врската се цепи така што секој производ задржува електрон и станува неутрален радикал. Во вториот случај, и двата електрони од хемиската врска остануваат со еден од производите, со што се добиваат наелектризирани јони. Дисоцијацијата има важна улога во поттикнување на верижни реакции, каква што е водород-кислород или реакциите на полимеризација.
- Дисоцијација на молекулата АВ на фрагменти А и В
За бимолекуларни реакции, две молекули се судруваат и реагираат една со друга. Нивното спојување се нарекува хемиска синтеза или реакција на адиција.
Освен ова, можно е само еден дел на молекулата да се пренесе на другата молекула. Овој тип на реакција се случува, на пример, при редокс и киселинско-базните реакции. Кај редокс реакциите, пренесената единка е електрон, додека кај киселинско-базните реакции е протон. Овој тип на реакција исто така се нарекува метатеза.
На пример:
Хемиска рамнотежа
[уреди | уреди извор]Повеќето хемиски реакции се повратни, односно тие можат да се одвиваат во две насоки (надесно и налево - обратно). Реакцијата насочена надесно и обратната на неа се натпреваруваат меѓусебе и се разликуваат по реакциските брзини. Овие брзини зависат од концентрацијата и затоа се менуваат со времето: обратната брзина постепено се зголемува и станува еднаква со брзината на реакцијата насочена надесно, со што се постигнува т.н. хемиска рамнотежа. Времето потребно да се дојде до рамнотежа зависи од такви параметри какви што се температурата, притисокот и учесниците во реакцијата, а се одредува по минималната слободна енергија. Во рамнотежа, Гибсовата слободна енергија мора да биде нула. Зависноста од притисокот може да се објасни со принципот на Ле Шателје. На пример, зголемувањето на притисокот како резултат на намалување на волуменот ја предизвикува реакцијата да се помести на страната со помалку молови гас.[16]
Добивката од реакцијата е стабилизирана при рамнотежа, но може да се зголеми со отстранување на производот од реакциската мешавина или со зголемување на температурата или притисокот. Промената во првичните концентрации на супстанците нема влијание на рамнотежата.
Термодинамика
[уреди | уреди извор]Хемиските реакции се одредени од законите на термодинамиката. Реакциите може да се одвиваат сами од себе ако се егзергонски, односно ако ослободуваат енергија. Слободната енергија на реакцијата се состои од две различни термодинамички квантитети - енталпија и ентропија:[17]
- G: слободна енергија, H: енталпија, T: температура, S: ентропија, Δ: разлика (промена настаната меѓу реактантот и производот)
Реакциите може да бидат егзотермни, каде ΔH е негативно и се ослободува енергија. Типични примери за егзотермни реакции се преципитацијата и кристализацијата, при кои подредените цврсти супстанци се добиваат од гасови или течности со неподредена структура. За споредба, за ендотермните реакции е потребна топлина од околината. Ова може да се постигне со зголемување на ентропијата на системот, и тоа најчесто преку образување на гасовити реакциски производи, кои имаат висока ентропија. Бидејќи ентропијата се зголемува со температурата, многу ендотермни реакции се одвиваат при високи температури. Сосема спротивно, многу егзотермни реакции (како кристализацијата) се одвиваат при ниски температури. Промените во температурата понекогаш можат да ја променат насоката на реакцијата, како што е при Бодуаровата реакција:
Оваа реакција меѓу јаглерод диоксидот и јаглеродот при што се добива јаглерод моноксид е ендотермна при температури над околу 800 °C и е егзотермна под оваа температура.[18]
Реакциите можат исто така да се одликуваат со внатрешната енергија која ги зема предвид промените во ентропијата, волуменот и хемискиот потенцијал. Последниот зависи, меѓу другото, од активитетите на супстанците кои влегуваат во реакцијата.[19]
- U: внатрешна енергија, S: ентропија, p: притисок, μ: хемиски потенцијал, n: број на молекули, d: знак за мала промена
Досег на хемиската реакција
[уреди | уреди извор]Досегот на хемиската реакција (ξ - кси) е величина која ни покажува до каде стигнала една хемиска реакција. Притоа, таа е секогаш подалеку кога повеќе реактанти (или поголем дел од реактант) се претвориле во производи, односно ако се образувале повеќе производи.
Математичкиот израз за досегот на хемиската реакција е:
- или
каде што:
- n(B)-n0(B) и Δn(B) - промена на количеството на учесникот B
- v(B) - стехиометриски коефициент на учесникот B.
Од горниот израз се гледа дека досегот на хемиската реакција е однос меѓу промената на количеството на супстанцијата на некој од учесниците во реакцијата (од отпочнувањето до даден момент) и стехиометрискиот коефициент на тој учесник во реакционата равенка.
При определувањето на досегот на хемиската реакција, стехиометриските коефициенти на реактантите се земаат со негативен предзнак, поради избегнувањето на ситуацијата ξ да е некогаш позитивна, а некогаш негативна величина.
Досегот на реакцијата се мери со истата единица како и количеството супстанција - мол.
Единичната промена на досегот на хемиската реакција, пак, ќе соодветствува на промената на количеството за даден учесник во реакцијата (реактант или производ) којашто е бројно еднаква со стехиометрискиот коефициент пред тој учесник во реакционата равенка запишана на определен начин.
Кинетика на хемиската реакција
[уреди | уреди извор]Основни поими во кинетиката на хемиската реакција се нејзината брзина, брзината на претворањето на учесниците и брзината на изменување на концентрацијата на даден учесник во рамките на таа реакција.
Брзина на претворањето и брзина на хемиската реакција
[уреди | уреди извор]Брзината на претворањето на учесниците во хемиската реакција (J) е однос на промената на досегот на реакцијата и времето што е потребно за да дојде до ваква промена:
каде
- Δξ - промена на досегот
- Δt - промена на времето.
Брзина на хемиската реакција е односот меѓу промената на досегот и волуменот помножен со промената на времето:
- од каде се добива дека
Брзината на реакцијата зависи од природата на супстанциите кои учествуваат во неа, како и од концентрацијата на учесниците, температурата на која се изведува и од присуството на катализатори.
Брзина на изменување на концентрацијата
[уреди | уреди извор]Промената на концентрацијата е мерка за изменувањето на досегот. Брзината на концентрацијата на учесникот во реакцијата или v(X) е однос меѓу промената на концентрацијата на учесникот X и времето кое е потребно за да дојде до таква промена на концентрацијата:
Во овој израз, позитивен предзнак се зема ако супстанцијата X е еден од производите од реакцијата, додека негативен - кога таа е реактант.
Ред на реакцијата
[уреди | уреди извор]Редот на реакцијата се определува само експериментално. Вкупниот ред на една хемиска реакција е збир од парцијалните редови на реакцијата. Тие покажуваат како влијае промената на брзината на концентрацијата на определен учесник во реакцијата врз брзината на самата хемиска реакција. Понекогаш се поклопуваат со стехиометриските коефициенти.
Молекуларност на реакцијата
[уреди | уреди извор]Тоа е број кој покажува колку честички учествуваат во елементарниот акт на хемиската трансформација.
Класификација на хемиските реакции
[уреди | уреди извор]Бројот на хемиските реакции е многу голем. Затоа, тие се класифицирани во две основни класи на реакции: повратни и неповратни хемиски реакции. Неповратни реакции се оние кои се одвиваат сè додека макар еден од реактантите не исчезне од реакциониот систем, односно сè додека количеството на макар еден од реактантите не стане практично нула и тогаш реакцијата завршува. Според тоа, за да има реакција, во реакциониот систем мора да бидат присутни сиет супстанци што се реактанти, односно ако нема барем еден од реактантите, реакцијата не може да се одвива. Меѓутоа, често се среќаваат хемиски реакции кои престануваат да се одвиваат, иако ниеден од реактантите не е потрошен. Тоа се случува кога истовремено се случуваат два процеса: еден во кој реактантите даваат продукти (директна реакција) и друг процес во кој продуктите се соединуваат и образуваат реактанти (обратна реакција). Ваквите реакции се нарекуваат повратни.[20]
Со една друга класификација, хемиските реакции се поделени на:
Основни типови
[уреди | уреди извор]Реакции на соединување или синтеза
[уреди | уреди извор]Во реакција на синтеза, две или повеќе прости супстанци реагираат и образуваат посложена супстанца. Два или повеќе реактанти кои даваат еден производ е друг начин за препознавање на реакција на синтеза. Овие реакции имаат општа формула: A + B → AB. На пример, водороден гас во реакција со кислороден гас дава посложена супстанца каква што е водата,[21] бакарот и сулфурот се соединуваат во бакар сулфид, а хлороводородот и амонијакот создаваат амониум хлорид. Постојат голем број процеси на соединување, како што се процесите на горење, или како што се процесите на адиција кои се својствени за незаситените органски соединенија.[22]
Реакции на разложување
[уреди | уреди извор]Реакција на разложување е спротивна на синтезната реакција. Тука посложена супстанца се разложува на своите попрости делови. До разложување понекогаш доаѓа спонтано, т.е. само од себе, а тоа се случува кога супстанцата е нестабилна. Сепак, најчесто, до разложување доаѓа под дејство на доведена топлина (пиролиза), под дејство на електрична енергија (електролиза), под дејство на светлина (фотолиза) или под дејство на јонизирачко зрачење (радиолиза). Со одредена резерва, во процесите на разложување може да се сместат и реакциите на елиминација, како што е процесот во кој, под дејство на концентрирана сулфурна киселина, од етанол се добива етен (етилен). Во минатото, реакциите на разложување до простите (елементарни) супстанции се нарекувале анализа, но денес овој назив има друго значење.[23] Овие реакции имаат општа формула:
Реакција на замена
[уреди | уреди извор]При овој тип на реакција, еден единичен елемент заменува друг во соединението.[21] Овие реакции се нарекуваат и реакции на супституција. Често, кога се зборува за овие реакции, не се мисли само на вистинска замена на едни атоми од молекулата во други, туку во реакциите на замена се вклучуваат и оние кај кои доаѓа до замена и на атомски групи кои влегуваат во составот на супстанциите што реагираат, дури и тогаш кога супстанциите не се изградени од молекули. Посебен вид реакции на замена се они кај кои доаѓа до меѓусебна размена на атоми или атомски групи. Овие реакции се викаат реакции на двојна замена.[25]
Реакција на двојна измена
[уреди | уреди извор]При оваа реакција, делови од две соединенија ги заменуваат своите места и образуваат нови соединенија.[21] Ова е случај кога анјоните и катјоните на две различни молекули ги заменуваат местата, образувајќи две целосно различни соединенија.[24] Овие реакции имаат општа формула:
- АB + CD → AD + CB
Пример за реакција на двојна измена е реакцијата меѓу олово(II) нитрат со калиум јодид, при што се добива олово(II) јодид и калиум нитрат:
- Pb(NO3)2 + 2 KI → PbI2 + 2 KNO3
Реакции на кондензација
[уреди | уреди извор]Под реакции на кондензација се подразбираат хемиски процеси во кои, гледано на молекуларно ниво, две честички даваат една друга, со одделување на некоја мала честичка (најчесто, молекула на вода). Притоа, можно е кондензирање и на повеќе од две честички. Пример за ваква реакција е спонтаното образување на т.н. дифосфорна киселина (на температури повисоки од температурата на топење на фосфорната киселина):[26]
- 2H3PO4 + H4P2O7 + H2O
Реакции на полимеризација и поликондензација
[уреди | уреди извор]Полимеризација е процес во кој доаѓа до сврзување на поголем број помали молекули при што се образуваат големи молекули без да се добиваат други производи. Молекулите што се сврзуваат првобинто припаѓаат на супстанци наречени мономери. Голем број молекули не се сврзуваат веднаш, туку најпрвин се образуваат димерни, потоа тримерни итн. молекули. Ако сите молекули што се сврзуваат се еднакви, тогаш добиениот продукт ќе има состав во кој количинските односи меѓу елементите се еднакви како кај појдовната супстанца (мономерот). Пример за реакција на полимеризација е образувањето полиетилен од мономерот етен. Исто така, можно е полимеризирање на различни мономери, а тој процес се нарекува кополимеризација. Полимерите најчесто се присутни во органската хемија, но постојат и во неорганската хемија. Големи молекули се образуваат и низ процесот на поликондензација, а тоа е процес во кој од голем број помали молекули се добиваат макромолекули, а се одделуваат супстанци образувани од мали молекули (вода, амонијак, итн.).[27]
Оксидација и редукција
[уреди | уреди извор]Редокс реакциите можат да се сфатат како пренос на електрони од еден учесник во реакција (редуцирачко средство) до друг (оскидирачко средство). При овој процес, првиот учесник во реакцијата се оксидира, а вториот се редуцира, па оттука и името редокс. Иако е доволен за делумно разбирање на овој тип реакции, овој опис не е целосно точен. Оксидација поточно означува зголемување на оксидациониот број, а редукција намалување на оксидациониот број. Во пракса, преносот на електрони секогаш ќе го менува оксидациониот број, но постојат многу реакции кои се именуваат редокс дури и ако притоа нема пренос на електрони (такви се оние во кои се вклучени ковалентни врски).[28][29]
Пример за редокс реакција е:
- 2 S2O32−(aq) + I2(aq) → S4O62–(aq) + 2 I−(aq)
Тука I2 се редуцира до I–, а S2O32– (тиосулфатен анјон) се оксидира до S4O62–.
Кој од учесниците реактанти ќе биде редуцирачко или оксидирачко средство може да се предвиди од електронегативноста на елементите кои влегуваат во нивниот состав. Елементите со ниска електронегативност, какви што се повеќето метали, полесно оддаваат електрони и се оксидираат - тие се редуцирачки средства. Спротивно, многу јони со големи оксидациони броеви, како H2O2, MnO−
4, CrO3, Cr2O2−
7, OsO4) можат да примат еден или два додатни електрони и се силни оксидирачки средства.
Бројот на електрони кој е оддаден или примен во дадена редокс реакција може да се предвиди од електронската конфигурација на елементот во состав на реактантот. Елементите се обидуваат да ја достигнат нискоенергетската конфигурација на благородните гасови и затоа алкалните метали и халогените ќе оддаваат и примат еден електрон, соодветно, а самите благородни гасови се хемиски неактивни.[30]
Важна класа на редокс реакции се електрохемиските реакции, при кои електроните од снабдувачот со енергија се користат како редуцирачко средство. Овие реакции се особено важни за производство на хемиски елементи, како на пример, хлор[31] или алуминиум. Обратниот процес при кој електроните се ослободуваат во редокс реакциите и можат да се користат како електрична енергија се користи кај батериите.
| Оксидација | Оддавање на електрони | Редуцирачко средство → производ + e− | Зголемен оксидационен број |
| Редукција | Примање на електрони | Оксидирачко средство + e− → производ | Намален оксидационен број |
Реакции на создавање комплексни соединенија
[уреди | уреди извор]
При овие реакции, кои се среќаваат и под името реакции на комплексација, неколку лиганди реагираат со метален атом и образуваат координациски комплекс. Ова се постигнува со обезбедувањето на слободни електронски парови од лигандите на празните орбитали на металниот атом, при што се образуваат диполарни врски. Лигандите се Луисови бази, тие може да се јони и неутрални молекули, како на пример, јаглерод моноксид, амонијак или вода. Бројот на лиганди кои реагираат со централен метален атом може да се најде користејќи го Правилото на 18 електрони според кое валентните обвивки на еден транзиционен метал вкупно би примиле 18 електрони, додека симетријата на добиениот комплекс може да се предвиди со теоријата на кристално поле и теоријата на лигандно поле. Во реакции на комплексација исто така припаѓаат и размената на лиганди, при што една или повеќе лиганди се заменуваат со друга, како и редокс процеси при кои се менува оксидациониот број на централниот метален атом.[32]
Киселинско-базни реакции
[уреди | уреди извор]При киселинско-базните реакции се одвива пренос на протони од една молекула (киселина) до друга (база). Киселините се однесуваат како дарители на протони, а базите како приматели.
- Киселинско-базна реакција, HA: киселина, B: база, A–: конјугирана база, HB+: конјугирана киселина
Преносот на протони доведува до создавање на т.н. конјугирана киселина и конјугирана база.[33] Обратната реакција е можна, па така киселината/базата и конјугираната база/киселина се секогаш во рамнотежа. Рамнотежата се одредува од дисоцијациските константи на киселината и базата (Ka и Kb) на супстанците кои влегуваат во реакција. Посебен случај на К-Б реакција е неутрализацијата при која една киселина и една база, земени во точно исти количества, образуваат неутрални соли.
К-Б реакции можат да се дефинираат на различни начини, во зависност од користениот концепт за тоа што е киселина, а што база. Некои од најчестите дефиниции се:
- Арениусова теорија: киселините дисоцираат во вода, ослободувајќи H3O+ јони; базите дисоцираат во вода, ослободувајќи OH– јони.
- Бренстед-Лауриева дефиниција: киселините се дарители на протони (H+), а базите се приматели на протони; тука е вклучена и Арениусовата дефиниција.
- Луисова дефиниција: киселините се приматели на електронски пар, а базите се дарители на електронски пар; тука е вклучена и Бренстед-Лауриевата дефиниција.
Таложење
[уреди | уреди извор]
Преципитација (таложење) подразбира образување на цврста супстанца во раствор или во некоја друга цврста супстанца што настанува за време на хемиска реакција. Обично се јавува кога концентрацијата на растворените јони ја надминува границата на растворливост[34] и се формираат нерастворливи соли. Овој процес може да се потпомогне со додавање на средство за таложење или со отстранување на растворувачот. Брзата преципитација доведува до аморфни или микрокристални остатоци, а бавната до единични кристали.[35]
Реакции меѓу цврсти супстанци
[уреди | уреди извор]Реакции може да се одвиваат меѓу две цврсти супстанци. Но, поради релативно малиот степен на дифузија кај цврстите тела, соодветните хемиски реакции се многу бавни во споредба со реакциите во течна и гасовита фаза. Тие се забрзуваат со зголемување на реакционата температура и со фина поделба на реактантот за да се зголеми контактната површина.[36]
Фотохемиски реакции
[уреди | уреди извор]При фотохемиските реакции, атомите и молекулите апсорбираат енергија (фотони) од светлината и преминуваат во возбудена состојба. Тие потоа можат да ја ослободат оваа енергија со раскинување на хемиските врски, со што се добиваат радикали. Во фотохемиски реакции припаѓаат водородно-кислородните реакции, радикалната полимеризација, верижни реакции и реакции на прегрупирања.[37]

Многу важни процеси се фотохемиски по својата природа. Најважен пример е фотосинтезата, при што повеќето растенија ја користат сончевата енергија за да го претворат јаглерод диоксидот и водата во гликоза, ослободувајќи се притоа од кислородот како спореден производ. Луѓето зависат од фотохемијата бидејќи на тој начин се образува витаминот D, а видот е поттикнат од фотохемиските реакции на родопсинот.[15] Кај светулките, реакцијата на биолуминисценција е катализирана од еден ензим што се наоѓа во абдоменот.[38] Во Земјината атмосфера се одвиваат многу значајни фотохемиски реакции, како образувањето на озонот, кои се дел од атмосферската хемија.
Катализа
[уреди | уреди извор]

Во случај на катализа, реакцијата не протекува директно, туку со помош на трета супстанца позната како катализатор. За разлика од останатите реактанти што учествуваат во хемиската реакција, катализаторот не се троши во самата реакција; меѓутоа, тој може да се инхибира, деактивира или уништи со секундарни процеси. Катализаторите може да се во различна агрегатна состојба (хетерогени) или во иста агрегатна состојба (хомогени) како и реактантите. При хетерогена катализа, типични секундарни процеси се коксирање, при што катализаторот се прекрива со полимерни споредни производи. Дополнително, хетерогените катализатори може да се растворат кога имаме цврсто-течен систем или да испарат кај цврсто-гасовит систем. Катализаторите можат само да ја забрзаат реакцијата - материите кои ја забавуваат се наречени инхибитори.[39][40] Супстанците кои ја зголемуваат активноста на катализаторите се наречени промотори, а оние кои ги деактивираат катализаторите се викаат каталитички отрови. Со катализатор, дадена реакција која е кинетички инхибирана со висока активациона енергија може да протече независно од оваа активациона енергија - со нејзино заобиколување.
Хетерогените катализатори се обично цврсти материи, прашкасти со цел да ја максимизираат нивната површина. Од големо значење за хетерогената катализа се металите од групата на платина и други преодни метали, кои се користат во хидрогенација, каталитичко преобликување и во синтезата на хемикалии важни во домаќинствата (азотна киселина и амонијак). Киселините се пример за хомогени катализатори, тие ја зголемуваат нуклеофилноста на карбонилните соединенија, дозволувајќи реакција која не би можела да протече со електрофилни честички. Предноста на хомогените катализатори е леснотијата на мешањето со реактантите, но тие може да бидат тешки за отстранување од производите. Затоа за многу индустриски процеси се претпочитаат хетерогени катализатори.[41]
Реакции на металите со киселини
[уреди | уреди извор]Некои метали (на пример, магнезиум, алуминиум, железо, итн.) реагираат на силни киселини, а алкалните метали реагираат и на слаби киселини при што во таквите реакции се ослободува гасовит водород. Меѓутоа, во некои случаи доаѓа до т.н. пасивизирање на металите. На пример, реакцијата на оловото со сулфурната киселина не тече во позначителна мерка зашто на површината се образува тешко растворливото соединение олово(II) сулфат. Алуминимумот, пак, се пасивизира во реакцијата со азотната киселина зашто на површината се образува слој од нерастворлив алуминиум оксид. Металите кои реагираат со киселините, полесно оддаваат електрони од гасовитиот водород. Ако, пак, металот потешко оддава електрони отколку гасовитиот водород, тогаш тој не реагира со киселини. Во зависност од леснотијата со која металите реагираат со киселини, попознатите метали можат да се подредат во следнава низа: Li k Ca Na Al Zn Fe Cd Ni Sn Pb H2 Cu Ag Hg Au. Поради врската меѓу реакциите на металите со киселини и електрохемиските процеси, оваа низа се нарекува електрохемиска низа на металите. Во низата е вклучен и водородот, иако тој не е метал, поради тоа што тој служи како основа за споредување. Ако во електрохемиската низа металот се наоѓа пред водородот, тогаш е можно во реакцијата на тој метал со киселини да се добие гасовит водород, а ако во електрохемиската низа металот се наоѓа по водородот, тогаш ваквата реакција не може спонтано да тече. Освен тоа, металот кој се наоѓа понапред во низата може од неговите соедененија да ги истиснува металите кои во низата се наоѓаат зад него.[42]
Реакции во органската хемија
[уреди | уреди извор]Во органската хемија, покрај реакциите на оксидација, редукција или киселинско-базните реакции, може да се сретнат и неколку други реакции во кои учествуваат ковалентните врски меѓу самите јаглеродни атоми или меѓу јаглеродните атоми и хетероатомите (како кислород, азот, халогени итн.). Многу поодделни реакции во органската хемија се именувани по нивните откривачи.
Супституција
[уреди | уреди извор]При реакција на супституција, една функционална група во дадено хемиско соединение се заменува со друга група.[43] Овие реакции може да се поделат според типот на супституирачките единки на нуклеофилна, електрофилна или радикална супституција.
Во првиот тип, еден нуклеофил, кој е атом или молекула со вишок на електрони и поради тоа со негативен полнеж или делумен полнеж, заменува друг атом или дел од „супстратната“ молекула. Електронскиот пар од нуклеофилот го напаѓа супстратот, формирајќи нова врска, додека заминувачката група се оттргнува со електронски пар. Нуклеофилната честичка може да биде електронеутрална или со негативен полнеж, а супстратот е обично неутрален или со позитивен полнеж. Примери за нуклеофили се хидроксиден јон, алкоксиди, амини и халиди. Овој тип реакција се среќава главно кај алифатичните јаглеводороди, а поретко кај ароматичните јаглеводороди. Последните имаат голема електронска густина и подлежат на нуклеофилна ароматична супституција само со многу јаки електрон-повлекувачки групи. Нуклеофилната супституција може да се одвива преку два различни механизми - SN1 и SN2. S во овие називи означува супституција, N значи нуклеофилна, а бројот го претставува кинетичкиот ред на реакцијата - едномолекуларна или двомолекуларна.[44]
Реакцијата SN1 протекува во два чекора. Прво, заминувачката група се елиминира, со што се добива карбокатјон. По ова следува брза реакција со нуклеофилот.[45]
При SN2 механизмот, нуклеофилот образува преодна состојба со нападнатата молекула, и само тогаш се одделува заминувачката група. Овие два механизми се разликуваат во стереохемијата на производите. SN1 води до нестереоспецифична адиција и не резултира во хирален центар, туку во група на геометриски изомери (cis/trans). За споредба, обратна (Валденова инверзија) на претходно постоечката стереохемија може да се сретне во SN2 механизмот.[46]
Електрофилната супституција е спротивна на нуклеофилната по тоа што напаѓачкиот атом или молекула, електрофил, има мала електронска густина, а со тоа и позитивен полнеж. Типични електрофилни честички се јаглеродниот атом од карбонилните групи, карбокатјоните или сулфурните или нитрониум катјони. Оваа реакција се среќава речиси исклучително кај ароматичните јаглеводороди, каде се нарекува електрофилна ароматична супституција. Електрофилниот напад резултира во т.н. σ-комплекс, преодна состојба кај која ароматичниот систем исчезнува. Потоа, заминувачката група, обично протон, се одделува и ароматичноста повторно се воспоставува. Алтернативна на ароматичната супституција е електрофилната алифатична супституција. Таа е слична на нуклеофилната алифатична супституција и исто така има два типа - SE1 и SE2.[47]
При третиот тип на реакција на супституција - радикална супституција - напаѓачката честичка е радикал.[43] Овој процес најчесто се одвива како верижна реакција, на пример, при реакција на алкани со халогени. Во првиот чекор, светлината или топлината ги разложуваат молекулите што содржат халогени, со што се добиваат радикалите. Потоа реакцијата продолжува како лавина сè додека двата радикала се сретнат и се рекомбинираат.[48]
- Реакции што протекуваат при верижната реакција на радикална супституција
Адиција и елиминација
[уреди | уреди извор]Адицијата и спротивната на неа - елиминацијата - се реакции при кои се менува бројот на супституенти на јаглеродниот атом и се формираат или раскинуваат повеќекратни врски. Двојните и тројните врски може да се добијат со елиминација на погодна заминувачка група. Слично на нуклеофилната супституција, постојат неколку можни реакциони механизми кои се именувани според соодветниот ред на реакцијата. Во Е1 механизмот, заминувачката група прва се отстранува, со што се формира карбокатјон. Следниот чекор - формирање на двојна врска - се одвива со елиминација на протон (депротонација).
Редот на заминување е обратен кај E1cb механизмот, односно прво се одделува протонот. За овој механизам е потребно учеството на база.[49] Поради сличните услови, двете реакции на E1 и E1cb елиминација секогаш се натпреваруваат со SN1 супституцијата.[50]
За Е2 механизмот исто така е потребна база, но тука нападот на базата и елиминацијата на заминувачката група протекуваат истовремено и не даваат јонски меѓупроизвод. Спротивно на Е1 елиминацијата, во Е2 механизмот можни се различни стереохемиски конфигурации за реакциониот производ, бидејќи базата обично напаѓа во антипозиција во однос на заминувачката група. Поради сличните услови и реактанти, Е2 елиминацијата е секогаш во натпревар со SN2-супституцијата.[51]
Спротивна на елиминацијата е адицијата при која двојните или тројните врски се претвораат во единични врски. Слично како кај супституциските реакции, постојат неколку типови на адиции кои се разликуваат по типот на напаѓачката честичка. На пример, при електрофилната адиција на бромоводород, еден електрофил (протон) ја напаѓа двојната врска и се формира карбокатјон кој потоа реагира со нуклеофилот (бром).
Карбокатјонот може да се формира на секоја страна од двојната врска, во зависност од групите прикачени за нејзините краеви, а претпочитаната конфигурација може да се предвиди со Марковниковото правило.[52] Ова правило гласи: „При хетеролитичка адиција на поларна молекула на алкен или алкин, поелектронегативниот (нуклеофилен) атом (или дел) кој влегува во составот на поларната молекула се прикачува за јаглеродниот атом кој носи помал број на водородни атоми“.[53]
Ако адицијата на функционална група се одвива на помалку супституираниот јаглероден атом од двојната врска, тогаш електрофилна супституција со киселини не е можна. Во овој случај, треба да се користи реакцијата на хидроборација-оксидација, каде во нејзиниот прв чекор, атомот на бор делува како електрофил и се надодава на помалку супституираниот јаглероден атом. Во вториот чекор, хуклеофилниот хидропероксид или халогенски анјон го напаѓа боровиот атом.[54]
Додека адицијата на богатите со електрони алкени и алкини е главно електрофилна, нуклеофилната адиција игра важна улога кај јаглерод-хетероатомските повеќекратни врски, а особено кај најважниот претставник со ваква структура - карбонилната група. Овој процес често е поврзан со елиминација, така што по реакцијата карбонилната група повторно е присутна. Затоа се нарекува адиционо-елиминациона реакција и може да протекува кај дериватите на карбоксилната киселина, како на пример, хлориди, естри и анхидриди. Оваа реакција најчесто е катализирана од киселини или бази, при што киселините ја зголемуваат електрофилноста на карбонилната група со врзување за атомот на кислород, додека базите ја зголемуваат нуклеофилноста на напаѓачкиот нуклеофил.[55]
Нуклеофилна адиција на карбанјон или друга нуклеофилна честичка на двојната врска од алфа- или бета-незаситено карбонилно соединение се среќава при реакцијата на Мајкл, која припаѓа на поголемата класа на конјугатни адиции. Ова е еден од најкорисните методи за блага формација на С-С врски.[56][57][58]
Некои адиции кои не можат да бидат сопрени со нуклеофилни или електрофилни честички, можат да се продолжат со слободни радикали. Како и со супституцијата со слободни радикали, така и радикалната адиција протекува како верижна реакција, а ваквите реакции се основа за полимеризацијата со слободни радикали.[59]
Други механизми на органските реакции
[уреди | уреди извор]При реакција на прегрупирање, јаглеродниот ‘рбет на молекулата се прегрупира и се добива структурен изомер на оригиналната молекула. Вакви реакции се реакциите на хидридна смена, какво што е Вагнер-Мирвајновото прегрупирање при кое водороден атом, алкил- или арил-група мигрира од еден јаглероден атом до друг соседен јаглероден атом. Повеќето прегрупирања се поврзани со раскинувањето и образувањето на нови јаглерод-јаглерод врски. Други примери се сигматропната реакција каква што е прегрупирањето на Коуп.[60]
Цикличните прегрупирања вклучуваат циклоадиции и, повоопштено, перициклични реакции, при кои две или повеќе молекули што содржат двојна врска образуваат циклична молекула. Важен пример за циклоадиција е Дилс-Алдеровата реакција (т.н. [4+2] циклоадиција) меѓу конјугиран диен и супституиран алкен, при што се добива супституиран циклохексански систем.[61]
Дали ќе или нема одредена циклоадиција да продолжи да тече зависи од електронските орбитали на учесниците во реакцијата, бидејќи само орбиталите со ист знак на брановата функција ќе се преклопат и конструктивно ќе заемодејствуваат за да се добијат нови врски. Циклоадицијата обично е потпомогната од светлината или топлината.
Овие растројувања резултираат во различен распоред на електроните во возбудена состојба кај молекулите-учесници, а поради тоа и во различни ефекти. На пример, [4+2] Дилс-Алдеровите реакции можат да бидат потпомогнати од топлината, додека [2+2] циклоадицијата е селективно индуцирана од светлината. Поради карактерот на орбиталите, потенцијалот за развивање на стереоизомерни производи по пат на циклоадиција е ограничен, што е опишано кај правилата на Вудвард-Хофман.[62]
Биохемиски реакции
[уреди | уреди извор]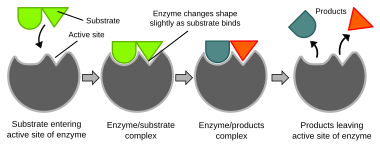
Биохемиските реакции се главно контролирани од ензими. Овие белковини можат специфично да катализираат една реакција, така што вкупниот број реакции можат да бидат многу прецизно контролирани. Реакцијата се одвива на активното место, кое претставува мал дел од ензимот што обично се наоѓа во шуплина или вдлабнување обиколено со остатоци од аминокиселини, а остатокот од ензимот служи главно за стабилизација. Каталитичката активност на ензимите се потпира на неколку механизми, меѓу кои се формата на молекулата, напрегнатоста на врските, близината и ориентацијата на молекулите во однос на ензимот, донацијата на протони или нивно повлекување (киселинско/базна катализа), електростатичките интеракции и многу други.[63]
Биохемиските реакции кои протекуваат во живите организми заеднички се познати како метаболизам. Меѓу најпознатите метаболички механизми е анаболизмот, при кој различни процеси контролирани од ДНК и ензими резултираат во производство на големи молекули (како белковини и јаглехидрати) добиени од помали единици.[64] Биоенергетиката ги проучува изворите на енергија за ваквите реакции. Важен енергетски извор е гликозата, која се произведува од растенијата по пат на фотосинтеза или се асимилира од храната. Сите организми ја користат оваа енергија за производство на аденозин трифосфат (АТФ) кој може да се искористи како енергенс за протекување на други реакции.
Примена
[уреди | уреди извор]Хемиските реакции заземаат централно место во хемиското инженерство, каде се користат за синтеза на нови соединенија од природни суровини, како на пример нафта и минерални руди. Од голема важност е реакцијата да биде што поефикасна, со што се максимизира добивката, а се минимизира количината на потребни реактанти, внесот на енергија и отпадокот. Катализаторите се особено корисни за редуцирање на енергијата потребна за реакцијата и зголемување на редот на хемиската реакција.[65][66]
Некои специфични реакции имаат свои посебни примени. На пример, термитската реакција се користи за добивање светлина и топлина во пиротехниката и заварувањето.[67]
Наводи
[уреди | уреди извор]- ↑ IUPAC, Compendium of Chemical Terminology, 2. изд. (the "Gold Book") (1997). Семрежна поправена верзија: (2006–) "chemical reaction". doi:10.1351/goldbook.C01033
- ↑ Бојан Шоптрајанов, Хемија за втора година на реформираното гимназиско образование (петто изменето и дополнето издание). Скопје: Просветно дело, 2009, стр. 5.
- ↑ Бојан Шоптрајанов, Хемија за втора година на реформираното гимназиско образование (петто изменето и дополнето издание). Скопје: Просветно дело, 2009, стр. 7.
- ↑ Weyer, Jost (1973). „Neuere Interpretationsmglichkeiten der Alchemie“. Chemie in unserer Zeit (германски). 7 (6): 177. doi:10.1002/ciuz.19730070604.
- ↑ Leonard J. Friedman & Samantha J. Friedman The History of the Contact Sulfuric Acid Process Архивирано на 26 мај 2012 г., Acid Engineering & Consulting, Inc. Boca Raton, Florida
- ↑ John E. Lesch The German chemical industry in the twentieth century, Springer, 2000, ISBN 0-7923-6487-2 p. 170
- ↑ Brock, pp. 34–55
- ↑ Brock, pp. 104–107
- ↑ Бојан Шоптрајанов, Хемија за втора година на реформираното гимназиско образование (петто изменето и дополнето издание). Скопје: Просветно дело, 2009, стр. 51-52.
- ↑ IUPAC, Compendium of Chemical Terminology, 2. изд. (the "Gold Book") (1997). Семрежна поправена верзија: (2006–) "chemical reaction equation". doi:10.1351/goldbook.C01034
- ↑ Бојан Шоптрајанов, Хемија за втора година на реформираното гимназиско образование (петто изменето и дополнето издание). Скопје: Просветно дело, 2009, стр. 8.
- ↑ Corey, E. J. (1988). „Robert Robinson Lecture. Retrosynthetic thinking?essentials and examples“. Chemical Society Reviews. 17: 111. doi:10.1039/CS9881700111.
- ↑ IUPAC, Compendium of Chemical Terminology, 2. изд. (the "Gold Book") (1997). Семрежна поправена верзија: (2006–) "elementary reaction". doi:10.1351/goldbook.E02035
- ↑ Gernot Frenking: Elementarreaktionen. In: Römpp Chemie-Lexikon, Thieme, 2006
- ↑ 15,0 15,1 Christophe Dugave Cis-trans isomerization in biochemistry, Wiley-VCH, 2006 ISBN 3-527-31304-4 p. 56
- ↑ Atkins, p. 114.
- ↑ Atkins, pp. 106–108
- ↑ Wiberg, pp. 810–811
- ↑ Atkins, p. 150
- ↑ Бојан Шоптрајанов, Хемија за втора година на реформираното гимназиско образование (петто изменето и дополнето издание). Скопје: Просветно дело, 2009, стр. 10-11.
- ↑ 21,0 21,1 21,2 21,3 To react or not to react? Архивирано на 25 август 2010 г.. Utah State Office of Education. Retrieved 4 June 2011.
- ↑ Бојан Шоптрајанов, Хемија за втора година на реформираното гимназиско образование (петто изменето и дополнето издание). Скопје: Просветно дело, 2009, стр. 12-14.
- ↑ Бојан Шоптрајанов, Хемија за втора година на реформираното гимназиско образование (петто изменето и дополнето издание). Скопје: Просветно дело, 2009, стр. 14-15.
- ↑ 24,0 24,1 Six Types of Chemical Reactions – MrGuch ChemFiesta.
- ↑ Бојан Шоптрајанов, Хемија за втора година на реформираното гимназиско образование (петто изменето и дополнето издание). Скопје: Просветно дело, 2009, стр. 16.
- ↑ Бојан Шоптрајанов, Хемија за втора година на реформираното гимназиско образование (петто изменето и дополнето издание). Скопје: Просветно дело, 2009, стр. 16-17.
- ↑ Бојан Шоптрајанов, Хемија за втора година на реформираното гимназиско образование (петто изменето и дополнето издание). Скопје: Просветно дело, 2009, стр. 17.
- ↑ Christian B. Anfinsen Advances in protein chemistry, Academic Press, 1991 ISBN 0-12-034242-1 p. 7
- ↑ A. G. Sykes Advances in Inorganic Chemistry, Volume 36, Academic Press, 1991 ISBN 0-12-023636-2 p. 359
- ↑ Wiberg, pp. 289–290
- ↑ Wiberg, p. 409
- ↑ Wiberg, pp. 1180–1205
- ↑ IUPAC, Compendium of Chemical Terminology, 2. изд. (the "Gold Book") (1997). Семрежна поправена верзија: (2006–) "conjugate acid–base pair". doi:10.1351/goldbook.C01266
- ↑ IUPAC, Compendium of Chemical Terminology, 2. изд. (the "Gold Book") (1997). Семрежна поправена верзија: (2006–) "precipitation". doi:10.1351/goldbook.P04795
- ↑ Jörg Wingender, Stefanie Ortanderl Ausfällung. In: Römpp Chemie-Lexikon., Thieme, July 2009
- ↑ Ralf Alsfasser, Erwin Riedel, C Janiak, HJ Meyer Modern Inorganic Chemistry. 3. Edition. de Gruyter, 2007, ISBN 978-3-11-019060-1, p. 171
- ↑ Atkins, pp. 937–950
- ↑ David Stanley Saunders Insect clocks, Elsevier, 2002, ISBN 0-444-50407-9 p. 179
- ↑ IUPAC, Compendium of Chemical Terminology, 2. изд. (the "Gold Book") (1997). Семрежна поправена верзија: (2006–) "catalyst". doi:10.1351/goldbook.C00876
- ↑ IUPAC, Compendium of Chemical Terminology, 2. изд. (the "Gold Book") (1997). Семрежна поправена верзија: (2006–) "inhibitor". doi:10.1351/goldbook.I03035
- ↑ Christoph Elschenbroich: Organometallchemie. 6th edition, Wiesbaden, 2008, ISBN 978-3-8351-0167-8, p. 263
- ↑ Бојан Шоптрајанов, Хемија за втора година на реформираното гимназиско образование (петто изменето и дополнето издание). Скопје: Просветно дело, 2009, стр. 96-99.
- ↑ 43,0 43,1 March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3. изд.), New York: Wiley, ISBN 0-471-85472-7
- ↑ S. R. Hartshorn, Aliphatic Nucleophilic Substitution, Cambridge University Press, London, 1973. ISBN 0-521-09801-7 pp. 1 ff
- ↑ Leslie C. Bateman, Mervyn G. Church, Edward D. Hughes, Christopher K. Ingold and Nazeer Ahmed Taher (1940). „188. Mechanism of substitution at a saturated carbon atom. Part XXIII. A kinetic demonstration of the unimolecular solvolysis of alkyl halides. (Section E) a general discussion“. Journal of the Chemical Society: 979. doi:10.1039/JR9400000979.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ Brückner, pp. 63–77
- ↑ Brückner, pp. 203–206
- ↑ Brückner, p. 16
- ↑ Brückner, p. 192
- ↑ Brückner, p. 183
- ↑ Brückner, p. 172
- ↑ Wiberg, pp. 950, 1602
- ↑ IUPAC, Compendium of Chemical Terminology, 2. изд. (the "Gold Book") (1997). Семрежна поправена верзија: (2006–) "Markownikoff rule". doi:10.1351/goldbook.M03707
- ↑ Brückner, p. 125
- ↑ Hans Peter Latscha, Uli Kazmaier, Helmut Alfons Klein Organische Chemie: Chemie-basiswissen II, Vol. 2. 6th edition, Springer, 2008, ISBN 978-3-540-77106-7, p. 273
- ↑ „Organic Reactions“. 2004. doi:10.1002/0471264180. ISBN 0-471-26418-0. Наводот journal бара
|journal=(help) - ↑ Ian Hunt. „Chapter 18: Enols and Enolates — The Michael Addition reaction“. University of Calgary.
- ↑ Brückner, p. 580
- ↑ Manfred Lechner, Klaus Gehrke, Eckhard Nordmeier Macromolecular Chemistry 3rd Edition, Birkhauser, Basel 2003, ISBN 3-7643-6952-3, pp. 53–65
- ↑ Marye Anne Fox, James K. Whitesell Organic chemistry, 2004, ISBN 0-7637-2197-2 p. 699
- ↑ Diels, Otto; Alder, Kurt (1928). „Synthesen in der hydroaromatischen Reihe“. Justus Liebig's Annalen der Chemie. 460: 98. doi:10.1002/jlac.19284600106.
- ↑ Woodward, R. B.; Hoffmann, Roald (1965). Journal of the American Chemical Society. 87 (2): 395. doi:10.1021/ja01080a054. Отсутно или празно
|title=(help) - ↑ Peter Karlson , Detlef Doenecke, Jan Koolman, Georg Fuchs, Wolfgang Gerok. Karlson Biochemistry and Pathobiochemistry, 16th edition, Georg Thieme, 2005, ISBN 978-3-13-357815-8, pp. 55–56
- ↑ IUPAC, Compendium of Chemical Terminology, 2. изд. (the "Gold Book") (1997). Семрежна поправена верзија: (2006–) "anabolism". doi:10.1351/goldbook.A00314
- ↑ Gerhard Emig, Elias Klemm. Technical Chemistry. 5th edition, Springer, 2005, ISBN 978-3-540-23452-4, pp. 33–34
- ↑ Trost, B. (1991). „The atom economy—a search for synthetic efficiency“. Science. 254 (5037): 1471–7. doi:10.1126/science.1962206. PMID 1962206.
- ↑ John J. McKetta, Guy E Weismantel Encyclopedia of Chemical Processing and Design: Volume 67 – Water and Wastewater Treatment: Protective Coating Systems to Zeolite, Volume 67[мртва врска], CRC Press, 1999 ISBN 0-8247-2618-9, p. 109
Литература
[уреди | уреди извор]- Atkins, Peter W. and Julio de Paula Physical Chemistry, 4th Edition, Wiley-VCH, Weinheim 2006, ISBN 978-3-527-31546-8
- Brock, William H. Viewegs Geschichte der Chemie. Vieweg, Braunschweig 1997, ISBN 3-540-67033-5.
- Brückner, Reinhard Reaktionsmechanismen. 3rd ed., Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9
- Wiberg, Egon, Wiberg, Nils and Holleman, Arnold Frederick Inorganic chemistry, Academic Press, 2001 ISBN 0-12-352651-5
| Статијата „Хемиска реакција“ е избрана статија. Ве повикуваме и Вас да напишете и предложите избрана статија (останати избрани статии). |
|