Атом: Разлика помеѓу преработките
| [непроверена преработка] | [непроверена преработка] |
с Бот Додава: vec:Àtomo |
|||
| Ред 160: | Ред 160: | ||
[[nrm:Atôme]] |
[[nrm:Atôme]] |
||
[[nov:Atome]] |
[[nov:Atome]] |
||
[[oc:Atòm]] |
|||
[[mhr:Атом]] |
[[mhr:Атом]] |
||
[[uz:Atom]] |
[[uz:Atom]] |
||
| Ред 187: | Ред 188: | ||
[[tl:Atomo]] |
[[tl:Atomo]] |
||
[[ta:அணு]] |
[[ta:அணு]] |
||
[[te:అణువు]] |
|||
[[th:อะตอม]] |
[[th:อะตอม]] |
||
[[tg:Атом]] |
[[tg:Атом]] |
||
Преработка од 01:51, 19 ноември 2010
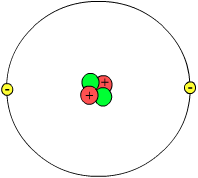
Во физиката и хемијата, атомот (на грчки άτομον - неделив) претставува најмалата структурна честица на секој хемиски елемент (со тоа и на материјата) што ги има неговите карактеристични својства. Секој атом се состои од атомско јадро и електронска обвивка. Притоа, и во јадрото, а и во електронската обвивка се наоѓаат неколку типови на елементарни честички: во јадрото се наоѓаат неутралните неутрони и позитивно наелектризираните протони (или позитрони), додека во електронската обвивка се наоѓаат негативно наелектризираните електрони (односно негатрони). Сите овие елементарни честички играат голема улога при идентификувањето на атомите, како и при нивното поврзување со други атоми од ист или различен хемиски елемент (род).
Историјат на атомот
Уште од времето на старогрчките философи луѓето размислувале од што и како е изградена материјата. Постоеле две групи на философи, од кои едните сметале дека материјата може бесконечно да се дели на помали делчиња, а другите сметале дека постојат најмали делчиња од супстанцијата кои понатаму не можат да се делат. Позначајни философи кои се занимавале со оваа тематика се Аристотел, Левкип и Демокрит.
Меѓутоа, многу години подоцна, во август, 1945 година, по појавата на кобната печурка над Хирошима и Нагасаки, кај човештвото длабоко се втисна поимот "атом". Во ова време се мислело дека атомите се создадени при создавањето на универзумот, и дека тие не можат ниту да се уништат, ниту да се трансформираат од еден во друг вид. Ваквото сфаќање е разнишано кон крајот на 19 и почетокот на 20 век.
Во годините меѓу 1895-1900 беа откриени пет необични зрачења со голема продорност и енергија. X и γ зрачењата се однесуваат како светлински (електромагнетни) бранови со многу куса бранова должина, а катодните, α и β зраците се однесуваат како снопови од наелектризирани честички.
Новите откритија наметнаа размислување за концепцијата на атомот, чија реализација започна со започнувањето 20 век, а врз основа на акумулираните откритија. Се дозна дека атомот е електронеутрален, но се очекуваше дека електростатските сили кај него да бидат од примарно значење. Според откритијата, електронот беше кандидат за носител на негативното електричество.
Атомски модели
Вилјем Томсонов модел
Првиот атомски модел е предложен од Вилјем Томсон во 1898, според кој атомот е топче со радиус приближно еднаков на 0,1 nm во кое е распределено позитивно електричество, а на определени места во него се наоѓаат негативните електрони, кои придонесуваат атомот надворешно да манифестира неутралност. Овој модел беше скромна претпоставка и без експериментална поддршка.
Класичен модел
Џозеф Џон Томсон во 1904 го развил класичниот модел на атомот, базирајќи се на претпоставката дека зрачењето од атомот треба да се покорува на максвеловите равенки на класичната електромагнетна теорија и дека динамиката на атомот треба да е во согласност со Њутновите закони од класичната механика. Според тоа, електроните во неговиот модел не се во статичка, туку во осцилирачка (динамичка) состојба.
Радерфордов модел
Врз основа на експерименталните факти од страна на Ернест Радерфорд е предложен нов модел на атомот. Тој се базира на резултатите добиени од Гајгер (студент на Радерфорд), кој имал задача да го регистрира расејувањето на α-честичките од тенка златна фолија со дебелина од неколку илјади атомски слоеви. Покасно ќе биде објаснето дека α-честичките се двојно позитивно јонизирани хелиумови јадра.
Експериментирањата на Гајгер покажаа дека фолијата од злато не е некоја позначајна препрека за поминување на α-честичките. Најголемиот број од честичките поминуваат низ фолијата, определен број се отклонуваат од нивната првобитна насока, а многу мал број се рефлектираат од самата фолија. Според расудувањата на Радерфорд, расејувањето на α-честичките се должи на кулоновите сили од јадрата на златото кои се концентрирани на многу мал волумен во атомите од златото. Овие експериментирања дадоа можност да се процени големината на атомот и на атомското јадро.
Ако α-честичката е со полнеж q = + ze (z е атомски број, за златото неговата вредност е 79), тогаш потенцијалната енергија на системот ќе биде:
Со доближуавње на α-честичката до атомот на златото, кулоновата сила кинетичката енергија ја трансформира во потенцијална, од каде следува:
Од овде е можно да се определи големината на радиусот на позитивниот полнеж кој ќе ја запре или пренасочи ;alpha;-честичката. Најголемо можно доближување на честичката е:
Направените пресметки од страна на Радерфорд покажуваат дека атомското јадро е со радиус од редот на големината 10-15-10-14, а радиусот на атомот е од редот на 10-10 m. Според тоа, позитивното количество што го содржи атомот е сконцентрирано во негов мал централен дел наречен јадро или nucleus на латински. Поради тоа повеќето α-честички кои наидуваат на фолијата од злато не се среќаваат со позитивните атомски јадра.
Планетарен модел
- Главна статија: Планетарен модел на атомот.
Со Радерфордовата претпоставка за расејувањето на α-честичките се создадоа услови за појава на планетарниот модел за градбата на атомот. Според него, најголемото количество на маса е сконцентрирано во централниот дел, околу кој кружат електроните, слично како планетите околу Сонцето.
Боров модел
- Главна статија: Боров модел на атомот.
Напорите кон создавање на стабилен модел на атомот не престанаа со добивањето на претставата за планетарниот модел. Нилс Бор во 1913 година направи една од најславните примени на енергетското квантување на системите во микросветот. Боровиот модел на атомот е претставен низ неговите три („Борови“) постулати:
- Секој атом може да постои само во определени (дискретни) атомски состојби кои одговараат на определени енергетски состојби E1, E2, E3... Во овие состојби атомот ниту емитира, ниту апсорбира енергија. Затоа овој постулат е наречен постулат на стационарните состојби.
- Атомот емитира (или апсорбира) енергија само при преминот од една стационарна состојба во друга. Преминот од повисоко кон пониско енергетско ниво е придружено со емисија на енергетски квант (hv = En - Em), а обратно со апсорпција. Овој постулат е наречен правило на фреквенциите: v = (En - Em) / h.
- На стационарните состојби соодветствува движење на електронот по кружни орбити со определен радиус r. При движењето по стационарните орбити, импулсниот момент на електронот L ги прима дискретните (квантизирани) вредности:
каде што n = 1, 2, 3, ...; m е маса на електронот, а v е линиската брзина. Константата h / 2π = 1,05 10-34 Js е квантната единица на импулсниот момент. Третиот Боров постулат е наречен правило за квантување на орбитите.
Квантномеханички модел
- Главна статија: Квантномеханички модел на атомот.
Врз основа на добиените сознанија за квантната механика (1925) беше создаден новиот квантномеханички модел на атомското јадро, кој во себе ја вклучува идејата за квантување при опишување на состојбата на атомот. Притоа се искористени сознанијата за брановидност при движење на електроните, поради што овде се користи брановата функција. Во таа смисла, електронот нема свое количество на движење и координати, што би се користеле од класичната механика, туку ќе се разгледува веројатноста тој да се најде во одредена зона и соодветна точка во доменот на атомот.
Видете и атомска орбитала.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||




