Фосфат

| |||
| |||
| Систематско име | фосфат[1] | ||
| Назнаки | |||
|---|---|---|---|
| 14265-44-2 | |||
| Бајлштајн | 3903772 | ||
| ChEBI | CHEBI:18367 | ||
| ChemSpider | 1032 | ||
| 1997 | |||
| 3Д-модел (Jmol) | Слика Слика Слика Слика | ||
| MeSH | Phosphates | ||
| PubChem | 1061 | ||
| |||
| UNII | NK08V8K8HR | ||
| Својства | |||
| Хемиска формула | |||
| Моларна маса | 0 g mol−1 | ||
| Конјуг. киселина | моноводород фосфат | ||
| Дополнителни податоци | |||
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |||
| Наводи | |||
Фосфат — анјон, сол, функционална група или естер на фосфорната киселина. Под ова најчесто се подразбира ортофосфат, изведен од ортофосфорната киселина H3PO4.
Фосфатниот или ортофосфатниот јон [PO4]3− е изведен од фосфорна киселина со отстранување на три протони H+. Со отстранување на еден или два протона се добива диводород фосфат [H2PO4]− и водород фосфат [HPO4]2−. Истите имиња важат и за солите на тие анјони, како што се амониум диводород фосфат и тринатриум фосфат.
-
H3PO4
Фосфорна
киселина -
[H2PO4]−
Диводород
фосфат -
[HPO4]2−
Водород
фосфат -
[PO4]3−
Фосфат
Во органската хемија, „фосфат“ или „ортофосфат“ е органофосфат, естер на ортофосфорната киселина од обликот PO4RR′R″ каде еден или повеќе водородни атоми се заменети со органски групи. Таков пример е триметил фосфатот, (CH3)3PO4. Поимот се однесува и на тривалентната функционална група OP(O-)3 кај таквите естри.
Профосфатите имаат особено значење меѓу различните фосфати поради нивните важни улоги во биохемијата, биогеохемијата и екологијата, како и нивната стопанска важност во земјоделството и индустријата.[2] Додавањето и отстранувањето на фосфатни групи (фосфорилација и дефосфорилација) се клучни чекори во клеточниот метаболизам.
Ортофосфатите можат да се кондензираат, образувајќи пирофосфати.
Хемиски својства
[уреди | уреди извор]Фосфатниот јон има моларна маса од 94,97 г/мол и е сочинет од средишен фосфорен атом обиколен со четири кислородни атоми во тетраедарска устроеност. Тој е конјугираната база на јонот водород восфат H(PO4)2−, кој е конјугираната база на јонот диводород фосфат H2(PO4)−, кој пак е конјугираната база на ортофосфорната киселина, H3PO4.
Многу фосфати се растворливи во вода при стандардна температура и притисок. Натриумот, калиумот, рубидиумот, цезиумот и амониумските фосфати се добро раствотливи во вода. Највеќето други фосфати се раствораат само малку или воопшто не се ратвораат во вода. По правило, водородните и диводородните фосфати се малку порастворливи од нивните сродници.
Рамнотежи во раствор
[уреди | уреди извор]
Во воден раствор, ортофосфорната киселина и нејзините три изведени анјони сосуштествуваат согласно долуприкажаните рамнотежи на дисасоцијација и рекомбинација[3]
| Рамнотежа | Дисасоцијациска константа Ka[4] | pKa |
|---|---|---|
| H3PO4 4 + H+ |
Ka1 = [ H+ ] [ H2PO− 4 ] / [ H3PO4 ] ≈ 7.5 × 10−3 |
pKa1 = 2.14 |
| H2PO− 4 4 + H+ |
Ka2 = [ H+ ] [ HPO2− 4 ] / [ H2PO− 4 ] ≈ 6.2 × 10−8 |
pKa2 = 7.20 |
| HPO2− 4 4 + H+ |
Ka3 = [ H+ ] [ PO3− 4 ] / [ HPO2− 4 ] ≈ 2.14 × 10−13 |
pKa3 = 12.37 |
Вредностите вважат за 25 °C и 0 јонска сила.
Вредностите на pKa се pH-вредностите каде концентрацијата на секој вид е еднаква на онаа на неговите конјугирани бази. При pH 1 или пониско, фосфорната киселина е практично недисоцирана. Околу pH 4,7 (на половина меѓу првите две вредности на pKa) јонот диводород фосфат, [H2PO4]−, е практично единствениот преостанат вид. Околу pH 9,8 (на половина меѓу втората и третата вредност на pKa), јонот моноводород фосфат, [HPO4]2−, е единствениот присутен вид. На pH 13 или повисоко, киселината целосно се дисоцира како фосфатниот јон (PO4)3−.
Ова значи дека солите на моно- и дифосфатните јони можат селективно да се кристализираат од воднен раствор со прилагодување на pH-вредноста на 4,7 или 9,8.
Во суштина, H3PO4, H2(PO4)− и H(PO4)2− се однесуваат како одделни слаби киселини бидејќи последователните pKa се разликуваат за повеќе од 4.
Фосфатот може да образува многу полимерни јони како пирофосфат, (P2O7)4−, и трифосфат, (P3O10)5−. Разните метафосфатни јони (кои обично се долги линеарни полимери) имаат емпириска формула (PO3)− и се среќаваат во многу соединенија.
Биохемија на фосфатите
[уреди | уреди извор]Во биолошките системи, фосфорот се среќава како слободни фосфатни анјони во раствор (неоргански фосфат) или сврзан со органски молекули како разни органофосфати.
Неорганскиот фосфат се бележи со Pi и при физиолошка (хомеостатичка) pH-вредност претежно се состои од мешавина од јоните [HPO4]2− и [H2PO4]−. При неутрална pH-вредност, како кај цитозолот (pH = 7,0), концентрациите на ортофосфорна киселина и нејзините три анјони ги имаат соодносите
- [ H2PO−
4 ] / [ H3PO4 ] ≈ 7,5 × 104 - [ HPO2−
4 ] / [ H2PO−
4 ] ≈ 0,62 - [ PO3−
4 ] / [ HPO2−
4 ] ≈ 2,14 × 10−6
Така, само јоните [H2PO4]− и [HPO4]2− се присутни во значајни количини во цитозолот (62 % [H2PO4]−, 38 % [HPO4]2−). Во вонклеточната течност (pH = 7,4), овој сооднос е обратен (61 % [HPO4]2−, 39 % [H2PO4]−).
Неорганскиот фосфат може да биде присутен и како пирофосфатни анјони [P2O7]4−, кои даваат ортофосфат по пат на хидролиза:
- [P2O7]4− + H2O
 2 [HPO4]2−
2 [HPO4]2−
Органските фосфати се често застапени во облик на естри како нуклеотиди (на пр. АМФ, АДФ, и АТФ) и во ДНК и РНК. Слободните ортофосфатни анјони можат да се ослободат со хидролиза на фосфоанхидридните врски во АТФ или АДФ. Овие реакции на фосфорилација и дефосфорилација се непосредниот склад и извор на енергија за многу метаболички процеси. АТФ и АДФ често се нарекуваат високоенергетски фосфати, како што е случај и со фосфагените во мискулното ткиво. Слични реакции постојат и за другите нуклеозидни дифосфати и трифосфати.
Во коските и забите
[уреди | уреди извор]Фосфатите се структурен материјал на коските и забите. Овие структури се сочинети од кристален калциум фосфат во облик на хидроксилапатит. Тврдата густа глеѓ на забите кај цицачите може да содржи флуоропатит, хидроксилен калциум фосфат кај кој некои од хидроксилните групи се заменети со флуоридни јони.
Медицинска употреба
[уреди | уреди извор]Медицинскиот тип (сол) на фосфорот е фосфатот. Некои фосфати, кои лекуваат многу инфекции на мочните патишта, се користат за скиселување на мочта, спречувајќи го создавањето на камењата.[5] Фосфатите се даваат како додаток кај пациентите кои не можат да внесат доволно фосфор во исхраната, обично поради извесни пореметувања или болести.[5]
Растителен метаболизам
[уреди | уреди извор]Растенијата примаат фосфор со арбускуларна микориз или со непосредно впивање.
Штетоност по здравјето
[уреди | уреди извор]Хиперфосфатемијата е заболување предизвикано од прекумерна количина на фосфати во крвта, и поврзано е со зголемена смртност кај населението. Хиперфосфатемијата ја предизвикуваат фосфатните прехранбени адитиви, бидејќи фосфатите природно застапени во храната нецелосно се впиваат во цревата. Фосфатите предизвикуваат калцификација на крвните садови, а високата концентрација на фосфати во крвта предизвикува срцеви заболувања.[6]
Фосфатите често се употребуваат како адитиви во индустриски преработена храна и брзата храна, кои се главни причинители за зголеменото внесување на фосфати меѓу населението. Фосфатните адитиви исто така често се среќаваат во газираните пијалаци како и некои млечни производи.[6]
Производство
[уреди | уреди извор]Геолошка застапеност
[уреди | уреди извор]

Фосфатите се природен облик на елементот фосфор, присутни во многу фосфатни минерали. Во минералогијата и геологијата, под фосфат се подразбира карпа или руда која содржи фосфатни јони. Неорганските фосфати се ископуваат од рудници за добивање на фосфор за земјоделството и индустријата.[2]
Најголем светски производител и извозник на фосфати е Кина.
Фосфоритни рудници има во:
- Африка: Мароко, Алжир, Египет, Нигер, Сенегал, Того, Тунис, Мавританија
- Близок Исток: Саудиска Арабија, Јордан, Израел, Сирија, Иран и Ирак кај гратчето Акашат близу границата со Хордан
- Северна Америка: САД, особено Флорида, со помали лежишта во Северна Каролина, Ајдахо и Тенеси
- Средна Азија: Казахстан
- Океанија: Австралија, Макатеја (Ф. Полинезија), Науру и Банаба (Кирибати)
Во 2007 г. е предвидено дека залихите на фосфор би биле исцрпени за 345 години со тогашното ниво на потрошувачка.[7]
Во декември 2012 г. во Република Конго е утврдено најголемото лежиште во светот со 531 милиони тони фосфат.[8]
Најголеми увозници на фосфат во светот се Бразил (3,2 милиони тони) Индија (2,9) и САД (1,6).[9]
Производство на фосфат
[уреди | уреди извор]Трите најголеми производители на фосфати (Кина, Мароко и САД) сочинуваат 70 % од светското производство.
| Земја | Производство (милиони кг) |
Удел во светското производство (%) |
Резерви (милиони кг) |
|---|---|---|---|
| 2.700 | 1,17 | 1.100.000 | |
| 1.300 | 0,54 | 2.200.000 | |
| 4.700 | 3,00 | 1.600.000 | |
| 4.650 | 1,21 | 30.000 | |
| 5.000 | 2,47 | 2.800.000 | |
| 2.810 | 1,48 | 57.000 | |
| 1.480 | 0,49 | 46.000 | |
| 200 | 0,09 | 430.000 | |
| 2.100 | 0,99 | 1.400.000 | |
| 9.220 | 3,36 | 800.000 | |
| 1.500 | 0,72 | 260.000 | |
| 95.000 | 44,83 | 3.200.000 | |
| 35.500 | 13,45 | 50.000.000 | |
| 558 | 0,76 | 30.000 | |
| 4.000 | 1,79 | 210.000 | |
| 13.100 | 5,60 | 600.000 | |
| 23.300 | 12,37 | 1.000.000 | |
| 6.500 | 1,48 | 1.400.000 | |
| 3.420 | 0,45 | 50.000 | |
| 2.000 | 0,34 | 1.800.000 | |
| 800 | 0,45 | 30.000 | |
| 4.110 | 1,79 | 100.000 | |
| 900 | 0,39 | 100.000 | |
| 995 | 0,44 | 1.000.000 | |
| останати земји | 1.140 | 1,17 | 840.000 |
| Вкупно | 227.000 | 100 | 71.000.000 |
Екологија
[уреди | уреди извор]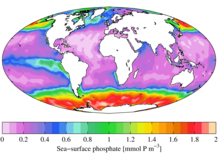
Од еколошко гледиште, фосфатот е мошне потребен ресурс поради неговата важна улога во биолошките системи, и недостатокот се одразува врз растот на организмите. Ова важи за слатководните средини, а во морските средини таа улога ја има азотот. Одлагањето на големи количеста на фосфат во средините каде тој обично е редок има значителни еколошки последици. На пример, ова може да предизвика подем на извесни организми за сметка на други, и помор на видови лишени од ресурси како кислород (еутрофикација). Во контекст на загадувањето, фосфатите се една составница на растворените супстанции, кои се главен показател за квалитетот на водата, макар што не целиот фосфор се наоѓа во молекуларен облик кој алгите можат да го разградат и примат.[11]
Калциум хидрксиапатитот и калцитните наслаги се среќаваат околу бактерии во горниот слој на алувијалната почва.[12] Бидејќи глинестите минерали предизвикуваат биоминерализација, присуството на бактерии и глинести минерали водат до наслаги од калциум хидроксиапатит и калцити.[12]
Фосфатните лежишта може да содржат значително количество на тешки метали. При обработката на фосфатна руда остануваат јаловишта со зголемено количество на кадмиум, олово, никел, бакар, хром и ураниум. Доколку не се преземаат внимателни мерки, овој отпад може да исцеди тешки метали во подземните води или околните речни устија. Тогаш растенијата и морските животни би ги примиле овие супстанции, што води до присуство на токсични тешки метали во прехранбените производи.[13]
Поврзано
[уреди | уреди извор]Наводи
[уреди | уреди извор]- ↑ „Phosphates – PubChem Public Chemical Database“. The PubChem Project. USA: National Center of Biotechnology Information.
- ↑ 2,0 2,1 „Phosphate Primer“. Florida Industrial and Phosphate Research Institute. Florida Polytechnic University. Архивирано од изворникот 29 август 2017. Посетено на 30 март 2018.
- ↑ Campbell, Neil A.; Reece, Jane B. (2005). Biology (Seventh. изд.). San Francisco, California: Benjamin Cummings. стр. 65. ISBN 0-8053-7171-0.
- ↑ Kipton J. Powell, Paul L. Brown, Robert H. Byrne, Tamás Gajda, Glenn Hefter, Staffan Sjöberg, Hans Wanner (2005): "Chemical speciation of environmentally significant heavy metals with inorganic ligands. Part 1: The Hg2+, Cl−, OH−, CO2−
3, SO2−
4, and PO3−
4 aqueous systems". Pure and Applied Chemistry, volume 77, issue 4, стр, 739–800. doi:10.1351/pac200577040739 - ↑ 5,0 5,1 „Phosphate Supplement (Oral Route, Parenteral Route) Description and Brand Names - Mayo Clinic“. www.mayoclinic.org. Посетено на 20 ноември 2020.
- ↑ 6,0 6,1 Ritz, Eberhard; Hahn, Kai; Ketteler, Markus; Kuhlmann, Martin K.; Mann, Johannes (јануари 2012). „Phosphate additives in food--a health risk“. Deutsches Ärzteblatt International. 109 (4): 49–55. doi:10.3238/arztebl.2012.0049. ISSN 1866-0452. PMC 3278747. PMID 22334826.
- ↑ Reilly, Michael (26 мај 2007). „How Long Will it Last?“. New Scientist. 194 (2605): 38–9. Bibcode:2007NewSc.194...38R. doi:10.1016/S0262-4079(07)61508-5.
- ↑ „Updated Hinda Resource Announcement: Now world's largest phosphate deposit (04/12/2012)“. Cominco Resources. Архивирано од изворникот на 5 октомври 2016. Посетено на 3 мај 2013.
- ↑ „Top countries for Phosphate Fertilizer Imports“.
- ↑ „PHOSPHATE ROCK, usgs“ (PDF).
- ↑ Hochanadel, Dave (10 декември 2010). „Limited amount of total phosphorus actually feeds algae, study finds“. Lake Scientist. Посетено на 10 јуни 2012.
[B]ioavailable phosphorus – phosphorus that can be utilized by plants and bacteria – is only a fraction of the total, according to Michael Brett, a UW engineering professor ...
- ↑ 12,0 12,1 Schmittner KE, Giresse P (1999). „Micro-environmental controls on biomineralization: superficial processes of apatite and calcite precipitation in Quaternary soils, Roussillon, France“. Sedimentology. 46 (3): 463–76. Bibcode:1999Sedim..46..463S. doi:10.1046/j.1365-3091.1999.00224.x. S2CID 140680495.
- ↑ Gnandi, K.; Tchangbedjil, G.; Killil, K.; Babal, G.; Abbel, E. (март 2006). „The Impact of Phosphate Mine Tailings on the Bioaccumulation of Heavy Metals in Marine Fish and Crustaceans from the Coastal Zone of Togo“. Mine Water and the Environment. 25 (1): 56–62. doi:10.1007/s10230-006-0108-4. S2CID 129497587.
Надворешни врски
[уреди | уреди извор] Фосфат на Ризницата ?
Фосфат на Ризницата ?- Фосфат — Енциклопедија Британика (англиски)
- Фосфати — Голема руска енциклопедија (руски)
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|




![[H2PO4]− Диводород фосфат](http://upload.wikimedia.org/wikipedia/commons/thumb/d/db/2-dihydrogenphosphate-3D-balls.png/152px-2-dihydrogenphosphate-3D-balls.png)
![[HPO4]2− Водород фосфат](http://upload.wikimedia.org/wikipedia/commons/thumb/8/87/1-hydrogenphosphate-3D-balls.png/123px-1-hydrogenphosphate-3D-balls.png)
![[PO4]3− Фосфат](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b0/0-phosphate-3D-balls.png/120px-0-phosphate-3D-balls.png)