Геномика
| Дел од темата |
| „Генетика“ |
|---|
| Најважни поими |
| Историја и теми |
| Истражувања |
|
|
Геномика ― меѓудисциплинарно поле на биологијата што се насочува на структурата, функцијата, еволуцијата, картирањето и уредувањето на геномите. Геномот е целосен сет на ДНК на организмот, вклучувајќи ги сите негови гени, како и неговата хиерархиска, тридимензионална структурна конфигурација.[1][2][3][4] За разлика од генетиката, која се однесува на проучување на „поединечни“ гени и нивните улоги во наследувањето, геномиката има за цел збирно одликување и квантификација на „сите“ гени на организмот, нивните меѓусебни односи и влијание врз организмот.[5] Гените може да го насочат производството на протеини со помош на ензими и молекули на гласници. За возврат, протеините ги сочинуваат телесните структури како органи и ткива, како и контролираат хемиски реакции и носат сигнали помеѓу клетките. Геномиката, исто така, вклучува секвенционирање и анализа на геномите преку употреба на секвенционирање на ДНК со висока пропусна моќ и биоинформатика за да се соберат и анализираат функцијата и структурата на цели геноми.[6][7] Напредокот во геномијата предизвика револуција во истражувањето засновано на откритија и системската биологија за да биде олеснето разбирањето дури и на најсложените биолошки системи како што е мозокот.[8]
Областа, исто така, вклучува студии за интрагеномски (во рамките на геномот) феномени како што се епистаза (ефект на еден ген врз друг), плејотропија (еден ген што влијае на повеќе од една карактеристика), хетероза (хибридна сила) и други меѓудејствија помеѓу локусите и алелите во геномот.[9]
Историја
[уреди | уреди извор]Етимологија
[уреди | уреди извор]Од грчкиот збор „ген“[10] (гама, ипсилон, ну, ипсилон) што значи „стане, создава, создавање, раѓање“ и последователни варијанти: генеалогија, генеза, генетика, ген, геном, генотип, генус (род) итн. Додека зборот геном (од германскиот збор genom, припишан на Ханс Винклер) бил во употреба на англиски уште во 1926 година,[11] поимот геномика бил измислен од Том Родерик, генетичар во Џексоновата лабораторија (Бар Харбор, Мејн), за време на пиење пиво со Џим Вомак, Том Шоус и Стивен О'Брајан на состанокот одржан во Мериленд за картирање на човечкиот геном во 1986 година.[12] Прво како име за ново списание, а потоа како сосема нова научна дисциплина.[13]
Рани напори за секвенционирање
[уреди | уреди извор]По потврдата на Розалинд Френклин за спиралната структура на ДНК, публикацијата на Џејмс Вотсон и Френсис Крик, за структурата на ДНК во 1953 година, и публикацијата на Фред Сенгер за аминокиселинската секвенца на инсулинот во 1955 година, секвенцирањето на јадрената киселина станала главна цел на раните молекуларни биолози.[14] Во 1964 година, Роберт В. Холи и неговите колеги ја објавиле првата секвенца на јадрена киселина што некогаш била утврдена, рибонуклеотидната секвенца на аланинска преносна РНК.[15][16] Проширувајќи ја оваа работа, Маршал Ниренберг и Филип Ледер ја откриле тројната природа на генетскиот код и биле во можност да ги одредат секвенците на 54 од 64 кодони во нивните опити.[17] Во 1972 година, Валтер Фиерс и неговата екипа во Лабораторијата за молекуларна биологија на Универзитетот во Гент (Гент, Белгија) биле првите кои ја утврдиле низата на генот: генот за бактериофагскиот MS2 обвивен протеин.[18] Групата на Фиерс ја проширила својата работа на MS2 обвивката на протеините, одредувајќи ја целосната јадрена секвенца на бактериофагот MS2-RNA (чиј геном кодира само четири гени во 3569 базни парови) и Симјан вирус 40 во 1976 и 1978 година, соодветно.[19][20]
Развивање на технологијата за секвенционирање на ДНК
[уреди | уреди извор]
Покрај неговата основна работа на аминокиселинската секвенца на инсулинот, Фредерик Сенгер и неговите колеги одиграле клучна улога во развојот на техники за секвенционирање на ДНК кои овозможиле воспоставување на сеопфатни проекти за секвенционирање на геномот.[9] Во 1975 година, тој и Алан Коулсон објавиле постапка за секвенционирање користејќи ДНК полимераза со радиоозначени нуклеотиди што тој ја нарекол Техника „плус и минус“.[21][22] Ова вклучува два тесно поврзани методи кои создаваат кратки олигонуклеотиди со дефинирани 3' завршници. Тие може да бидат поделени со електрофореза на полиакриламиден гел (наречен електрофореза со полиакриламиден гел) и да бидат видени со користење на авторадиографија. Постапката можела да биде секвенционирана до 80 нуклеотиди во едно движење и било големо подобрување, но сепак била многу макотрпна. Како и да е, во 1977 година неговата група успеала да ги секвенционира повеќето од 5.386 нуклеотиди на едноверижниот бактериофаг φX174, завршувајќи го првиот целосно секвенциониран геном заснован на ДНК.[23] Усовршувањето на методот „плус и минус“ резултирало со завршување на синџирот, или Сенгеровиот метод (види подолу), кој ја образувал основата на техниките на секвенционирање на ДНК, картирањето на геномот, складирање податоци и биоинформатска анализа најшироко користени во следните 25-годишни истражувања.[24][25] Истата година, Волтер Гилберт и Алан Максам од Универзитетот Харвард независно го развиле Максам-Гилбертовиот медот (исто така познат како „хемиски метод“) за секвенционирање на ДНК, што вклучува преференцијално расцепување на ДНК на познати бази, помалку ефикасен метод.[26][27] За нивната револуционерна работа во секвенционирањето на нуклеинските киселини, Гилберт и Сенгер ја поделиле половина од Нобеловата награда за хемија во 1980 година со Пол Берг (рекомбинантна ДНК).
Целосни геноми
[уреди | уреди извор]Доаѓањето на овие технологии резултирала со брзо интензивирање на обемот и брзината на завршување на проектите за секвенционирање на геномот. Првата целосна геномска секвенца на еукариотска органела, човечкиот митохондрион (16,568 bp, околу 16,6 kb [килобаза]), била пријавена во 1981 година,[28] и првите геноми на хлоропласти следеле во 1986 година.[29][30] Во 1992 година, првиот еукариотски хромозом, хромозомот III на пивскиот квасец Saccharomyces cerevisiae (315 kb) бил секвенциониран.[31] Првиот слободно жив организам што бил секвенциониран бил оној на Haemophilus influenzae (1,8 Mb [мегабаза]) во 1995 година.[32] Следната година, конзорциум од истражувачи од лаборатории низ Северна Америка, Европа и Јапонија го објавиле завршувањето на првата целосна геномска секвенца на еукариот, S. cerevisiae (12,1 Mb), и оттогаш геномите продолжиле да бидат секвенирани со експоненцијално растечки темпо.[33] Согласно 2011 година, целосните секвенци се достапни за: 2.719 вируси, 1.115 археи и бактерии и 36 еукариоти, од кои околу половина се габи.[34][35]

Повеќето од микроорганизмите чии геноми се целосно секвенционирани се проблематични патогени, како што е Haemophilus influenzae, што резултирало со изразена пристрасност во нивната филогенетска распространетост во споредба со ширината на микробната разновидност.[36][37] Од другите секвенционирани видови, повеќето биле избрани затоа што биле добро проучени организми-модели или ветиле дека ќе станат добри модели. Лебниот квасец (Saccharomyces cerevisiae) долго време биле важен моделен организам за еукариотската клетка, додека овошната мушичка Drosophila melanogaster била многу важна алатка (особено во раната предмолекуларна генетика). Црвот Caenorhabditis elegans е често користен едноставен модел за многуклеточни организми. Зебрестата риба Brachydanio rerio е користена за многу развојни студии на молекуларно ниво, а растението Arabidopsis thaliana е модел на организам за цветни растенија. Јапонската дуечка риба (Takifugu rubripes) и Точкестата зелена дуечка риба (Tetraodon nigroviridis) се интересни поради нивните мали и збиени геноми, кои содржат многу малку некодирачка ДНК во споредба со повеќето видови.[38][39] Од цицачите, домашното куче (Canis familiaris),[40] кафеавиот стаорец (Rattus norvegicus), глушецот (Mus musculus) и обичното шимпанзо (Pan troglodytes) се сите важни животни-модели во медицинските истражувања.[27]
Груб нацрт на човечкиот геном бил завршен од страна на Проектот за човечки геном на почетокот на 2001 година, создавајќи многу одбележани настани.[41] Овој проект, завршен во 2003 година, го секвенционирал целиот геном за една посебна личност, а до 2007 година оваа низа била прогласена за „завршена“ (помалку од една грешка во 20.000 бази и сите собрани хромозоми).[41] Во годините оттогаш, геномите на многу други поединци биле секвенционирани, делумно под покровителство на Проектот „1000 геноми“, кој го објавил секвенционирањето на 1.092 геноми во октомври 2012 година.[42] Завршувањето на овој проект било овозможено со развојот на драматично поефикасни технологии за секвенционирање и барало посветеност на значајни биоинформатички ресурси од голема меѓународна соработка.[43] Постојаната анализа на човечките геномски податоци има длабоки политички и општествени реперкусии за човечките општества.[44]
Револуцијата на „омика“.
[уреди | уреди извор]Неологизмот „омикс“ (omics) на англиски јазик неформално се однесува на поле на студии по биологија што завршува на „-омика“, како што се геномика, протеомика или метаболомика. Поврзаниот суфикс „-ом“ (-ome) е користен за адресирање на предметите на проучување на таквите полиња, како што се геномот, протеомот или метаболомот (липидом), соодветно. Наставката -ом како што е користена во молекуларната биологија се однесува на некаков „тоталитет“; на сличен начин, „омиката“ воглавно се однесува на проучување на големи, сеопфатни збирки на биолошки податоци. Додека растот на употребата на поимот доведе некои научници (Џонатан Ајзен, меѓу другите[45]) да тврдат дека тој е прекористен,[46] тој ја одразува промената во ориентацијата кон квантитативната анализа на целосна или речиси целосна асортиман на сите составни делови на еден систем.[47] Во проучувањето на симбиозите, на пример, истражувачите кои некогаш биле ограничени на проучување на еден производ од еден ген, сега можат истовремено да го споредат вкупниот комплемент на неколку видови биолошки молекули.[48][49]
Анализа на геном
[уреди | уреди извор]Откако ќе биде избран организам, геномските проекти вклучуваат три компоненти: секвенционирање на ДНК, составување на таа низа за да се создаде претстава на првичниот хромозом и прибелешка и анализа на таа претстава.[9]
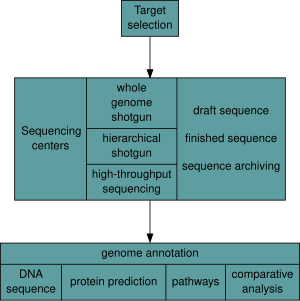
Секвенционирање
[уреди | уреди извор]Историски гледано, секвенционирањето се правело во центри за секвенционирање, централизирани работни единици (од големи независни установи како што е Заедничкиот институт за геном кој секвенционира десетици терабази годишно, до месни основни работни единици за молекуларна биологија) кои содржат истражувачки лаборатории со неопходна скапа инструментација и техничка поддршка. Меѓутоа, како што технологијата на секвенционирање продолжува да биде подобрувана, новата генерација на ефективни секвенционери за брзо превртување е на дофат на просечната академска лабораторија.[50][51] Во целина, пристапите за секвенционирање на геномот спаѓаат во две широки категории, т.н. „сачмарка“ и секвенционирање со т.н. „висок пропуст“ (или „следна генерација“).[9]
Секвенционирање со „сачмарка“
[уреди | уреди извор]
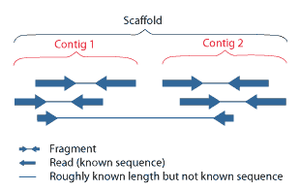
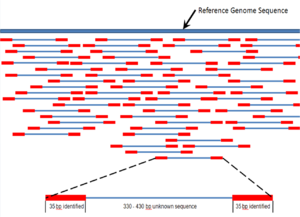
Секвенционирањето со „сачмарка“ е метод на секвенционирање дизајниран за анализа на секвенци на ДНК подолги од 1000 базни парови, до и вклучувајќи цели хромозоми.[52] Именуван е по аналогија со брзорастечкиот, квазислучаен модел на пукање на сачмарка. Бидејќи секвенционирањето со гелска електрофореза може да биде користено само за прилично кратки секвенци (100 до 1000 базни парови), подолгите ДНК секвенци мора да бидат поделени на случајни мали сегменти кои потоа се секвенционирани за да бидат добиени отчитувања. Повеќекратните преклопувачки отчитувања за целната ДНК се добиваат со извршување на неколку круга на оваа фрагментација и секвенционирање. Сметачките програми потоа користат преклопувачки краеви на различни читања за да ги соберат во продолжена низа.[52][53] Секвенционирањето со сачмарка е постапка на случајно земање примероци, кој бара прекумерно земање примероци за да се осигура дека даден нуклеотид е претставен во реконструираната низа; просечниот број на читања со кои геномот е прекумерен примерок се нарекува покриеност.[54]
Во поголемиот дел од својата историја, технологијата во основата на секвенционирањето со „сачмарка“ бил класичниот метод на завршување на синџирот или „Сенгеров метод“, кој се заснова на избрано вклучување на дидеоксинуклеотиди кои завршуваат синџир со ДНК-полимераза за време на ин витро репликација на ДНК.[23][55] Неодамна, секвенционирањето со „сачмарка“ е заменето со методи на секвенционирање со голема брзина, особено за големи, автоматизирани анализи на геномот. Сепак, Сенгеровиот метод останува во широка употреба, првенствено за проекти од помал обем и за добивање особено долги отчитувања на секвенци на ДНК (>500 нуклеотиди).[56] Методите за завршување на синџирот бараат едноверижна шаблон за ДНК, ДНК зачетник, ДНК-полимераза, нормални деоксинуклеозидтрифосфати (dNTP) и модифицирани нуклеотиди (дидеоксиНТПи) кои го завршуваат издолжувањето на влакното на ДНК-та. Овие нуклеотиди кои завршуваат со синџирот немаат 3'-OH група потребна за образување на фосфодиестерска врска помеѓу два нуклеотида, предизвикувајќи ДНК полимеразата да престане да продолжување на ДНК кога ddNTP е вклучена. ddNTPs може да бидат радиоактивно или флуоресцентно означени за детекција во секвенционерите на ДНК.[9] Вообичаено, овие машини можат да секвенционираат до 96 примероци на ДНК во една серија (работа) до 48 вртења на ден.[57]
Секвенционирање со голема брзина
[уреди | уреди извор]Високата побарувачка за секвенционирање со ниска цена го поттикнало развојот на технологии за секвенционирање со висок процент што го паралелизираат постапката на секвенционирање, произведувајќи илјадници или милиони секвенци одеднаш.[58][59] Секвенционирањето со висок пропусен опсег е наменето да ги намали трошоците за секвенционирање на ДНК над она што е можно со стандардните методи на одлучување со боја. Во секвенционирањето со ултра висок пропусен опсег, може да бидат извршувани напоредно дури 500.000 зафати на секвенционирање по синтеза.[60][61]

Методот на секвенционирање со боја на Илумина се заснова на реверзибилни одлучувачи со бои и е развиен во 1996 година во Женевскиот биомедицински истражувачки институт, од Паскал Мајер и Лоран Фаринели.[62] Во овој метод, молекулите на ДНК и зачетниците прво се прикачувани на слајд и се засилуваат со полимераза, така што се образувани месни клонски колонии, првично именувани како „ДНК колонии“. За да биде одредена низата, се додавани четири врсти на реверзибилни терминаторски бази (RT-бази) и се измиваат невклучените нуклеотиди. За разлика од пиросеквенционирањето, синџирите на ДНК се прошируваат еден по еден нуклеотид и стекнувањето на сликата може да биде извршено во задоцнет момент, овозможувајќи многу големи низи на ДНК колонии да бидат фатени со секвенцијални слики направени од една камера. Одвојувањето на ензимската реакција и снимањето на сликата овозможува оптимална пропусност и теоретски неограничен капацитет за секвенционирање; со оптимална конфигурација, крајната пропусност на инструментот зависи само од стапката на конверзија A/D на камерата. Камерата прави слики од флуоресцентно означените нуклеотиди, а потоа бојата заедно со терминалниот 3' блокатор се хемиски отстранети од ДНК, овозможувајќи го следниот циклус.[63]
Алтернативен пристап, секвенционирање на јонски полупроводници, се заснова на стандардна хемија за репликација на ДНК. Оваа технологија го мери ослободувањето на водороден јон секој пат кога базата е вградена. Микробунар што содржи шаблонска ДНК е преплавен со еден нуклеотид, доколку нуклеотидот е комплементарен со шаблонот, тој ќе биде вграден и ќе биде ослободен водороден јон. Ова ослободување активира ISFET јонски сензор. Доколку е присутен хомополимер во шаблонската низа повеќе нуклеотиди ќе бидат вклучени во еден циклус на поплава, а откриениот електричен сигнал ќе биде пропорционално поголем.[64]
Составување
[уреди | уреди извор]Склопувањето секвенца се однесува на порамнување и спојување на фрагменти од многу подолга ДНК секвенца со цел да биде реконструирана првичната секвенца.[9] Ова е потребно бидејќи сегашната технологија за секвенционирање на ДНК не може да чита цели геноми како продолжена секвенца, туку чита мали делови од помеѓу 20 и 1000 бази, во зависност од користената технологија. Технологиите за секвенционирање од трета генерација како што се PacBio или Oxford Nanopore рутински генерираат секвенционирање читања >10 kb во должина; сепак, тие имаат висока стапка на грешка од приближно 15 проценти.[65][66] Вообичаено, кратките фрагменти, наречени читања, произлегуваат од секвенционирање на геномската ДНК од пушка или генски транскрипти (изразен секценциски белешки).[9]
Пристапи до составување
[уреди | уреди извор]Составувањето може широко да биде категоризирано во два пристапа: склопување „на ново“ (de novo), за геномите кои не се слични на ниеден секвенциониран во минатото, и споредбено склопување, кое ја користи постоечката низа на тесно поврзан организам како референца за време на склопувањето.[54] Во однос на споредбеното склопување, склопување „на ново“ е сметачки тешко (NP-hard), што го прави помалку поволно за NGS технологии за кратко читање. Во рамките на парадигмата на de novo склопување постојат две примарни стратегии за склопување, стратегии за Ојлеров пат и стратегии за преклопување-распоред-консензус. Стратегиите со преклопување-распоред-консензус на крајот се обидуваат да создадат Хамилтонова патека низ графикот на преклопување што е проблем со NP-hard. Стратегиите на Ојлеровата патека се пресметувачки попогодни затоа што се обидуваат да најдат Ојлеров пат преку деБруеновиот граф.[54]
Завршување
[уреди | уреди извор]Завршените геноми се дефинирани како да имаат единствена соседна секвенца без нејаснотии што го претставуваат секој репликон.[67]
Прибелешка
[уреди | уреди извор]Само склопот на ДНК секвенцата е од мала вредност без дополнителна анализа.[9] Прибелешката на геномот е постапка на прикачување на биолошки информации на секвенци и се состои од три главни чекори:[68]
- идентификување на делови од геномот кои не кодираат протеини
- идентификување на елементи на геномот, постапка наречена генско предвидување и
- прикачување на биолошки информации за овие елементи.
Алатките за автоматска прибелешка се обидуваат да ги изведат овие чекори „in silico“, за разлика од рачната прибелешка (позната и како курација) која вклучува човечка стручност и потенцијална опитна верификација.[69] Идеално, овие пристапи взаемно постојат и се надополнуваат еден со друг во истите прибелешки (исто така видете подолу).
Традиционално, основното ниво на прибелешка е користењето на BLAST за пронаоѓање сличности, а потоа и прибележување на геномите засновани на хомолози.[9] Во поново време, дополнителни информации се додадени на платформата за прибелешки. Дополнителните информации им овозможуваат на рачните прибележувачи да ги отстранат несовпаѓањата помеѓу гените на кои им е дадена истата прибелешка. Некои бази на податоци користат информации за контекстот на геномот, резултати за сличност, експериментални податоци и интеграции на други ресурси за да обезбедат прибелешки за геномот преку нивниот пристап на Подсистеми. Другите бази на податоци (на пр. Ensembl) се потпираат на курирани извори на податоци, како и на низа софтверски алатки во нивната автоматизирана проточна обработка за прибелешки за геном.[70] „Структурната прибелешка“ се состои од идентификација на геномски елементи, првенствено ORF и нивна локализација, или структура на ген. „Функционалната прибелешка“ се состои од прикачување на биолошки информации на геномските елементи.
Секвенционирање на проточна обработка и бази на податоци
[уреди | уреди извор]Потребата за репродуктивност и ефикасно управување со големиот број податоци поврзани со геномските проекти значи дека пресметковните цевководи имаат важна примена во геномиката.[71]
Истражувачки области
[уреди | уреди извор]Функционална геномика
[уреди | уреди извор]Функционална геномика е поле на молекуларната биологија која се обидува да го искористи огромното богатство на податоци произведени од геномски проекти (како што се проектите за секвенционирање на геномот) за да ги опише функциите и интеракциите на гените (и протеините). Функционалната геномика се насочува на динамичките гледишта како што се генска транскрипција, транслација и протеин-протеински меѓудејствија, наспроти статичните аспекти на геномските информации како што се нуклеотидната низа или структурите. Функционална геномика се обидува да одговори на прашањата за функцијата на ДНК на нивоа на гени, транскрипти на РНК и протеински производи. Клучна одлика на изучувањата за функционална геномика е нивниот пристап на овие прашања ширум геномот, кој воглавно вклучува методи со висок пропуст наместо потрадиционален пристап „ген по ген“.
Главната гранка на геномиката сè уште се занимава со секвенционирање на геномите на различни организми, но познавањето на целосните геноми создаде можност за полето на функционална геномика, главно поврзано со моделите на генско изразување при различни услови. Најважните алатки овде се микронизите и биоинформатиката.
Структурна геномика
[уреди | уреди извор]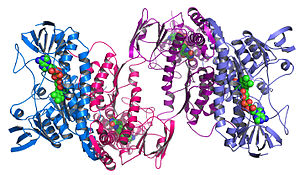
Структурната геномика се обидува да ја опише тродимензионалната структура на секој протеин кодиран од даден геном.[72][73] Овој пристап заснован на геном овозможува метод за определување на структурата со висока пропусност со комбинација на опитни и моделни пристапи. Основната разлика помеѓу структурната геномика и традиционалното структурно предвидување е дека структурната геномика се обидува да ја одреди структурата на секој протеин кодиран од геномот, наместо да се насочува на еден одреден протеин. Со достапни секвенци со целосен геном, предвидувањето на структурата може да се направи побрзо преку комбинација на опитни и моделни пристни, особено затоа што достапноста на голем број на секвенционирани геноми и претходно решени протеински структури им овозможуваат на научниците да ја моделираат структурата на протеините на структурите на претходно решените хомологи. Структурната геномика вклучува преземање голем број пристапи за одредување структура, вклучувајќи опитни методи со користење на геномски секвенци или пристапи засновани на моделирање засновани на секвенца или структурна хомологија на протеин со позната структура или врз основа на хемиски и физички начела за протеин без хомологија на која било позната структура. За разлика од традиционалната структурна биологија, определувањето на структурата на белковинот преку структурен геномичен напор често (но не секогаш) доаѓа пред што било познато во врска со протеинската функција. Ова покренува нови предизвици во структурната биоинформатика, т.е. одредување на функцијата на протеините од неговата тродимензионална структура.[74]
Епигеномика
[уреди | уреди извор]Епигеномиката е проучување на целосниот сет на епигенетски модификации на генетскиот материјал на клетката, познат како епигеном.[75] Епигенетските модификации се реверзибилни модификации на ДНК или хистони на клетката кои влијаат на генското изразување без промена на ДНК секвенцата.[76] Две од најособените епигенетски модификации се метилацијата на ДНК и хистонската модификација.[77] Епигенетските модификации играат важна улога во генското изразување и регулација и се вклучени во бројни клеточни постапки како што се диференцијацијата/развојот [78] и туморигенезата.[75] Студијата на епигенетиката на светско ниво е овозможена дури неодамна преку приспособување на геномски тестови со висока пропусност.[79]
Метагеномика
[уреди | уреди извор]
Метагеномиката е проучување на метагеномите, генетски материјал обновен директно од примероци од животната средина. Широкото поле може да се нарече и како еколошка геномика, економика или геномика на заедницата. Додека традиционалната микробиологија и секвенционирањето на микробиолошкиот геном се потпираат на култивирани клонски култури, раното секвенционирање на гените во животната средина клонирала специфични гени (често генот 16S рибозомна РНК) за да произведе профил на разновидност во природен примерок. Таквата работа откри дека огромното мнозинство на микробиолошка биоразновидност е пропуштено од методите засновани на одгледување.[80] Неодамнешните студии користат Сенгеровото секвенционирање со „сачмарка“ или масовно напоредно пиросеквенционирање за да бидат добиени главно непристрасни примероци од сите гени од сите членови на земените заедници.[81] Поради својата моќ да ја открие претходно скриената разновидност на микроскопскиот живот, метагеномијата нуди моќна леќа за гледање на микробниот свет што има потенцијал да го револуционизира разбирањето на целиот жив свет.[82][83]
Моделни системи
[уреди | уреди извор]Вируси и бактериофаги
[уреди | уреди извор]Бактериофагите играа и продолжуваат да играат клучна улога во бактериската генетика и молекуларната биологија. Историски гледано, тие биле користени за дефинирање на структурата на гените и генската регулација. Исто така, првиот геном што бил секвенциониран бил бактериофаг. Сепак, истражувањето на бактериофагите не ја предводел геномската револуција, во која очигледно надвладејува бактериската геномика. Само неодамна станало истакнато проучувањето на геномите на бактериофагите, со што им овозможува на истражувачите да ги разберат механизмите на еволуцијата на бактериофагот. Секвенците на геномот на бактериофагот може да бидат добиени преку директно секвенционирање на изолирани бактериофаги, но исто така може да бидат изведени како дел од микробиолошките геноми. Анализата на бактериските геноми покажало дека значителна количина на микробна ДНК се состои од профажни секвенци и елементи слични на профаги.[84] Подробната база на податоци која ги ископува овие секвенци нуди увид во улогата на профагите во обликувањето на бактерискиот геном: Воглавно, овој метод потврдил многу познати бактериофаги групи, што го прави ова корисна алатка за предвидување на односите на профагите од бактериските геноми.[85][86]
Цијанобактерии
[уреди | уреди извор]Во моментов има 24 цијанобактерии за кои е достапна вкупна геномска секвенца. 15 од овие цијанобактерии доаѓаат од морската средина. Тоа се шест соеви Prochlorococcus, седум морски Synechococcus соеви, Trichodesmium erythraeum IMS101 и Crocosphaera watsonii WH8501. Неколку студии покажале како овие секвенци може многу успешно да бидат користени за да бидат заклучени важни еколошки и физиолошки одлики на морските цијанобактерии. Сепак, има многу повеќе геномски проекти во моментот во тек, меѓу нив има дополнителни изолати на Prochlorococcus и морски Synechococcus, Acaryochloris и Prochloron, филаментозната цијанобактерија N2 фиксираната Nodularia spumigena, Lyngbya aestuarii и Lyngbya cucciarias wellamacecula. Така, растечкото тело на информации за геномот, исто така, може да се искористи на поопшт начин за решавање на светските проблеми со примена на споредбен пристап. Некои нови и возбудливи примери за напредок на ова поле се идентификацијата на гени за регулаторните РНК, увид во еволутивното потекло на фотосинтезата или проценка на придонесот на хоризонталниот преност на гени во геномите кои се анализирани.[87]
Примени
[уреди | уреди извор]
Геномиката обезбедила примени во многу области, вклучувајќи медицината, биотехнологијата, антропологијата и други општествени науки.[44]
Геномска медицина
[уреди | уреди извор]Геномските технологии од следната генерација им овозможуваат на лекарите и на биомедицинските истражувачи драстично да го зголемат количеството на геномски податоци собрани на големи изучувања за населението.[88] Кога се комбинираат со нови информатички пристапи кои вклучуваат многу видови податоци со геномски податоци во истражувањето на болеста, ова им овозможува на истражувачите подобро да ги разберат генетските основи на одговорот на лекот и болеста.[89][90] Раните напори за примена на геномот во медицината ги вклучија оние на екипата од Стенфорд предводен од Јуан Ешли кој ги разви првите алатки за медицинско толкување на човечкиот геном.[91][92][93] Истражувачката програма Genomes2People во Бригамовата и женска болница, Броудовиот институт и Харвардскиот медицински факултет е основана во 2012 година за да спроведе емпириско истражување за преведување на геномијата во здравје. Бригамовата и женска болница отворила клиника за спречувачка геномика во август 2019 година, а Општата болница во Масачусетс следеше еден месец подоцна.[94][95] Истражувачката програма „Сите нас“ (All of Us) има за цел да собере податоци за секвенцата на геномот од 1 милион учесници за да стане критична компонента на платформата за истражување на прецизна медицина.[96]
Синтетичка биологија и биоинженерство
[уреди | уреди извор]Растот на геномското знаење овозможило сè пософистицирани примени на синтетичката биологија.[97] Во 2010 година, истражувачите од Институтот „Џ. Крег Вентер“ објавиле создавање на делумно синтетички вид на бактерија, Mycoplasma laboratorium, изведен од геномот на Mycoplasma genitalium.[98]
Геномика на населението и зачувувањето
[уреди | уреди извор]Геномиката на населението била развиена како популарно поле на истражување, каде што методите на геномско секвенционирање се користени за да бидат спроведени големи споредби на секвенците на ДНК меѓу населенијата, надвор од границите на генетските маркери како што се производите на полимеразата верижна реакција со краток опсег или микросателитите кои традиционално се користени во генетиката на населението. Геномиката на населението ги проучува ефектите на геномот за да го подобри нашето разбирање за микроеволуцијата за да може да биде научена филогенетската историја и демографијата на населението.[99] Геномските методи за населението се користени за многу различни области, вклучувајќи еволутивна биологија, екологија, биогеографија, биологија за зачувување и управување со рибарството. Слично на тоа, пределната геномика била развиена од пределната генетика за да користи геномски методи за да ги идентификува односите помеѓу моделите на природозаштитни и генетски варијации.
Зачувувачите можат да ги користат информациите собрани со геномско секвенционирање со цел подобро да ги проценат генетските фактори клучни за зачувување на видовите, како што е генетската разновидност на населението или дали поединецот е хетерозиготен за рецесивно наследно генетско нарушување.[100] Со користење на геномски податоци за да бидат проценети ефектите од еволутивните постапки и да бидат забележани моделите на варијација низ дадено население, зачувувачите можат да формулираат планови за помош на даден вид без толку многу променливи оставени непознати како оние кои не се решени со стандардни генетски пристапи.[101]
Поврзано
[уреди | уреди извор]
- Когнитивна геномика
- Сметачка геномика
- епигеномика
- Функционална геномика
- Повикување ген, технологија за профилирање на мРНК
- Геномика на припитомувањето
- Генетиката во фикцијата
- Гликомика
- Имуномика
- Метагеномика
- Патогеномика
- Лична геномика
- Протеомика
- Транскриптомика
- Веномика
- Психогеномика
- Секвенционирање на цел геном
- Томас Родерик
Наводи
[уреди | уреди извор]- ↑ Franklin RE, Gosling RG (April 1953). „Molecular configuration in sodium thymonucleate“. Nature. 171 (4356): 740–1. Bibcode:1953Natur.171..740F. doi:10.1038/171740a0. PMID 13054694. S2CID 4268222.
- ↑ Satzinger H (March 2008). „Theodor and Marcella Boveri: chromosomes and cytoplasm in heredity and development“. Nature Reviews. Genetics. 9 (3): 231–238. doi:10.1038/nrg2311. PMID 18268510. S2CID 15829893.
- ↑ Cremer T, Cremer C (2006). „Rise, fall and resurrection of chromosome territories: a historical perspective. Part I. The rise of chromosome territories“. European Journal of Histochemistry. 50 (3): 161–176. PMID 16920639.
- ↑ Rossi, M.J; Kuntala, P.K; Lai, W.K.M; Yamada, N; Badjatia, N; Mittal, C; Kuzu, G; Bocklund, K; Farrell, N.P; Blanda, T.R; Mairose, J.D; Basting, A.V; Mistretta, K.S; Rocco, D.J; Perkinson, E.S; Kellogg, G.D; Mahony, S; Pugh, B.F (март 2021). „A high-resolution protein architecture of the budding yeast genome“. Nature. 592 (7853): 309–314. Bibcode:2021Natur.592..309R. doi:10.1038/s41586-021-03314-8. PMC 8035251 Проверете ја вредноста
|pmc=(help). PMID 33692541 Проверете ја вредноста|pmid=(help). - ↑ „WHO definitions of genetics and genomics“. World Health Organization. Архивирано од изворникот на June 30, 2004.
- ↑ Concepts of genetics (10th. изд.). San Francisco: Pearson Education. 2012. ISBN 978-0-321-72412-0.
- ↑ Culver KW, Labow MA (8 November 2002). „Genomics“. Во Robinson R (уред.). Genetics. Macmillan Science Library. Macmillan Reference USA. ISBN 978-0-02-865606-9.
- ↑ Kadakkuzha BM, Puthanveettil SV (July 2013). „Genomics and proteomics in solving brain complexity“. Molecular BioSystems. 9 (7): 1807–1821. doi:10.1039/C3MB25391K. PMC 6425491. PMID 23615871.
- ↑ 9,0 9,1 9,2 9,3 9,4 9,5 9,6 9,7 9,8 Pevsner J (2009). Bioinformatics and functional genomics (2nd. изд.). Hoboken, NJ: Wiley-Blackwell. ISBN 978-0-470-08585-1.
- ↑ Liddell HG, Scott R (2013). Intermediate Greek-English Lexicon. Martino Fine Books. ISBN 978-1-61427-397-4.
- ↑ „Genome, n“. Oxford English Dictionary (Third. изд.). Oxford University Press. 2008. Посетено на 2012-12-01.(бара претплата)
- ↑ Yadav SP (December 2007). „The wholeness in suffix -omics, -omes, and the word om“. Journal of Biomolecular Techniques. 18 (5): 277. PMC 2392988. PMID 18166670.
- ↑ O'Brien SJ (June 2022). „A decade of GigaScience: A perspective on conservation genetics“. GigaScience. 11. doi:10.1093/gigascience/giac055. PMC 9197679 Проверете ја вредноста
|pmc=(help). PMID 35701371 Проверете ја вредноста|pmid=(help). - ↑ Ankeny RA (June 2003). „Sequencing the genome from nematode to human: changing methods, changing science“. Endeavour. 27 (2): 87–92. doi:10.1016/S0160-9327(03)00061-9. PMID 12798815.
- ↑ Holley RW, Everett GA, Madison JT, Zamir A (May 1965). „Nucleotide sequences in the yeast alanine transfer ribonucleic acid“. The Journal of Biological Chemistry. 240 (5): 2122–2128. doi:10.1016/S0021-9258(18)97435-1. PMID 14299636.
- ↑ Holley RW, Apgar J, Everett GA, Madison JT, Marquisee M, Merrill SH, и др. (March 1965). „Structure of a Ribonucleic Acid“. Science. 147 (3664): 1462–1465. Bibcode:1965Sci...147.1462H. doi:10.1126/science.147.3664.1462. PMID 14263761. S2CID 40989800.
- ↑ Nirenberg M, Leder P, Bernfield M, Brimacombe R, Trupin J, Rottman F, O'Neal C (May 1965). „RNA codewords and protein synthesis, VII. On the general nature of the RNA code“. Proceedings of the National Academy of Sciences of the United States of America. 53 (5): 1161–1168. Bibcode:1965PNAS...53.1161N. doi:10.1073/pnas.53.5.1161. PMC 301388. PMID 5330357.
- ↑ Min Jou W, Haegeman G, Ysebaert M, Fiers W (May 1972). „Nucleotide sequence of the gene coding for the bacteriophage MS2 coat protein“. Nature. 237 (5350): 82–88. Bibcode:1972Natur.237...82J. doi:10.1038/237082a0. PMID 4555447. S2CID 4153893.
- ↑ Fiers W, Contreras R, Duerinck F, Haegeman G, Iserentant D, Merregaert J, и др. (April 1976). „Complete nucleotide sequence of bacteriophage MS2 RNA: primary and secondary structure of the replicase gene“. Nature. 260 (5551): 500–507. Bibcode:1976Natur.260..500F. doi:10.1038/260500a0. PMID 1264203. S2CID 4289674.
- ↑ Fiers W, Contreras R, Haegemann G, Rogiers R, Van de Voorde A, Van Heuverswyn H, и др. (May 1978). „Complete nucleotide sequence of SV40 DNA“. Nature. 273 (5658): 113–120. Bibcode:1978Natur.273..113F. doi:10.1038/273113a0. PMID 205802. S2CID 1634424.
- ↑ Tamarin RH (2004). Principles of genetics (7. изд.). London: McGraw Hill. ISBN 978-0-07-124320-9.
- ↑ Sanger F (1980). „Nobel lecture: Determination of nucleotide sequences in DNA“ (PDF). Nobelprize.org. Посетено на 2010-10-18.
- ↑ 23,0 23,1 Sanger F, Air GM, Barrell BG, Brown NL, Coulson AR, Fiddes CA, и др. (February 1977). „Nucleotide sequence of bacteriophage phi X174 DNA“. Nature. 265 (5596): 687–695. Bibcode:1977Natur.265..687S. doi:10.1038/265687a0. PMID 870828. S2CID 4206886.
- ↑ Kaiser O, Bartels D, Bekel T, Goesmann A, Kespohl S, Pühler A, Meyer F (December 2003). „Whole genome shotgun sequencing guided by bioinformatics pipelines--an optimized approach for an established technique“. Journal of Biotechnology. 106 (2–3): 121–133. doi:10.1016/j.jbiotec.2003.08.008. PMID 14651855.
- ↑ Sanger F, Nicklen S, Coulson AR (December 1977). „DNA sequencing with chain-terminating inhibitors“. Proceedings of the National Academy of Sciences of the United States of America. 74 (12): 5463–5467. Bibcode:1977PNAS...74.5463S. doi:10.1073/pnas.74.12.5463. PMC 431765. PMID 271968.
- ↑ Maxam AM, Gilbert W (February 1977). „A new method for sequencing DNA“. Proceedings of the National Academy of Sciences of the United States of America. 74 (2): 560–564. Bibcode:1977PNAS...74..560M. doi:10.1073/pnas.74.2.560. PMC 392330. PMID 265521.
- ↑ 27,0 27,1 Darden L, Tabery J (2010). „Molecular Biology“. Во Zalta EN (уред.). The Stanford Encyclopedia of Philosophy (Fall 2010. изд.).
- ↑ Anderson S, Bankier AT, Barrell BG, de Bruijn MH, Coulson AR, Drouin J, и др. (April 1981). „Sequence and organization of the human mitochondrial genome“. Nature. 290 (5806): 457–465. Bibcode:1981Natur.290..457A. doi:10.1038/290457a0. PMID 7219534. S2CID 4355527.(бара претплата)
- ↑ Shinozaki K, Ohme M, Tanaka M, Wakasugi T, Hayashida N, Matsubayashi T, и др. (September 1986). „The complete nucleotide sequence of the tobacco chloroplast genome: its gene organization and expression“. The EMBO Journal. 5 (9): 2043–2049. doi:10.1002/j.1460-2075.1986.tb04464.x. PMC 1167080. PMID 16453699.
- ↑ Ohyama K, Fukuzawa H, Kohchi T, Shirai H, Sano T, Sano S, и др. (1986). „Chloroplast gene organization deduced from complete sequence of liverwort Marchantia polymorpha chloroplast DNA“. Nature. 322 (6079): 572–574. Bibcode:1986Natur.322..572O. doi:10.1038/322572a0. S2CID 4311952.
- ↑ Oliver SG, van der Aart QJ, Agostoni-Carbone ML, Aigle M, Alberghina L, Alexandraki D, и др. (May 1992). „The complete DNA sequence of yeast chromosome III“. Nature. 357 (6373): 38–46. Bibcode:1992Natur.357...38O. doi:10.1038/357038a0. PMID 1574125. S2CID 4271784.
- ↑ Fleischmann RD, Adams MD, White O, Clayton RA, Kirkness EF, Kerlavage AR, и др. (July 1995). „Whole-genome random sequencing and assembly of Haemophilus influenzae Rd“. Science. 269 (5223): 496–512. Bibcode:1995Sci...269..496F. doi:10.1126/science.7542800. PMID 7542800. S2CID 10423613.
- ↑ Goffeau A, Barrell BG, Bussey H, Davis RW, Dujon B, Feldmann H, и др. (October 1996). „Life with 6000 genes“. Science. 274 (5287): 546, 563–546, 567. Bibcode:1996Sci...274..546G. doi:10.1126/science.274.5287.546. PMID 8849441. S2CID 211123134.(бара претплата)
- ↑ „Complete genomes: Viruses“. NCBI. 17 November 2011. Посетено на 2011-11-18.
- ↑ „Genome Project Statistics“. Entrez Genome Project. 7 October 2011. Посетено на 2011-11-18.
- ↑ Zimmer C (29 December 2009). „Scientists Start a Genomic Catalog of Earth's Abundant Microbes“. The New York Times. ISSN 0362-4331. Посетено на 2012-12-21.
- ↑ Wu D, Hugenholtz P, Mavromatis K, Pukall R, Dalin E, Ivanova NN, и др. (December 2009). „A phylogeny-driven genomic encyclopaedia of Bacteria and Archaea“. Nature. 462 (7276): 1056–1060. Bibcode:2009Natur.462.1056W. doi:10.1038/nature08656. PMC 3073058. PMID 20033048.
- ↑ „Human gene number slashed“. BBC. 20 October 2004. Посетено на 2012-12-21.
- ↑ Yue GH, Lo LC, Zhu ZY, Lin G, Feng F (April 2006). „The complete nucleotide sequence of the mitochondrial genome of Tetraodon nigroviridis“. DNA Sequence. 17 (2): 115–121. doi:10.1080/10425170600700378. PMID 17076253. S2CID 21797344.
- ↑ National Human Genome Research Institute (14 July 2004). „Dog Genome Assembled: Canine Genome Now Available to Research Community Worldwide“. Genome.gov. Посетено на 2012-01-20.
- ↑ 41,0 41,1 McElheny V (2010). Drawing the map of life: inside the Human Genome Project. New York NY: Basic Books. ISBN 978-0-465-04333-0.
- ↑ Abecasis GR, Auton A, Brooks LD, DePristo MA, Durbin RM, Handsaker RE, и др. (November 2012). „An integrated map of genetic variation from 1,092 human genomes“. Nature. 491 (7422): 56–65. Bibcode:2012Natur.491...56T. doi:10.1038/nature11632. PMC 3498066. PMID 23128226.
- ↑ Nielsen R (October 2010). „Genomics: In search of rare human variants“. Nature. 467 (7319): 1050–1051. Bibcode:2010Natur.467.1050N. doi:10.1038/4671050a. PMID 20981085.
- ↑ 44,0 44,1 Barnes B, Dupré J (2008). Genomes and what to make of them. Chicago: University of Chicago Press. ISBN 978-0-226-17295-8.
- ↑ Eisen JA (July 2012). „Badomics words and the power and peril of the ome-meme“. GigaScience. 1 (1): 6. doi:10.1186/2047-217X-1-6. PMC 3617454. PMID 23587201.
- ↑ Hotz RL (13 August 2012). „Here"s an Omical Tale: Scientists Discover Spreading Suffix“. Wall Street Journal. ISSN 0099-9660. Посетено на 2013-01-04.
- ↑ Scudellari M (1 October 2011). „Data Deluge“. The Scientist. Посетено на 2013-01-04.
- ↑ Chaston J, Douglas AE (August 2012). „Making the most of "omics" for symbiosis research“. The Biological Bulletin. 223 (1): 21–29. doi:10.1086/BBLv223n1p21. PMC 3491573. PMID 22983030.
- ↑ McCutcheon JP, von Dohlen CD (August 2011). „An interdependent metabolic patchwork in the nested symbiosis of mealybugs“. Current Biology. 21 (16): 1366–1372. doi:10.1016/j.cub.2011.06.051. PMC 3169327. PMID 21835622.
- ↑ 50,0 50,1 Baker M (14 September 2012). „Benchtop sequencers ship off“ (Blog). Nature News Blog. Посетено на 2012-12-22.
- ↑ Quail MA, Smith M, Coupland P, Otto TD, Harris SR, Connor TR, и др. (July 2012). „A tale of three next generation sequencing platforms: comparison of Ion Torrent, Pacific Biosciences and Illumina MiSeq sequencers“. BMC Genomics. 13: 341. doi:10.1186/1471-2164-13-341. PMC 3431227. PMID 22827831.
- ↑ 52,0 52,1 Staden R (June 1979). „A strategy of DNA sequencing employing computer programs“. Nucleic Acids Research. 6 (7): 2601–2610. doi:10.1093/nar/6.7.2601. PMC 327874. PMID 461197.
- ↑ Anderson S (July 1981). „Shotgun DNA sequencing using cloned DNase I-generated fragments“. Nucleic Acids Research. 9 (13): 3015–3027. doi:10.1093/nar/9.13.3015. PMC 327328. PMID 6269069.
- ↑ 54,0 54,1 54,2 Pop M (July 2009). „Genome assembly reborn: recent computational challenges“. Briefings in Bioinformatics. 10 (4): 354–366. doi:10.1093/bib/bbp026. PMC 2691937. PMID 19482960.
- ↑ Sanger F, Coulson AR (May 1975). „A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase“. Journal of Molecular Biology. 94 (3): 441–448. doi:10.1016/0022-2836(75)90213-2. PMID 1100841.
- ↑ Mavromatis K, Land ML, Brettin TS, Quest DJ, Copeland A, Clum A, и др. (2012). Liu Z (уред.). „The fast changing landscape of sequencing technologies and their impact on microbial genome assemblies and annotation“. PLOS ONE. 7 (12): e48837. Bibcode:2012PLoSO...748837M. doi:10.1371/journal.pone.0048837. PMC 3520994. PMID 23251337.
- ↑ Illumina, Inc. (28 February 2012). An Introduction to Next-Generation Sequencing Technology (PDF). San Diego, California, USA: Illumina, Inc. стр. 12. Архивирано од изворникот (PDF) на 2013-04-11. Посетено на 2012-12-28.
- ↑ Hall N (May 2007). „Advanced sequencing technologies and their wider impact in microbiology“. The Journal of Experimental Biology. 210 (Pt 9): 1518–1525. doi:10.1242/jeb.001370. PMID 17449817.
- ↑ Church GM (January 2006). „Genomes for all“. Scientific American. 294 (1): 46–54. Bibcode:2006SciAm.294a..46C. doi:10.1038/scientificamerican0106-46. PMID 16468433. S2CID 28769137.
- ↑ ten Bosch JR, Grody WW (November 2008). „Keeping up with the next generation: massively parallel sequencing in clinical diagnostics“. The Journal of Molecular Diagnostics. 10 (6): 484–492. doi:10.2353/jmoldx.2008.080027. PMC 2570630. PMID 18832462.
- ↑ Tucker T, Marra M, Friedman JM (August 2009). „Massively parallel sequencing: the next big thing in genetic medicine“. American Journal of Human Genetics. 85 (2): 142–154. doi:10.1016/j.ajhg.2009.06.022. PMC 2725244. PMID 19679224.
- ↑ US 20050100900, Kawashima EH, Farinelli L, Mayer P, "Method of nucleic acid amplification", published 12 May 2005, issued 26 July 2011, assigned to Solexa Ltd Great Britain.
- ↑ Mardis ER (2008). „Next-generation DNA sequencing methods“ (PDF). Annual Review of Genomics and Human Genetics. 9: 387–402. doi:10.1146/annurev.genom.9.081307.164359. PMID 18576944. Архивирано од изворникот (PDF) на 2013-05-18. Посетено на 2013-01-04.
- ↑ Davies K (2011). „Powering Preventative Medicine“. Bio-IT World (September–October). Архивирано од изворникот на 2016-06-06. Посетено на 2024-02-02.
- ↑ „Home“. PacBio.
- ↑ „home“. Oxford Nanopore Technologies.
- ↑ Chain PS, Grafham DV, Fulton RS, Fitzgerald MG, Hostetler J, Muzny D, и др. (October 2009). „Genomics. Genome project standards in a new era of sequencing“. Science. 326 (5950): 236–237. Bibcode:2009Sci...326..236C. doi:10.1126/science.1180614. PMC 3854948. PMID 19815760.
- ↑ Stein L (July 2001). „Genome annotation: from sequence to biology“. Nature Reviews. Genetics. 2 (7): 493–503. doi:10.1038/35080529. PMID 11433356. S2CID 12044602.
- ↑ Brent MR (January 2008). „Steady progress and recent breakthroughs in the accuracy of automated genome annotation“ (PDF). Nature Reviews. Genetics. 9 (1): 62–73. doi:10.1038/nrg2220. PMID 18087260. S2CID 20412451. Архивирано од изворникот (PDF) на 2013-05-29. Посетено на 2013-01-04.
- ↑ Flicek P, Ahmed I, Amode MR, Barrell D, Beal K, Brent S, и др. (January 2013). „Ensembl 2013“. Nucleic Acids Research. 41 (Database issue): D48–D55. doi:10.1093/nar/gks1236. PMC 3531136. PMID 23203987.
- ↑ Keith JM (2008). Keith JM (уред.). Bioinformatics. Methods in Molecular Biology. 453. стр. v–vi. doi:10.1007/978-1-60327-429-6. ISBN 978-1-60327-428-9. PMID 18720577.
- ↑ Marsden RL, Lewis TA, Orengo CA (March 2007). „Towards a comprehensive structural coverage of completed genomes: a structural genomics viewpoint“. BMC Bioinformatics. 8: 86. doi:10.1186/1471-2105-8-86. PMC 1829165. PMID 17349043.
- ↑ Brenner SE, Levitt M (January 2000). „Expectations from structural genomics“. Protein Science. 9 (1): 197–200. doi:10.1110/ps.9.1.197. PMC 2144435. PMID 10739263.
- ↑ Brenner SE (October 2001). „A tour of structural genomics“. Nature Reviews. Genetics. 2 (10): 801–809. doi:10.1038/35093574. PMID 11584296. S2CID 5656447.
- ↑ 75,0 75,1 Francis RC (2011). Epigenetics: the ultimate mystery of inheritance. New York: WW Norton. ISBN 978-0-393-07005-7.
- ↑ (Russell 2010 стр. 475)
- ↑ Gallego, L.D; Schneider, M; Mittal, C; Romanuska, Anete; Gudino Carrillo, R.M; Schubert, T; Pugh, B.F; Kohler, A (March 2020). „Phase separation directs ubiquitination of gene-body nucleosomes“. Nature. 579 (7800): 592–597. Bibcode:2020Natur.579..592G. doi:10.1038/s41586-020-2097-z. PMC 7481934. PMID 32214243.
- ↑ Sams, K.L; Mukai, C; Marks, B.A; Mittal, C; Demeter, E.A; Nelissen, S; Grenier, J.K; Tate, A.E; Ahmed, F (October 2022). „Delayed puberty, gonadotropin abnormalities and subfertility in male Padi2/Padi4 double knockout mice“. Reprod Biol Endocrinol. 20 (1): 150. doi:10.1186/s12958-022-01018-w. PMC 9555066 Проверете ја вредноста
|pmc=(help). PMID 36224627 Проверете ја вредноста|pmid=(help). - ↑ Laird PW (March 2010). „Principles and challenges of genomewide DNA methylation analysis“. Nature Reviews. Genetics. 11 (3): 191–203. doi:10.1038/nrg2732. PMID 20125086. S2CID 6780101.
- ↑ Hugenholtz P, Goebel BM, Pace NR (September 1998). „Impact of culture-independent studies on the emerging phylogenetic view of bacterial diversity“. Journal of Bacteriology. 180 (18): 4765–4774. doi:10.1128/JB.180.18.4765-4774.1998. PMC 107498. PMID 9733676.
- ↑ Eisen JA (March 2007). „Environmental shotgun sequencing: its potential and challenges for studying the hidden world of microbes“. PLOS Biology. 5 (3): e82. doi:10.1371/journal.pbio.0050082. PMC 1821061. PMID 17355177.
- ↑ Marco D, уред. (2010). Metagenomics: Theory, Methods and Applications. Caister Academic Press. ISBN 978-1-904455-54-7.
- ↑ Marco D, уред. (2011). Metagenomics: Current Innovations and Future Trends. Caister Academic Press. ISBN 978-1-904455-87-5.
- ↑ Canchaya C, Proux C, Fournous G, Bruttin A, Brüssow H (June 2003). „Prophage genomics“. Microbiology and Molecular Biology Reviews. 67 (2): 238–76, table of contents. doi:10.1128/MMBR.67.2.238-276.2003. PMC 156470. PMID 12794192.
- ↑ McGrath S, van Sinderen D, уред. (2007). Bacteriophage: Genetics and Molecular Biology (1st. изд.). Caister Academic Press. ISBN 978-1-904455-14-1.
- ↑ Fouts DE (November 2006). „Phage_Finder: automated identification and classification of prophage regions in complete bacterial genome sequences“. Nucleic Acids Research. 34 (20): 5839–5851. doi:10.1093/nar/gkl732. PMC 1635311. PMID 17062630.
- ↑ Herrero A, Flores E, уред. (2008). The Cyanobacteria: Molecular Biology, Genomics and Evolution (1st. изд.). Caister Academic Press. ISBN 978-1-904455-15-8.
- ↑ Hudson KL (September 2011). „Genomics, health care, and society“. The New England Journal of Medicine. 365 (11): 1033–1041. doi:10.1056/NEJMra1010517. PMID 21916641.
- ↑ O'Donnell CJ, Nabel EG (December 2011). „Genomics of cardiovascular disease“. The New England Journal of Medicine. 365 (22): 2098–2109. doi:10.1056/NEJMra1105239. PMID 22129254.
- ↑ Lu YF, Goldstein DB, Angrist M, Cavalleri G (July 2014). „Personalized medicine and human genetic diversity“. Cold Spring Harbor Perspectives in Medicine. 4 (9): a008581. doi:10.1101/cshperspect.a008581. PMC 4143101. PMID 25059740.
- ↑ Ashley EA, Butte AJ, Wheeler MT, Chen R, Klein TE, Dewey FE, и др. (May 2010). „Clinical assessment incorporating a personal genome“. Lancet. 375 (9725): 1525–1535. doi:10.1016/S0140-6736(10)60452-7. PMC 2937184. PMID 20435227.
- ↑ Dewey FE, Chen R, Cordero SP, Ormond KE, Caleshu C, Karczewski KJ, и др. (September 2011). „Phased whole-genome genetic risk in a family quartet using a major allele reference sequence“. PLOS Genetics. 7 (9): e1002280. doi:10.1371/journal.pgen.1002280. PMC 3174201. PMID 21935354.
- ↑ Dewey FE, Grove ME, Pan C, Goldstein BA, Bernstein JA, Chaib H, и др. (March 2014). „Clinical interpretation and implications of whole-genome sequencing“. JAMA. 311 (10): 1035–1045. doi:10.1001/jama.2014.1717. PMC 4119063. PMID 24618965.
- ↑ Robbins R (16 August 2019). „Top U.S. medical centers roll out DNA sequencing clinics for healthy (and often wealthy) clients“. STAT News.
- ↑ „Two Boston Health Systems Enter the Growing Direct-to-Consumer Gene Sequencing Market by Opening Preventative Genomics Clinics, but Can Patients Afford the Service?“. Dark Daily. The Dark Intelligence Group. 3 January 2020.
- ↑ „NIH-funded genome centers to accelerate precision medicine discoveries“. National Institutes of Health: All of Us Research Program. National Institutes of Health. 25 September 2018.
- ↑ Church GM, Regis E (2012). Regenesis: how synthetic biology will reinvent nature and ourselves. New York: Basic Books. ISBN 978-0-465-02175-8.
- ↑ Baker M (May 2011). „Synthetic genomes: The next step for the synthetic genome“. Nature. 473 (7347): 403, 405–403, 408. Bibcode:2011Natur.473..403B. doi:10.1038/473403a. PMID 21593873. S2CID 205064528.
- ↑ Luikart G, England PR, Tallmon D, Jordan S, Taberlet P (December 2003). „The power and promise of population genomics: from genotyping to genome typing“. Nature Reviews. Genetics. 4 (12): 981–94. doi:10.1038/nrg1226. PMID 14631358. S2CID 8516357.
- ↑ Frankham R (1 September 2010). „Challenges and opportunities of genetic approaches to biological conservation“. Biological Conservation. 143 (9): 1922–1923. doi:10.1016/j.biocon.2010.05.011.
- ↑ Allendorf FW, Hohenlohe PA, Luikart G (October 2010). „Genomics and the future of conservation genetics“. Nature Reviews. Genetics. 11 (10): 697–709. doi:10.1038/nrg2844. PMID 20847747. S2CID 10811958.
Дополнителна книжевност
[уреди | уреди извор]
- Lesk AM (2017). Introduction to Genomics (3rd. изд.). New York: Oxford University Press. стр. 544. ISBN 978-0-19-107085-3. ASIN 0198754833.
- Stunnenberg HG, Hubner NC (June 2014). „Genomics meets proteomics: identifying the culprits in disease“. Human Genetics. 133 (6): 689–700. doi:10.1007/s00439-013-1376-2. PMC 4021166. PMID 24135908.
- Shibata T (October 2012). „Cancer genomics and pathology: all together now“. Pathology International. 62 (10): 647–659. doi:10.1111/j.1440-1827.2012.02855.x. PMID 23005591. S2CID 27886018.
- Roychowdhury S, Chinnaiyan AM (2016). „Translating cancer genomes and transcriptomes for precision oncology“. CA. 66 (1): 75–88. doi:10.3322/caac.21329. PMC 4713245. PMID 26528881.
- Грешка во Lua во Модул:Citation/CS1/Identifiers, ред 500: wrong number of arguments to 'insert' electronic-book ISBN 978-94-007-5561-1 ISSN 1559-0836
Надворешни врски
[уреди | уреди извор]
- Annual Review of Genomics and Human Genetics Архивирано на 18 јануари 2009 г.
- BMC Genomics: A BMC journal on Genomics
- Genomics journal
- Genomics.org: An openfree genomics portal.
- NHGRI: US government's genome institute
- JCVI Comprehensive Microbial Resource
- KoreaGenome.org: The first Korean Genome published and the sequence is available freely.
- GenomicsNetwork: Looks at the development and use of the science and technologies of genomics.
- Institute for Genome Sciences: Genomics research.
- MIT OpenCourseWare HST.512 Genomic Medicine A free, self-study course in genomic medicine. Resources include audio lectures and selected lecture notes.
- ENCODE threads explorer Machine learning approaches to genomics. Nature
- Global map of genomics laboratories
- Genomics: Scitable by nature education
|