Молекуларна генетика
| Дел од темата |
| „Генетика“ |
|---|
| Најважни поими |
| Историја и теми |
| Истражувања |
|
|
Молекуларна генетика ― гранка на биологијата која се занимава со тоа како разликите во структурите или изразувањето на молекулите на ДНК се манифестираат како варијации меѓу организмите. Молекуларната генетика често применува „истражувачки пристап“ за одредување на структурата и/или функцијата на гените во геномот на организмот користејќи генетски слики.[1][2]
Областа на студии се заснова на спојување на неколку под-области во биологијата: класични Менделови закони, цитологија, молекуларна биологија, биохемија и биотехнологија. Ги интегрира овие дисциплини за да ги истражи работите како генетско наследство, регулација и изразување на гените и молекуларниот механизам зад различни животни постапки.[1]
Клучна цел на молекуларната генетика е да се идентификуваат и проучуваат генетските мутации. Истражувачите бараат мутации во генот или индуцираат мутации во генот за да поврзат генска секвенца со специфичен фенотип.[3] Затоа, молекуларната генетика е моќна методологија за поврзување на мутациите со генетските состојби што може да помогне во потрагата по третмани на различни генетски болести.
Историја[уреди | уреди извор]
Откривањето на ДНК како план за живот и откритија во истражувањето на молекуларната генетика дошло од комбинираните дела на многу научници. Во 1869 година, хемичарот Јохан Фридрих Мишер, кој го истражувал составот на белите крвни зрнца, открил и изолирал нова молекула која ја нарекол нуклеин од клеточното јадро, што на крајот би било првото откритие на молекулната ДНК за која подоцна било утврдено дека е молекуларната основа на животот. Тој утврдил дека се состои од водород, кислород, азот и фосфор.[4] Биохемичарот Албрехт Косел го идентификувал нуклеинот како нуклеинска киселина и го дал неговото име деоксирибонуклеинска киселина (ДНК). Тој продолжил да се надоврзува на тоа со изолирање на основните градежни блокови на ДНК и РНК; составен од нуклеотиди: аденин, гванин, тимин, цитозин, и урацил. Неговата работа на нуклеотиди му ја донело Нобеловата награда за физиологија.[5]
Во раните 1900-ти, Грегор Мендел, кој станал познат како еден од татковците на генетиката, дал голем придонес во полето на генетиката преку неговите различни опити со грашок каде што бил во можност да ги открие начелата на наследување, како што се рецесивни и доминантни особини, без да се знае од кои гени се состојат.[6] Во средината на 19 век, анатомистот Волтер Флеминг го открил она што сега го знаеме како хромозоми и постапката на одвојување што тие го поминуваат преку митоза. Неговата работа заедно со Теодор Бовери најпрво излегло со Хромозомската теорија на наследување, која помогнала да бидат објаснети некои од шемите што Мендел ги забележал многу порано.[7]
За да биде развиена молекуларната генетика како дисциплина, биле неопходни неколку научни откритија. Откривањето на ДНК како средство за пренос на генетскиот код на животот од една клетка во друга и помеѓу генерации беше од суштинско значење за идентификување на молекулата одговорна за наследноста. Молекуларната генетика првично произлегла од студии кои вклучуваат генетска преобразба кај бактериите. Во 1944 година, Ејвори, МекЛеод и МекКарти[8] изолирале ДНК од вирулентен сој на S. pneumoniae, и користејќи ја токму оваа ДНК успеале да пренаменат безопасен сој во вирулентност. Тие го нарекле навлегувањето, вклучувањето и изразувањето на ДНК од бактерии „преобразба“. Ова откритие наведува дека ДНК е генетскиот материјал на бактериите.[9] Бактериската преобразба често е предизвикана од услови на стрес, а функцијата на преобразба се чини дека е поправка на геномското оштетување.[9]
Во 1950 година, Ервин Чаргаф извел правила кои нудат докази дека ДНК е генетски материјал на животот. Овие беа „1) дека базниот состав на ДНК варира помеѓу видовите и 2) во природните молекули на ДНК, количината на аденин (А) е еднаква на количината на тимин (Т), а количината на гванин (G) е еднаква до количината на цитозин (C).“[10] Овие правила, познати како Чаргафови правила, помогнале да биде разберена молекуларната генетика.[10] Во 1953 година, Френсис Крик и Џејмс Вотсон, врз основа на работата на кристалографијата со рендген, направена од Розалинд Френклин и Морис Вилкинс, можеле да ја изведат тродимензионалната структура на двојната спирала на ДНКта.[11]
Бактериофагната група била неформална мрежа на биолози собрана околу Макс Делбрик, која значително придонела за молекуларната генетика и потеклото на молекуларната биологија во периодот од околу 1945 до 1970 година.[12] Бактериофагната група го добила своето име од бактериофагите, вирусите што ги инфицираат бактериите кои групата ги користела како организми за опитен модел. Студиите на молекуларните генетичари поврзани со оваа група придонесле да биде разбрана како генетско кодираните протеини функционираат во репликацијата на ДНК, поправката на ДНК и рекомбинацијата на ДНК и за тоа како вирусите се составуваат од компонентите на протеини и нуклеинска киселина (молекуларна морфогенеза). Понатаму, била разјаснета улогата на кодоните што завршуваат со синџирот. Една значајна студија била изведена од Сиднеј Бренер и соработниците користејќи „килибарни“ мутанти кои се неисправни во генот што го кодира главниот протеин на бактериофагот Т4.[13] Оваа студија ја покажа заедничката линеарност на генот со неговиот кодиран полипептид, со што обезбеди силен доказ за „хипотезата за секвенца“ дека амино киселинската секвенца на протеинот е специфицирана со нуклеотидната секвенца на генот што го одредува протеинот.
Изолацијата на рестриктивна ендонуклеаза во E. coli од страна на Арбер и Лин во 1969 година го отвори полето на генетското инженерство.[14] Биле користени рестриктивни ензими за линеаризирање на ДНК за одделување со електрофореза и Саутерновиот метод дозволено за идентификација на специфични ДНК-ови сегменти преку сонди за хибридизација.[15][16] Во 1971 година, Берг користел рестриктивни ензими за да ја создаде првата рекомбинантна ДНК молекула и првиот рекомбинантен ДНК плазмид.[17] Во 1972 година, Коен и Бојер го создале првиот рекомбинантен ДНК организам со вметнување на рекомбинантна ДНК плазмиди во E. coli, сега позната како бактериска преобразба, и го отвориле патот за молекуларно клонирање.[18] Развојот на техниките за секвенционирање на ДНК во доцните 1970-ти, прво од Максам и Гилберт, а потоа и од Фредерик Сангер, бил клучен за молекуларното генетско истражување и им овозможило на научниците да започнат со спроведување на генетски слики за поврзување на генотипските секвенци со фенотиповите.[19] Полимеразна верижна реакција со користење на Такова полимераза, измислена од Мулис во 1985 година, им овозможи на научниците да создадат милиони копии од специфична ДНК секвенца што може да се користи за преобразба или да се манипулира со раздвојување на гел од агароз.[20] Една деценија подоцна, првиот целосен геном бил секвенциониран (Haemophilus influenzae), проследено со евентуалното секвенционирање на човечкиот геном преку проектот за човечки геном во 2001 година.[21] Кулминацијата на сите тие откритија било новото поле наречено геномика кое ја поврзува молекуларната структура на генот со протеинот или РНК кодирани од тој сегмент на ДНК и функционалното изразување на тој протеин во организмот.[22] Денес, преку примената на молекуларните генетски техники, геномијата се изучува во многу моделски организми и податоците се собираат во сметачки бази на податоци како NCBI и Ensembl. Сметачката анализа и споредба на гените во и помеѓу различни видови се нарекува биоинформатика и ги поврзува генетските мутации на еволутивна скала.[23]
Средишна догма[уреди | уреди извор]
Оваа слика покажува пример на средишната догма со помош на ДНК-ово влакно што се транскрибира, потоа се преведува и покажува важни ензими што се користени во постапките.
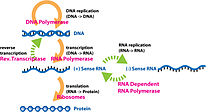
Средишната догма играла клучна улога во проучувањето на молекуларната генетика. Средишната догма наведува дека ДНК се реплицира, ДНК се транскрибира во РНК, а РНК се преведува во протеини.[24] Заедно со Средишната догма, генетскиот код е користен за да биде разбран како РНК е преведувана во протеини. Репликацијата на ДНК и транскрипцијата од ДНК во мРНК се случува во јадрото додека преводот од РНК во протеини се случува во рибозомот.[25] Генетскиот код е направен од четири заменливи делови на молекулите на ДНК, наречени „бази“: аденин, цитозин, урацил (во РНК; тимин во ДНК) и гванин и е вишок, што значи повеќе комбинации на овие базни парови (кои се читаат во трипати) ја произведуваат истата аминокиселина.[26] Протеомиката и геномиката се области во биологијата кои произлегуваат од проучувањето на молекуларната генетика и Средишната догма.[27]
Структура на ДНК[уреди | уреди извор]
Геномот на еден организам го сочинува целата негова поставеност на ДНК и е одговорен за неговите генетски особини, функција и развој. Самиот состав на ДНК е суштинска компонента на полето на молекуларната генетика; тоа е основата за тоа како ДНК може да складира генетски информации, да ги пренесува и да биде во формат што може да се чита и преведува.[28]
ДНК е двоверижна молекула, при што секоја влакно е ориентирана на антипаралелен начин. Нуклеотидите се градежни блокови на ДНК, секоја составена од молекула на шеќер, фосфатна група и една од четирите азотни бази: аденин, гванин, цитозин и тимин. Една нишка на ДНК се држи заедно со ковалентни врски, додека двете антипаралелни нишки се држат заедно со водородни врски помеѓу нуклеотидните бази. Аденинот се врзува со тимин, а цитозинот со гванин. Токму овие четири базни секвенци го образуваат генетскиот код за целиот биолошки живот и ги содржат информациите за сите протеини што организмот ќе може да ги синтетизира.[29]
Неговата единствена структура овозможува ДНК да складира и пренесува биолошки информации низ генерации за време на клеточната делба. При клеточната делба, клетките мора да бидат способни да го копираат својот геном и да го пренесат на ќерките клетки. Ова е можно поради двоверижната структура на ДНК бидејќи едната нишка е комплементарна со нејзиното партнерско влакно, и затоа секоја од овие нишки може да дејствува како шаблон влакно за образување на нова комплементарна нишка. Ова е причината зошто постапката на репликација на ДНК е позната како полуконзервативна постапка.[30]
Техники[уреди | уреди извор]
Напредна генетика[уреди | уреди извор]
Напредната генетика е техника на молекуларна генетика која е користена за да бидат идентификувани гени или генетски мутации кои произведуваат одреден фенотип. Во генетскиот екран, случајните мутации се создавани со мутагени (хемикалии или зрачење) или транспозони и поединците се проверуваат за специфичниот фенотип. Често, секундарна анализа во облик на селекција може да следи мутагенеза каде што саканиот фенотип е тешко да биде набљудуваб, на пример во бактерии или клеточни култури. Клетките може да бидат преобразени со помош на ген за отпорност на антибиотици или флуоресцентен известувач, така што мутантите со саканиот фенотип се избираат од немутантите.[31]
Мутантите кои го покажуваат интересниот фенотип се изолирани и може да се изврши комплементарен тест за да се утврди дали фенотипот произлегува од повеќе од еден ген. Мутантните гени потоа се одлукуваат како доминантни (што резултира со зголемување на функцијата), рецесивни (покажува губење на функцијата) или епистатични (мутантниот ген го маскира фенотипот на друг ген). Конечно, местоположбата и специфичната природа на мутацијата се мапирани преку секвенционирање.[32] Напредната генетика е непристрасен пристап и често води до многу неочекувани откритија, но може да биде скапа и одзема многу време. Моделите на организмите како нематодниот црв Caenorhabditis elegans, овошната мушичка Drosophila melanogaster и зебрестата риба Danio rerio се успешно искористени за проучување на фенотиповите кои произлегуваат од генски мутации.[33]

Обратна генетика[уреди | уреди извор]

Обратна генетика е поим за техники на молекуларна генетика што се користени за одредување на фенотипот што произлегува од намерна мутација во ген од интерес. Фенотипот е користен за да се заклучи функцијата на немутираната верзија на генот. Мутациите може да бидат случајни или намерни промени на генот од интерес. Мутациите може да бидат мутација со погрешна смисла предизвикана од замена на нуклеотид, додавање или бришење на нуклеотид за да се индуцира мутација на промена на рамката или целосно додавање/бришење на ген или генски сегмент. Бришењето на одреден ген создава генско соборување каде што генот не е изразен и резултира со губење на функцијата (на пр. соборени глувци). Мутациите со погрешна смисла може да предизвикаат целосно губење на функцијата или да резултираат со делумно губење на функцијата, познато како соборување. Нокдаун може да се постигне и со интерференција на РНК (РНКи).[35] Алтернативно, гените може да бидат заменети во геномот на организмот (исто така познат како трансген) за да се создаде генски удар и да резултира со зголемување на функцијата од страна на домаќинот.[36] Иако овие техники имаат одредена инхерентна пристрасност во однос на одлуката да се поврзе фенотипот со одредена функција, таа е многу побрза во однос на производството отколку напредната генетика бидејќи генот од интерес е веќе познат.
Молекуларни генетски алатки[уреди | уреди извор]
Молекуларната генетика е научен пристап кој ги користи основите на генетиката како алатка за подобро разбирање на молекуларната основа на болеста и биолошките постапки во организмите. Подолу се дадени некои алатки кои лесно ги користат истражувачите во оваа област.
Микросателити[уреди | уреди извор]
Микросателитите или повторувањата на една секвенца се кратки повторливи сегменти на ДНК составен од 6 нуклеотиди на одредено место на геномот кои се користени како генетски маркер. Истражувачите можат да ги анализираат овие микросателити во техники како што се ДНК отпечатоци од прсти и тестирање за татковство бидејќи овие повторувања се многу уникатни за поединци/семејства. a може да се користи и при конструирање генетски карти и за проучување на генетската поврзаност за пронаоѓање на генот или мутацијата одговорна за специфична особина или болест. Микросателитите може да бидат применети и во популационата генетика за да бидат проучувани споредбите помеѓу групите.[37]
Изучувања за геномски поврзаности[уреди | уреди извор]
Изучувањата за геномски поврзаности се техника која се потпира на единечни нуклеотидни полиморфизми за проучување на генетските варијации во населенијата кои можат да бидат поврзани со одредена болест. Проектот за човечки геном го мапирал целиот човечки геном и го направил овој пристап полесно достапен и исплатлив за истражувачите да го применуваат. За да спроведат ваква техника, истражувачите користат две групи, едната група која ја има болеста што истражувачите ја проучуваат и другата која делува како контрола што ја нема таа конкретна болест. Примероците на ДНК се добиваат од учесниците, а нивниот геном потоа може да се изведе преку лабораториски машини и брзо да се испита за да се споредат учесниците и да се бараат еднинечни нуклеотидни полиморфизми кои потенцијално можат да бидат поврзани со болеста. Оваа техника им овозможува на истражувачите точно да ги одредат гените и местата на интерес во човечкиот геном што потоа можат дополнително да ги проучуваат за да ја идентификуваат таа причина за болеста.[38]
Кариотипизација[уреди | уреди извор]
Кариотипизацијата им овозможува на истражувачите да ги анализираат хромозомите за време на метафазата на митозата, кога тие се во кондензирана состојба. Хромозомите се обоени и визуелизирани преку микроскоп за да бидат барани какви било хромозомски абнормалности. Оваа техника може да се користи за откривање на вродени генетски нарушувања, како што е Даунов синдром, за идентификување на полот во ембрионите и за дијагностицирање на некои видови рак кои се предизвикани од хромозомски мутации, како што се транслокациите.[39]
Современи примени[уреди | уреди извор]
Генетско инженерство[уреди | уреди извор]
Генетското инженерство е ново поле на науката, а истражувачите можат да ја искористат молекуларната генетска технологија за да ја модифицираат ДНК на организмите и да создадат генетски модифицирани и подобрени организми за индустриски, земјоделски и медицински цели. Ова може да се направи преку техники за уредување на геномот, што може да вклучи модификација на базни парови во секвенца на ДНК или додавање и бришење на одредени региони на ДНК.[40]
Уредување на гени[уреди | уреди извор]
Уредувањето на гените им овозможува на научниците да ја менуваат/уредат ДНК на организам. Еден начин да се должи ова е преку техниката Crispr/Cas9, која била приспособена од имунолошката одбрана на геномот што природно се јавува кај бактериите. Оваа техника се потпира на протеинот Cas9 кој им овозможува на научниците да направат пресек на нишките на ДНК на одредено место и користи специјализирана водечка низа на РНК за да се осигура дека сечењето е направено на соодветно место во геномот. Потоа, научниците користат патишта за поправка на ДНК за да предизвикаат промени во геномот; оваа техника има широки импликации за лекување на болеста.[41]
Персонализирана медицина[уреди | уреди извор]
Молекуларната генетика има широки импликации во медицинскиот напредок и разбирањето на молекуларната основа на болеста дава можност за поефективни дијагностички и терапии. Една од целите на оваа област е персонализирана медицина, каде што генетиката на поединецот може да помогне да биде утврдена причината и да биде прилагоден лекот за болеста со која се заболени и потенцијално да овозможи поиндивидуализирани пристапи за третман кои би можеле да бидат поефикасни. На пример, одредени генетски варијации кај поединците би можеле да ги направат поприемливи за одреден лек, додека други би можеле да имаат поголем ризик од несакани реакции на третманите. Така, оваа информација ќе им овозможи на истражувачите и клиничките лекари да донесат најинформирани одлуки за ефикасноста на третманот за пациентите наместо стандардниот пристап на обиди и грешки.[42]
Форензичка генетика[уреди | уреди извор]
Форензичката генетика игра суштинска улога за злосторнички истраги преку таа употреба на различни молекуларни генетски техники. Една вообичаена техника е отпечатоците од ДНК, кои се прават со помош на комбинација на молекуларни генетски техники како полимеразна верижна реакција и гелова електрофореза. Полимеразната верижна реакција е техника која овозможува засилување на целната ДНК секвенца, што значи дека дури и мала количина на ДНК од местото на злосторството може да биде екстрахирана и умножувана многу пати за да се обезбеди доволна количина на материјал за анализа. Електрофорезата со гел овозможува одвојување на секвенцата на ДНК врз основа на големината, а моделот што се добива е познат како ДНК отпечаток од прст и е единствен за секој поединец. Оваа комбинација на молекуларни генетски техники овозможува да се екстрахира едноставна ДНК секвенца, да се засили, анализира и спореди со други и е стандардна техника што се користи во судското вештачење.[43]
Поврзано[уреди | уреди извор]
- Комплементираност (генетика)
- Оштетување на ДНК (природно настанување)
- Теорија на стареење за оштетувањето на ДНК
- Епигенетика
- Картирање на ген
- Генетски код
- Генетска рекомбинација
- Геномско втискување
- Историја на генетиката
- Хомологна рекомбинација
- Мутагенеза
- Регулација на генското изразување
- Времеслед на историјата на генетиката
- Преобразба (генетика)
Наводи[уреди | уреди извор]
- ↑ 1,0 1,1 Waters, Ken (2013), Zalta, Edward N. (уред.), Molecular Genetics (Fall 2013. изд.), Metaphysics Research Lab, Stanford University, Посетено на 2019-10-07
- ↑ Alberts, Bruce (2014-11-18). Molecular biology of the cell (Sixth. изд.). New York, NY. ISBN 978-0-8153-4432-2. OCLC 887605755.
- ↑ Brown, Terence A. (2002), „Mutation, Repair and Recombination“, Genomes. 2nd edition (англиски), Wiley-Liss, Посетено на 1 февруари 2024
- ↑ Lamm, Ehud; Harman, Oren; Veigl, Sophie Juliane (јуни 2020). „Before Watson and Crick in 1953 Came Friedrich Miescher in 1869“. Genetics. 215 (2): 291–296. doi:10.1534/genetics.120.303195. ISSN 0016-6731. PMC 7268995. PMID 32487691.
- ↑ „The Nobel Prize in Physiology or Medicine 1910“. NobelPrize.org (англиски). Посетено на 2023-10-15.
- ↑ „Gregor Mendel and the Principles of Inheritance | Learn Science at Scitable“. www.nature.com (англиски). Посетено на 1 февруари 2024.
- ↑ Paweletz, N. (January 2001). „Walther Flemming: pioneer of mitosis research“. Nature Reviews. Molecular Cell Biology. 2 (1): 72–75. doi:10.1038/35048077. ISSN 1471-0072. PMID 11413469.
- ↑ Avery OT, Macleod CM, McCarty M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types: Induction of transformation by a desoxyribonucleic acid fraction isolated form pneumococcus type III. J Exp Med. 1 февруари 1944;79(2):137-58. doi:10.1084/jem.79.2.137. PubMed (англиски); Предлошка:PMCID
- ↑ 9,0 9,1 Bernstein H, Bernstein C, Michod RE (2018). Sex in microbial pathogens. Infection, Genetics and Evolution volume 57, стр. 8-25. doi:10.1016/j.meegid.2017.10.024
- ↑ 10,0 10,1 Elson, David; Chargaff, Erwin (мај 1954). „Regularities in the Composition of Pentose Nucleic Acids“. Nature (англиски). 173 (4413): 1037–1038. Bibcode:1954Natur.173.1037E. doi:10.1038/1731037a0. ISSN 1476-4687. PMID 13165710.
- ↑ Watson, J. D.; Crick, F. H. C. (април 1953). „Molecular Structure of Nucleic Acids: A Structure for Deoxyribose Nucleic Acid“. Nature (англиски). 171 (4356): 737–738. Bibcode:1953Natur.171..737W. doi:10.1038/171737a0. ISSN 1476-4687. PMID 13054692.
- ↑ Phage and the Origins of Molecular Biology (2007) Edited by John Cairns, Gunther S. Stent, and James D. Watson, Cold Spring Harbor Laboratory of Quantitative Biology, Cold Spring Harbor, Long Island, New York ISBN 978-0-87969-800-3
- ↑ Sarabhai AS, Stretton AO, Brenner S, Bolle A (јануари 1964). "Co-linearity of the gene with the polypeptide chain". Nature. 201 (4914): 13–7. Bibcode:1964Natur.201...13S. doi:10.1038/201013a0. PubMed (англиски). S2CID 10179456
- ↑ „Restriction Enzymes Spotlight | Learn Science at Scitable“. www.nature.com. Посетено на 1 февруари 2024.
- ↑ Righetti, Pier Giorgio (24 јуни 2005). „Electrophoresis: The march of pennies, the march of dimes“. Journal of Chromatography A. 1079 (1–2): 24–40. doi:10.1016/j.chroma.2005.01.018. PMID 16038288.
- ↑ „Southern Blotting | MyBioSource Learning Center“. Посетено на 1 февруари 2024.
- ↑ „Professor Paul Berg | Biographical summary“. WhatisBiotechnology.org. Посетено на 1 февруари 2024.
- ↑ „Herbert W. Boyer and Stanley N. Cohen“. Science History Institute. 2016-06-01. Посетено на 1 февруари 2024.
- ↑ „DNA sequencing | genetics“. Encyclopedia Britannica. Посетено на 1 февруари 2024.
- ↑ „The Invention of PCR“. Bitesize Bio. 2007-10-24. Посетено на 1 февруари 2024.
- ↑ „Timeline: Organisms that have had their genomes sequenced“. yourgenome. Посетено на 1 февруари 2024.
- ↑ „What is genomics?“. EMBL-EBI Train online. 2011-09-09. Посетено на 1 февруари 2024.
- ↑ „What is bioinformatics? A proposed definition and overview of the field“. Methods of Information in Medicine. 40 (2). 2001. doi:10.1055/s-008-38405. ISSN 0026-1270.
- ↑ „The Central Dogma | Protocol“. www.jove.com. Посетено на 1 февруари 2024.
- ↑ „Transcription, Translation and Replication“. www.atdbio.com. Посетено на 1 февруари 2024.
- ↑ „Genetic Code“. Genome.gov (англиски). Посетено на 1 февруари 2024.
- ↑ „A Brief Guide to Genomics“. Genome.gov (англиски). Посетено на 1 февруари 2024.
- ↑ „Home - Genome - NCBI“. www.ncbi.nlm.nih.gov. Посетено на 1 февруари 2024.
- ↑ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002), „The Structure and Function of DNA“, Molecular Biology of the Cell. 4th edition (англиски), Garland Science, Посетено на 1 февруари 2024
- ↑ „Semi-Conservative DNA Replication | Learn Science at Scitable“. www.nature.com (англиски). Посетено на 1 февруари 2024.
- ↑ „Selection versus Screening in Directed Evolution“, Directed Evolution of Selective Enzymes (англиски), John Wiley & Sons, Ltd, 2016, стр. 27–57, doi:10.1002/9783527655465.ch2, ISBN 978-3-527-65546-5
- ↑ Schneeberger, Korbinian (20 август 2014). „Using next-generation sequencing to isolate mutant genes from forward genetic screens“. Nature Reviews Genetics (англиски). 15 (10): 662–676. doi:10.1038/nrg3745. ISSN 1471-0056. PMID 25139187.
|hdl-access=бара|hdl=(help) - ↑ Lawson, Nathan D.; Wolfe, Scot A. (2011-07-19). „Forward and Reverse Genetic Approaches for the Analysis of Vertebrate Development in the Zebrafish“. Developmental Cell (англиски). 21 (1): 48–64. doi:10.1016/j.devcel.2011.06.007. ISSN 1534-5807. PMID 21763608.
- ↑ Kutscher, Lena M. (2014). „Forward and reverse mutagenesis in C. elegans“. WormBook: 1–26. doi:10.1895/wormbook.1.167.1. PMC 4078664. PMID 24449699.
- ↑ Hardy, Serge; Legagneux, Vincent; Audic, Yann; Paillard, Luc (октомври 2010). „Reverse genetics in eukaryotes“. Biology of the Cell. 102 (10): 561–580. doi:10.1042/BC20100038. PMC 3017359. PMID 20812916.
- ↑ Doyle, Alfred; McGarry, Michael P.; Lee, Nancy A.; Lee, James J. (април 2012). „The construction of transgenic and gene knockout/knockin mouse models of human disease“. Transgenic Research. 21 (2): 327–349. doi:10.1007/s11248-011-9537-3. ISSN 0962-8819. PMC 3516403. PMID 21800101.
- ↑ „Microsatellite“. Genome.gov (англиски). Посетено на 1 февруари 2024.
- ↑ „Genome-Wide Association Studies Fact Sheet“. Genome.gov (англиски). Посетено на 2023-12-07.
- ↑ „Karyotyping | Learn Science at Scitable“. www.nature.com (англиски). Посетено на 1 февруари 2024.
- ↑ Howard, Heidi C.; van El, Carla G.; Forzano, Francesca; Radojkovic, Dragica; Rial-Sebbag, Emmanuelle; de Wert, Guido; Borry, Pascal; Cornel, Martina C. (јануари 2018). „One small edit for humans, one giant edit for humankind? Points and questions to consider for a responsible way forward for gene editing in humans“. European Journal of Human Genetics. 26 (1): 1–11. doi:10.1038/s41431-017-0024-z. ISSN 1018-4813. PMC 5839051. PMID 29192152.
- ↑ „What are genome editing and CRISPR-Cas9?: MedlinePlus Genetics“. medlineplus.gov (англиски). Посетено на 1 февруари 2024.
- ↑ Goetz, Laura H.; Schork, Nicholas J. (јуни 2018). „Personalized Medicine: Motivation, Challenges and Progress“. Fertility and Sterility. 109 (6): 952–963. doi:10.1016/j.fertnstert.2018.05.006. ISSN 0015-0282. PMC 6366451. PMID 29935653.
- ↑ Li, Chengtao (2018-07-18). „Forensic genetics“. Forensic Sciences Research. 3 (2): 103–104. doi:10.1080/20961790.2018.1489445. ISSN 2096-1790. PMC 6197140. PMID 30483657.
Дополнителна литература[уреди | уреди извор]
- Мрежни страници и бази на податоци поврзани со генетика, цитогенетика и онкологија, на Атлас за генетика и цитогенетика во онкологија и хематологија
- Џереми В. Дејл и Сајмон Ф. Парк. 2010 година. Molecular Genetics of Bacteria, 5-то издание ISBN 978-0-470-74184-9
Надворешни врски[уреди | уреди извор]
 Молекуларна генетика на Ризницата ?
Молекуларна генетика на Ризницата ?
|
