Медицинска генетика
Медицинска генетика е гранка на медицината која вклучува дијагноза и третман на наследни нарушувања. Медицинската генетика се разликува од човечката генетика по тоа што човечката генетика е поле од научно истражување кое може или не може да се однесува на медицината, додека медицинската генетика се однесува на примената на генетиката во медицинската нега. Пример, истражувањето за генетските нарушувања, причините и наследството за нив ќе се разгледува и во рамките на човечката генетика и медицинската генетик.
Проучувањето на типично немедицински фенотипови како што е генетиката на бојата на очите ќе се смета за дел од човечката генетика, но не мора да биде релевантно за медицинската генетика. Генетска медицина е понов поим за медицинска генетика и вклучува области како што се генска терапија, персонализирана медицина и брзо појавната нова медицинска специјалност, предиктивна медицина.
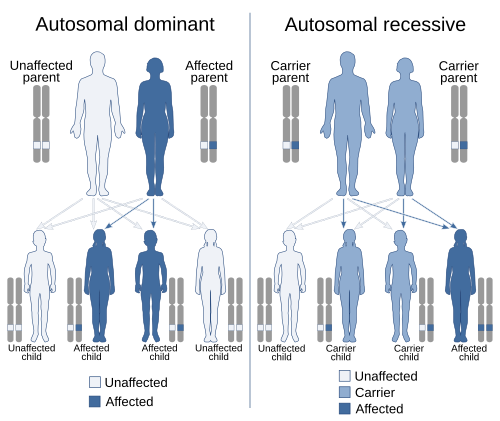
Медицинската генетика опфаќа многу различни области, вклучувајќи клиничка пракса, генетски советници и нутриционисти, клинички дијагностички лабораториски активности и истражување за причините и наследството на генетските нарушувања. Примери на состојби кои спаѓаат во опсегот на медицинската генетика вклучуваат вродени дефекти и дисморфологија, интелектуални попречености, аутизам, митохондријални нарушувања, скелетна дисплазија, нарушувања на сврзното ткиво. Медицинската генетика се повеќе станува релевантна за многу вообичаени болести. Почнале да се појавуваат преклопувања со други медицински специјалности, бидејќи неодамнешниот напредок во генетиката открива етиологии за морфолошки, ендокрини, кардиоваскуларни, пулмонални, офталмолог и други состојби.
Субспецијалности[уреди | уреди извор]
На некој начин, многу од поединечните полиња во медицинската генетика се хибриди помеѓу клиничката нега и истражувањето. Ова делумно се должи на неодамнешниот напредок во науката и технологијата кои овозможија невидено разбирање на генетските нарушувања.
Клиничка генетика[уреди | уреди извор]
Клиничка генетика е медицинска специјалност. Гранките на клиничката генетика вклучуваат:
- 1. Пренатална генетика
- Парови изложени на ризик да имаат дете со генетско нарушување предконцепција или додека се бремени
- Резултати од висок ризик пренатален скрининг
- Абнормален ултразвук на фетусот
- 2. Детска генетика
- Вродени дефекти
- Попреченост во развојот, аутизам, епилепсија
- низок раст и скелетна дисплазија
- 3. Возрасна генетика
- кардиомиопатија и срцеви дисритмии
- наследна бубрежна болест
- деменција и невродегенерација
- болест на сврзното ткиво
- 4. Генетика на ракот
- рак на дојка/јајници
- рак на дебелото црево
- ендокрини тумори
Примери за генетски синдроми кои вообичаено се гледаат во клиниката за генетика вклучуваат хромозомски преуредувања, синдром на Кревка Х, Марфанов синдром, неврофиброматоза, фамилијарна болест, неврофиброматоза и др.
Обука и квалификација[уреди | уреди извор]
Во Соединетите Американски Држави, лекарите кои практикуваат клиничка генетика се акредитирани од Американскиот одбор за медицинска генетика и геномика (ABMGG).[1] За да стане лекар по клиничка генетика овластен од одборот, лекарот мора да заврши минимум 24 месеци обука во програма акредитирана од ABMGG.
Во Австралија и Нов Зеланд, клиничката генетика е тригодишна програма за напредна обука за оние кои веќе ја имаат својата примарна медицинска квалификација и успешно ја завршиле основната обука или за педијатриска медицина или за медицина на возрасни. Обуката ја надгледувал Кралскиот австралазиски колеџ на лекари со Австралазиското здружение на клинички генетичари кои придонесуваат за авторството на наставната програма преку нивната матична организација, Здружението за хумана генетика на Австралија.[2]
Метаболичка/биохемиска генетика[уреди | уреди извор]
Метаболичката (или биохемиска) генетика вклучува дијагноза и управување со вродени грешки на метаболизмот во кои пациентите имаат ензимски недостатоци кои ги нарушуваат биохемиските патишта вклучени во метаболизмот на јаглени хидрати, амино киселини и липиди. Примери за метаболички нарушувања вклучуваат галактоземија, болест на складирање на гликоген, нарушувања на лизозомалното складирање, метаболна ацидоза и др.
Цитогенетика[уреди | уреди извор]
Цитогенетиката е проучување на хромозомите и хромозомските абнормалности. Додека цитогенетиката историски се потпирала на микроскопија за анализирање на хромозомите, новите молекуларни технологии како што е компаративната геномска хибридизација на низа станале широко користени.
Молекуларна генетика[уреди | уреди извор]
Молекуларната генетика вклучува откривање и лабораториско тестирање за мутации на ДНК кои се во основата на многу нарушувања на еден ген. Примери за нарушувања на еден ген вклучуваат ахондроплазија, цистична фиброза, мускулна дистрофија на Душен, наследен рак на дојка, Хантингтонова болест, Марфанов синдром, Нунан синдром и Рет синдром.
Митохондријална генетика[уреди | уреди извор]
Митохондријалната генетика се однесува на дијагнозата и управувањето со митохондријалните нарушувања, кои имаат молекуларна основа.
Постои одредено преклопување помеѓу медицинските генетски дијагностички лаборатории и молекуларната патологија.
Генетско советување[уреди | уреди извор]
Генетското советување е процес на обезбедување информации за генетските состојби, дијагностичкото тестирање и ризиците кај другите членови на семејството, во рамките на недирективното советување. Генетските советници се не-лекар членови на тимот за медицинска генетика кои се специјализирани за проценка на семејниот ризик и советување на пациентите во врска со генетските нарушувања. Прецизната улога на генетскиот советник донекаде варира во зависност од нарушувањето. Кога работат заедно со генетичарите, генетските советници обично се специјализирани за педијатриска генетика која се фокусира на развојни абнормалности присутни кај новороденчиња, доенчиња или деца.
Историја[уреди | уреди извор]
Иако генетиката има свои корени уште во 19 век со работата на боемскиот монах Грегор Мендел и други пионери научници, човечката генетика се појавила подоцна. Почнала да се развива, иако бавно, во првата половина на 20 век. Менделовото наследување (еден ген) било проучено кај голем број важни нарушувања како што се албинизам, брахидактилија (кратки прсти на рацете и нозете) и хемофилија.
Медицинската генетика била доцна развиена, која се појавила главно по завршувањето на Втората светска војна (1945), кога движењето за евгеника паднало во лоша репутација.[3] Нацистичката злоупотреба на евгениката звучело како смрт.[4] Скратен од евгениката, можел да се користи научен пристап и бил применет на човечката и медицинската генетика. Медицинската генетика забележала сè побрз пораст во втората половина на 20 и 21 век.
Тековна практика[уреди | уреди извор]
Клиничкото опкружување во кое се оценуваат пациентите го одредувало обемот на практиката, дијагностичките и терапевтските интервенции. Tипичните средби меѓу пациентите и генетските практичари може да вклучуваат:
Дијагностичка евалуација[уреди | уреди извор]
Секој пациент ќе подлежи на дијагностичка евалуација прилагодена на нивните знаци и симптоми. Генетичарот ќе воспостави диференцијална дијагноза. Тестовите може да оценат хромозомски нарушувања на еден ген или вродени грешки во метаболизмот.
Хромозомски студии[уреди | уреди извор]

Хромозомските студии се користат во клиниката за општа генетика за да се утврди причината за доцнење во развојот или интелектуална попреченост, вродени дефекти, дисморфни карактеристики или аутизам. Анализата на хромозомите се врши и во пренатална средина за да се утврди дали фетусот е зафатен со анеуплоидија или други хромозомски преуредувања.
Основни метаболички студии[уреди | уреди извор]
Биохемиски студии се вршат за да се испита нерамнотежата на метаболитите во телесната течност, обично крвта (плазма/серум) или урината, но исто така и во цереброспиналната течност (CSF). Под одредени околности се користат и тестови за ензимската функција. Во САД, екранот за новороденчиња вклучува биохемиски тестови за скрининг за состојби кои се лекуваат како што се галактоземија и фенилкетонурија (PKU). Пациентите може да се подложат на следниве тестови:
- Квантитативната анализа на аминокиселините обично се изведува со помош на реакцијата на нинхидрин, проследена со течна хроматографија за мерење на количината на аминокиселина во примерокот (урина, плазма/серум или CSF). Мерењето на амино киселините во плазмата или серумот се користи за евалуација на нарушувања на метаболизмот на аминокиселините како што се нарушувања на циклусот на уреа, уринарна болест од јаворов сируп и PKU. Мерењето на амино киселините во урината може да биде корисно во дијагнозата на цистинурија или бубрежниот Фанкони синдром, како што може да се забележи кај цистиноза.
- Анализата на органска киселина во урината може да се изврши со квантитативни или квалитативни методи, но во секој случај тестот се користи за откривање на екскреција на абнормални органски киселини. Овие соединенија вообичаено се произведуваат за време на телесниот метаболизам на амино киселините и масни киселини со непарен синџир, но се акумулираат кај пациенти со одредени метаболички состојби.
- Комбинираниот профил на ацилкарнитин открива соединенија како органски киселини и масни киселини конјугирани со карнитин. Тестот се користи за откривање на нарушувања кои вклучуваат метаболизам на масни киселини, вклучително и MCAD.
- Пируватот и лактатот се нуспроизводи на нормалниот метаболизам, особено за време на анаеробниот метаболизам. Овие соединенија вообичаено се акумулираат за време на вежбање или исхемија, но исто така се покачени кај пациенти со нарушувања на метаболизмот на пируватите или митохондријални нарушувања.
- Амонијакот е краен производ на метаболизмот на аминокиселините и се претвора во црниот дроб во уреа преку серија ензимски реакции наречени циклус на уреа. Затоа, покачен амонијак може да се открие кај пациенти со нарушувања на циклусот на уреа, како и други состојби кои вклучуваат откажување на црниот дроб.
- Ензимско тестирање се врши за широк опсег на метаболички нарушувања за да се потврди дијагнозата сомнителна врз основа на скрининг тестовите.
Молекуларни студии[уреди | уреди извор]
- Секвенционирањето на ДНК се користи за директно да се анализира геномската ДНК секвенца на одреден ген. Општо земено, се анализираат само деловите од генот што го кодираат изразениот протеин ( екзони ) и мали количини на околните непреведени региони и интрони . Затоа, иако овие тестови се многу специфични и чувствителни, тие рутински не ги идентификуваат сите мутации кои можат да предизвикаат болест.
- Анализата на метилација на ДНК се користи за дијагностицирање на одредени генетски нарушувања кои се предизвикани од нарушувања на епигенетските механизми како што се геномско втиснување и еднородителска дисомија.
- Southern blotting е рана техника основна за детекција на фрагменти од ДНК одвоени по големина преку гел електрофореза и откриени со помош на радио означени сонди. Овој тест рутински се користеше за откривање на бришења или дупликации во состојби како што е мускулната дистрофија на Душен, но се заменува со компаративни техники на геномска хибридизација на низа со висока резолуција. Саутерн blotting е сè уште корисен во дијагнозата на нарушувања предизвикани од повторувања на тринуклеотид.
Третмани[уреди | уреди извор]
Секоја клетка од телото содржи наследна информација (ДНК) обвиткана во структури наречени хромозоми. Бидејќи генетските синдроми обично се резултат на промени на хромозомите или гените, во моментов не постои достапен третман кој може да ги коригира генетските промени во секоја клетка од телото. Затоа, во моментов не постои „лек“ за генетски нарушувања. Сепак, за многу генетски синдроми постои достапен третман за управување со симптомите. Во некои случаи, особено вродените грешки на метаболизмот, механизмот на болеста е добро разбран и нуди потенцијал за диететски и медицински третман за да се спречат или да се намалат долгорочните компликации.
- Терапија за замена на ензими
Одредени болести на лизозомалното складирање се третираат со инфузии на рекомбинантен ензим (произведен во лабораторија), кој може да ја намали акумулацијата на соединенијата во различни ткива. Примерите вклучуваат болест на Гоше, Фабри болест, Мукополисахаридози и болест на складирање на гликоген тип II. Ваквите третмани се ограничени од способноста на ензимот да допре до погодените области (крвно-мозочната бариера го спречува ензимот да стигне до мозокот, на пример), а понекогаш може да биде поврзан со алергиски реакции.
Други примери[уреди | уреди извор]
- Блокатори на ангиотензин рецептор кај Марфанов синдром и Лојс-Диц
- Трансплантација на коскена срцевина
- Генска терапија
Патеки за кариера и обука[уреди | уреди извор]
| ||||||||||

Постојат различни патеки за кариера во областа на медицинската генетика. Информациите вклучени во овој дел се однесуваат на типичните патеки во Соединетите Држави и може да има разлики во други земји. Американските лекари во клинички, советодавни или дијагностички супспецијалности обично добивале сертификација од одборот преку Американскиот одбор за медицинска генетика.
| Кариера | Степен | Опис | Обука |
| Клинички генетичар | MBBS, MD, DO, или MD-PhD | Клинички генетичар е типично лекар кој ги оценува пациентите во канцеларија или како болничка консултација. Овој процес вклучува медицинска историја, семејна историја ( педигре ), детален физички преглед, преглед на објективни податоци како што се слики и резултати од тестот, воспоставување диференцијална дијагноза и препорачување соодветни дијагностички тестови. | Факултет (4 години) → Медицинско училиште (4 години) → Основен престој (1 година) → Резиденција по клиничка генетика (2 години). Некои клинички генетичари, исто така, добиваат докторат (4-7 год.). Новата патека за престој нуди 4-годишен примарен престој по клиничка генетика веднаш по завршувањето на Медицинскиот факултет.[се бара извор]</link>[ Потребен е цитат ] |
| Генетски советник | ГОСПОЃИЦА | Генетски советник е специјализиран за комуникација на генетски информации до пациентите и семејствата. Генетските советници често тесно соработуваат со клинички генетичари или други лекари (како што се акушери или онколози ) и често ги пренесуваат резултатите од препорачаните тестови. | Колеџ (4 год.) → Програма за постдипломски студии по генетско советување (2 год.). |
| Метаболичка медицинска сестра и/или нутриционист | БА / BS, MS, RN | Еден од критичните аспекти на менаџментот на пациентите со метаболички нарушувања е соодветната нутритивна интервенција (или ограничување на соединението што не може да се метаболизира, или дополнување соединенија кои се дефицитарни како резултат на ензимски дефицит). Метаболичката медицинска сестра и нутриционистот играат важна улога во координирањето на управувањето со исхраната. | Колеџ (4 години) → Училиште за медицински сестри или постдипломски обуки за исхрана. |
| Биохемиска дијагностика | BS, MS, PhD, MBBS, MD, DO, MD-PhD | Поединци кои се специјализирани за биохемиска генетика обично работат во дијагностичка лабораторија, анализирајќи и толкувајќи специјализирани биохемиски тестови кои ги мерат амино киселините, органските киселини и ензимската активност. Некои клинички генетичари се исто така сертифицирани за биохемиска генетика. | Колеџ (4 години) → Факултет за завршено (д-р, обично 4-7 години) и/или Медицинско училиште (4 години) |
| Цитогенетска дијагностика | BS, MS, PhD, MBBS, MD, DO, MD-PhD | Поединци кои се специјализирани за цитогенетика обично работат во дијагностичка лабораторија, анализирајќи и толкувајќи кариотипови, FISH и компаративни тестови за геномска хибридизација . Некои клинички генетичари се исто така сертифицирани за цитогенетика. | Колеџ (4 години) → Факултет за завршено (д-р, обично 4-7 години) и/или Медицинско училиште (4 години) |
| Молекуларна генетика | BS, MS, PhD, MBBS, MD, DO, MD-PhD | Поединци кои се специјализирани за молекуларна генетика обично работат во дијагностичка лабораторија, анализирајќи и толкувајќи специјализирани генетски тестови кои бараат промени ( мутации ) во ДНК кои предизвикуваат болести. Некои примери на молекуларни дијагностички тестови вклучуваат секвенционирање на ДНК и саутерно размачкање . | Колеџ (4 години) → Факултет за завршено (д-р, обично 4-7 години) и/или Медицинско училиште (4 години) |
| Истражувачки генетичар | BS, MS, PhD, MBBS, MD, DO, MD-PhD | Секој истражувач кој ја проучува генетската основа на човечката болест или користи моделски организми за проучување на механизмите на болеста, може да се смета за Истражувачки генетичар. Многу од клиничките патеки за кариера вклучуваат и основни или преведувачки истражувања, а со тоа и поединци од областа на медицинската генетика често учествуваат во некоја форма на истражување. | Колеџ (4 години) → Факултет за завршено (д-р, обично 4-7 години) и/или Медицинско училиште (4 години) → Обука за пост-докторски истражувања (обично 3+ години) |
| Лабораториски техничар | АС, БС, МС | Техничарите во дијагностичките или истражувачките лаборатории се справуваат со примероците и ги спроведуваат анализите на клупата. | Колеџ (4 години), може да има повисок степен (MS, 2+ години) |
Етички, правни и социјални импликации[уреди | уреди извор]
Генетските информации обезбедуваат уникатен тип на знаење за поединецот и неговото/нејзиното семејство, фундаментално различно од типично лабораториски тест кој дава „слика“ на здравствената состојба на поединецот.
На 19 март 2015 година, научниците побарале светска забрана за клиничка употреба на методи, особено употребата на CRISPR и цинк прст, за уредување на човечкиот геном на начин што може да се наследи.[5][6][7][8] Во април 2015 и април 2016 година, кинеските истражувачи објавиле резултати од основното истражување за уредување на ДНК на неодржливи човечки ембриони со помош на CRISPR.[9][10][11] Во февруари 2016 година, британските научници добиле дозвола од регулаторите да модифицираат генетски човечки ембриони користејќи CRISPR и сродни техники, под услов ембрионите да бидат уништени во рок од седум дена.[12] Во јуни 2016 година, беше објавено дека холандската влада планира да го следи примерот со слични регулативи кои ќе наведат ограничување од 14 дена.[13]
Општества[уреди | уреди извор]
Пристап кон човечката и медицинската генетика бил формализиран со основањето во 1948 година на Американското здружение за хумана генетика. Друштвото првпат започнало со годишни состаноци таа година (1948) и неговиот меѓународен колега, Меѓународниот конгрес за хумана генетика, се составувале на секои 5 години од неговото основање во 1956 година.
Медицинската генетика е препознаена како посебна медицинска специјалност. Во САД, медицинската генетика има свој одобрен одбор (Американски одбор за медицинска генетика) и клинички специјализиран колеџ (Американски колеџ за медицинска генетика). Колеџот одржува годишен научен состанок, објавува месечно списание Генетика во медицината.
Во Австралија и Нов Зеланд, медицинските генетичари се обучувале и сертифицирале под покровителство на Кралскиот австралазиски колеџ на лекари, но професионално припаѓаат на Здружението за хумана генетика на Австралија и неговата група за посебен интерес, Австралазиското здружение на клинички генетичари.
биоетиката[уреди | уреди извор]
Истражување[уреди | уреди извор]
| ||||||||||
Широкиот опсег на истражувања во медицинската генетика го одразува опсегот на оваа област, вклучувајќи ги основните истражувања за генетското наследство и човечкиот геном, механизмите на генетските и метаболичките нарушувања.
Алелна архитектура на болеста[уреди | уреди извор]
| ||||||||||
Понекогаш врската помеѓу болеста и необична генска варијанта е посуптилна. Генетската архитектура на заедничките болести е важен фактор во одредувањето на степенот до кој моделите на генетски варијации влијаат на групните разлики во здравствените резултати.[14][15][16] Според хипотезата за вообичаена болест/заедничка варијанта, вообичаените варијанти присутни кај популацијата на предците пред растурањето на современите луѓе од Африка играат важна улога во болестите на луѓето.[17] Генетските варијанти поврзани со Алцхајмерова болест, длабока венска тромбоза, Кронова болест и дијабетес тип 2 се чини дека се придржуваат до овој модел.[18]
Бројот на варијанти кои придонесуваат за болеста и интеракциите меѓу тие варијанти, исто така, може да влијаат на распределбата на болестите меѓу групите. Тешкотијата што се среќава во пронаоѓањето на алели кои придонесуваат за сложени болести и во реплицирањето позитивни асоцијации сугерира дека многу сложени болести вклучуваат бројни варијанти наместо умерен број алели, а влијанието на која било дадена варијанта може да зависи на критични начини од генетските и еколошка позадина.[19][20][21][22]
Подструктура на населението во генетичко истражување[уреди | уреди извор]
| ||||||||||
Една област во која категориите на популации можат да бидат важни размислувања во генетичкото истражување е контролата на мешањето помеѓу потструктурата на населението, изложеноста на животната средина и здравствените резултати. Студиите за асоцијација можат да произведат лажни резултати ако случаите и контролите имаат различни алели фреквенции за гените кои не се поврзани со болеста што се проучува,[23] иако големината на овој проблем во студиите за генетска асоцијација е предмет на дебата.[24][25]
Подструктурата на популацијата, исто така, може да се користи како предност во студиите за генетска асоцијација.[26] На пример, популациите што претставуваат неодамнешни мешавини на географски одвоени групи на предци може да покажат нерамнотежа на поврзаноста на подолг опсег помеѓу алели на подложност и генетски маркери отколку што е случајот со другите популации. Генетските студии можат да ја искористат оваа нерамнотежа на поврзаноста на примеси за да бараат алели на болеста со помалку маркери отколку што би било потребно инаку.
Исто така види[уреди | уреди извор]
- Целосно секвенционирање на геномот
- Вродена грешка во метаболизмот
- Предиктивна медицина
Наводи[уреди | уреди извор]
| ||||||||||
Понатамошно читање[уреди | уреди извор]
- Peter Harper; Lois Reynolds; Tilli Tansey, уред. (2010), Clinical Genetics in Britain: Origins and development, Wellcome Witnesses to Contemporary Medicine, History of Modern Biomedicine Research Group, ISBN 978-0-85484-127-1, Википодатоци Q29581774
Надворешни врски[уреди | уреди извор]
- Домашна референца за генетика
- Националниот институт за истражување на човечкиот геном е домаќин на информативен центар
- На Phenomizer – алатка за клиничка дијагностика во медицинската генетика. Феномизатор
| ||||||||||
- ↑ „American Board of Medical Genetics and Genomics“. abmgg.org.
- ↑ RACP. „Clinical Genetics“. Royal Australasian College of Physicians.
- ↑ Rose, Nikolas. (2009). The Politics of Life Itself : Biomedicine, Power, and Subjectivity in the Twenty-First Century. Princeton University Press. ISBN 978-0-691-12190-1. OCLC 995257497.
- ↑ KOCH, TOM (2011-03-25). „Eugenics and the Genetic Challenge, Again: All Dressed Up and Just Everywhere to Go“. Cambridge Quarterly of Healthcare Ethics. 20 (2): 191–203. doi:10.1017/s0963180110000848. ISSN 0963-1801. PMC 3535762. PMID 21435294.
- ↑ Wade, Nicholas (19 March 2015). „Scientists Seek Ban on Method of Editing the Human Genome“. New York Times. Посетено на 20 March 2015.
- ↑ Pollack, Andrew (3 March 2015). „A Powerful New Way to Edit DNA“. New York Times. Посетено на 20 March 2015.
- ↑ Baltimore, David; Berg, Paul; Botchan, Dana; Charo, R. Alta; Church, George; Corn, Jacob E.; Daley, George Q.; Doudna, Jennifer A.; Fenner, Marsha (19 March 2015). „A prudent path forward for genomic engineering and germline gene modification“. Science. 348 (6230): 36–8. Bibcode:2015Sci...348...36B. doi:10.1126/science.aab1028. PMC 4394183. PMID 25791083.
- ↑ Lanphier, Edward; Urnov, Fyodor; Haecker, Sarah Ehlen; Werner, Michael; Smolenski, Joanna (26 March 2015). „Don't edit the human germ line“. Nature. 519 (7544): 410–411. Bibcode:2015Natur.519..410L. doi:10.1038/519410a. PMID 25810189.
- ↑ Kolata, Gina (23 April 2015). „Chinese Scientists Edit Genes of Human Embryos, Raising Concerns“. New York Times. Посетено на 24 April 2015.
- ↑ Liang, Puping; Xu, Yanwen; Zhang, Xiya; Ding, Chenhui; Huang, Rui; Zhang, Zhen; Lv, Jie; Xie, Xiaowei; Chen, Yuxi (18 April 2015). „CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes“. Protein & Cell. 6 (5): 363–72. doi:10.1007/s13238-015-0153-5. PMC 4417674. PMID 25894090.
- ↑ Regalado, Antonio (2016-05-08). „Chinese Researchers Experiment with Making HIV-Proof Embryos“. MIT Technology Review. Посетено на 2016-06-10.
- ↑ Gallagher, James (1 February 2016). „Scientists get 'gene editing' go-ahead“. BBC News. BBC. Посетено на 10 June 2016.
- ↑ Amjad, Anneesa (2016-06-06). „Dutch government seeks to allow creation of human embryos for research“. BioNews. Архивирано од изворникот на 2016-06-07. Посетено на 2016-06-10.
- ↑ „On the allelic spectrum of human disease“. Trends Genet. 17 (9): 502–510. 2001. doi:10.1016/s0168-9525(01)02410-6. PMID 11525833.
- ↑ Pritchard JK (2002). „The allelic architecture of human disease genes: common disease-common variant...or not?“. Hum Mol Genet. 11 (20): 2417–2423. doi:10.1093/hmg/11.20.2417. PMID 12351577.
- ↑ „The allelic structure of common disease“. Hum Mol Genet. 11 (20): 2455–2461. 2002. CiteSeerX 10.1.1.497.3708. doi:10.1093/hmg/11.20.2455. PMID 12351581.
- ↑ „Human migrations and population structure: what we know and why it matters“. Annu Rev Genom Hum Genet. 3: 129–152. 2002. doi:10.1146/annurev.genom.3.022502.103200. PMID 12142358.
- ↑ „Meta-analysis of genetic association studies supports a contribution of common variants to susceptibility to common disease“. Nat Genet. 33 (2): 177–182. 2003. doi:10.1038/ng1071. PMID 12524541.
- ↑ „How many diseases does it take to map a gene with SNPs?“. Nat Genet. 26 (2): 151–157. 2000. doi:10.1038/79866. PMID 11017069.
- ↑ Risch N (2000). „Searching for the genetic determinants in a new millennium“. Nature. 405 (6788): 847–856. doi:10.1038/35015718. PMID 10866211.
- ↑ „Genomewide scans of complex human diseases: true linkage is hard to find“. Am J Hum Genet. 69 (5): 936–950. 2001. doi:10.1086/324069. PMC 1274370. PMID 11565063.
- ↑ „A comprehensive review of genetic association studies“. Genet Med. 4 (2): 45–61. 2002. doi:10.1097/00125817-200203000-00002. PMID 11882781.
- ↑ „Population stratification and spurious allelic association“. Lancet. 361 (9357): 598–604. 2003. doi:10.1016/s0140-6736(03)12520-2. PMID 12598158.; „The effects of human population structure on large genetic association studies“. Nat Genet. 36 (5): 512–517. 2004. doi:10.1038/ng1337. PMID 15052271.
- ↑ „Point: population stratification: a problem for case-control studies of candidate-gene associations?“. Cancer Epidemiol Biomarkers Prev. 11 (6): 505–512. 2002. PMID 12050090.
- ↑ „Counterpoint: bias from population stratification is not a major threat to the validity of conclusions from epidemiological studies of common polymorphisms and cancer“. Cancer Epidemiol Biomarkers Prev. 11 (6): 513–520. 2002. PMID 12050091.
- ↑ „Accounting for ancestry: population substructure and genome-wide association studies“. Human Molecular Genetics. 17 (R2): R143–R150. October 2008. doi:10.1093/hmg/ddn268. PMC 2782357. PMID 18852203.
