Молекуларно клонирање

Молекуларно клонирање ― збир на опитни методи во молекуларната биологија кои се користени за склопување на рекомбинантни молекули на ДНК и за насочување на нивната репликација во организмите домаќини.[1] Употребата на зборот клонирање се однесува на фактот дека методот вклучува репликација на една молекула за да створи население на клетки со идентични молекули на ДНК. Молекуларното клонирање воглавно користи низи на ДНК од два различни организми: видот кој е извор на ДНК што треба да биде клониран и видот што ќе служи како жив домаќин за репликација на рекомбинантната ДНК. Методите на молекуларно клонирање се главни појави за многу современи области на современата биологија и медицина.[2]
Во конвенционален опит за молекуларно клонирање, ДНК што треба да биде клонирана се добива од организам од интерес, а потоа е третирана со ензими во епрувета за да бидат создадени помали фрагменти на ДНК. Последователно, овие фрагменти потоа се комбинирани со векторска ДНК за да создаваат рекомбинантни молекули на ДНК. Рекомбинантната ДНК потоа е внесувана во организмот домаќин (обично лесен за растење, бениген, лабораториски врста на бактерија E. coli). Ова ќе створи население на организми во кои рекомбинантните молекули на ДНК се реплицираат заедно со ДНК-та на домаќинот. Бидејќи тие содржат туѓи фрагменти на ДНК, тоа се трансгенски или генетски изменет микроорганизам.[3] Оваа постапка го користи фактот дека една бактериска клетка може да биде индуцирана да зафаќа и реплицира една единствена рекомбинантна молекула на ДНК. Оваа единствена клетка потоа може да се прошири експоненцијално за да создава голем број бактерии, од кои секоја содржи копии од првобитната рекомбинантна молекула. Така, и настанатото бактериско население, и рекомбинантната молекула ДНК, најчесто се нарекувани „клонови“. Строго кажано, „рекомбинантната ДНК“ се однесува на молекулите на ДНК, додека „молекуларното клонирање“ се однесува на опитните методи што се користени за нивно склопување. Била појавена идејата дека различни низи на ДНК може да бидат вметнати во плазмид и дека овие туѓи низи ќе се носени во бактерии и ќе се вари како дел од плазмидот. Односно, овие плазмиди би можеле да послужат како вектори за клонирање за да носат гени.[4]
Практично секоја низа на ДНК може да биде клонирана и засилена, но има некои фактори кои може да го ограничат успехот на постапката. Примери на низи на ДНК кои тешко се клонирани се превртените повторувања, потеклото на репликацијата, центромерите и теломерите. Исто така, има помали шанси за успех кога се вметнувани низи на ДНК со големи димензии. Вметнувањата поголеми од 10 kbp имаат многу ограничен успех, но бактериофагите како бактериофагот λ може да бидат изменети за успешно да вметнат низа до 40 kbp.[5]
Историја[уреди | уреди извор]
Пред 1970-тите, разбирањето на генетиката и молекуларната биологија било сериозно попречено од неможноста да бидат изолирани и проучувани поединечни гени од сложени организми. Ова драматично било променето со доаѓањето на методите на молекуларно клонирање. Микробиолозите, барајќи да ги разберат молекуларните механизми преку кои бактериите го ограничуваат растот на бактериофагите, изолирале рестрикциони ендонуклеази, ензими кои можат да ги расцепат молекулите на ДНК само кога ќе се сретнат специфични низи на ДНК.[6] Тие покажале дека рестрикционите ензими ги расцепуваат молекулите на ДНК со должина на хромозомот на одредени места и дека специфичните делови од поголемата молекула може да бидат прочистени со расцепкување на големината. Со користење на втор ензим, ДНК-лигаза, фрагменти создавани од рестрикциони ензими може да бидат споени во нови комбинации, наречени рекомбинантна ДНК. Со рекомбинирање на ДНК сегменти од интерес со векторска ДНК, како што се бактериофаги или плазмиди, кои природно се реплицираат во бактериите, може да бидат направени големи количини на прочистени рекомбинантни ДНК молекули во бактериски култури. Првите рекомбинантни молекули на ДНК биле создадени и проучувани во 1972 година.[7][8]
Преглед[уреди | уреди извор]
Молекуларното клонирање го користи фактот дека хемиската структура на ДНК е фундаментално иста кај сите живи организми. Затоа, ако некој сегмент од ДНК од кој било организам е вметнат во сегмент на ДНК кој ги содржи молекуларните низи потребни за репликација на ДНК, а добиената рекомбинантна ДНК е внесена во организмот од кој се добиени низите за репликација, тогаш туѓата ДНК ќе се реплицира заедно со ДНК на клетката домаќин во трансгенскиот организам.
Молекуларното клонирање е слично на полимеразната верижна реакција по тоа што дозволува репликација на низата на ДНК. Основната разлика помеѓу двата методи е што молекуларното клонирање вклучува репликација на ДНК во жив микроорганизам, додека полимеразната верижна реакција реплицира ДНК во ин витро раствор, без живи клетки.
Дигитално клонирање и симулации[уреди | уреди извор]
Пред да бидат извршени вистински опити за клонирање во лабораторија, повеќето опити за клонирање биле планирани на сметач, користејќи специјализиран софтвер. Иако подробното планирање на клонирањето може да биде направено во кој било уредувач на текст, заедно со семрежни алатки за на пр. дизајн на зачетник со полимеразната верижна реакција, постои посебен софтвер за таа цел. Софтверот за таа цел вклучува на пример ApE[1] (отворен код), DNAStrider[2] (отворен код), Serial Cloner[3] (бесплатен), Collagene[4] (отворен код) и SnapGene (комерцијален). Овие програми овозможуваат симулирање на полимеразните верижни реакции, рестрикциони дигести, лигации итн., односно сите чекори опишани подолу.
Чекори[уреди | уреди извор]
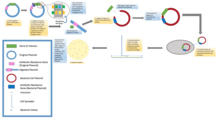
Во стандардните молекуларни опити за клонирање, клонирањето на кој било фрагмент на ДНК суштински вклучува седум чекори: (1) Избор на организам домаќин и вектор за клонирање, (2) Подготовка на векторска ДНК, (3) Подготовка на ДНК што треба да биде клонирана, (4) создавање на рекомбинантна ДНК, (5) Воведување на рекомбинантна ДНК во организмот домаќин, (6) Избор на организми кои содржат рекомбинантна ДНК, (7) Преглед за клонови со сакани внесови на ДНК и биолошки својства.
Имено, растечкиот капацитет и верноста на платформите за синтеза на ДНК овозможуваат сè посложени дизајни во молекуларното инженерство. Овие проекти може да вклучуваат многу долги нишки од нова низа на ДНК и/или да тестираат цели библиотеки истовремено, за разлика од поединечните низи. Овие промени воведуваат сложеност што бара дизајнот да биде оддалечено од рамната претстава заснована на нуклеотид и кон повисоко ниво на апстракција. Примери за такви алатки се GenoCAD, Teselagen[5] (бесплатно за академските кругови) или GeneticConstructor[6] Архивирано на 10 април 2018 г. (бесплатно за академици).
Избор на организам домаќин и вектор за клонирање[уреди | уреди извор]

Иако се користени многу голем број на организми домаќини и вектори за молекуларно клонирање, поголемиот дел од опитите за молекуларно клонирање започнуваат со лабораториска врста на бактеријата Escherichia coli и плазмиден вектор за клонирање. E. coli и плазмидните вектори се во вообичаена употреба бидејќи се технички софистицирани, разновидни, широко достапни и нудат брз раст на рекомбинантните организми со минимална опрема.[3] Ако ДНК што треба да биде клонирана е исклучително голема (од стотици илјади до милиони базни парови), тогаш често е избиран бактериски вештачки хромозом[10] или вектор на вештачки хромозом од квасец.
Специјализираните примени може да бараат специјализирани системи за домаќин-вектор. На пример, ако испитувачите сакаат да соберат одредена белковина од рекомбинантниот организам, тогаш е избиран изразувачки вектор кој содржи соодветни сигнали за транскрипција и превод во посакуваниот организам домаќин. Алтернативно, ако е сакана репликација на ДНК во различни видови (на пример, пренос на ДНК од бактерии на растенија), тогаш може да биде избран вектор на повеќекратен опсег на домаќин (исто така наречен двофункционален вектор). Меѓутоа, во пракса, засебните опити за молекуларно клонирање обично започнуваат со клонирање во бактериски плазмид, проследено со потклонирање во засебен вектор.
Без оглед на комбинацијата на домаќин и вектор, векторот речиси секогаш содржи четири сегменти на ДНК кои се критично важни за неговата функција и опитна корист:[3]
- Потеклото на репликација на ДНК е неопходно за векторот (и неговите поврзани рекомбинантни низи) да се реплицираат во организмот домаќин
- едно или повеќе уникатни места за препознавање на рестрикциона ендонуклеаза да служат како места каде што може да биде воведена туѓа ДНК
- може да биде избран генетски маркер што може да биде користен за да биде овозможено преживување на клетките кои зафатиле векторски низи
- ген за ознака што може да биде користени за преглед на клетки кои содржат туѓа ДНК

Подготовка на векторска ДНК[уреди | уреди извор]
Векторот за клонирање е третиран со рестрикциона ендонуклеаза за да биде расцепена ДНК на местото каде што ќе биде вметната туѓа ДНК. Рестрикциониот ензим е избран да создаде конфигурација на местото на расцепување што е соодветно со краевите на туѓата ДНК (види крај на ДНК). Вообичаено, ова се прави со расцепување на векторската ДНК и туѓа ДНК со истиот рестрикционен ензим или рестрикциона ендонуклеаза, на пример EcoRI и овој рестрикционен ензим бил изолиран од E.coli.[11] Повеќето современи вектори содржат разновидни погодни места за расцепување кои се единствени во рамките на векторската молекула (така што векторот може да се расцепи само на едно место) и се сместени во рамките на генот (често бета-галактозидаза) чие исклучување може да биде користено за да бидат разликувани рекомбинантните од нерекомбинантните организми на подоцнежен чекор во постапката. За да биде подобрен односот на рекомбинантните и нерекомбинантните организми, расцепениот вектор може да биде третиран со ензим (алкална фосфатаза) кој ги дефосфорилира краевите на векторот. Векторските молекули со дефосфорилирани краеви не се способни да се реплицираат, а репликацијата може да биде обновена само ако туѓа ДНК е вметната во местото на расцепување.[12]
Подготовка на ДНК за клонирање[уреди | уреди извор]
За клонирање на геномската ДНК, ДНК што треба да биде клонирана, е екстрахирана од организмот од интерес. Практично секој извор на ткиво може да биде користен (дури и ткива од изумрени животни,[13] се додека ДНК не е интензивно разградена. ДНК потоа е прочистувана со помош на едноставни методи за отстранување на контаминирачките белковини (екстракција со фенол), РНК (рибонуклеаза) и помали молекули (таложење и/или хроматографија). Методите со полимеразна верижна реакција често се користени за амплификација на специфични низи на ДНК или РНК (обратна транскрипција-полимеразна верижна реакција) пред молекуларното клонирање.
ДНК за опити за клонирање, исто така, може да биде добиена од РНК со користење на повратна транскриптаза (клонирање на комплементарна ДНК) или во облик на синтетичка ДНК (синтеза на вештачки гени). Клонирањето на комплементарна ДНК обично е користена за да бидат добиени клонови претставителни од тоа население на информациска РНК на клетките од интерес, додека синтетичката ДНК е користена за да биде добиема која било прецизна низа дефинирана од дизајнерот. Таква дизајнирана низа може да биде потребна кога се движат гените низ генетските кодови (на пример, од митохондриите до јадрото)[14] или едноставно за зголемување на изразивањето преку оптимизација на кодонот.[15]
Прочистената ДНК потоа е третирана со рестрикционен ензим за да бидат создадени фрагменти со краеви способни да се поврзат со оние на векторот. Доколку е потребно, може да бидат додадени кратки двоверижни сегменти на ДНК (поврзувачи) кои ги содржат саканите места за ограничување за да се создадат крајни структури кои се соодветни со векторот.[3][12]
Создавање на рекомбинантна ДНК со ДНК-лигаза[уреди | уреди извор]
Создавањето на рекомбинантна ДНК на многу начини е наједноставниот чекор во постапката на молекуларно клонирање. ДНК подготвена од векторот и странскиот извор едноставно се мешани заедно во соодветни концентрации и се изложени на ензим (ДНК-лигаза) кој ковалентно ги поврзува краевите заедно. Оваа реакција на спојување често е нарекувана лигатура. Добиената смеса од ДНК која содржи случајно споени краеви потоа е подготвена за внесување во организмот домаќин.
ДНК-лигазата ги препознава и делува само на краевите на линеарните молекули на ДНК, што обично резултира со сложена мешавина на молекули на ДНК со случајно споени краеви. Ќе бидат присутни посакуваните производи (векторска ДНК ковалентно поврзана со туѓа ДНК), но обично се присутни и други низи (на пр. странска ДНК поврзана со себе, векторска ДНК поврзана со себе и комбинации од повисок ред на векторска и туѓа ДНК) исто така обично се присутни. Оваа сложена смеса е средувана во следните чекори од постапката на клонирање, откако смесата на ДНК ќе биде внесена во клетките.[3][12]
Воведување на рекомбинантна ДНК во организмот домаќин[уреди | уреди извор]
Смесата на ДНК, претходно манипулирана ин витро, е вратена назад во жива клетка, наречена организам домаќин. Методите што се користени за внесување на ДНК во клетките се различни, а името применето на овој чекор во постапката на молекуларно клонирање често зависи од избраниот опитен метод (на пр. преобразба, трансдукција, трансфекција, електропорација).[3][12]
Кога микроорганизмите се способни да ја преземат и реплицираат ДНК од нивната месна средина, постапката е нарекувана преобразба, а клетките кои се во физиолошка состојба така што можат да заземат ДНК е велено дека се способни .[16] Во клеточната култура на цицачите, аналогната постапка на внесување на ДНК во клетките обично е нарекувана трансфекција. И преобразбата и трансфекцијата обично бараат подготовка на клетките преку посебен режим на раст и постапка на хемиски третман кој ќе варира во зависност од специфичните видови и врсти клетки што се користени.
Електропорацијата користи електрични импулси со висок напон за транслокација на ДНК низ клеточната мембрана (и клеточниот ѕид, доколку е присутен).[17] Спротивно на тоа, трансдукцијата вклучува пакување на ДНК во честички добиени од вирусот и користење на овие честички слични на вирусот за внесување на инкапсулираната ДНК во клетката преку постапка што личи на вирусна инфекција. Иако електропорацијата и трансдукцијата се високо специјализирани методи, тие можеби се најефикасните методи за преместување на ДНК во клетките.
Избор на организми кои содржат векторски низи[уреди | уреди извор]
Без разлика кој метод е користен, воведувањето на рекомбинантна ДНК во избраниот организам домаќин обично е постапка со ниска ефикасност; односно само мал дел од клетките всушност ќе зафатат ДНК. Опитните научници се справуваат со ова прашање преку чекор на вештачко генетско одбирање, во која клетките кои не зафатиле ДНК, се одбрано убивани, а само оние клетки кои можат активно да реплицираат ДНК што го содржи избирачкиот ген за маркер кодиран од векторот се способни да преживеат.[3][12]
Кога бактериските клетки се користени како организми домаќини, маркерот што може да е избран е обично ген кој дава отпорност кон антибиотик кој инаку би ги убивал клетките, вообичаено ампицилин. Клетките во кои се наоѓа плазмидот ќе преживеат кога ќе бидат изложени на антибиотикот, додека оние кои не успеале да ги зафатат плазмидните низи, ќе умрат. Кога се користени клетки од цицачи (на пр. клетки од човек или глушец), е користена слична стратегија, освен што генот за маркер (во овој случај вообичаено кодиран како дел од касетата kanMX) дава отпорност на антибиотикот генетицин.
Преглед за клонови со сакани внесови на ДНК и биолошки својства[уреди | уреди извор]
Современите вектори за клонирање бактерии (на пр. pUC19 и подоцнежните деривати вклучувајќи ги и pGEM векторите) го користат сино-белиот прегледен систем за да ги разликуваат колониите (клоновите) на трансгенските клетки од оние што го содржат родителскиот вектор (т.е. векторска ДНК без вметната рекомбинантна низа). Во овие вектори, туѓа ДНК е вметната во низа која шифрира суштински дел од бета-галактозидаза, ензим чија активност резултира со создавање на сино обоена колонија на медиумот за култура што е користен за оваа работа. Вметнувањето на странската ДНК во низата за кодирање на бета-галактозидаза ја оневозможува функцијата на ензимот, така што колониите што содржат преобразена ДНК остануваат безбојни (бели). Затоа, испитувачите лесно можат да идентификуваат и да спроведат понатамошни студии за трансгенски бактериски клонови, притоа вклучувајќи ги оние што не содржат рекомбинантна ДНК.
Вкупното население на поединечни клонови добиени во опит за молекуларно клонирање често е нарекувана библиотека на ДНК. Библиотеките може да бидат многу сложени (како кога е клонирана целосна геномска ДНК од организам) или релативно едноставни (како кога е преместуван претходно клониран ДНК фрагмент во различен плазмид), но речиси секогаш е неопходно да бидат испитани голем број различни клонови за да биде уверено дека е добивана саканата структурирана ДНК. Ова може да биде постигнато преку многу широк опсег на опитни методи, вклучувајќи употреба на хибридизации на нуклеинска киселина, сонди за антитела, полимеразна верижна реакција, анализа на рестрикционен фрагмент и/или секвенционирање на ДНК.[3][12]
Примени[уреди | уреди извор]
Молекуларното клонирање им обезбедува на научниците суштински неограничено количество на поединечни сегменти на ДНК добиени од кој било геном. Овој материјал може да биде користен за широк спектар на цели, вклучувајќи ги и оние во основната и применетата биолошка наука. Неколку од поважните примени се сумирани овде.
Организација на геном и генско изразување[уреди | уреди извор]
Молекуларното клонирање довело директно до разјаснување на целосната низа на ДНК на геномите на многу голем број видови и до истражување на генетската разновидност во поединечните видови, работа која била направена главно со одредување на низата на ДНК на голем број случајни клонирани фрагменти од геномот и склопување на преклопувачките низи.
На ниво на поединечни гени, молекуларните клонови се користени за создавање сонди кои се користени за испитување на тоа како се изразувани гените и како тој израз е поврзан со други постапки во биологијата, вклучувајќи ја метаболичката средина, екстрацелуларните сигнали, развојот, учењето, стареењето и клеточна смрт. Клонираните гени, исто така, можат да обезбедат алатки за испитување на биолошката функција и важност на поединечни гени, дозволувајќи им на истражувачите да ги исклучуваат гените или да направат посуптилни мутации користејќи регионална мутагенеза или мутагенеза насочена кон место. Гените клонирани во изразувачки вектори за функционално клонирање обезбедуваат средство за проверка на гени врз основа на функцијата на изразената белковина.
Производство на рекомбинантни белковини[уреди | уреди извор]
Добивањето на молекуларниот клон на генот може да доведе до развој на организми кои произведуваат белковински производ од клонираните гени, наречена рекомбинантна белковина. Во пракса, често е потешко да биде развиен организам кој произведува активен облик на рекомбинантната белковина во пожелни количини отколку да биде клониран генот. Тоа е затоа што молекуларните сигнали за генско изразување се сложени и променливи, и затоа што преклопувањето на белковините, стабилноста и преносот може да бидат многу предизвикувачки.
Многу корисни белковини моментално се достапни како рекомбинантни производи. Тие се: (1) медицински корисни белковини чија користење може да поправи расипан или слабо изразен ген (на пр. рекомбинантен фактор VIII, фактор на згрутчување на крвта кој е во недостиг кај некои облици на хемофилија,[18] и рекомбинантен инсулин, кој е користен за лекување на некои облици на дијабетес[19]), (2) белковини кои може да бидат користени за да помогнат во итни случаи опасни по живот (на пр. ткивен плазминоген активатор, кој е користен за лекување на мозочни удари[20]), (3) вакцини за рекомбинантна подединица, во која прочистена белковина може да е користена за имунизација на пациентите против заразни болести, без нивно изложување на самиот инфективен агенс (на пр. вакцина против хепатитис Б[21]), и (4) рекомбинантни белковини како стандарден материјал за дијагностички лабораториски тестови.
Трансгенски организми[уреди | уреди извор]
Откако ќе се карактеризираат и манипулираат за да бидат обезбедени сигнали за соодветно изразување, клонираните гени може да бидат вметнати во организмите, создавајќи трансгенски организми, исто така наречени генетски изменети организми. Иако повеќето генетски изменети организми се создавани за целите на основното биолошко истражување (види на пример, трансгенски глушец), голем број генетски изменети организми се развиени за комерцијална употреба, почнувајќи од животни и растенија кои произведуваат фармацевтски производи или други соединенија (фармирање), растителна култура отпорна на хербициди и флуоресцентни тропски риби (GloFish) како миленичиња.[1]
Генска терапија[уреди | уреди извор]
Генската терапија вклучува снабдување со функционален ген на клетките на кои им недостасува таа функција, со цел да биде поправено генетско нарушување или стекната болест. Генската терапија може широко да биде поделена во две категории. Првата е промена на зародишните клетки, односно сперматозоидите или јајце-клетките, што резултира со трајна генетска промена за целиот организам и следните генерации. Оваа „генетска терапија од бактериска линија“ многумина ја сметаат за неетична кај луѓето.[22] Вториот вид генска терапија, „генетска терапија со соматски клетки“, е аналогна на пресадување органи. Во овој случај, едно или повеќе специфични ткива се насочени со директен третман или со отстранување на ткивото, додавање на терапевтскиот ген или гени во лабораторија и враќање на третираните клетки на пациентот. Клиничките испитувања на генетската терапија со соматски клетки започнале кон крајот на 1990-тите, главно за третман на рак и нарушувања на крвта, црниот дроб и белите дробови.[23]
И покрај големиот публицитет и ветувања, историјата на терапијата со човечки гени се одликува со релативно ограничен успех.[23] Ефектот на воведување ген во клетките често промовира само делумно и/или минливо ослободување од симптомите на болеста што е третирана. Некои пациенти кои се тестирани со генска терапија претрпеле негативни последици од самиот третман, вклучително и смртни случаи. Во некои случаи, негативните ефекти се резултат на нарушување на есенцијалните гени во геномот на пациентот со инсерцијално исклучување. Во други, вирусните вектори кои се користени за генска терапија се контаминирани со заразен вирус. Сепак, генската терапија сè уште е сметана за ветувачка идна област на медицината и е област каде што има значително ниво на истражувачка и развојна активност.
Наводи[уреди | уреди извор]
- ↑ 1,0 1,1 Watson JD (2007). Recombinant DNA: genes and genomes: a short course. San Francisco: W.H. Freeman. ISBN 978-0-7167-2866-5.
- ↑ Patten CL, Glick BR, Pasternak J (2009). Molecular Biotechnology: Principles and Applications of Recombinant DNA. Washington, D.C: ASM Press. ISBN 978-1-55581-498-4.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 Brown T (2006). Gene cloning and DNA analysis: an introduction. Cambridge, MA: Blackwell Pub. ISBN 978-1-4051-1121-8.
- ↑ Garrett RH, Grisham CM (2013). Biochemistry (5. изд.). Brooks/Cole, Cengage Learning. ISBN 978-1-133-10629-6. OCLC 777722371.
- ↑ Garrett RH, Grisham CM (2010). Biochemistry (4. изд.). Belmont, CA, Brooks/Cole: Cengage Learning. стр. 380. ISBN 978-0-495-10935-8. OCLC 297392560.
- ↑ „Restriction endonucleases in the analysis and restructuring of dna molecules“. Annual Review of Biochemistry. 44: 273–93. 1975. doi:10.1146/annurev.bi.44.070175.001421. PMID 166604.
- ↑ „Construction of biologically functional bacterial plasmids in vitro“. Proceedings of the National Academy of Sciences of the United States of America. 70 (11): 3240–4. ноември 1973. Bibcode:1973PNAS...70.3240C. doi:10.1073/pnas.70.11.3240. PMC 427208. PMID 4594039.
- ↑ „Biochemical method for inserting new genetic information into DNA of Simian Virus 40: circular SV40 DNA molecules containing lambda phage genes and the galactose operon of Escherichia coli“. Proceedings of the National Academy of Sciences of the United States of America. 69 (10): 2904–9. октомври 1972. Bibcode:1972PNAS...69.2904J. doi:10.1073/pnas.69.10.2904. PMC 389671. PMID 4342968.
- ↑ „plasmid / plasmids | Learn Science at Scitable“. www.nature.com (англиски). Посетено на 29 февруари 2024.
- ↑ „Cloning and stable maintenance of 300-kilobase-pair fragments of human DNA in Escherichia coli using an F-factor-based vector“. Proceedings of the National Academy of Sciences of the United States of America. 89 (18): 8794–7. септември 1992. Bibcode:1992PNAS...89.8794S. doi:10.1073/pnas.89.18.8794. PMC 50007. PMID 1528894.
- ↑ „Structure and function of type II restriction endonucleases“. Nucleic Acids Research. 29 (18): 3705–3727. септември 2001. doi:10.1093/nar/29.18.3705. PMC 55916. PMID 11557805.
- ↑ 12,0 12,1 12,2 12,3 12,4 12,5 Russell DW, Sambrook J (2001). Molecular cloning: a laboratory manual. Cold Spring Harbor, N.Y: Cold Spring Harbor Laboratory. ISBN 978-0-87969-576-7.
- ↑ „DNA sequences from the quagga, an extinct member of the horse family“. Nature. 312 (5991): 282–284. 1984. Bibcode:1984Natur.312..282H. doi:10.1038/312282a0. PMID 6504142.
- ↑ „Stable nuclear expression of ATP8 and ATP6 genes rescues a mtDNA Complex V null mutant“. Nucleic Acids Research. 44 (19): 9342–9357. ноември 2016. doi:10.1093/nar/gkw756. PMC 5100594. PMID 27596602.CS1-одржување: display-автори (link)
- ↑ „Synonymous but not the same: the causes and consequences of codon bias“. Nature Reviews. Genetics. 12 (1): 32–42. јануари 2011. doi:10.1038/nrg2899. PMC 3074964. PMID 21102527.
- ↑ „The transformation of genetics by DNA: an anniversary celebration of Avery, MacLeod and McCarty (1944)“. Genetics. 136 (2): 423–6. февруари 1994. doi:10.1093/genetics/136.2.423. PMC 1205797. PMID 8150273.
- ↑ „Transformation of various species of gram-negative bacteria belonging to 11 different genera by electroporation“. Molecular & General Genetics. 216 (1): 175–7. март 1989. doi:10.1007/BF00332248. PMID 2659971.
- ↑ „Haemophilia care then, now and in the future“. Haemophilia. 15 (Suppl 1): 2–7. јануари 2009. doi:10.1111/j.1365-2516.2008.01946.x. PMID 19125934.
- ↑ „Human insulin: DNA technology's first drug“. American Journal of Hospital Pharmacy. 46 (11 Suppl 2): S9-11. ноември 1989. PMID 2690608.
- ↑ „Treatment of acute ischemic stroke“. Annals of Emergency Medicine. 37 (2): 202–16. февруари 2001. doi:10.1067/mem.2001.111573. PMID 11174240.
- ↑ „Universal hepatitis B vaccination in Taiwan and the incidence of hepatocellular carcinoma in children. Taiwan Childhood Hepatoma Study Group“. The New England Journal of Medicine. 336 (26): 1855–9. јуни 1997. doi:10.1056/NEJM199706263362602. PMID 9197213.
- ↑ August JT (1997). Gene Therapy. 40. Academic Press. стр. 508. ISBN 978-0-08-058132-3.
- ↑ 23,0 23,1 „Gene therapy: promises and problems“. Annual Review of Genomics and Human Genetics. 2: 177–211. 2001. doi:10.1146/annurev.genom.2.1.177. PMID 11701648.
Дополнителна книжевност[уреди | уреди извор]
- Matsumura I (септември 2015). „Why Johnny can't clone: Common pitfalls and not so common solutions“. BioTechniques. 59 (3): IV–XIII. doi:10.2144/000114324. PMID 26345511. Архивирано од изворникот на 2015-09-16. Посетено на 29 февруари 2024.
Надворешни врски[уреди | уреди извор]
| Библиотечни извори за Молекуларно клонирање |
 Молекуларно клонирање на Ризницата ?
Молекуларно клонирање на Ризницата ?
|
