Калај
 лево: бела, бета, β; десно: сива, алфа, α | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Општи својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име и симбол | калај (Sn) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изглед | сребрено-бела (бета, β) или сива (алфа, α) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Алотропи | алфа, α (сива); бета, β (бела) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Калајот во периодниот систем | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски број | 50 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандардна атомска тежина (±) (Ar) | 118,710(7)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категорија | слаб метал | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Група и блок | група 14 (јаглеродна), p-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Периода | V периода | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електронска конфигурација | [Kr] 4d10 5s2 5p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
по обвивка | 2, 8, 18, 18, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физички својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза | цврста | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка на топење | 505,08 K (231,93 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка на вриење | 2.875 K (2.602 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Густина близу с.т. | бела, β: 7,365 г/см3 сива, α: 5,769 г/см3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| кога е течен, при т.т. | 6,99 г/см3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлина на топење | бела, β: 7,03 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлина на испарување | бела, β: 296,1 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Моларен топлински капацитет | бела, β: 27,112 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
парен притисок
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Оксидациони степени | 4, 3,[2] 2, 1,[3] −1, −2, −3, −4 (амфотерен оксид) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електронегативност | Полингова скала: 1,96 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Енергии на јонизација | I: 708,6 kJ/mol II: 1.411,8 kJ/mol II: 2.943,0 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски полупречник | емпириски: 140 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентен полупречник | 139±4 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ван дер Валсов полупречник | 217 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Разни податоци | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристална структура | четириаголна бел (β) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристална структура | дијамантска коцкеста сива (α) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Брзина на звукот тенка прачка | 2.730 м/с (при с.т.) (валован) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлинско ширење | 22 µм/(m·K) (при 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлинска спроводливост | 66,8 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електрична отпорност | 115 nΩ·m (при 0 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнетно подредување | gray: дијамагнетно[4] бела (β): парамагнетно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул на растегливост | 50 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул на смолкнување | 18 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул на збивливост | 58 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Поасонов сооднос | 0,36 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бринелова тврдост | 50–440 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-број | 7440-31-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Историја | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Откриен | Околу 3500 година п.н.е. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Најстабилни изотопи | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Режимите на распад во загради се предвидени, но сè уште не се забележани | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Калај — хемиски елемент со симболот Sn (од латински: stannum) и атомски број 50. Тоа е слаб метал во групата 14 од периодниот систем на елементи. Се добива главно од минералниот каситерит, кој содржи станичен оксид, SnO 2. Калајот покажува хемиска сличност со двата соседи во групата 14, германиум и олово, и има две главни оксидациски состојби, +2 и малку постабилна +4. Ова е 49-тиот најбитен елемент и има, со 10 стабилни изотопи, најголем број на стабилни изотопи во периодниот систем, благодарение на магичниот број на протони. Има две главни алтотропи: на собна температура, стабилната алотропа е β-калај, сребрено-бел, податлив метал, но при ниски температури се претвора во помалку густа сива α-калај, која има дијамантски кубни структура. Металните калај не лесно се оксидираат во воздухот.
Првиот калај легура употребен во голем обем беше бронзата, изработена од 1/8 калај и 7/8 бакар, уште од 3000 п.н.е. По 600 п.н.е., бил произведен чист метален калај. Калап, кој е легура од 85-90% калај, а остатокот најчесто се состои од бакар, сунѓер и олово, се користел за мебел од бронзеното доба до 20 век. Во модерните времиња, калајот се користи во многу легури, особено калај / олово мека војници, кои се обично 60% или повеќе калај и во производството на транспарентен, електрично спроведување филмови на Индиум калај оксид во оптоелектронски апликации. Друга голема апликација за калај е отпорна на корозија од калај од челик. Поради ниската токсичност на неоргански калај, лимот од челик за челик се користи за пакување на храна како лимени конзерви. Сепак, некои органонски соединенија можат да бидат речиси токсични како цијанид.
Особености[уреди | уреди извор]
Физички својства[уреди | уреди извор]

Калајот е мек, податлив , нодуларен и високо кристален сребрено-бел метал. Кога свиткана лента е свиткана, може да се слушне звук кој се нарекува "калај крик" од збратимувањето на кристалите.[5] Калапот се топи на ниски температури од околу 232 °C (450 °F), што е најниско во групата 14. Точката на топење е дополнително намалена на 177.3 °C (351.1 °F) за 11 nm честички.[6]
β-калај (метална форма или бел калај, BCT структура), која е стабилна на и над собна температура, е податлив. Спротивно на тоа, α-калај (неметалична форма или сив калај), која е стабилна под 13.2 °C (55.8 °F), е кршливо. α-калајот има дијамантски кубни кристални структури, слични на дијамант , силициум или германиум . α-калајот воопшто нема метални својства, бидејќи неговите атоми формираат ковалентна структура во која електроните не можат слободно да се движат. Тоа е досадно-сив прашкаст материјал кој не е вообичаен, освен неколку специјализирани полупроводнички апликации.[5] Овие два allotropes , α-калај и β-калај, се повеќе познати како сива калај и бел калај, соодветно. Постојат уште две алотропи, γ и σ на температури над 161 °C (322 °F) и притисоци над неколку GPa .[7] Во ладни услови, β-оловото има тенденција да се трансформира спонтано во α-лим, феномен познат како " калај штетник ".[8] Иако температурата на α-β трансформација е номинално 13.2 °C (55.8 °F), нечистотии (на пр Ал, Zn, итн) ја намалуваат температурата на транзиција многу под 0 °C (32 °F), а при додавање на антимон или бизмут , трансформацијата воопшто не може да се случи, зголемувајќи ја издржливоста на калај.[9]
Комерцијалните оценки од калај (99,8%) се спротивставуваат на трансформацијата поради инхибициониот ефект на малите количини на бизмут, антимон, олово и сребро присутни како нечистотии. Леживите елементи како што се бакар, антимон, бизмут, кадмиум и сребро ја зголемуваат својата цврстина. Калаевата тенденција прилично лесно да формираат тврди, кршливи интерметални фази, кои често се непожелни. Таа не формира широко опсег на цврсти раствори во други метали воопшто, а неколку елементи имаат значително цврста растворливост во калај. Меѓутоа, едноставни евтектички системи се јавуваат со бизмут, галиум, олово, талиум и цинк.[9]
Калајот станува суперпроводник под 3.72 K [10] и бил еден од првите суперспроводници кои треба да се изучуваат; ефектот на Меиснер , една од карактеристичните одлики на суперспроводниците, за првпат беше откриен во кристалите на супер-спроводливост на калај.[11]
Хемиски својства[уреди | уреди извор]
Калајот е отпорен на корозија од вода, но може да биде нападнат од киселини и алкали. Калајот може да биде високо полиран и се користи како заштитно покритие за други метали.[5] Заштитен оксид ( пасивација ) слој спречува натамошна оксидација, исто што се формира на калај и други калај легури.[12] Калајот делува како катализатор кога кислородот е во раствор и помага да се забрза хемиската реакција. [5]
Изотопи[уреди | уреди извор]
Калајот има десет стабилни изотопи , со атомски маси од 112, од 114 до 120, 122 и 124, најголем број од било кој елемент. Од нив најбројни се 120 Sn (речиси една третина од сите калај), 118 Sn и 116 Sn, додека најмалку изобилство е 115 Sn. Изотопите со бројни маси немаат јадрен спин , додека оние со непарен имаат спин од +1/2. Калајот, со неговите три заеднички изотопи 116 Sn, 118 Sn и 120 Sn, е меѓу најлесните елементи за откривање и анализа со NMR спектроскопија , а неговите хемиски поместувања се референцирани против SnMe4 </br> SnMe4 . [б 1][13]
Овој голем број на стабилни изотопи се смета дека се директен резултат на атомскиот број 50, " магичен број " во јадрената физика. Калајот, исто така, се јавува во 29 нестабилни изотопи, опфаќајќи ги сите останати атомски маси од 99 до 137. Покрај 126 Sn , со полуживот од 230.000 години, сите радиоизотопи имаат полуживот помал од една година. Радиоактивниот 100 Sn , откриен во 1994 година и <sup id="mwhw">132</sup> Sn, се еден од ретките нуклиди со " двојно магично " јадро: и покрај тоа што се нестабилни, со многу изолирани протон-неутронски односи, тие претставуваат крајни точки над кои стабилноста брзо се намалува.[14] Уште 30 метастабилни изомери се одликуваат за изотопи помеѓу 111 и 131, најстабилните се <sup id="mwiw">121m</sup> Sn со полуживот од 43,9 години.[15]
Релативните разлики во изобилството на стабилните изотопи на калапот може да се објаснат со нивните различни форми на формирање во ѕвездената нуклеосинтеза . 116 Sn преку 120 Sn вклучени се формираат во <i id="mwkQ">s-</i> процесите (бавно неутронско снимање) кај повеќето ѕвезди и оттаму тие се најчестите изотопи, додека 122 Sn и 124 Sn се формираат само во r- процесите (брзиот неутронски снимање) кај супернова и се поретки. (Изотопите 117 Sn до 120 Sn исто така добиваат придонеси од r -процесот. ) Конечно, најретки изотопи богати со протони, 112 Sn, 114 Sn и 115 Sn, не можат да се направат во значајни количини во s -или r- процесите и се сметаат за меѓу p-јадра , чие потекло сè уште не е добро разбрано . Некои шпекулирани механизми за нивно формирање вклучуваат зафаќање на протони, како и фотодизаинтеграција , иако 115 Sn, исто така, може да биде делумно произведена во s -процесот, и директно, и како ќерка на долготрајни <sup id="mwpg">115</sup> In .[16]
Потекло на поимот[уреди | уреди извор]
Зборот " калај" се споделува меѓу германските јазици и може да се проследи наназад до реконструираниот прагермански * калај-ом ; сродни вклучуваат германски Zinn , Шведски tenn и холандски tin . Не се наоѓа во други гранки на Индоевропски , освен со позајмување од германски (на пример, ирски tinne од англиски).[17][18]
Латинското име stannum првично значело легура на сребро и олово, а во 4 век станал "калај" [19] - претходниот латински збор за тоа бил plumbum candidum , или "бело олово". Stannum очигледно доаѓа од претходниот stāgnum (што значи иста супстанца),[17] потеклото на романтизмот и келтските термини за калај .[17][20] Потеклото на stannum / stāgnum е непознат; можно е да постои пред- индоевропските јазици.[21]
Meyers Konversations-Lexikon напротив, шпекулира дека stannum е изведен од (предците на) Корниски stean , и е доказ дека Корнвол во првите векови AD бил главен извор на калај.
Историја[уреди | уреди извор]

Извлекувањето и употребата на калајот може да датира од почетокот на бронзеното време околу 3000 п.н.е., кога беше забележано дека бакарни предмети формирани од полиметални руди со различни метални содржини имале различни физички својства.[22] Најраните бронзени предмети имале содржина на калај или арсен од помалку од 2% и поради тоа се верува дека се резултат на ненамерно легирање поради содржината на трага во бакарната руда.[23] Додавањето на вториот метал на бакар ја зголемува својата цврстина, ја намалува температурата на топење и го подобрува процесот на леење со производство на повеќе флуидно топе што се лади на погуста, помалку сунѓерест метал.[23] Ова беше важна иновација која овозможи многу посложени форми фрлени во затворени калапи од бронзеното време. Арсенските бронзени предмети најпрвин се појавуваат на Блискиот Исток, каде што најчесто се наоѓаат арсениците во врска со бакарната руда, но ризиците по здравјето брзо се реализираа и потрагата по извори на многу помалку опасни калајни руди почна во почетокот на бронзеното време.[24] Тоа создаде побарувачката за ретки калај метал и формира трговска мрежа која ги поврзува далечни извори на калај до пазарите на бронзеното време култури.
Каситерит (SnO 2 ), форма на калај оксид од калај, најверојатно бил оригиналниот извор на калај во антички времиња. Други форми на калај руди се помалку изобилуваат сулфиди, како што се стенит, кои бараат повеќе вклучени топење процес. Каситеритот често се акумулира во алувијални канали како депозити на пластери, бидејќи е потешко, потежок и хемиски отпорен од придружниот гранит .[25] Каситерит е обично црно или генерално темно во боја, и овие депозити лесно може да се видат во речните брегови .
Соединенија и хемија[уреди | уреди извор]
Во поголемиот дел од неговите соединенија, калајот има оксидациона состојба II или IV.
Неоргански соединенија[уреди | уреди извор]
Халидните соединенија се познати и за состојбата на оксидација. За Sn (IV), сите четири халиди се добро познати: SnF 4 , SnCl 4 , SnBr 4 и SnI 4 . Трите потешки членови се испарливи молекуларни соединенија, додека тетрафлуоридот е полимерен. Сите четири халиди се познати и за Sn (II): SnF 2 , SnCl 2 , SnBr 2 и SnI 2 . Сите се полимерни цврсти материи. Од овие осум соединенија, обоени се само јодидите.[26]
Калај (II) хлоридот (исто така познат како застарен хлорид) е најважниот калај-халид во комерцијална смисла. Илустрирајќи ги патиштата кон таквите соединенија, хлорот реагира со метални метали за да даде SnCl 4 додека реакцијата на хлороводородна киселина и калај произведува SnCl 2 и водороден гас. Алтернативно, SnCl 4 и Sn се комбинираат со каламус хлорид со процес наречен компропорцијација :[27]
- SnCl 4 + Sn → 2 SnCl 2
Калајот може да формира многу оксиди, сулфиди и други деривати на халкогенид. Диоксидот SnO 2 (каситерит) се формира кога калај се загрева во присуство на воздух .[26] SnO 2 е амфотерен , што значи дека се раствора и во кисели и во основни раствори.[28] Станати со структура [Sn (OH) 6 ] 2- , како K 2 [Sn (OH) 6 ], исто така се познати, иако слободната станична киселина H 2 [Sn (OH) 6 ] е непозната.
Сулфиди од калај постојат и во двете оксидациски состојби на +2 и 4: калај (II) сулфид и калај (IV) сулфид ( мозаично злато ).

Хидриди[уреди | уреди извор]
Станан (SnH 4 ), со калај во оксидациската состојба +4, е нестабилен. Органотински хидриди се сепак добро познати, на пример, трибутилин хидрид (Sn (C 4 H 9) 3 H).[5] Овие соединенија се ослободуваат од транзиентни трибутилни лимени радикали, кои се ретки примери на соединенија од калај (III).[30]
Органотински соединенија[уреди | уреди извор]
Органотинските соединенија, понекогаш наречени станбени, се хемиски соединенија со калај-јаглеродни врски.[31] Од соединенијата од калај, органските деривати се најкорисните комерцијално.[32] Некои органски соединенија се високо токсични и се користат како биоциди . Првиот органотински соединение што треба да се Пријавени беше diethyltin дијодид ((C 2 H 5) 2 SNI 2), пријавена од страна на Едвард Франкланд во 1849.[33]
Повеќето органотински соединенија се безбојни течности или цврсти материи кои се стабилни за воздух и вода. Тие ја усвојуваат тетрахедралната геометрија. Тетраалкил- и тетраарилинските соединенија може да се подготват со помош на реагенси Григна:[32]
- SnCl + 4 RMgBr → R4Sn + 4 MgBrCl
Мешаните халид-алкили, кои се почести и поважни комерцијално од дериватите на тетраоргано, се подготвуваат со редистрибутивни реакции :
- SnCl4 + R4Sn → 2 SnCl2R2
Дивалентните органотински соединенија се невообичаени, иако се почести отколку сродни двовалентни органорманиум и органосилициски соединенија. Поголемото стабилизирање кое го ужива Sn (II) се припишува на " ефектот на инертен пар ". Органотински (II) соединенија вклучуваат двете stannylenes (со формулата: R2 Sn, како што се гледа за молекуларниот карбен ) и distannylenes (R4 Sn 2), кои се приближно еднаков на алкени . И двете класи покажуваат невообичаени реакции.[34]
Појава[уреди | уреди извор]


Калајот се создава преку долгиот s-процес во ѕвезди со ниска до средна маса (со маси од 0,6 до 10 пати поголеми од оној на Сонцето), и конечно со бета распаѓање на тешки изотопи на индиум.[35] Калајот е 49-тиот најбитен елемент во Земјината кора, што претставува 2 ppm во споредба со 75 ppm за цинк, 50 ppm за бакар и 14 ppm за олово.[36] Калајот не се јавува како мајчин елемент, туку треба да се извади од разни руди. Каситерит (SnO2) е единствениот комерцијално важен извор на калај, иако мали количества калај се обновуваат од комплексните сулфиди како што се сталани, цилиндрити, франккејти, канифилит и теалите. Минералите со калај речиси секогаш се поврзани со гранитната карпа, обично на ниво од 1% содржина на олово-оксид.[37] Поради повисоката специфична тежина на калај диоксид, околу 80% од рударскиот калај е од секундарни депозити пронајдени низводно од основните лози. Калај често се обновува од гранули што се мијат низводно во минатото и се депонираат во долините или морето. Најекономичните начини на рударството се од корито, хидраулика или отворени јами. Најголемиот дел од калајот во светот се произведува од депозити на пластери, кои можат да содржат само 0,015% калај.[38] Во 2011 година се ископани 253.000 тони калај, главно во Кина (110.000 т), Индонезија (51.000 т), Перу (34.600 т), Боливија (20.700 т) и Бразил (12.000 т).[39] Проценките за производство на калај историски варира со динамиката на економската изводливост и развојот на рударските технологии, но се проценува дека, според моменталните стапки на потрошувачка и технологии, Земјата ќе истече од минливи извори за 40 години.[40] Лестер Браун предложил дека конзервата може да истече во рок од 20 години врз основа на екстремно конзервативна екстраполација на раст од 2% годишно.[41] Секундарно, или отпадоци, калај е исто така важен извор на метал. Обновувањето на калај преку секундарно производство, или рециклирање на отпадоци, брзо се зголемува. Со оглед на тоа што Соединетите Американски Држави ниту го ископуваа од 1993 година, ниту пак го топат калајот од 1989 година,сепак тие беа најголемиот секундарен производител преку рециклирање скоро 14.000 тони во 2006 година. Нови депозити се пријавени во јужна Монголија [42], а во 2009 година, нови количини на калај во Колумбија се откриени од страна на Семиноле Група Колумбија КИ, САС.[43]
Продукција[уреди | уреди извор]
Калај се произведува со карботермично намалување на оксидната руда со јаглерод или кокаин. Може да се користи реверберациона печка и електрична печка..[44][45][46]
Ископување и топење[уреди | уреди извор]

Главна статија: Калај рударство
Индустрија[уреди | уреди извор]
Десетте најголеми компании произведоа најголем дел од калајот во светот во 2007 година.
Најголемиот дел од светскиот калај се тргува на Лондонската металска берза (LME), од 8 земји, под 17 брендови.[47]
Во 1947 година беше формиран Меѓународен совет за калај за контрола на цената на калај, сè додека не се распадна во 1985 година. Во 1984 година беше формирана Асоцијација на производители на калај, со Австралија, Боливија, Индонезија, Малезија, Нигерија, Тајланд и Заир како членови.[48]
Цени и размена[уреди | уреди извор]
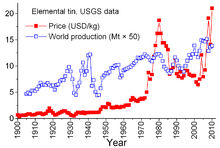
Калајот е посебен меѓу другите минерални производи поради сложените договори помеѓу земјите-производители и потрошувачки земји кои датираат од 1921 година. Претходните договори имале тенденција да бидат малку неформални и спорадични и доведоа до "Прв меѓународен договор за калај" во 1956 година, прв од постојано нумерирани серии кои ефикасно се распаднаа во 1985 година. Преку оваа серија договори, Меѓународниот совет за калај (ИТЦ) имаше значително влијание врз цените на калај. ИТЦ ја поддржа цената на калај за време на периоди на ниски цени со купување калај за своја тампон и можеше да ја ограничи цената во периоди на високи цени со продажба на калај од резервите. Ова беше пристап против слободниот пазар, дизајниран да обезбеди доволен проток на калај во земјите-кориснички и профит за земјите-производители. Сепак, тампон резервите не беа доволно големи, а за време на повеќето од овие 29 години цените на казанот се зголемија, понекогаш остро, особено од 1973 до 1980 година, кога неконтролираната инфлација ја погоди многу светски економии.[49]
Во текот на доцните 1970-ти и раните 1980-ти, американската резерва на калај беше во агресивен продажна форма, делумно за да ги искористи историски високите цени на калај. Острата рецесија од 1981-82 година се покажа доста груба во индустријата за производи од калај. Потрошувачката на калај драматично се намали. ИТЦ беше во можност да избегне вистински стрмни намалувања преку забрзано купување за складирање на тампон; оваа активност бара од ИТЦ широко да се позајми од банки и фирми за трговија со метали за да ги зголеми своите ресурси. ИТЦ продолжи да позајмува до крајот на 1985 година, кога го достигна својот кредитен лимит. Веднаш, следеше главната "крива на калај" - беше отсечена од трговијата на Лондонската берза на метали за околу три години, ИТЦ распуштен наскоро потоа, а цената на калај, сега во слободна пазарна средина, драстично падна на 4 долари за фунта и остана на тоа ниво во текот на 1990-тите.[49] Цената повторно се зголеми до 2010 година со пораст на потрошувачката по светската економска криза во 2008-09 година, придружувајќи го обновувањето и континуираниот раст на потрошувачката од светските економии во развој.[50]
Лондонската размена на метали (LME) е главната трговска локација за калај.[50] Други пазари за контејнери се Културниот лимберски пазар (KLTM) и Индонезиската калајска размена (ИНАТИН).[51]
| 2008 | 2009 | 2010 | 2011 | 2012 | |
|---|---|---|---|---|---|
| цена | 18.51 | 13.57 | 20.41 | 26.05 | 21.13 |
Употреба[уреди | уреди извор]
Во 2006 година, околу половина од сите произведени калај биле користени во лемење. Остатокот беше поделен помеѓу калај, калај хемикалии, месинг и бронзени легури, како и употреба на ниши [52]
Лемење[уреди | уреди извор]

Калај долго време се користи во легури со олово како лемење, во количини од 5 до 70% w / w. Калај со олово формира евтектичка мешавина со тежина од 61,9% калај и 38,1% олово (атомски процент: 73,9% калај и 26,1% олово), со температура на топење од 183 °C (361,4 °F). Таквите војници првенствено се користат за приклучување на цевки или електрични конзола. Бидејќи Директивата на ЕУ за Директивата за отпадна електрична и електронска опрема (директивата за ОЕЕО) и Директивата за ограничување на опасните супстанции стапи на сила на 1 јули 2006 година, содржината на олово во таквите легури е намалена. Заменувањето на оловото има многу проблеми, вклучително и повисока точка на топење, и формирање на калапи што предизвикуваат електрични проблеми. Калај-штетници може да се појават во безоловни приклучоци, што доведува до губење на лемениот зглоб. Задолжителни легури брзо се наоѓаат, иако остануваат проблеми со заедничкиот интегритет.[53]
засејување со калај[уреди | уреди извор]
Калајните врски лесно се ставаат на железо и се користат за обложување на олово, цинк и челик за да се спречи корозија. Конзерви од челик се користат за зачувување на храната, и тоа претставува голем дел од пазарот за метален калај. Во 1812 година во Лондон бил произведен канистер за конзервирање за зачувување на храната.[54] Звучниците на британскиот англиски ги нарекуваат "калај", додека звучниците на американскиот англиски ги нарекуваат "конзерви" или "лимени конзерви". Една изработка на таквата употреба е терминот за сленг "tinnie" или "tinny", што значи "лименка да пиво" во Австралија. Калај свирче е наречено затоа што било прво масовно произведено во челичен лим.[55][56] Бакарни садови за готвење, како што се сопењи и тави за тави, честопати се наредени со тенок слој од калај, бидејќи комбинацијата на киселински храни со бакар може да биде токсична.
Специјални легури[уреди | уреди извор]

Калај во комбинација со други елементи формира широк спектар на корисни легури. Калајот најчесто се легира со бакар. Калапот е 85-99% калај,[57] имајќи метал има висок процент на калај, како и [58][59] Бронзата е претежно бакар (12% калај), додека додавањето фосфор дава фосфорна бронза. Бел метал исто така е легура на бакар-калај, која содржи 22% калај. Калај понекогаш се користи во монета; на пример, таа еднаш формираше едноцифрен процент (обично пет проценти или помалку) од американски [60] и канадски [61] пени. Бидејќи бакар често е главен метал во такви монети, понекогаш вклучувајќи цинк, тие може да се наречат бронзени и / или месинг легури. Ниобиум-телин соединението Nb3Sn е комерцијално користено во калеми на суперспроводливи магнети за неговата висока критична температура (18 К) и критично магнетно поле (25 Т). Суперспроводен магнет со тежина од само два килограми е способен за магнетно поле на конвенционален електромагнет со тежина од тежина.[62]
Мал процент калај се додава во легури на циркони за обложување на јадрено гориво.[63]

Повеќето метални цевки во орган за цевки се од легура / оловна легура, при што 50/50 е најчестата композиција. Пропорцијата на калај во цевката го дефинира тонот на цевката, бидејќи калај има посакувана тонска резонанца. Кога се лади легура / олово, оловото се лади малку побрзо и произведува впечаток или забележан ефект. Оваа метална легура се нарекува забележан метал. Главните предности на користењето на калај за цевки го вклучуваат неговиот изглед, неговата обработливост и отпорност на корозија.[64][65]
Оптоелектроники[уреди | уреди извор]
Оксидите од индиум и калај се електрично проводни и транспарентни и се користат за да се направат транспарентни електрични проводни филмови со апликации во уредите за оптоелектроника како што се дисплеи со течни кристали. [71]
Други употреби[уреди | уреди извор]

Пробиен лимен челик, исто така наречен прободен калај, е занаетчиска техника со потекло од Средна Европа за создавање на housewares кои се функционални и декоративни. Декоративни пирсинг дизајни постојат во широк спектар, врз основа на локалната традиција и личните творби на занаетчијата. Пенчлените лимени ламинати се најчеста примена на оваа занаетчиска техника. Светлината на свеќа која сјае низ прободениот дизајн создава декоративна светлина во просторијата каде што седи. Фенери и други удирани статии од стакло беа создадени во Новиот Свет од најраната европска населба. Добро познат пример е фреската Revere, именувана по Пол Ревере.[66]
Пред модерната ера, во некои области на Алпите, коза од овци или овци би била заострена, а со помош на азбуката би можеле да се напише и метална плоча, а бројот од еден до девет. Оваа алатка за учење беше соодветно позната како "рог". Модерните репродукции се украсени со такви мотиви како срца и лалиња.
Во Америкасефови за храна беа во употреба во деновите пред ладење. Тоа беа дрвени шкафове со разни стилови и големини - или подни или висечки шкафове за да се обесхрабри штетниците и инсектите и да се чува прашина од лесно расипливи прехранбени производи. Овие кабинети имале влошки на лименки во вратите, а понекогаш и на страните, пробиени од сопственикот на куќи, градежник или лимар во различни дизајни за да овозможи циркулација на воздухот, со исклучок на мувите. Модерните репродукции на овие написи остануваат популарни во Северна Америка.[67][68]

Стакленото стакло најчесто се произведува од лебдеше стопено стакло на лиена калај (пливачко стакло), што резултира со рамна и беспрекорна површина. Ова е исто така наречено "Pilkington процес".[69]
Калај се користи како негативна електрода во напредните Li-ion батерии. Неговата примена е донекаде ограничена со фактот што некои лимени површини [кои?] Катализираат распаѓање на електролитите засновани на карбонат што се користат во Li-јонските батерии.[70]
Калај(II) флуорид е додаден во некои стоматолошки производи за нега [71] како флаворен флорид (SnF2). Калај(II) флуорид може да се меша со калциумови абразиви, додека почестото натриум флуорид постепено станува биолошки неактивен во присуство на калциумови соединенија [72] Исто така, се покажало дека е поефикасно од натриум флуорид во контролирањето на гингивитис .[73]
Органски соединенија[уреди | уреди извор]
Главен извор:Органска хемија
ПБЦ Стабилизатори[уреди | уреди извор]
Главната комерцијална примена на органотични соединенија е во стабилизацијата на ПВЦ пластика. Во отсуство на такви стабилизатори, ПВЦ инаку брзо би се деградирал под топлина, светлина и атмосферски кислород, што резултирало со обезцветен, кршлив производ. Калај зачинува лабилни хлоридидни јони (Cl-), што инаку би иницирало губење на HCl од пластичниот материјал.[74] Типични соединенија од лимени производи се деривати на карбуксилна киселина од дибутилтин дихлорид, како што е дилаурата.[75]
Биоциди[уреди | уреди извор]
Некои органски соединенија се релативно токсични, со предности и проблеми. Тие се користат за биоцидни својства како фунгициди, пестициди, алгициди, заштитни средства за дрво и средства за спречување на задушување .[74] Tributyltin oxide се користи како конзерванс за дрво.[76] Tributyltin беше користен како адитив за бродовите за спречување на растот на морските организми на бродови, со употреба на опаѓање откако органотинските соединенија беа препознаени како перзистентни органски загадувачи со исклучително висока токсичност за некои морски организми (на пример, кучето, на пример).[77] ЕУ ја забрани употребата на органотин соединенија во 2003 година,[78] додека загриженоста околу токсичноста на овие соединенија во морскиот живот и оштетувањето на репродукцијата и растот на некои морски видови [74] (некои извештаи опишуваат биолошки ефекти на морски животни во концентрација од 1 нанограм за литар) доведоа до светска забрана од страна на Меѓународната поморска организација.[79] Многу нации сега ја ограничуваат употребата на органотински соединенија на бродови долги повеќе од 25 метри (82 стапки).[74]
Органска хемија[уреди | уреди извор]
Некои метални реагенси се корисни во органската хемија. Во најголема апликација, застарен хлорид е чест редуцирачки агенс за претворање на нитро и оксим групи во амини. Реакцијата на Стил ги спојува органотинските соединенија со органски халиди или псевдохалиди.[80]
Литиумскојонски батерии[уреди | уреди извор]
Калај формира неколку меѓуметални фази со литиумски метал, што го прави потенцијално привлечен материјал за батерија апликации. Големи зафатнински експанзија на калај по легирање со литиум и нестабилност на рабната површина на калајооргански електролит при ниски електрохемиски потенцијали се најголемите предизвици за вработување во комерцијалните ќелии. Проблемот беше делумно решен од Sony. Калајниот меѓуметал соединението со кобалт и јаглерод е имплементирано од страна на Sony во своите Nexelion клетки објавени кон крајот на 2000-тите. Составот на активниот материјал е приближно Sn0.3Co0.4C0 март Неодамнешните истражувања покажаа дека само некои кристални аспекти на четириаголни (бета) Sn се одговорни за несакана електрохемиска активност.[81]
Мерки за претпазливост[уреди | уреди извор]
Случаите на труење од метални метали, неговите оксиди и неговите соли се речиси непознати. Од друга страна, одредени органо-соединенија се речиси токсични како цијанид.[32]
Изложеноста на калај на работното место може да се појави со вдишување, контакт со кожата и контакт со очите. Управата за безбедност и здравје при работа (OSHA) го постави законскиот лимит (дозволена граница на изложеност) за изложеност на калај на работното место како 2 mg / m3 во текот на 8-часовен работен ден. Националниот институт за безбедност и здравје при работа (NIOSH) утврди препорачана граница на изложеност (REL) од 2 mg / m3 во текот на 8-часовен работен ден. На ниво од 100 мг / м3, калај веднаш е опасен за животот и здравјето.[82]
Белешки[уреди | уреди извор]
- ↑ Само H, F, P, Tl и Xe имаат повисока приемчивост за NMR анализа за примероци кои содржат изотопи при нивното природно изобилство.
Наводи[уреди | уреди извор]
- ↑ Standard Atomic Weights 2013. Commission on Isotopic Abundances and Atomic Weights
- ↑ „SnH3“. NIST Chemistry WebBook. National Institure of Standards and Technology. Посетено на 23 January 2013.
- ↑ „HSn“. NIST Chemistry WebBook. National Institute of Standards and Technology. Посетено на 23 January 2013.
- ↑ Lide, D. R., уред. (2005). „Magnetic susceptibility of the elements and inorganic compounds“. CRC Handbook of Chemistry and Physics (PDF) (86th. изд.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ 5,0 5,1 5,2 5,3 5,4 Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). Lehrbuch der Anorganischen Chemie. Tin (германски) (91–100. изд.). Walter de Gruyter. стр. 793–800. ISBN 978-3-11-007511-3.
- ↑ Ink with tin nanoparticles could print future circuit boards [{{{1}}} Архивирано] на {{{2}}}., Physorg, April 12, 2011; Jo, Yun Hwan; Jung, Inyu; Choi, Chung Seok; Kim, Inyoung; Lee, Hyuck Mo (2011). „Synthesis and characterization of low temperature Sn nanoparticles for the fabrication of highly conductive ink“. Nanotechnology. 22 (22): 225701. Bibcode:2011Nanot..22v5701J. doi:10.1088/0957-4484/22/22/225701. PMID 21454937.
- ↑ Molodets, A. M.; Nabatov, S. S. (2000). „Thermodynamic Potentials, Diagram of State, and Phase Transitions of Tin on Shock Compression“. High Temperature. 38 (5): 715–721. doi:10.1007/BF02755923.
- ↑ This conversion is known as tin disease or tin pest. Tin pest was a particular problem in northern Europe in the 18th century as organ pipes made of tin alloy would sometimes be affected during long cold winters. There are anecdotal claims that tin pest destroyed some of Captain Scott's stores in the ill-fated expedition (see tin pest). Some unverifiable sources also say that, during Napoleon's Russian campaign of 1812, the temperatures became so cold that the tin buttons on the soldiers' uniforms disintegrated over time, contributing to the defeat of the Grande Armée.Le Coureur, Penny; Burreson, Jay (2004). Napoleon's Buttons: 17 Molecules that Changed History. New York: Penguin Group USA., a persistent legend that probably has no background in real events. Öhrström, Lars (2013). The Last Alchemist in Paris. Oxford: Oxford University Press. ISBN 978-0-19-966109-1. Cotton, Simon (2014). „Book review: The last alchemist in Paris“. Chemistry World.http://rsc.li/CW_140501 Архивирано на 10 август 2014 г.
- ↑ 9,0 9,1 Schwartz, Mel (2002). Encyclopedia of Materials, Parts and Finishes. Tin and Alloys, Properties (2. изд.). CRC Press. ISBN 978-1-56676-661-6.
- ↑ Dehaas, W.; Deboer, J.; Vandenberg, G. (1935). „The electrical resistance of cadmium, thallium and tin at low temperatures“. Physica. 2 (1–12): 453. Bibcode:февруари .453D 1935Phy.... февруари .453D Проверете го
|bibcode=length (help). doi:10.1016/S0031-8914(35)90114-8. - ↑ Meissner, W.; R. Ochsenfeld (1933). „Ein neuer effekt bei eintritt der Supraleitfähigkeit“. Naturwissenschaften. 21 (44): 787–788. Bibcode:1933NW.....21..787M. doi:10.1007/BF01504252.
- ↑ Craig, Bruce D.; Anderson, David S.; International, A. S. M. (January 1995). Handbook of corrosion data. стр. 126. ISBN 978-0-87170-518-1. Архивирано од изворникот на 2016-05-11.
- ↑ „Interactive NMR Frequency Map“. Архивирано од изворникот на 2011-06-04. Посетено на 2009-05-05.
- ↑ Walker, Phil (1994). „Doubly Magic Discovery of Tin-100“. Physics World. 7 (June). Архивирано од изворникот на 2008-04-30.
- ↑ Audi, Georges; Bersillon, O.; Blachot, J.; Wapstra, A. H. (2003). „The NUBASE Evaluation of Nuclear and Decay Properties“. Nuclear Physics A. 729 (1): 3–128. Bibcode:2003NuPhA.729....3A. CiteSeerX 10 јануари 1.692.8504 Проверете ја вредноста
|citeseerx=(help). doi:10.1016/j.nuclphysa.203 ноември 001 Проверете ја вредноста|doi=(help). Архивирано од изворникот на 2017-01-03. - ↑ Cameron, A. G. W. (1973). „Abundance of the Elements in the Solar System“ (PDF). Space Science Reviews. 15 (1): 121–146. Bibcode:1973SSRv...15..121C. doi:10.1007/BF00172440. Архивирано од изворникот (PDF) на 2011-10-21.
- ↑ 17,0 17,1 17,2 „tin“, Oxford English Dictionary (3rd. изд.), Oxford University Press, September 2005 Invalid
|mode=CS1(help) (бара Претплата или членство во британска јавна библиотека .) - ↑ Harper, Douglas. „tin“. Online Etymology Dictionary.
- ↑ Encyclopædia Britannica, 11-то издание, 1911, sv " калај ", повикувајќи се на Х. Kopp
- ↑ „The Ancient Mining of Tin“. oxleigh.freeserve.co.uk. Архивирано од изворникот на 2009-04-03. Посетено на 2009-07-07.
- ↑ Американски наследство речник
- ↑ Cierny, J.; Weisgerber, G. (2003). Giumlia-Mair, A.; Lo Schiavo, F. (уред.). The Problem of Early Tin. The "Bronze Age tin mines in Central Asia. Oxford: Archaeopress. стр. 23–31. ISBN 978-1-84171-564-3.
- ↑ 23,0 23,1 Penhallurick, R. D. (1986). Tin in Antiquity: its Mining and Trade Throughout the Ancient World with Particular Reference to Cornwall. London: The Institute of Metals. ISBN 978-0-904357-81-3.
- ↑ Charles, J. A. (1979). Franklin, A. D.; Olin, J. S.; Wertime, T. A. (уред.). The Search for Ancient Tin. The development of the usage of tin and tin-bronze: some problems. Washington D.C.: A seminar organized by Theodore A. Wertime and held at the Smithsonian Institution and the National Bureau of Standards, Washington D.C. March 14–15, 1977. стр. 25–32.
- ↑ Penhallurick 1986
- ↑ 26,0 26,1 Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (уред.), Inorganic Chemistry, Преведено од Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, ISBN 0-12-352651-5
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. изд.). Butterworth-Heinemann. ISBN 0080379419.
- ↑ Неорганска и теоретска хемија , Ф. Шервуд Тејлор, Хајнеман, 6-ти издание (1942)
- ↑ J. M. Leger; J. Haines; A. Atouf (1996). „The high pressure behaviour of the cotunnite and post-cotunnite phases of PbCl2 and SnCl2“. J. Phys. Chem. Solids. 57 (1): 7–16. Bibcode:1996JPCS...57....7L. doi:10.1016/0022-3697(95)00060-7.
- ↑ Gaur, D. P.; Srivastava, G.; Mehrotra, R. C. (1973). „Organic Derivatives of Tin. III. Reactions of Trialkyltin Ethoxide with Alkanolamines“. Zeitschrift für Anorganische und Allgemeine Chemie. 398: 72. doi:10.1002/zaac.19733980109.
- ↑ Elschenbroich, C. "Organometallics" (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ↑ 32,0 32,1 32,2 Graf, G. G. (2000) "Tin, Tin Alloys, and Tin Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH, Weinheim doi:10.1002/14356007.a27_049
- ↑ Sander H.L. Thoonen; Berth-Jan Deelman; Gerard van Koten (2004). „Synthetic aspects of tetraorganotins and organotin(IV) halides“ (PDF). Journal of Organometallic Chemistry (689): 2145–2157. Архивирано од изворникот (PDF) на 2011-08-07. Посетено на 2009-07-31.
- ↑ Peng, Yang; Ellis, Bobby D.; Wang, Xinping; Fettinger, James C.; Power, P. P. (2009). „Reversible Reactions of Ethylene with Distannynes Under Ambient Conditions“. Science. 325 (5948): 1668–1670. Bibcode:2009Sci...325.1668P. doi:10.1126/science.1176443. PMID 19779193.
- ↑ Thoonen, Sander H.L; Deelman, Berth-Jan; Koten, Gerard van (2004-07). март 027 „Synthetic aspects of tetraorganotins and organotin(IV) halides“ Проверете ја вредноста
|url=(help). Journal of Organometallic Chemistry. 689 (13): 2145–2157. doi:10.1016/j.jorganchem.204 март 027 Проверете ја вредноста|doi=(help). ISSN 0022-328X. Проверете ги датумските вредности во:|date=(help) - ↑ Shu, Frank H. (1982). The physical universe : an introduction to astronomy. Mill Valley, Calif.: University Science Books. ISBN 0935702059. OCLC 8805302.
- ↑ „Cumulative author index to volumes 501–503“. Physics Letters B. 503 (3–4): 433–449. 2001-03. doi:10.1016/s0370-2693(01)00301-x. ISSN 0370-2693. Проверете ги датумските вредности во:
|date=(help) - ↑ Tin and tin alloys. Ingot tin, BSI British Standards, Посетено на 2019-05-14
- ↑ „The United States Geological Survey“. General Information Product. 1978. doi:10.3133/70039404.
- ↑ Reilly, Michael (2007-06). „The last place on earth to preserve a piece of Earth's original crust“. New Scientist. 194 (2608): 38. doi:10.1016/s0262-4079(07)61508-5. ISSN 0262-4079. Проверете ги датумските вредности во:
|date=(help) - ↑ MYERS, NORMAN (2006-03). „Plan B 2.0: Rescuing a Planet Under Stress and a Civilization in TroubleBY LESTER R. BROWN 365 pp., 23 × 15 × 2 cm, ISBN 0 393 32831 7 paperback, GB£ 10.99, New York, USA/London, UK: WW Norton & Co. Ltd, 2006“. Environmental Conservation. 33 (1): 84–85. doi:10.1017/s0376892906273119. ISSN 0376-8929. Проверете ги датумските вредности во:
|date=(help) - ↑ Kovalenko, V. I.; Yarmolyuk, V. V. (1995-05-01). март 520 „Endogenous rare metal ore formations and rare metal metallogeny of Mongolia“ Проверете ја вредноста
|url=(help). Economic Geology. 90 (3): 520–529. doi:10.2113/gsecongeo.90 март 520 Проверете ја вредноста|doi=(help). ISSN 1554-0774. - ↑ Dictionary Geotechnical Engineering/Wörterbuch GeoTechnik. Berlin, Heidelberg: Springer Berlin Heidelberg. 2014. стр. 676–676. ISBN 9783642417139.
- ↑ Schrader, George F.; Elshennawy, Ahmad K.; Doyle, Lawrence E. (July 2000). Manufacturing processes and materials. ISBN 978-0-87263-517-3. Архивирано од изворникот на 2016-05-11.
- ↑ Louis, Henry (1911). Metallurgy of tin. McGraw-Hill book Company. Архивирано од изворникот на 2016-05-31.
- ↑ Knorr, Klaus (1945). Tin Under Control. Stanford University Press. ISBN 978-0-8047-2136-3. Архивирано од изворникот на 2016-05-19.
- ↑ „International Tin Research Institute. LME Tin Brands“. ITRI. Архивирано од изворникот на 2008-12-07. Посетено на 2009-05-05.
- ↑ “Agreement establishing the Association of Tin Producing Countries ATS 10 of 1984". Australasian Legal Information Institute, Australian Treaties Library. Посетено на 14 June 2017.
- ↑ 49,0 49,1 Carlin, James F., Jr. (1998). Significant events affecting tin prices since 1958 Архивирано на 28 октомври 2011 г.. USGS.
- ↑ 50,0 50,1 Грешка во наводот: Погрешна ознака
<ref>; нема зададено текст за наводите по имеUSGS200YB. - ↑ „12 Januari Pemasaran Perdana INATIN“. December 15, 2011. Архивирано од изворникот на April 26, 2012.
- ↑ „Tin Use Survey 2007“. ITRI. Архивирано од изворникот на 2008-12-07. Посетено на 2008-11-21.
- ↑ Black, Harvey (2005). „Getting the Lead Out of Electronics“. Environmental Health Perspectives. 113 (10): A682–5. doi:10.1289/ehp.113-a682. PMC 1281311. PMID 16203230.
- ↑ Childs, Peter (July 1995). „The tin-man's tale“. Education in Chemistry. том 32 no. 4. Royal Society of Chemistry. стр. 92. Посетено на 19 June 2018.
- ↑ Control, Tin Under (1945). Tin Under Control. стр. 10–15. ISBN 978-0-8047-2136-3. Архивирано од изворникот на 2016-05-31.
- ↑ Panel On Tin, National Research Council (U.S.). Committee on Technical Aspects of Critical and Strategic Materials (1970). Trends in the use of tin. стр. 10–22. Архивирано од изворникот на 2016-05-22.
- ↑ Hull, Charles (1992). Pewter. Osprey Publishing. стр. 1–5. ISBN 978-0-7478-0152-8.
- ↑ Brakes, James (2009). https://books.google.com/?id=hZ3zGS6by9UC&printsec=frontcover На
|chapter-url=му недостасува наслов (help). Analysis of Babbit. Introduction. BiblioBazaar, LLC. стр. 1–2. ISBN 978-1-110-11092-6. - ↑ Williams, Robert S. (2007). Principles of Metallography. Read books. стр. 46–47. ISBN 978-1-4067-4671-6.
- ↑ „The Composition of the Cent“. US Mint. Архивирано од изворникот на 2011-10-25. Посетено на 2011-10-28.
- ↑ „Composition of canadian coins“ (PDF). Canadian Mint. Архивирано од изворникот (PDF) на 2012-01-13. Посетено на 2011-10-28.
- ↑ Geballe, Theodore H. (October 1993). „Superconductivity: From Physics to Technology“. Physics Today. 46 (10): 52–56. Bibcode:1993PhT....46j..52G. doi:10.1063/1.881384.
- ↑ Campbell, Flake C. (2008). https://web.archive.org/web/20160528212426/https://books.google.com/books?id=6VdROgeQ5M8C&pg=PA597 На
|archiveurl=му недостасува наслов (help). Elements of Metallurgy and Engineering Alloys. Zirconium. стр. 597. ISBN 978-0-87170-867-0. Архивирано од изворникот на 2016-05-28. - ↑ Robert Palmieri, уред. (2006). https://books.google.com/?id=cgDJaeFFUPoC&pg=PT426 На
|chapter-url=му недостасува наслов (help). Encyclopedia of keyboard instruments. Pipe Metal. New York: Garland. стр. 411. ISBN 978-0-415-94174-7. - ↑ George Ashdown Audsley (1988). https://books.google.com/?id=I0h525OVoTgC&pg=PA501 На
|chapter-url=му недостасува наслов (help). The Art of Organ Building Audsley, George Ashdown. Metal Pipes: And the Materials used in their Construction. Courier Dover Publications. стр. 501. ISBN 978-0-486-21315-6. - ↑ Kim, H; Gilmore, C; Pique, A; Horwitz, J; Mattoussi, H; Murata, H; Kafafi, Z; Chrisey, D. (1999). „Electrical, optical, and structural properties of indium tin oxide thin films for organic light-emitting devices“. Journal of Applied Physics. 86 (11): 6451. Bibcode:1999JAP....86.6451K. doi:10.1063/1.371708.
- ↑ Bridge, Janet (September 1996). Making & decorating picture frames. ISBN 978-0-89134-739-2. Архивирано од изворникот на 2016-05-20.
- ↑ „Tin punching“. Архивирано од изворникот на August 11, 2011. Посетено на August 15, 2011.
- ↑ Pilkington, L. A. B. (1969). „Review Lecture. The Float Glass Process“. Proceedings of the Royal Society of London. Series A, Mathematical and Physical Sciences. 314 (1516): 1–25. Bibcode:1969RSPSA.314....1P. doi:10.1098/rspa.1969.0212. JSTOR 2416528.
- ↑ Lucas, Ivan T.; Syzdek, Jarosław; Kostecki, Robert (2011). „Interfacial processes at single-crystal β-Sn electrodes in organic carbonate electrolytes“. Electrochemistry Communications. 13 (11): 1271–1275. doi:10.1016/j.elecom.2011 август 026 Проверете ја вредноста
|doi=(help). - ↑ „Colgate Gel-Kam“. Архивирано од изворникот на 2009-04-27. Посетено на 2009-05-05.
- ↑ Hattab, F. (April 1989). „The State of Fluorides in Toothpastes“. Journal of Dentistry. 17 (2): 47–54. doi:10.1016/0300-5712(89)90129-2. PMID 2732364.
- ↑ Perlich, M. A.; Bacca, L. A.; Bollmer, B. W.; Lanzalaco, A. C.; McClanahan, S. F.; Sewak, L. K.; Beiswanger, B. B.; Eichold, W. A.; Hull, J. R.; и др. (1995). „The clinical effect of a stabilized stannous fluoride dentifrice on plaque formation, gingivitis and gingival bleeding: a six-month study“. The Journal of Clinical Dentistry. 6 (Special Issue): 54–58. PMID 8593194.
- ↑ 74,0 74,1 74,2 74,3 Atkins, Peter; Shriver, Duward F; Overton, Tina & Rourke, Jonathan (2006). Inorganic chemistry (4. изд.). W.H. Freeman. стр. 343, 345. ISBN 978-0-7167-4878-6.
- ↑ Wilkes, Charles E.; Summers, James W.; Daniels, Charles Anthony; Berard, Mark T. (August 2005). PVC handbook. стр. 108. ISBN 978-1-56990-379-7. Архивирано од изворникот на 2016-05-09.
- ↑ David N.-S. Hon; Nobuo Shiraishi, уред. (2001). https://books.google.com/?id=pKiTzbEDy1QC&pg=PA799 На
|chapter-url=му недостасува наслов (help). Wood and cellulosic chemistry. Preservation of Wood. New York, NY: Dekker. стр. 799. ISBN 978-0-8247-0024-9. - ↑ Eisler, Ronald. „Tin Hazards To Fish, Wildlife, and Invertebrates: A Synoptic Review“ (PDF). U.S. Fish and Wildlife Service Patuxent Wildlife Research Center. Архивирано од изворникот (PDF) на 2012-01-18.
- ↑ „Regulation (EC) No 782/2003 of the European Parliament and of the Council of 14 April 2003 on the prohibition of organotin compounds on ships“. Посетено на 2009-05-05.
- ↑ Dürr, Simone; Thomason, Jeremy, уред. (2008). https://books.google.com/?id=pERX3gKmFy4C&pg=PT227 На
|chapter-url=му недостасува наслов (help). Biofouling. Fouling on Shipping. Oxford: Blackwell. стр. 227. ISBN 978-1-4051-6926-4. - ↑ Farina, Vittorio; Krishnamurthy, Venkat; Scott, William J. (1997). The Stille Reaction. Organic Reactions. New York: Wiley. doi:10.1002/0471264180.or050.01. ISBN 978-0-471-31273-4.
- ↑ Lucas, Ivan; Syzdek, Jaroslaw (2011). „Electrochemistry Communications“. Electrochemistry Communications. 13 (11): 1271. doi:10.1016/j.elecom.2011 август 026 Проверете ја вредноста
|doi=(help). - ↑ „CDC - NIOSH Pocket Guide to Chemical Hazards - Tin“. www.cdc.gov. Архивирано од изворникот на 2015-11-25. Посетено на 2015-11-24.
Надворешни врски[уреди | уреди извор]
| Периоден систем на елементите | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| I | H | He | |||||||||||||||||||||||||||||||
| II | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| III | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| IV | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| V | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| VI | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| VII | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||
| ||||||||||
|


