Стронциум
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Општи својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име и симбол | стронциум (Sr) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изглед | металик сребрено-бела | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стронциумот во периодниот систем | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски број | 38 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандардна атомска тежина (±) (Ar) | 87,62(1)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категорија | земноалкални метали | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Група и блок | група 2 (земноалкални), s-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Периода | V периода | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електронска конфигурација | [Kr] 5s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
по обвивка | 2, 8, 18, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физички својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка на топење | 1.050 K (777 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка на вриење | 1.650 K (1.377 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Густина близу с.т. | 2,64 г/см3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| кога е течен, при т.т. | 2,375 г/см3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлина на топење | 7.43 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлина на испарување | 141 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Моларен топлински капацитет | 26.4 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
парен притисок
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Оксидациони степени | 2, 1[2] (силен базичен оксид) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електронегативност | Полингова скала: 0,95 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Енергии на јонизација | I: 549,5 kJ/mol II: 1.064,2 kJ/mol II: 4.138 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски полупречник | емпириски: 215 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентен полупречник | 195±10 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ван дер Валсов полупречник | 249 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Разни податоци | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристална структура | страноцентрирана коцкеста (сцк) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлинско ширење | 22,5 µм/(m·K) (при 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлинска спроводливост | 35,4 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електрична отпорност | 132 nΩ·m (при 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнетно подредување | парамагнетно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул на растегливост | 15,7 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул на смолкнување | 6,03 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Поасонов сооднос | 0,28 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мосова тврдост | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-број | 7440-24-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Историја | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Наречен по | Според минералот стронциjанит, кој пак е именуван според Стронцијан, Шкотска | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Откриен | Вилијам Круикшанк (1787) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Првпат издвоен | Хамфри Дејви (1808) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Најстабилни изотопи | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Режимите на распад во загради се предвидени, но сè уште не се забележани | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Стронциум — хемиски елемент со симбол Sr и атомски број 38. Земноалакален метал , стронциум е мек сребрено бел жолтеникав метален елемент кој е високо хемиски реактивен . Металот формира слој од темен оксид кога е изложен на воздух. Стронциумот има физички и хемиски својства слични на оние на неговите два вертикални соседи во периодниот систем, калциум и бариум. Се јавува природно главно во минералите целестин и стронцијантит, и главно е миниран од овие. Додека природниот стронциум е стабилен, синтетичкиот 90 Sr изотоп е радиоактивен и е една од најопасните компоненти на јадрените последици , бидејќи стронциумот се апсорбира од телото на сличен начин како калциумот. Од друга страна, природниот стабилен стронциум не е опасен за здравјето.
Стронциумот и стронцианитот се именувани по Штронтијан , село во Шкотска, во близина на местото каде што минералот бил откриен во 1790 година од Адер Крофорд и Вилијам Круксханк, следната година беше идентификуван како нов елемент од својата црвена боја на црвениот пламен тест . Стронциумот за првпат беше издвоен како метал во 1808 година од страна на Хамфри Дејви, користејќи го новооткриениот процес на електролиза . Во текот на 19 век, стронциумот најчесто се користел во производството на шеќер од шеќерна репка. На врвот на производството на телевизиски катодни цевки , дури 75 проценти од потрошувачката на стронциум во САД се користи за стакло.[3] Со замена на катодни цевки со други методи, потрошувачката на стронциум драстично се намали.[3]
Особености[уреди | уреди извор]

Стронциум е двовалентен сребрен метал со бледо жолта нијанса чии својства најчесто се меѓупросторни и слични со оние на спседите калциум и бариум .[4] Тој е помек од калциумот и потежок од бариумот. Се топи на 777 °C и врие на 1655 °C кои се пониски од оние на калциумот 842 °C и 1757 °C, бариумот го продолжува овој надолен тренд во точката на топење 727 °C, но не и во точката на вриење 2170 °C. Густината на стронциум е 2,64г/см3 која е слично средна помеѓу оние на калциум (1.54 г/см3) и бариум (3.594 г/см3). [5] Постојат три алотропи на метален стронциум, со точки на транзиција на 235 и 540 °C.[6]
Стандардниот електроден потенцијал за Sr 2+ / Sr е -2,89 V, приближно на средината помеѓу оние на Ca 2+ / Ca (-2,84 V) и Ba 2+ / Ba (-2,92 V) , и блиски до оние од соседните алкални метали .[7] Стронциумот е во средина помеѓу калциумот и бариумот во неговата реактивност кон водата, со што реагира на контакт за да се произведе стронциум хидроксид и водороден гас. Металот на стронциум гори на воздух за производство на стронциум оксид и стронциум нитрид , но бидејќи не реагира со азот под 380 °C, на собна температура спонтано го формира само оксидот.[5] Покрај едноставниот оксид SrO, пероксидот SrO 2 може да се направи со директна оксидација на метал од стронциум под висок притисок на кислород, а постојат и некои докази за жолт супероксид Sr (O 2 ) 2 .[8] Стронциум хидроксид , Sr (OH) 2 , е силна база, иако не е толку силна како хидроксидите на бариум или алкалните метали.[9] Сите четири дихалиди на стронциум се познати.[10]
Поради големинаta на тешките s-блокови, вклучувајќи стронциум, познат е широк спектар на координатни броеви од 2, 3 или 4 до 22 или 24 во SrCd 11 и SrZn 13 . Ср 2+ јон е прилично голем, така што високите координативни броеви се правилни.[11] Големината на стронциум и бариум игра значајна улога во стабилизирањето на стронциумските комплекси со полидентатен макроциклични лиганди како што се крунистичките етери, на пример, додека 18-круна-6 формира релативно слаби комплекси со калциум и алкални метали, комплексите на стронциум и бариум се многу посилни.[12]
Органостроциумските соединенија содржат една или повеќе стронциум-јаглеродна врска. Тие се пријавени како посредници во реакции на Барбиер тип .[13][14][15] Иако стронциумот е во истата група како магнезиум, а органомагнезиумските соединенија многу често се користат во хемијата, органостронциевите соединенија не се слично раширени, бидејќи тие се потешки да се направат и пореактивни. Органостронциевите соединенија имаат тенденција да бидат послични на органоевропиум или органосамариумски соединенија поради сличните јонски полупречници на овие елементи (Sr 2+ 118 pm; Еу 2+ 117 pm; Sm 2+ 122 pm). Повеќето од овие соединенија може да се подготват само при ниски температури, обемните лиганди имаат тенденција да ја одржуваат стабилноста. На пример, стронциум дициклопентадиенил , СР (C5 H 5) 2, мора да се направи со директна реакција на стронциум метал со меркуроцен или циклопентадиен себе; заменувајќи го C 5 H 5 лигандот со поширокиот C 5 (CH 3 ) 5 лиганд, од друга страна, ја зголемува растворливоста, нестабилноста и кинетичката стабилност на соединението.[16]
Поради својата екстремна реактивност со кислород и вода, стронциумот се јавува природно само во соединенија со други елементи, како што се минералите стронциан и целестин . Се држи под течен јаглеводород како што се минералното масло или керозин за да се спречи оксидација ; свежо изложениот метал од стронциум брзо преминува во жолтеникава боја со формирање на оксид. Филтрираниот стронциум во прав е пирофорен, што значи дека ќе се запали спонтано на воздух на собна температура. Лекалните соли на стронциум даваат пламен на светлоцрвена боја и овие соли се користат во пиротехника и за производството на ракети .[5] Калциум и бариум, како и алкалните метали и двовалентните лантаноиди европиум и иттербиум , метал од стронциум се раствора директно во течен амонијак и се добива темносина боја.[4]
Изотопи[уреди | уреди извор]
Природниот стронциум е мешавина од четири стабилни изотопи : 84 Sr, 86 Sr, 87 Sr и 88 Sr.[5] Нивното изобилство се зголемува со зголемување на масата, а најтешкото 88 Sr, сочинува околу 82,6% природен стронциум, иако изобилството варира поради производство на радиогени 87 Sr како ќерка на долготрајното бета-распаѓање 87 Rb .[17] Од нестабилните изотопи, основниот начин на распаѓање на изотопите помали од 85 Sr е електорнски зафат или позитронска емисија на изотопи на рубидиум, а оној на изотопите потешки од 88 Sr е емисија на електрони до изотопи на иттриум . Од посебна значење се <sup id="mwlQ">89</sup> Sr и <sup id="mwlw">90</sup> Sr. Првиот има полуживот од 50,6 дена и се користи за лекување на рак на коските поради хемиската сличност на стронциум и оттаму способноста да се замени калциумот.[18][19] Додека 90 Sr (полуживот 28.90 години) се користи слично, исто така е изотоп, во последиците од јадреното оружје и јадрените несреќи поради неговото производство како производ на цепење . Неговото присуство во коските може да предизвика рак на коските, рак на блиските ткива и леукемија .[20] Јадрената несреќа во Чернобил во 1986 година контаминираше околу 30.000 km 2 со поголем од 10 kBq / m 2 со 90 Sr, што претставува 5% од главниот инвентар од 90 Sr.[21]
Историја[уреди | уреди извор]

Стронциумот е именуван по шкотското село Стронјан (Галски Сон и Ситеин ), каде што е откриен во оловните рудници.[22] Томас Чарлс Надеж првично го нарекол елементот стронциан , но името наскоро беше скратено до стронциум .[23]
Во 1790 година, Адам Крафорд , лекар вклучен во подготовката на бариумот, и неговиот колега Вилијам Круиксхенк , признавале дека рудниците на стронтиан покажале својства кои се разликуваат од оние во другите извори на "тешки ракови".[24] Ова дозволува Адеир да заклучи на страница 355 "... навистина е веројатно дека минералот на скот е нов вид на земја која досега не била доволно разгледана ". Лекарот и колекторот на минерали Фридрих Габриел Сулзер заедно со Јохан Фридрих Блуменбах го анализирал минералот од стронтијан и го нарекол стронциан. Тој, исто така, дошол до заклучок дека е различен од осетината и содржел нова земја (Neue Grunderde).[25] Во 1793 г. Томас Чарлс Хоуп , професор по хемија на Универзитетот во Глазгов, го предложил името stronites .[26][27][28][29] Тој ја потврди претходната работа на Крафорд и раскажува: ". . . Со оглед дека тоа е чудна земја,мислев дека е неопходно да му се даде име. Јас тоа го нарекувам Strontites, од местото каде што беше пронајден; начин на деривација според мое мислење, сосема правилно како и секој квалитет што може да го поседува, што е сегашната мода ". Елементот на крајот беше изолиран од Сер Хемфри Дејви во 1808 година со електролиза на мешавината која содржи стронциум хлорид и меркуричен оксид , а на него го објави во предавање на Кралското друштво на 30 јуни 1808.[30] Во согласност со именувањето на другите алкални земли, тој го сменил името во стронциум .[31][32][33][34][35]
Првата голема намена на стронциум беше во производството на шеќер од шеќерна репка . Иако процесот на кристализација со користење на стронциум хидроксид бил патентиран од Аугустин-Пјер Дубрунфут во 1849 година [36] , воведувањето на голем обем дојде со подобрување на процесот во раните 1870-ти. Германската шеќерна индустрија добро го користела процесот во 20 век. Пред Првата светска војна, индустријата за репроматеријали од шеќер користеше 100.000 до 150.000 тони годишно стронциум хидроксид за овој процес.[37] Стронциум хидроксидот беше рециклиран во процесот, но побарувачката за замена на загубите за време на производството беше доволно висока за да создаде значителна побарувачка за отпочнување на рударството на стронцианитот во Минстерланд . Рударството на строонјаните во Германија завршило кога започнало рударството на целестинските наноси во Глостершир .[38] Овие рудници обезбедија најголем дел од снабдувањето со стронциум од светот од 1884 до 1941 година. Иако целестинските наслаги во сливот на Гранада беа познати по извесно време, големите рударски работи не започнаа пред 1950-тите.[39]
За време на тестирање на атмосферско јадрено оружје , беше забележано дека стронциум-90 е еден од јадрените производи со релативно висок принос. Сличноста на калциумот и можноста дека стронциум-90 може да се збогати во коските, направи важна тема за истражување на метаболизмот на стронциум.[40][41]
Појава[уреди | уреди извор]

Стронциумот вообичаено се јавува во природата, што е 15-тиот најбитен елемент на Земјата (неговиот потежок бактериум е 14-тиот), проценет на околу 360 делови на милион во Земјината кора [42] и се наоѓа главно како сулфат минерален целестин (SrSO 4 ) и карбонатски стронциант (SrCO 3 ). Од двете, целестината се јавува многу почесто во депозити со доволна големина за рударството. Бидејќи стронциумот најчесто се користи во карбонатната форма, стронциантот би бил покорисен од двата вообичаени минерали, но се откриени и неколку депозити кои се погодни за развој.[43]
Во подземните води стронциумот се однесува хемиски многу слично на калциумот. Киселината pH Sr 2+ е доминантен вид на стронциум. Во присуство на јони на калциум, стронциумот најчесто формира коприципитации со минерали на калциум како калцит и анхидрид при зголемена pH вредност. На средно до кисела pH, растворениот стронциум е врзан за честички на почвата со катјонска размена .[44]
Средната содржина на стронциум во океанската вода е 8 mg / l.[45][46] Во концентрација помеѓу 82 и 90 μmol / l на стронциум, концентрацијата е значително пониска од концентрацијата на калциум, која вообичаено е помеѓу 9,6 и 11,6 mmol / l.[47][48] Сепак, тоа е многу повисоко од оној на бариум, 13 μg / l.[5]
Производство[уреди | уреди извор]
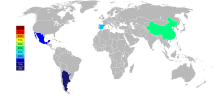
Трите главни производители на стронциум како целина од 2015 година се Кина (150.000 т), Шпанија (90.000 т ) и Мексико (70.000 t), а Аргентина (10.000 т) и Мароко (2.500 т) се помали производители. Иако депозитите на стронциум се појавуваат нашироко во САД, тие не се минирани од 1959 година.[49]
Голем дел од минираниот целестин (SrSO 4 ) се претвора во карбонат со два процеси. Или целестината е директно исцедена со раствор на натриум карбонат или целестината е печена со јаглен за да се формира сулфид. Втората фаза произведува темно обоен материјал кој содржи претежно стронциум сулфид . Ова т.н. "црн пепел" се раствора во вода и се филтрира. Стронциум карбонат се преципитира од растворот на стронциум сулфид со воведување на јаглерод диоксид .[50] Сулфатот се сведува на сулфид со карботермично намалување :
- SrSO 4 + 2 C → SrS + 2 CO 2
Околу 300.000 тони се обработуваат на овој начин годишно.[51]
Металот се произведува комерцијално со намалување на стронциум оксид со алуминиум . Стронциумот се дестилира од смесата.[51] Металот на стронциум, исто така, може да се подготви на мал размер со електролиза на раствор на стронциум хлорид во стопен калиум хлорид :[7]
- Sr 2+ + 2
e−
</br>
e−
</br> → Ср - 2 Cl - → Cl 2 + 2
e−
</br>
e−
</br>
Апликации[уреди | уреди извор]

Користејќи 75% од производството, примарната употреба на стронциум е во стакло за катодни цевки во боја во боја,[51] каде што се спречува емитувањето на Х-зраци .[52][53] Оваа апликација за стронциум опаѓа бидејќи CRTs се заменуваат со други методи на прикажување. Овој пад има значајно влијание врз рударството и рафинирањето на стронциум.[43] Сите делови на CRT мора да апсорбираат Х-зраци. Во вратот и инката од цевката се користи оловно стакло, но овој тип на стакло покажува ефект на зацврстување поради интеракцијата на Х-зраците со стаклото. Затоа, предната плоча е направена од различна стаклена мешавина со стронциум и бариум за апсорпција на Х-зраците. Просечните вредности за стаклената мешавина утврдени од студијата за рециклирање во 2005 година изнесува 8,5% стронциум оксид и 10% бариум оксид .[54]
Бидејќи стронциум е толку сличен на калциумот, тој е инкорпориран во коската. Сите четири стабилни изотопи се инкорпорирани, во приближно истите пропорции се наоѓаат во природата. Сепак, вистинската распределба на изотопите има тенденција да варира во голема мера од една географска локација до друга. Така, анализата на коската на поединецот може да помогне да се одреди регионот од кој ke произлезе.[55][56] Овој пристап помага да се идентификуваат древните модели на миграција и потеклото на човечките остатоци во погребните места на бојното поле.[57]
87 Sr / 86 Sr сооднос најчесто се користат за да се одредат веројатните провиденски области на седиментот во природните системи, особено во морските и флувијалните средини. Даш (1969) покажа дека површинските седименти на Атлантикот покажуваат 87 Sr / 86 Sr коефициенти што може да се сметаат како големи средни вредности на 87 Sr / 86 Sr коефициенти на геолошки терени од соседните копнежи.[58] Добриот пример за флувиално-морски систем на кој биле успешно применети студии за изотопско проучување на Sr е речниот нилско-Средоземен систем.[59] Поради различните возрасти на карпите кои го сочинуваат поголемиот дел од Синиот и Белиот Нил, сливните подрачја на променливите провиденции на седиментот кои достигнуваат делта на реката Нил и Источно Средоземно Море можат да се разберат преку изотопските студии на стронциум. Ваквите промени се климатски контролирани во доцниот кватернер .[59]
Неодамна, соодносот 87 Sr / 86 Sr исто така се користи за одредување на изворот на антички археолошки материјали, како што се дрвa и пченка во кањонот Чако, Ново Мексико.[60][61] 87 Sr / 86 Sr соодносот во забите, исто така, може да се користи за следење на миграциите на животните.[62][63]
Стронецум алуминатот често се користи во флуоросцентните играчки, бидејќи е хемиски и биолошки инертен. [ бара извор ]

Стронциум карбонат и други соли на стронциум се додаваат во огномети за да се добие длабока црвена боја.[64] Овој ист ефект ги идентификува катјоните од стронциум во тестот за пламен . Огнометто троши околу 5% од светското производство.[51] Стронциум карбонат се користи во производството на тврди феритни магнети.[65][66]
Стронциум хлорид понекогаш се користи во пастите за заби за осетливи заби. Еден популарен бренд вклучува 10% вкупен стронциум хлорид хексахидрат по тежина.[67] Мали количини се користат при рафинирање на цинк за да се отстранат малите количини на олово од нечистотии.[5] Самиот метал има ограничена употреба како геттер, за да ги отстрани несаканите гасови во вакуум со реакција со нив, иако бариум исто така може да се користи за оваа намена.[7]
Ултра-тесната оптичка транзиција помеѓу електронската основна состојба [Kr] 5s 2 1 S 0 и метастабилната [Kr] 5s5p 3 P 0 возбудена состојба на 87 Sr е еден од водечките кандидати за идната редефиниција на втората оптичка транзиција, наспроти сегашната дефиниција која произлегува од транзиција на микробранови помеѓу различни хиперфински основни состојби од 133 Cs. [68] Тековните оптички атомски часовници кои работат на оваа транзиција веќе ја надминуваат прецизноста и точноста на тековната дефиниција на втората.
Радиоактивен стронциум[уреди | уреди извор]
<sup id="mwAUw">89</sup> Sr е активна состојка во Метастрон,[69] радиофармацевтски препарат за коскена болка секундарно на метастатски рак на коските . Стронциумот се обработува како калциум од телото, претежно инкорпорирајќи го во коските на местата на зголемена остеогенеза . Оваа локализација ја фокусира изложеноста на зрачење на канцерогената лезија.[19]

<sup id="mwAVg">90</sup> Sr се користи како извор на енергија за радиоизотопните термоелектрични генератори (RTGs). 90 Sr произведува приближно 0,93 вати на топлина по грам (е помал за формата од 90 Sr што се користи во RTGs, што е стронциум флуорид ).[70] Сепак, 90 Sr има една третина од животниот век и помала густина од 238 Pu, друго RTG гориво. Главната предност на 90 Sr е дека е поевтина од 238 Pu и се наоѓа во јадрен отпад . Советскиот Сојуз распореди речиси 1000 од овие РТГ на северниот брег како извор на енергија за станици за светилници и метеорологија.[71][72]
Биолошка улога[уреди | уреди извор]
| Опасности | |
|---|---|
| ГИС-пиктограми |  
|
| GHS сигнален збор | Опасност |
| H261, H315 | |
| P223, P231 + 232, P370 + 378, P422 [73] | |
| NFPA 704 |  <span style="color:black;" title="Flammability code 0: Will not burn. E.g., water">0</span> <span style="color:black;" title="Health code 2: Intense or continued but not chronic exposure could cause temporary incapacitation or possible residual injury. E.g., chloroform">2</span> <span style="color:black;" title="Reactivity code 2: Undergoes violent chemical change at elevated temperatures and pressures, reacts violently with water, or may form explosive mixtures with water. E.g., phosphorus">2</span> <span style="font-size:15px; color:black; width:23px; position:absolute; left:29px;" title="Special hazard W: Reacts with water in an unusual or dangerous manner. E.g., cesium, sodium"><s>W</s></span> |
Акантарија, релативно голема група на морски радиолокарни протозои, произведува сложени минерални скелети составени од стронциум сулфат .[74] Во биолошките системи, калциумот во помал степен се заменува со стронциум.[75] Во човечкото тело, најголемиот дел од апсорбираниот стронциум се депонира во коските. Односот на стронциум со калциум во човечките коски е помеѓу 1: 1000 и 1: 2000, приближно во истиот опсег како во крвниот серум.[76]
Ефект врз човечкото тело[уреди | уреди извор]
Човечкото тело апсорбира стронциум како да е негов полесен конгенериран калциум. Бидејќи елементите се хемиски многу слични, стабилните изотопи на стронциум не претставуваат значајна здравствена закана. Просечниот човек има внес од околу два милиграма стронциум дневно.[77] Кај возрасните, конзумирањето на стронциум има тенденција да се закачи само на површината на коските, но кај децата, стронциумот може да го замени калциумот во минералот на растечките коски и на тој начин да доведе до проблеми со растот на коските.[78]
Биолошкиот полуживот на стронциум кај луѓето е објавен различно од 14 до 600 дена,[79][80] 1000 дена,[81] 18 години,[82] 30 години [83] и, во горната граница, 49 години.[84] Широките објавени биолошки бројки за полуживот се објаснуваат со комплексниот метаболизам на стронциум во телото. Сепак, со проседување на сите патеки на екскреција, вкупниот биолошки полуживот се проценува на околу 18 години.[85] Стапката на елиминација на стронциум е силно погодена од возраста и полот, поради разликите во коскениот метаболизам .[86]
Наркотичниот стронциум ранлеат помага при раст на коските, ја зголемува коскената густина и ја намалува појавата на фрактури на вертебрални, периферни и колкови.[87][88] Сепак, стронциум ранлеат, исто така, го зголемува ризикот од венски тромбоемболизам, белодробна емболија и сериозни кардиоваскуларни нарушувања, вклучувајќи миокарден инфаркт. Затоа неговата употреба е ограничена.[89] Нејзините корисни ефекти се исто така дискутабилни, бидејќи зголемената коскена густина е делумно предизвикана од зголемената густина на стронциум над калциумот што ја заменува. Стронциум, исто така, биоакумулира во телото.[90] И покрај ограничувањата на стронциум ранлеат, стронциумот сè уште се содржи во некои додатоци.[91][92] Нема многу научни докази за ризиците од стронциум хлорид кога се земаат преку уста. Оние со лична или семејна историја на нарушувања на згрутчување на крвта се препорачуваат за да се избегне стронциум.[91][92]
Се покажа дека стронциум ја инхибира сетилната иритација кога се применува локално на кожата.[93][94] Се покажало дека локално се применува, стронциумот ја забрзува стапката на обновување на бариерата на епидермалната проницаемост (бариера на кожата).[95]
Поврзано[уреди | уреди извор]
Наводи[уреди | уреди извор]
- ↑ Standard Atomic Weights 2013. Commission on Isotopic Abundances and Atomic Weights
- ↑ Colarusso, P.; Guo, B.; Zhang, K.-Q.; Bernath, P.F. (1996). „High-Resolution Infrared Emission Spectrum of Strontium Monofluoride“ (PDF). J. Molecular Spectroscopy. 175: 158. Bibcode:1996JMoSp.175..158C. doi:10.1006/jmsp.1996.0019.
- ↑ 3,0 3,1 „Mineral Resource of the Month: Strontium“. U.S. Geological Survey. Посетено на 16 August 2015.
- ↑ 4,0 4,1 Гринвуд и Ерншоу, pp. 112-13
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 C. R. Hammond The elements (pp. 4–35) in Lide, D. R., уред. (2005). CRC Handbook of Chemistry and Physics (LXXXVI. изд.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ Ropp, Richard C. (31 December 2012). Encyclopedia of the Alkaline Earth Compounds. стр. 16. ISBN 978-0-444-59553-9.
- ↑ 7,0 7,1 7,2 Гринвуд и Ерншоу, стр. 111Грешка во наводот: Неважечка ознака
<ref>; називот „Greenwood111“ е зададен повеќепати со различна содржина. - ↑ Гринвуд и Ерншоу, стр. 119
- ↑ Гринвуд и Ерншоу, стр. 121
- ↑ Гринвуд и Ерншоу, стр. 117
- ↑ Гринвуд и Ерншоу, стр. 115
- ↑ Гринвуд и Ерншоу, стр. 124
- ↑ Miyoshi, N.; Kamiura, K.; Oka, H.; Kita, A.; Kuwata, R.; Ikehara, D.; Wada, M. (2004). „The Barbier-Type Alkylation of Aldehydes with Alkyl Halides in the Presence of Metallic Strontium“. Bulletin of the Chemical Society of Japan. 77 (2): 341. doi:10.1246/bcsj.77.341.
- ↑ Miyoshi, N.; Ikehara, D.; Kohno, T.; Matsui, A.; Wada, M. (2005). „The Chemistry of Alkylstrontium Halide Analogues: Barbier-type Alkylation of Imines with Alkyl Halides“. Chemistry Letters. 34 (6): 760. doi:10.1246/cl.2005.760.
- ↑ Miyoshi, N.; Matsuo, T.; Wada, M. (2005). „The Chemistry of Alkylstrontium Halide Analogues, Part 2: Barbier-Type Dialkylation of Esters with Alkyl Halides“. European Journal of Organic Chemistry. 2005 (20): 4253. doi:10.1002/ejoc.200500484.
- ↑ Гринвуд и Ерншоу, стр. 136-37
- ↑ Гринвуд и Ерншоу, стр. 19
- ↑ Halperin, Edward C.; Perez, Carlos A.; Brady, Luther W. (2008). Perez and Brady's principles and practice of radiation oncology. Lippincott Williams & Wilkins. стр. 1997–. ISBN 978-0-7817-6369-1. Посетено на 19 July 2011.
- ↑ 19,0 19,1 Bauman, Glenn; Charette, Manya; Reid, Robert; Sathya, Jinka (2005). „Radiopharmaceuticals for the palliation of painful bone metastases – a systematic review“. Radiotherapy and Oncology. 75 (3): 258.E1–258.E13. doi:10.1016/j.radonc.2005.03.003.
- ↑ „Strontium | Radiation Protection | US EPA“. EPA. 24 April 2012. Посетено на 18 June 2012.
- ↑ „Chernobyl: Assessment of Radiological and Health Impact, 2002 update; Chapter I – The site and accident sequence“ (PDF). OECD-NEA. 2002. Посетено на 3 June 2015.
- ↑ Murray, W. H. (1977). The Companion Guide to the West Highlands of Scotland. London: Collins. ISBN 0-00-211135-7.
- ↑ http://www.chem.ed.ac.uk/about-us/history/professors/thomas-charles-hope
- ↑ Crawford, Adair (1790). „On the medicinal properties of the muriated barytes“. Medical Communications. 2: 301–59.
- ↑ Sulzer, Friedrich Gabriel; Blumenbach, Johann Friedrich (1791). „Über den Strontianit, ein Schottisches Foßil, das ebenfalls eine neue Grunderde zu enthalten scheint“. Bergmännisches Journal: 433–36.
- ↑ Although Thomas C. Hope had investigated strontium ores since 1791, his research was published in: Hope, Thomas Charles (1798). „Account of a mineral from Strontian and of a particular species of earth which it contains“. Transactions of the Royal Society of Edinburgh. 4 (2): 3–39. doi:10.1017/S0080456800030726.
- ↑ Murray, T. (1993). „Elementary Scots: The Discovery of Strontium“. Scottish Medical Journal. 38 (6): 188–89. doi:10.1177/003693309303800611. PMID 8146640.
- ↑ Doyle, W.P. „Thomas Charles Hope, MD, FRSE, FRS (1766–1844)“. The University of Edinburgh. Архивирано од изворникот на 2 June 2013.
- ↑ Hope, Thomas Charles (1794). „Account of a mineral from Strontian and of a particular species of earth which it contains“. Transactions of the Royal Society of Edinburgh. 3 (2): 141–49. doi:10.1017/S0080456800020275.
- ↑ Davy, H. (1808). „Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia“. Philosophical Transactions of the Royal Society of London. 98: 333–70. doi:10.1098/rstl.1808.0023.
- ↑ Taylor, Stuart (19 June 2008). „Strontian gets set for anniversary“. Lochaber News. Архивирано од изворникот на 13 January 2009.
- ↑ Weeks, Mary Elvira (1932). „The discovery of the elements: X. The alkaline earth metals and magnesium and cadmium“. Journal of Chemical Education. 9 (6): 1046–57. Bibcode:1932JChEd...9.1046W. doi:10.1021/ed009p1046.
- ↑ Partington, J. R. (1942). „The early history of strontium“. Annals of Science. 5 (2): 157. doi:10.1080/00033794200201411.
- ↑ Partington, J. R. (1951). „The early history of strontium. Part II“. Annals of Science. 7: 95. doi:10.1080/00033795100202211.
- ↑ Many other early investigators examined strontium ore, among them: (1) Martin Heinrich Klaproth, "Chemische Versuche über die Strontianerde" (Chemical experiments on strontian ore), Crell's Annalen (September 1793) no. ii, pp. 189–202 ; and "Nachtrag zu den Versuchen über die Strontianerde" (Addition to the Experiments on Strontian Ore), Crell's Annalen (February 1794) no. i, p. 99 ; also (2) Kirwan, Richard (1794). „Experiments on a new earth found near Stronthian in Scotland“. The Transactions of the Royal Irish Academy. 5: 243–56.
- ↑ Fachgruppe Geschichte Der Chemie, Gesellschaft Deutscher Chemiker (2005). Metalle in der Elektrochemie. стр. 158–62.
- ↑ Heriot, T. H. P (2008). Manufacture of Sugar from the Cane and Beet. strontium saccharate process. ISBN 978-1-4437-2504-0.
- ↑ Börnchen, Martin. „Der Strontianitbergbau im Münsterland“. Архивирано од изворникот на 11 December 2014. Посетено на 9 November 2010.
- ↑ Martin, Josèm; Ortega-Huertas, Miguel; Torres-Ruiz, Jose (1984). „Genesis and evolution of strontium deposits of the granada basin (Southeastern Spain): Evidence of diagenetic replacement of a stromatolite belt“. Sedimentary Geology. 39 (3–4): 281. Bibcode:1984SedG...39..281M. doi:10.1016/0037-0738(84)90055-1.
- ↑ „Chain Fission Yields“. iaea.org.
- ↑ Nordin, B. E. (1968). „Strontium Comes of Age“. British Medical Journal. 1 (5591): 566. doi:10.1136/bmj.1.5591.566. PMC 1985251.
- ↑ Turekian, K. K.; Wedepohl, K. H. (1961). „Distribution of the elements in some major units of the Earth's crust“. Geological Society of America Bulletin. 72 (2): 175–92. Bibcode:1961GSAB...72..175T. doi:10.1130/0016-7606(1961)72[175:DOTEIS]2.0.CO;2.
- ↑ 43,0 43,1 Ober, Joyce A. „Mineral Commodity Summaries 2010: Strontium“ (PDF). United States Geological Survey. Посетено на 14 May 2010.
- ↑ Heuel-Fabianek, B. (2014). „Partition Coefficients (Kd) for the Modelling of Transport Processes of Radionuclides in Groundwater“ (PDF). Berichte des Forschungszentrums Jülich. 4375. ISSN 0944-2952.
- ↑ Stringfield, V. T. (1966). Artesian water in Tertiary limestone in the southeastern States. Strontium. Geological Survey Professional Paper. United States Government Printing Office. стр. 138–39.
- ↑ Angino, Ernest E.; Billings, Gale K.; Andersen, Neil (1966). „Observed variations in the strontium concentration of sea water“. Chemical Geology. 1: 145. Bibcode:1966ChGeo...1..145A. doi:10.1016/0009-2541(66)90013-1.
- ↑ Sun, Y.; Sun, M.; Lee, T.; Nie, B. (2005). „Influence of seawater Sr content on coral Sr/Ca and Sr thermometry“. Coral Reefs. 24: 23. doi:10.1007/s00338-004-0467-x.
- ↑ Kogel, Jessica Elzea; Trivedi, Nikhil C.; Barker, James M. (5 March 2006). „Industrial Minerals & Rocks: Commodities, Markets, and Uses“. ISBN 978-0-87335-233-8. Наводот journal бара
|journal=(help) - ↑ 49,0 49,1 Ober, Joyce A. „Mineral Commodity Summaries 2015: Strontium“ (PDF). United States Geological Survey. Посетено на 26 March 2016.
- ↑ Kemal, Mevlüt; Arslan, V.; Akar, A.; Canbazoglu, M. (1996). Production of SrCO3 by black ash process: Determination of reductive roasting parameters. стр. 401. ISBN 978-90-5410-829-0.
- ↑ 51,0 51,1 51,2 51,3 MacMillan, J. Paul; Park, Jai Won; Gerstenberg, Rolf; Wagner, Heinz; Köhler, Karl and Wallbrecht, Peter (2002) "Strontium and Strontium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. doi:10.1002/14356007.a25_321.
- ↑ „Cathode Ray Tube Glass-To-Glass Recycling“ (PDF). ICF Incorporated, USEP Agency. Архивирано од изворникот (PDF) на 19 December 2008. Посетено на 7 January 2012.
- ↑ Ober, Joyce A.; Polyak, Désirée E. „Mineral Yearbook 2007: Strontium“ (PDF). United States Geological Survey. Посетено на 14 October 2008.
- ↑ Méar, F.; Yot, P.; Cambon, M.; Ribes, M. (2006). „The characterization of waste cathode-ray tube glass“. Waste Management. 26 (12): 1468–76. doi:10.1016/j.wasman.2005.11.017. PMID 16427267.
- ↑ Price, T. Douglas; Schoeninger, Margaret J.; Armelagos, George J. (1985). „Bone chemistry and past behavior: an overview“. Journal of Human Evolution. 14 (5): 419–47. doi:10.1016/S0047-2484(85)80022-1.
- ↑ Steadman, Luville T.; Brudevold, Finn; Smith, Frank A. (1958). „Distribution of strontium in teeth from different geographic areas“. The Journal of the American Dental Association. 57 (3): 340–44. doi:10.14219/jada.archive.1958.0161.
- ↑ Schweissing, Matthew Mike; Grupe, Gisela (2003). „Stable strontium isotopes in human teeth and bone: a key to migration events of the late Roman period in Bavaria“. Journal of Archaeological Science. 30 (11): 1373–83. doi:10.1016/S0305-4403(03)00025-6.
- ↑ Dasch, J. (1969). „Strontium isotopes in weathering profiles, deep-sea sediments, and sedimentary rocks“. Geochimica et Cosmochimica Acta. 33 (12): 1521–52. Bibcode:1969GeCoA..33.1521D. doi:10.1016/0016-7037(69)90153-7.
- ↑ 59,0 59,1 Krom, M. D.; Cliff, R.; Eijsink, L. M.; Herut, B.; Chester, R. (1999). „The characterisation of Saharan dusts and Nile particulate matter in surface sediments from the Levantine basin using Sr isotopes“. Marine Geology. 155 (3–4): 319–30. Bibcode:1999MGeol.155..319K. doi:10.1016/S0025-3227(98)00130-3.
- ↑ Benson, L.; Cordell, L.; Vincent, K.; Taylor, H.; Stein, J.; Farmer, G. & Kiyoto, F. (2003). „Ancient maize from Chacoan great houses: where was it grown?“. Proceedings of the National Academy of Sciences. 100 (22): 13111–15. Bibcode:2003PNAS..10013111B. doi:10.1073/pnas.2135068100. PMC 240753. PMID 14563925.
- ↑ English NB; Betancourt JL; Dean JS; Quade J. (October 2001). „Strontium isotopes reveal distant sources of architectural timber in Chaco Canyon, New Mexico“. Proc Natl Acad Sci USA. 98 (21): 11891–96. Bibcode:2001PNAS...9811891E. doi:10.1073/pnas.211305498. PMC 59738. PMID 11572943.
- ↑ Barnett-Johnson, Rachel; Grimes, Churchill B.; Royer, Chantell F.; Donohoe, Christopher J. (2007). „Identifying the contribution of wild and hatchery Chinook salmon (Oncorhynchus tshawytscha) to the ocean fishery using otolith microstructure as natural tags“. Canadian Journal of Fisheries and Aquatic Sciences. 64 (12): 1683–92. doi:10.1139/F07-129.
- ↑ Porder, S.; Paytan, A. & E.A. Hadly (2003). „Mapping the origin of faunal assemblages using strontium isotopes“. Paleobiology. 29 (2): 197–204. doi:10.1666/0094-8373(2003)029<0197:MTOOFA>2.0.CO;2.
- ↑ „Chemistry of Firework Colors – How Fireworks Are Colored“. Chemistry.about.com. 10 April 2012. Посетено на 14 April 2012.
- ↑ „Ferrite Permanent Magnets“. Arnold Magnetic Technologies. Архивирано од изворникот на 14 May 2012. Посетено на 18 January 2014.
- ↑ „Barium Carbonate“. Chemical Products Corporation. Архивирано од изворникот на 6 October 2014. Посетено на 18 January 2014.
- ↑ Ghom (1 December 2005). Textbook of Oral Medicine. стр. 885. ISBN 978-81-8061-431-6.[мртва врска]
- ↑ CartlidgeMar. 1, Edwin; 2018; Pm, 12:00 (2018-02-28). „With better atomic clocks, scientists prepare to redefine the second“. Science | AAAS (англиски). Посетено на 2019-02-10.CS1-одржување: бројчени имиња: список на автори (link)
- ↑ „FDA ANDA Generic Drug Approvals“. Food and Drug Administration. Архивирано од изворникот на 2016-04-09. Посетено на 2019-04-20.
- ↑ „What are the fuels for radioisotope thermoelectric generators?“. qrg.northwestern.edu.
- ↑ Doyle, James (30 June 2008). Nuclear safeguards, security and nonproliferation: achieving security with technology and policy. стр. 459. ISBN 978-0-7506-8673-0.
- ↑ O'Brien, R. C.; Ambrosi, R. M.; Bannister, N. P.; Howe, S. D.; Atkinson, H. V. (2008). „Safe radioisotope thermoelectric generators and heat sources for space applications“. Journal of Nuclear Materials. 377 (3): 506–21. Bibcode:2008JNuM..377..506O. doi:10.1016/j.jnucmat.2008.04.009.
- ↑ https://www.sigmaaldrich.com/catalog/product/aldrich/343730?lang=en®ion=US
- ↑ De Deckker, Patrick (2004). „On the celestite-secreting Acantharia and their effect on seawater strontium to calcium ratios“. Hydrobiologia. 517 (1–3): 1. doi:10.1023/B:HYDR.0000027333.02017.50.
- ↑ Pors Nielsen, S. (2004). „The biological role of strontium“. Bone. 35 (3): 583–88. doi:10.1016/j.bone.2004.04.026. PMID 15336592.
- ↑ Cabrera, Walter E.; Schrooten, Iris; De Broe, Marc E.; d'Haese, Patrick C. (1999). „Strontium and Bone“. Journal of Bone and Mineral Research. 14 (5): 661–68. doi:10.1359/jbmr.1999.14.5.661. PMID 10320513.
- ↑ Emsley, John (2011). Nature's building blocks: an A–Z guide to the elements. Oxford University Press. стр. 507. ISBN 978-0-19-960563-7.
- ↑ Agency for Toxic Substances and Disease Registry (21 January 2015). „ATSDR – Public Health Statement: Strontium“. cdc.gov. Agency for Toxic Substances and Disease Registry. Посетено на 17 November 2016.
- ↑ Tiller, B. L. (2001), Hanford Site 2001 Environmental Report (PDF), 4.5 Fish and Wildlife Surveillance, DOE, Архивирано од изворникот (PDF) на 2013-05-11, Посетено на 14 January 2014
- ↑ Driver, C. J. (1994), Ecotoxicity Literature Review of Selected Hanford Site Contaminants (PDF), DOE, doi:10.2172/10136486, Посетено на 14 January 2014
- ↑ „Freshwater Ecology and Human Influence“. Area IV Envirothon. Архивирано од изворникот на 1 January 2014. Посетено на 14 January 2014.
- ↑ „Radioisotopes That May Impact Food Resources“ (PDF). Epidemiology, Health and Social Services, State of Alaska. Архивирано од изворникот (PDF) на 21 August 2014. Посетено на 14 January 2014.
- ↑ „Human Health Fact Sheet: Strontium“ (PDF). Argonne National Laboratory. October 2001. Архивирано од изворникот (PDF) на 24 January 2014. Посетено на 14 January 2014.
- ↑ „Biological Half-life“. HyperPhysics. Посетено на 14 January 2014.
- ↑ Glasstone, Samuel; Dolan, Philip J. (1977). The effects of Nuclear Weapons (PDF). XII: Biological Effects. стр. 605. Посетено на 14 January 2014.
- ↑ Shagina, N. B.; Bougrov, N. G.; Degteva, M. O.; Kozheurov, V. P.; Tolstykh, E. I. (2006). „An application of in vivo whole body counting technique for studying strontium metabolism and internal dose reconstruction for the Techa River population“. Journal of Physics: Conference Series. 41: 433–40. doi:10.1088/1742-6596/41/1/048.
- ↑ Meunier P. J.; Roux C.; Seeman E.; Ortolani, S.; Badurski, J. E.; Spector, T. D.; Cannata, J.; Balogh, A.; Lemmel, E. M. (January 2004). „The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis“. New England Journal of Medicine. 350 (5): 459–68. doi:10.1056/NEJMoa022436. PMID 14749454.
- ↑ Reginster JY; Seeman E; De Vernejoul MC; Adami, S.; Compston, J.; Phenekos, C.; Devogelaer, J. P.; Diaz Curiel, M.; Sawicki, A. (May 2005). „Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: treatment of peripheral osteoporosis (TROPOS) study“ (PDF). J Clin Metab. 90 (5): 2816–22. doi:10.1210/jc.2004-1774. PMID 15728210.
- ↑ „Strontium ranelate: cardiovascular risk – restricted indication and new monitoring requirements“. Medicines and Healthcare products Regulatory Agency, UK. March 2014.
- ↑ Price, Charles T.; Langford, Joshua R.; Liporace, Frank A. (5 April 2012). „Essential Nutrients for Bone Health and a Review of their Availability in the Average North American Diet“. Open Orthop. J. 6: 143–49. doi:10.2174/1874325001206010143. PMC 3330619. PMID 22523525.
- ↑ 91,0 91,1 „Strontium“. WebMD. Посетено на 20 November 2017.
- ↑ 92,0 92,1 „Strontium for Osteoporosis“. WebMD. Посетено на 20 November 2017.
- ↑ Hahn, G.S. (1999). „Strontium Is a Potent and Selective Inhibitor of Sensory Irritation“ (PDF). Dermatologic Surgery. 25 (9): 689–94. doi:10.1046/j.1524-4725.1999.99099.x. PMID 10491058. Архивирано од изворникот (PDF) на 31 May 2016.
- ↑ Hahn, G.S. (2001). Anti-irritants for Sensory Irritation. Handbook of Cosmetic Science and Technology. стр. 285. ISBN 978-0-8247-0292-2.
- ↑ Kim, Hyun Jeong; Kim, Min Jung; Jeong, Se Kyoo (2006). „The Effects of Strontium Ions on Epidermal Permeability Barrier“. The Korean Dermatological Association, Korean Journal of Dermatology. 44: 1309. Архивирано од изворникот на 2021-06-04. Посетено на 2019-04-20.
| Периоден систем на елементите | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| I | H | He | |||||||||||||||||||||||||||||||
| II | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| III | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| IV | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| V | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| VI | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| VII | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||
| ||||||
|


