Калиум цијанид
| |

| |
Назив според МСЧПХ Калиум цијанид | |
| Назнаки | |
|---|---|
| 151-50-8 | |
| ChEBI | CHEBI:33191 |
| ChemSpider | 8681 |
| EC-број | 205-792-3 |
| |
| 3Д-модел (Jmol) | Слика |
| PubChem | 9032 |
| RTECS-бр. | TS8750000 |
| |
| UNII | MQD255M2ZO |
| ОН-бр. | 1680 |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | Бела кристална цврста супстанца deliquescent |
| Мирис | слаб, арома на бадем |
| Густина | 1,52 g/cm3
Solubility = 71.6 g/100 ml (25 °C) |
| Точка на топење | |
| Точка на вриење | |
| Растворливост во метанол | 4,91 g/100 mL (20 °C) |
| Растворливост во глицерол | soluble |
| Растворливост во формамид | 14,6 g/100 mL |
| Растворливост во етанол | 0,57 g/100mL |
| Растворливост во хироксиламин | 41 g/100 mL |
| Киселост (pKa) | 11,0 |
| −37,0·10−6 cm3/mol | |
| Показател на прекршување (nD) | 1,410 |
| Термохемија | |
| Ст. енталпија на формирање ΔfH |
−131,5 kJ/mol |
| Стандардна моларна ентропија S |
127,8 J K−1 mol−1 |
| Опасност | |
| GHS-ознаки: | |
Пиктограми
|
   
|
Сигнални зборови
|
Опасност |
Изјави за опасност
|
H290, H300, H310, H330, H370, H372, H410 |
Изјави за претпазливост
|
P260, P264, P273, P280, P284, P301+P310 |
| NFPA 704 | |
| Температура на запалување | {{{value}}} |
| Смртоносна доза или концентрација: | |
LD50 (средна доза)
|
5 mg/kg (орално, зајак) 10 mg/kg (орално, стаорец) 5 mg/kg (орално, стаоред) 8.5 mg/kg (орално, глушец)[2] |
| NIOSH (здравствени граници во САД): | |
PEL (дозволива)
|
TWA 5 mg/m3[1] |
REL (препорачана)
|
C 5 mg/m3 (4.7 ppm) [10-минути][1] |
IDLH (непосредна опасност)
|
25 mg/m3[1] |
| Безбедносен лист | ICSC 0671 |
| Слични супстанци | |
| Други анјони | Калиум цијанит Калиум тиоцијанат |
| Други катјони | Натриум цијанид Рубидиум цијанид Литиум цијанид Цeзиум цијанид |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Калиум цијанид е соединение со формулата KCN. Оваа безбојна кристална сол, по изглед слична на шеќерот, е многу растворлива во вода. Повеќето KCN се користи во ископувањето на злато, во органски синтези и за галванизација. Помалите употреби вклучуваат при хемиско обложување и печење на накит.[4]
Калиум цијанидот е многу токсичен. Влажната цврста сол од KCN испушта мали количини на водород цијанид поради хидролиза, што може да мириса на горчлив бадем.[5] Сепак, не секој може да намириса цијанид; способноста да се направи тоа е генетска одлика.
Вкусот на калиум цијанид е опишан како остар и горчлив, со чувство на печење[6] слично на лугата.[7]
Производство[уреди | уреди извор]
KCN се произведува со третирање на водород цијанид со воден раствор на калиум хидроксид, проследено со испарување на растворот во вакуум:[8]
Годишно се произведуваат околу 50.000 тони калиум цијанид.[4]
Историско производство[уреди | уреди извор]
Пред 1900 година и пронаоѓањето на Кастнеровиот процес, калиум цијанидот бил најважниот извор на цијаниди од алкални метали.[4] Во овој историски процес, калиум цијанидот бил произведен со распаѓање на калиум фероцијанид:[9]
Структура[уреди | уреди извор]
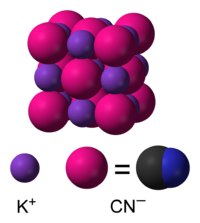
Во воден раствор, KCN дисоцира на хидрирани јони на калиум(K+) и цијанидни јони (CN−). Вообичаената форма на цврст KCN, стабилна на амбиентален притисок и температура, ја има истата кубна кристална структура како и натриум хлоридот, при што секој јон на калиум е опкружен со шест јони на цијанид, и обратно. И покрај тоа што јоните на цијанид се двоатомски, а со тоа и помалку симетрични од хлоридот, тие ротираат толку брзо што нивната форма во просек за време е сферична. При ниска температура и висок притисок, оваа слободна ротација е попречена, што резултира со помалку симетрична кристална структура со цијанидни јони распоредени во листови [10][11]
Aпликација[уреди | уреди извор]
KCN и натриум цијанид (NaCN) широко користени во органската синтеза за подготовка на нитрили и карбоксилни киселини, особено во реакцијата на von Richter. Исто така, наоѓа употреба за синтеза на хидантоини, кои можат да бидат корисни синтетички посредници, кога реагираат со карбонилно соединение како што е алдехид или кетон во присуство на амониум карбонат.
KCN се користи како фотографски фиксатор во процесот на колодиум на влажна плоча.[12] KCN го раствора среброто онаму каде што не станало нерастворливо од развивачот. Ова ја открива и стабилизира сликата, што ја прави повеќе нечувствителна на светлина. Модерните фотографи со влажна плоча можеби претпочитаат помалку токсични фиксатори, често избирајќи натриум тиосулфат, но KCN сè уште се користи
Калиум злато цијанид[уреди | уреди извор]
Во ископувањето злато, KCN формира сол растворлива во вода калиум злато цијанид (или злато калиум цијанид) и калиум хидроксид од метално злато во присуство на кислород (обично од околниот воздух) и вода:
- 4 Au + 8 KCN + O2 + 2 H2O → 4 K[Au(CN)2] + 4 KOH
Сличен процес користи NaCN за производство на натриум злато цијанид (NaAu(CN2)).
Токсичност[уреди | уреди извор]
Калиум цијанидот е моќен инхибитор на клеточното дишење, делувајќи на митохондријалната цитохром c оксидаза, па оттука ја блокира оксидативната фосфорилација. Потоа се јавува млечна ацидоза како последица на анаеробен метаболизам. Првично, акутното труење со цијанид предизвикува црвен или румен тен кај жртвата бидејќи ткивата не се во можност да го користат кислородот во крвта. Ефектите на калиум цијанид и натриум цијанид се идентични, а симптомите на труење обично се јавуваат во рок од неколку минути по внесувањето на супстанцијата: лицето ја губи свеста и на крајот следи мозочна смрт. Во овој период жртвата може да претрпи конвулзии. Смртта е предизвикана од церебрална хипоксија. Очекуваната доза на LD100 (човечка) за калиум цијанид е 200–300 mg додека средната смртоносна доза LD50 се проценува на 140 mg.[13]
Луѓето кои умреле со самоубиство или биле убиени користејќи калиум цијанид се:
- Виктор Мајер, германски хемичар од 19 век, умрел со самоубиство во 1897 година откако земал цијанид[14]
- Густав Вид, дански романсиер, поет и драматург, во 1914 година
- Притилата Вадедар, индиски револуционерен националист, земал цијанид во 1932 година за да избегне фаќање од британската полиција
- Бадал Гупта, револуционер од Бенгал, кој започнал напад врз Зградата на писателите во Калкута, конзумирал цијанид во 1930 година веднаш по нападот
- Волас Каротерс, полимерен хемичар кој умрел со самоубиство во 1937 година, откако со години се борел со депресија
Високи личности во нацистичка Германија, како Ервин Ромел, долгогодишната придружничка на Хитлер, Ева Браун, Џозеф Гебелс, Хајнрих Химлер и Херман Геринг
- Алан Тјуринг, компјутерски научник кој починал од труење со цијанид во 1954 г
- Рамон Сампедро, шпански тетраплегичар и активист чие потпомогнато самоубиство во 1998 година предизвика национална дебата за евтаназијата, и беше тема на филмот награден со Оскар „The Sea Inside“
- Роналд Кларк О'Брајан, оптичар од Тексас кој го уби својот син со врзување на пикси стап со калиум цијанид во 1974 година
- Храмот на народот, секташкото самоубиство од 1978 година во (Џонстаун), Гвајана
- MЧленови на LTTE вклучени во атентатот на индискиот премиер Раџив Ганди во 1991 година
- Џејсон Алтом, перспективен дипломиран студент во лабораторијата на нобеловецот Е.Џ. Кори на Харвард, почина откако испил калиум цијанид во 1998 година.
- Слободан Праљак, воен генерал во Република Хрватска, почина со самоубиство пиејќи од шишенце со калиум цијанид за време на читањето на неговата жалбена пресуда во Хаг за Меѓународниот кривичен трибунал за поранешна Југославија (МКТЈ) на 29 ноември 2017 година.[15]
Професионалните ентомолози го користат како средство за убивање при собирање во тегли, бидејќи инсектите за неколку секунди подлегнуваат на испарувањата од HCN што ги испушта, со што се минимизира штетата дури и на многу кревките примероци.
KCN може најефикасно да се детоксицира со водород пероксид или со раствор од натриум хипохлорит. Таквите раствори треба да се чуваат алкални секогаш кога е можно за да се елиминира можноста за создавање на водород цијанид:[4]
- KCN + H2O2 → KOCN + H2O
Наводи[уреди | уреди извор]
- ↑ 1,0 1,1 1,2 „Џебен водич за опасните хемиски материи #0522“. Национален институт за безбедност и здравје при работа (NIOSH). (англиски)
- ↑ „Cyanides (as CN)“. Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ „POTASSIUM CYANIDE | CAMEO Chemicals | NOAA“.
- ↑ 4,0 4,1 4,2 4,3 Andreas Rubo, Raf Kellens, Jay Reddy, Joshua Wooten, Wolfgang Hasenpusch "Alkali Metal Cyanides" in Ullmann's Encyclopedia of Industrial Chemistry 2006 Wiley-VCH, Weinheim, Germany. doi:10.1002/14356007.i01_i01
- ↑ „Suicide note reveals taste of cyanide“. 2006-07-08.
- ↑ ലേഖകൻ, മാധ്യമം (2021-12-19). „'സയനൈഡ് ചവർപ്പാണ്... പുകച്ചിലാണ്...'; ആ 'രുചി രഹസ്യം' പുറത്തുവിട്ട മലയാളി നടന്ന വഴിയിലൂടെ | Madhyamam“. www.madhyamam.com (малајалски). Посетено на 2021-12-21.
- ↑ „The only taste: Cyanide is acrid“. hindustantimes.com. Hindustan Times. 2006-07-08.
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ Von Wagner, Rudolf (1897). Manual of chemical technology. New York: D. Appleton & Co. стр. 474 & 477.
- ↑ Crystallography Open Database, Structure of KCN
- ↑ H. T. Stokes; D. L. Decker; H. M. Nelson; J. D. Jorgensen (1993). „Structure of potassium cyanide at low temperature and high pressure determined by neutron diffraction“. Physical Review B (Submitted manuscript). 47 (17): 11082–11092. Bibcode:1993PhRvB..4711082S. doi:10.1103/PhysRevB.47.11082. PMID 10005242..
- ↑ J. Towler, MD. "The Silver Sunbeam (Facsimile 1864 edition, 1969)" pg 119
- ↑ John Harris Trestrail III. Criminal Poisoning - Investigational Guide for Law Enforcement, Toxicologists, Forensic Scientists, and Attorneys (2nd edition). p. 119
- ↑ „Top 10 Scientists who Committed Suicide“. 2007-10-07.
- ↑ „War criminal 'took cyanide' in Hague court“ (англиски). BBC News. 2017-12-01. Посетено на 2017-12-01.
Надворешни врски[уреди | уреди извор]
- International Chemical Safety Card 0671
- Hydrogen cyanide and cyanides (CICAD 61)
- National Pollutant Inventory - Cyanide compounds fact sheet
- NIOSH Pocket Guide to Chemical Hazards
- CSST (Canada)
- NIST Standard Reference Database
- Institut national de recherche et de sécurité (1997). "Cyanure de sodium. Cyanure de potassium". Fiche toxicologique n° 111, Paris:INRS, 6pp. (на француски)
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|

