Калиум дихромат

| |

| |
Назив според МСЧПХ Калиум дихромат(VI) | |
| Назнаки | |
|---|---|
| 7778-50-9 | |
| ChEMBL | ChEMBL1374101 |
| ChemSpider | 22910 |
| EC-број | 231-906-6 |
| 3Д-модел (Jmol) | Слика |
| PubChem | 24502 |
| RTECS-бр. | HX7680000 |
| |
| UNII | T4423S18FM |
| ОН-бр. | 3288 |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | црвено-портокалова кристална цврстина |
| Мирис | без мирис |
| Густина | 2.676 g/cm3, solid |
| Точка на топење | |
| Точка на вриење | |
| 4.9 g/100 mL (0 °C) 13 g/100 mL (20 °C) 102 g/100 mL (100 °C) | |
| Растворливост | нерастворлив во алкохол, ацетон. |
| Показател на прекршување (nD) | 1.738 |
| Структура | |
| Кристална структура | Триклиник (α-form, <241.6 °C) |
| Тетрахедрал (за Cr) | |
| Термохемија | |
| Ст. енталпија на формирање ΔfH |
−2033 kJ/mol |
| Стандардна моларна ентропија S |
291.2 J/(K·mol) |
| Специфичен топлински капацитет, C | 219 J/mol[2] |
| Опасност | |
| Безбедност при работа: | |
Главни опасности
|
канцероген,[4] |
| GHS-ознаки: | |
Пиктограми
|
     [3] [3]
|
| NFPA 704 | |
| Температура на запалување | {{{value}}} |
| Смртоносна доза или концентрација: | |
LD50 (средна доза)
|
25 mg/kg (орално, стаорец)[5] |
| Безбедносен лист | ICSC 1371 |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |

Калиум дихромат, со формула K
2Cr
2O
7 — вообичаен неоргански хемиски реагенс, кој најчесто се користи како оксидирачки агенс во различни лабораториски и индустриски цели. Како и кај сите хексавалентни соединенија на хром, тој е акутно и хронично штетен за здравјето. Тоа е кристална јонска цврста материја со многу светла, црвено-портокалова боја. Солта е популарна во лабораторија бидејќи не е деликатна, за разлика од индустриски порелевантната сол натриум дихромат.[6]
Хемија[уреди | уреди извор]
Производство[уреди | уреди извор]
Калиум дихромат обично се подготвува со реакција на калиум хлорид на натриум дихромат. Алтернативно, може да се добие и од калиум хромат со печење на хромитова руда со калиум хидроксид. Растворлив е во вода и во процесот на растворање јонизира:
- K 2 Cr 2 O 7 → 2 К + + Cr2O2−
7 Cr2O2−
7 + H 2 O ⇌ 2 CrO2−
4 CrO2−
4 + 2 H +
Реакција[уреди | уреди извор]
Калиум дихромат е оксидирачки агенс во органската хемија и е поблаг од калиум перманганат. Се користи за оксидација на алкохоли. Ги претвора примарните алкохоли во алдехиди и, под посилни услови, во карбоксилни киселини. Спротивно на тоа, калиум перманганат има тенденција да дава карбоксилни киселини како единствени производи. Секундарните алкохоли се претвораат во кетони. На пример, ментонот може да се подготви со оксидација на ментол со закиселена дихромат. Терциерните алкохоли не можат да се оксидираат.
Во воден раствор, прикажаната промена на бојата може да се користи за тестирање за разликување на алдехидите од кетони. Алдехидите го намалуваат дихроматот од +6 на +3 оксидациона состојба, менувајќи ја бојата од портокалова во зелена. Оваа промена на бојата се јавува затоа што алдехидот може да се оксидира до соодветната карбоксилна киселина. Кетонот нема да покаже таква промена бидејќи не може дополнително да се оксидира, па така растворот ќе остане портокалов.
Кога силно се загрева, се распаѓа со еволуцијата на кислородот.
- K2Cr2O7 + K2CO3 → 2 K2CrO4 + CO2
Кога се додава алкал во портокалово-црвен раствор кој содржи дихромат јони, се добива жолт раствор поради формирање на хромат јони (CrO2−
4). На пример, калиум хромат се произведува индустриски користејќи поташа:
- K2Cr2O7 + 2 H2SO4 → 2 CrO3 + 2 KHSO4 + H2O
Реакцијата е реверзибилна.
Третманот со ладна сулфурна киселина дава црвени кристали на хром анхидрид (хром триоксид, CrO 3):
- K 2 Cr 2 O 7 + 2 H 2 SO 4 → 2 CrO 3 + 2 KHSO <sub id="mwgg">4</sub> + H 2 O
При загревање со концентрирана киселина, кислородот еволуира:
Употреба[уреди | уреди извор]
Калиум дихромат има неколку големи примени, бидејќи натриумовата сол е доминантна индустриски. Главната употреба е како претходник на калиум хром стипса, кој се користи во штавење кожа.[6][7]
Чистење[уреди | уреди извор]
Како и другите соединенија на хром(VI) (хром триоксид, натриум дихромат), калиум дихромат се користи за подготовка на „хромна киселина“ за чистење на стаклени садови и материјали за офорт. Поради загриженоста за безбедноста поврзана со хексавалентен хром, оваа практика во голема мера е прекината.
Градба[уреди | уреди извор]
Се користи како состојка во цементот во кој го успорува стврднувањето на смесата и ја подобрува нејзината густина и текстура. Оваа употреба најчесто предизвикува контактен дерматитис кај градежните работници.[8]
Фотографија и печатење[уреди | уреди извор]
Во 1839 година, Мунго Понтон открил дека хартијата обработена со раствор од калиум дихромат е видливо исончана со изложување на сончева светлина, а промената на бојата останала откако ќе се исплакне калиум дихроматот. Во 1852 година, Хенри Фокс Талбот открил дека изложувањето на ултравиолетова светлина во присуство на калиум дихромат ги стврднува органските колоиди како што се желатин и арапска гума, што ги прави помалку растворливи.
Овие откритија набрзо довеле до јаглероден отпечаток, бихромат на гума за џвакање и други процеси на фотографско печатење засновани на диференцијално стврднување. Вообичаено, по изложувањето, незацврстениот дел бил исплакнат со топла вода, оставајќи тенок релјеф кој или содржел пигмент вклучен во текот на производството или потоа бил обоен со боја. Некои процеси зависеле само од стврднувањето, во комбинација со диференцијалната апсорпција на одредени бои од стврднатите или незацврстените области. Бидејќи некои од овие процеси овозможиле употреба на високо стабилни бои и пигменти, како што е саѓи, може да се направат отпечатоци со екстремно висок степен на архивска трајност и отпорност на избледување од продолжената изложеност на светлина.
Дихромираните колоиди исто така се користеле како фоторезисти во различни индустриски примени, најшироко при создавањето на метални печатарски плочи за употреба во процесите на фотомеханичко печатење.
Интензивирањето на хромот или Photochromos користи калиум дихромат заедно со еднакви делови на концентрирана хлороводородна киселина разредена до приближно 10% v/v за третирање на слаби и тенки негативи на црно-бел фотографски ролни. Овој раствор повторно ги конвертира елементарните сребрени честички во филмот во сребрен хлорид. По темелно миење и изложување на актинична светлина, филмот може повторно да се развие до својата крајна точка со што ќе се добие посилен негатив кој може да произведе позадоволителен отпечаток.
Растворот на калиум дихромат во сулфурна киселина може да се користи за да се добие негативен пресврт (т.е. позитивна транспарентност од негативен филм). Ова се постигнува со развивање на црно-бел филм, но дозволувајќи му на развојот да продолжи повеќе или помалку до крајната точка. Развојот потоа се запира со обилно миење и филмот потоа се третира во раствор на киселински дихромат. Ова го претвора сребрениот метал во сребрен сулфат, соединение кое е нечувствително на светлина. По темелно миење и изложување на актинична светлина, филмот повторно се развива што овозможува претходно неизложениот сребрен халид да се сведе на сребрен метал. Добиените резултати може да бидат непредвидливи, но понекогаш се добиваат одлични резултати при што се добиваат слики кои инаку би биле недостижни. Овој процес може да се поврзе со соларизација, така што крајниот производ наликува на негатив и е погоден за печатење на вообичаен начин.
Cr(VI) соединенијата имаат својство на сончање животински белковини кога се изложени на силна светлина. Овој квалитет се користи при фотографско печатење на екран.
При ситопечатење, фин екран од свила со завртки или сличен материјал се затегнува на рамка слична на начинот на кој се подготвува платното пред сликањето. Колоид сензибилизиран со дихромат се нанесува рамномерно на затегнатиот екран. Откако смесата од дихромат се суши, фотографска позитива со целосна големина е безбедно прикачена на површината на екранот, а целиот состав е изложен на силна светлина - времињата варираат од 3 минути до половина час на силна сончева светлина - стврднувајќи го изложениот колоид. Кога ќе се отстрани позитивата, неизложената смеса на екранот може да се измие со топла вода, оставајќи ја зацврстената смеса недопрена, делувајќи како прецизна маска на саканата шема, која потоа може да се испечати со вообичаениот процес на печатење на екран.
Аналитички реагенс[уреди | уреди извор]
Бидејќи е нехигроскопски, калиум дихромат е вообичаен реагенс во класичните „влажни тестови“ во аналитичката хемија.
Одредување на етанол[уреди | уреди извор]

Концентрацијата на етанол во примерокот може да се одреди со повторна титрација со закиселена калиум дихромат. Со реакција на примерокот со вишок на калиум дихромат, целиот етанол се оксидира до оцетна киселина:
- CH 3 CH 2 OH + 2[O] → CH 3 COOH + H 2 O
Целосна реакција на претворање на етанол во оцетна киселина:
- 3 C 2 H 5 OH + 2 K 2 Cr 2 O 7 + 8 H 2 SO 4 → 3 CH 3 COOH + 2 Cr 2 (SO 4 ) 3 + 2 K 2 SO 4 + 11 H 2 O
Вишокот на дихромат се одредува со титрација против натриум тиосулфат. Со додавање на количината на вишок дихромат од почетната количина, се добива количеството на присутен етанол. Точноста може да се подобри со калибрирање на растворот на дихромат во однос на празно.
Една од главните апликации за оваа реакција е во старите полициски алкотестови. Кога алкохолната пареа ќе дојде до контакт со портокаловите кристали обложени со дихромат, бојата се менува од Cr(VI) портокалова во Cr(III) зелена. Степенот на промена на бојата е директно поврзан со нивото на алкохол во здивот на осомничениот.
Сребрен тест[уреди | уреди извор]
Кога се раствора во приближно 35% раствор на азотна киселина, тој се нарекува Швертеровиот раствор и се користи за тестирање на присуство на различни метали, особено за одредување на чистотата на среброто. Чистото сребро ќе го претвори растворот светло црвено, среброто ќе го претвори темноцрвено, среброто со ниска оценка (0,800) ќе стане кафеаво (во голема мера поради присуството на бакар кој го претвора растворот кафеав) па дури и зелено за 0,500 сребро. Месингот станува темно кафеав, бакарот станува кафеав, оловото и калајот стануваат жолти додека златото и паладиумот не се менуваат.
Тест за сулфур диоксид[уреди | уреди извор]
Хартијата со калиум дихромат може да се користи за тестирање на сулфур диоксид, бидејќи се претвора од портокалово во зелено. Ова е типично за сите редокс реакции каде што шествалентен хром се сведува на тривалентен хром. Затоа, тоа не е убедлив тест за сулфур диоксид. Формираниот финален производ е Cr 2 (SO 4 ) 3 .
Третман на дрво[уреди | уреди извор]
Калиум дихромат се користи за боење на одредени видови дрво со затемнување на танините во дрвото. Создава длабока, богата кафена боја што не може да се постигне со модерни бои. Тоа е особено ефикасен третман за махагони.[9]
Природна појава[уреди | уреди извор]

Калиум дихромат природно се јавува како редок минерал лопезит. Пријавено е само како вуг пломби во нитратните наслаги во пустината Атакама во Чиле и во магматскиот комплекс Бушвелд во Јужна Африка.[10]
Безбедност[уреди | уреди извор]
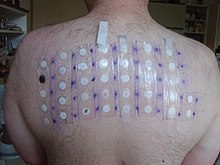
Калиум дихромат е една од најчестите причини за хром дерматитис;[11] хромот е многу веројатно да предизвика сензибилизација што доведува до дерматитис, особено на раката и подлактиците, кој е хроничен и тешко се лекува. Токсиколошките студии дополнително ја илустрирале неговата високо токсична природа. Со зајаци и глодари, концентрации до 14 mg/kg покажале стапка на смртност од 50% меѓу тест групите.[12] Водните организми се особено ранливи доколку се изложени, па затоа се препорачува одговорно отстранување во согласност со локалните еколошки прописи.
Како и со другите Cr(VI) соединенија, калиум дихроматот е канцероген.[13] Соединението е исто така корозивно и изложувањето може да предизвика сериозно оштетување на очите или слепило.[14] Човечката изложеност дополнително ја опфаќа нарушената плодност.
Наводи[уреди | уреди извор]
- ↑ „POTASSIUM DICHROMATE LISTING“ (PDF). US EPA. 2015-07-23.
- ↑ Binnewies, M.; Milke, E. (2002). Thermochemical Data of Elements and Compounds (2. изд.). Weinheim: Wiley-VCH. стр. 405. ISBN 978-3-527-30524-7.
- ↑ Sigma-Aldrich Co., Chromium(VI) oxide. Посетено на 2014-06-15.
- ↑ Like all compounds of hexavalent chromium, potassium dichromate is carcinogenic
- ↑ Chambers, Michael. „ChemIDplus - 7778-50-9 - KMUONIBRACKNSN-UHFFFAOYSA-N - Potassium dichromate - Similar structures search, synonyms, formulas, resource links, and other chemical information“.
- ↑ 6,0 6,1 Gerd Anger, Jost Halstenberg, Klaus Hochgeschwender, Christoph Scherhag, Ulrich Korallus, Herbert Knopf, Peter Schmidt, Manfred Ohlinger, "Chromium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. doi:10.1002/14356007.a07_067
- ↑ M. Saha; C. R. Srinivas; S. D. Shenoy; C. Balachandran (May 1993). „Footwear dermatitis“. Contact Dermatitis. 28 (5): 260–264. doi:10.1111/j.1600-0536.1993.tb03428.x. PMID 8365123.
- ↑ Pekka Roto; Hannele Sainio; Timo Reunala; Pekka Laippala (January 1996). „Addition of ferrous sulfate to cement and risk of chromium dermatitis among construction workers“. Contact Dermatitis. 34 (1): 43–50. doi:10.1111/j.1600-0536.1996.tb02111.x. PMID 8789225.
- ↑ Jewitt, Jeff (1997). Hand-Applied Finishes. Newtown, CT USA: The Taunton Press, Inc. ISBN 978-1-56158-154-2.
- ↑ „Lópezite: Lópezite mineral information and data“.
- ↑ Farokh J. Master (2003). Diseases of Skin. New Delhi: B Jain Pub Pvt Ltd. стр. 223. ISBN 978-81-7021-136-5.
- ↑ „Potassium dichromate MSDS“. Sigma-Aldrich. Посетено на 2011-07-20.
- ↑ IARC (2012) [17-24 March 2009]. Volume 100C: Arsenic, Metals, Fibres, and Dusts (PDF). Lyon: International Agency for Research on Cancer. ISBN 978-92-832-0135-9. Архивирано од изворникот (PDF) на 2020-03-17. Посетено на 2020-01-05.
There is sufficient evidence in humans for the carcinogenicity of chromium (VI) compounds. Chromium (VI) compounds cause cancer of the lung. Also positive associations have been observed between exposure to Chromium (VI) compounds and cancer of the nose and nasal sinuses. There is sufficient evidence in experimental animals for the carcinogenicity of chromium (VI) compounds. Chromium (VI) compounds are carcinogenic to humans (Group 1).
- ↑ „Potassium dichromate MSDS“. JT Baker.
Надворешни врски[уреди | уреди извор]
| „Калиум дихромат“ на Ризницата ? |
- Калиум дихромат на периодична табела на видеа (Универзитет во Нотингем)
- Меѓународна хемиска безбедносна картичка 1371
- Национален инвентар на загадувачи – информативен лист за хром VI и соединенија
- NIOSH Џебен водич за хемиски опасности
- Монографија на IARC „Хром и соединенија на хром“
- Статија за рафинирање на злато што наведува промена на бојата при тестирање на метали со Швертеровото решение Архивирано на 3 април 2018 г.
| ||||||||||||||||||||


