Бариум јодид
| |
Назив според МСЧПХ Бариум јодид | |
Други називи Бариум јодид, анхидриден | |
| Назнаки | |
|---|---|
| 13718-50-8 (анхидриден) 7787-33-9 (дихидрат) 13477-15-1 (хексахидрат) | |
| ChemSpider | 75507 |
| EC-број | 237-276-9 |
| |
| 3Д-модел (Jmol) | Слика Слика |
| PubChem | 83684 |
| |
| UNII | WKC4T7680A |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | Бели орторомбични кристали;(анхидриден) безбојни кристали (дихидрат) |
| Мирис | без мирис |
| Густина | 5.15 g/cm3 (anhydrous) 4.916 g/cm3 (dihydrate) |
| Точка на топење | |
| 166.7 g/100 mL (0 °C) 221 g/100 mL (20 °C) 246.6 g/100 mL (70 °C) | |
| Растворливост | растворлив во етанол, ацетон |
| -124.0·10−6 cm3/mol | |
| Структура | |
| Кристална структура | Орторомбичен, oP12, SpaceGroup = Pnma, No. 62 |
| Термохемија | |
| Ст. енталпија на образување ΔfH |
-602.1 kJ·mol−1 |
| Опасност | |
| Безбедност при работа: | |
Главни опасности
|
toxic |
| Слични супстанци | |
| Други анјони | бариум флуорид бариум хлорид бариум бромид |
| Други катјони | берилиум јодид магензиум јодид калциум јодид стронциум јодид |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Бариум јодид — неорганско соединение со хемиска формула BaI2. Соединението постои во анхидридна и во хидратна форма(BaI2(H2O)2), каде што и двете се бели кристални супстанци. Кога се загрева хидратната сол се претвора во анхидридна сол. Хидратната форма е растворлива во вода, етанол, и ацетон.
Структура
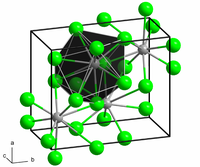
[уреди | уреди извор]Структурата на безводната форма наликува на олово(II) хлорид при што секој Ba центар е врзан за девет јодиди лиганди[2] и има кристална структура на пакување која е доста слична на BaCl2.[3]
Реакции
[уреди | уреди извор]Анхидридната BaI2 може да се подготви со третирање на Ba метал со1,2-дијодоетан во диетил етер.[4]
BaI2 реагира со алкил калиум соединенија за да формира органобариум соединенија.[5]
BaI2 може да биде редуциран со литиум бифенил, за да се добие високо реактивна форма на бариум метал.[6]
Безбедност
[уреди | уреди извор]Како и сите растворливи соли на бариум, бариум јодид е токсичен.
Наводи
[уреди | уреди извор]- ↑ Lide, David R. (1998), Handbook of Chemistry and Physics (87. изд.), Boca Raton, FL: CRC Press, стр. 4–44, ISBN 0-8493-0594-2
- ↑ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- ↑ Brackett, E. B.; Brackett, T. E.; Sass, R. L.; The Crystal Structures of Barium Chloride, Barium Bromide, and Barium Iodide. J. Phys. Chem., 1963, volume 67, 2132 – 2135
- ↑ Duval, E.; Zoltobroda, G.; Langlois, Y.; A new preparation of BaI2: application to (Z)-enol ether synthesis. Tetrahedron Letters, 2000, 41, 337-339
- ↑ Walter, M. D.; Wolmershauser, G.; Sitzmann, H.; Calcium, Strontium, Barium, and Ytterbium Complexes with Cyclooctatetraenyl or Cyclononatetraenyl Ligands. J. Am. Chem. Soc., 2005, 127 (49), 17494 – 17503.
- ↑ Yanagisawa, A.; Habaue, S.; Yasue, K.; Yamamoto, H.; Allylbarium Reagents: Unprecedented Regio- and Stereoselective Allylation Reactions of Carbonyl Compounds. J. Am. Chem. Soc.1994, 116,6130-6141
| ||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
