Галиум монојодид
| Назнаки | |
|---|---|
| 15605-68-2 | |
| ChemSpider | 9138803 |
| |
| 3Д-модел (Jmol) | Слика |
| PubChem | 10963591 |
| |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Галиум монојодид (GaI или Ga4I4) — нисковалентен вид на галиум кој делува како реактивен меѓупроизвод за многу производи базирани на галиум. Галиум(I) халидите први биле кристалографски карактеризирани од Шнекел и неговите соработници [1] и овозможиле синтетички пат до многу нисковалентни видови галиум. Сепак, хемиските синтези кои користат „GaI“ наместо прекурсори на халид на галиум(I) се повеќе се истражуваат со оглед на леснотијата на синтеза на овој реагенс. Додека синтетичкиот метод на Шнекел и неговите соработници за синтетизирање на галиум(I) халиди бара извонредно високи температури, едноставната подготовка на „GaI“ на речиси собна температура овозможило истражување на нови хемии базирани на галиум.
Синтеза
[уреди | уреди извор]
Во 1990 година, Малколм Грин и неговите соработниците синтетизирале вид „GaI“, чиј метод на подготовка најмногу се следи.[3] Тие откриле дека ултразвукот на течен галиум метал со јод во толуен растворувач дава нов бледо зелен прав што тие го нарекле „GaI“. Иако овој посредник бил релативно едноставен за синтеза, хемискиот состав на „GaI“ не бил утврден до почетокот на до средината на2010-тите.
Во2012 година, било утврдено дека бледозелениот прав GaI е комбинација од различни видови базирани на галиум.[4] Во2012 година, Видифилд и соработниците утврдиле дека „GaI“ синтетизиран од целосната реакција на галиум метал со јод има хемиски состав [Ga 0] 2 [Ga +][GaI 4 −].[4] Меѓутоа, во2014 година, Малбрехт и соработниците откриле во малку контрадикторна студија дека нецелосната реакција на металот галиум со јод дава „GaI“ со овој хемиски состав. „GaI“ синтетизиран со подолго време на реакција за целосна реакција имал различен хемиски состав [Ga 0] 2 [Ga +] 2 [Ga 2 I 6 2-].[2] Бидејќи различни варијанти на "GaI" можат да пристапат до различни видови хемиски реактивности, овие контрадикторни резултати поддржуваат дека хемискиот состав на "GaI" мора да се потврди за секој препарат пред понатамошно експериментирање.
Шема на подготовката користена од Малбрехт и соработниците за пристап до различни композиции „GaI“ е прикажана погоре. Сите варијанти биле сунифицирани за времето наведено во толуен на 30 ˚C.[2][3] Откриено е дека добиениот прашок „GaI“ е многу чувствителен на воздух, но стабилен под услови на инертна атмосфера до една година на -35 ˚C.[2]
Карактеризација
[уреди | уреди извор]Составот на „GaI“ е испитан со спектроскопија FT-Раман, дифракција на рендгенски зраци во прав, 69/71 Ga цврста NMR спектроскопија и 127 I јадрена четириполна резонанца (NQR).[2][4][5] M. Вилкинсон и Ворал кои синтетизирале „GaI“ вид преку различен препарат во 1975 година, утврдиле дека „GaI“ е веројатно комбинација од галиум(0) метал, Ga2I3 и Ga2I4 врз основа на одликата Рамановите спектри на овие состојки.[5] Оваа хипотеза била потврдена бидејќи две варијанти на „GaI“ биле утврдени дека имаат хемиски состав [Ga0]2 [Ga+][GaI4−] и [Ga0]2 [Ga+]2 [Ga2I62-], каде што [Ga+][GaI4−] може да се изрази и како Ga2I4 или GaI2 и [Ga+]2 [Ga2I62-] може да се изрази и како Ga2I3.[2][4]
[Ga0]2 [Ga][GaI4−]
[уреди | уреди извор]Кога се испитува со 69/71 Ga NMR спектроскопија во цврста состојба, „GaI“ со хемиски состав [Ga0]2 [Ga+[GaI 4 −] има високо оклопен сигнал на δ iso = 4488,1 (0,3) ppm без значајна тензор за интеракција на галиум четирипол (QI). Ова е претставник на течен галиум(0) метал наместо цврст галиум(0) метал.[4] Кога биле испитани со 127 I NQR, забележани се четири врвови на 113,69, 132,04, 134,39 и 163,71 MHz.[2] Хемиските поместувања се усогласуваат со референца Ga2I4 [6] и дополнително ја бранат задачата [Ga0]2 [Ga +][GaI 4−]. Рамановата спектроскопија исто така ја потврдила оваа задача на составот со вибрациони фреквенции идентификувани на 141 (силна),230 (слаба) и 85 (слаба) cm −1 .[2] Додека овие фреквенции се совпаѓаат со референцата за Ga 2 I 4,[7] тие исто така се преклопуваат со GaI 3 наводот.[2] Меѓутоа, со оглед на обликот на спектрите, доказите од другите спектроскопски методи и шемите на дифракција на моќните рендгенски зраци, доделувањето на [Ga0]2 [Ga +][GaI 4 −] за оваа „GaI“ варијанта била потврдена.
[Ga0]2 [Ga+] 2 [Ga2I62-]
[уреди | уреди извор]Кога биле испитани со 127 I NQR, забележани се три врвови на 106,35, 107,83 и 123,54 MHz, кои се усогласуваат со задачата за Ga2I3.[2] Рамановата спектроскопија исто така ја потврдила оваа задача со вибрациони фреквенции на 124 (силна),292 (слаба) и 188 (слаба) cm −1 .[2] Овие фреквенции се усогласуваат со оние од референцата Ga 4 I 6 .[7] Конечно, моќната дифракција на рендген поддржува дека оваа „GaI“ варијанта се совпаѓа со онаа на карактеристичниот Ga 2 I 3, што е различно од онаа на GaI 2 .[2]
69/71 Ga SSNMR на "GaI"
[уреди | уреди извор]Имало некои спротивставени извештаи во толкувањето на 69/71 Ga солидна состојба NMR спектрите на двете „GaI“ варијанти. Едно толкување е дека сигналот на δ iso = -424(5) ppm со ненулти QI тензор е карактеристичен за искривена тетраедрална [GaI 4 −] состојка.[4] Така, овој спектра би бранел [Ga 0] 2 [Ga +][GaI 4 −] задача. Сепак, друго откритие покажува дека овој сигнал на δ iso = -425 (3) се гледа во врска со друг врв на δ iso = 15 (5) ppm. Во овој случај, врвот на δ iso = -425(3) може да одговара на Ga + како што се гледа во GaI 2, а δ iso = 15 (5) ppm може да одговара на [Ga 2 I 6 2-].[2] Така, овој спектра би можел да брани и задача [Ga 0] 2 [Ga +] 2 [Ga 2 I 6 2-]. Овие различни толкувања сугерираат дека 69/71 Ga во цврста состојба NMR нема да може дефинитивно да додели специфичен хемиски состав на варијантата „GaI“. 69/71 Ga NMR во цврста состојба треба да се анализира заедно со други спектроскопски мерења за да се направат овие задачи робусни.
Важно е да се забележи дека бидејќи [Ga0]2 [Ga +][GaI4−] може да се претвори во [Ga0] 2 [Ga +] 2 [Ga 2 I 6 2-] со текот на времето [2] хемискиот состав на „GaI“ треба да се потврди за производи до кои може да се пристапи само со една варијанта „GaI“.
Реактивност
[уреди | уреди извор]Иако постои одредено несовпаѓање со тоа како се добиваат овие различни „GaI“ варијанти (т.е. должина на реакција, температура на реакција, време на деградација), фактот што може да се пристапи до две различни „GaI“ варијанти обезбедува одреден увид во тоа како толку широк опсегот на реактивности може да се пристапи преку „GaI“.
„GaI“ се користи како претходник за различни реакции. На почетокот, се покажало дека „GaI“ пристапува до алкилгалиум дијодиди преку оксидативно додавање со реакција на течен галиум метал и јод во присуство на алкил јодид, RI.[1][3][8] Оттогаш, се пристапило кон други органогалиумски комплекси, како и до адукти на Луисовите бази и кластери базирани на галиум.[8] Некои од овие хемии се подетално објаснети подолу.
Га Луис база адукти
[уреди | уреди извор]
„GaI“ може да реагира со широк опсег на монодентатни Луисови киселини и бази за да формира Ga(II), Ga(III) или мешани валентни видови, како и димери и тримери базирани на галиум. На пример, „GaI“ може да реагира со примарни, секундарни и терциерни амини, секундарни или терциерни фосфини или етери за да формира Ga(II)-Ga(II) димери.[3][8][10] „GaI“ може да реагира и со PPh 3 за да формира Ga(III)I 3 PPh 3 комплекс.[3] Исто така, може да реагира со помалку стерично оптоварени PEt 3 лиганд за да формира Ga(II)-Ga(I)-Ga(II) мешан валентен комплекс со дативно координирани PEt 3 лиганди.[8][10] Додека точниот состав на почетниот материјал „GaI“ од кој се добиени овие адукти е неизвесен, се верува дека овие реакции се случуваат преку несразмерност со оглед на тоа што цврстиот Ga метал се депонира при реакцијата.[9]
Кога „GaI“ реагира со SbPh 3 во слични услови на реакција како со лигандот PPh 3, набљудуваме фрагмент SbPh 3 дативно поврзан со фрагмент GaPhI2.[11] Разликата во реактивноста помеѓу PPh 3 и SbPh3, тежок атом аналог на PPh3, може да се припише на послаба Sb-C врска, што овозможува пренос на фенилна група од антимон во галиум. Ова сугерира дека „GaI“ може да се користи и како средство за намалување.[8][11]

Кога N-хетероцикличните карбени реагирале со "GaI", било прикажано само стерички оптоварениот IPr лиганд за да формира адукт на Луисовиата база.[9] Сепак, како што е опишано подолу, се покажало дека "GaI" реагира со диазабутадиени и последователно редуцирање со калиум метал за да формира Ga аналози на NHCs.[8] Други карбени базирани на Ga може да се пристапат од прекурсор „GaI“ користејќи Li[nacnac].[8]
Додека монодентатните Луисови бази формираат Ga адукти кои пристапуваат до широк опсег на состојби на оксидација на Ga, кога „GaI“ реагира со мултидентатни Луисови бази, претежно се формираат Ga(III) комплекси. Оваа реактивност е испитана со бипиридин (бипи), фенил-терпиридин (Фтерпи) и бис(имино)пиридин (бимпи) лиганди, од кои сите дадоа Ga(III) комплекси.[8][12] Кристалографски, се покажало дека дериватот бипи прифаќа искривена октаедрална геометрија, со должина на Ga-N врска од2,063 Å. Дериватот прифаќа искривена тригонална бипирамидална геометрија каде што двете екваторијални Ga-N врски (како што се нацртани) се подолги од аксијалната Ga-N врска, со должини на врската2,104 Å и2,007 (5) Å соодветно. Просечната должина на врската Ga-N (2,071 Å) се покажала дека е слична на онаа на неутрален GaCl 3 (terpy) Луисов базен адукт (2,086 Å).[13] Бимпискиот дериват е опишан како со искривена пирамидална геометрија базирана на квадрат. Како и за дериватот Phterpy, екваторијалните имино Ga-N врски (2,203 Å) беа пронајдени дека се подолги од аксијалната пиридилна Ga-N врска (2,014 (7) A˚).[12] И покрај овие слични реактивности и одлики на врската, кога „GaI“ бил реагирано со имино-супституирани пиридини (RN=C(H)Py), била забележана единствена реактивност. Редуктивното спојување на имино-супституираните пиридини формираше комплекси на диамидо-дигалиум (III).[12] Таквата реактивност укажува на корисноста на прекурсорите „GaI“ во органската синтеза, со оглед на формирањето на нови CC врски.

Ga хетероцикли
[уреди | уреди извор]„GaI“ може да се користи и како претходник за формирање на хетероцикли базирани на галиум. Реакциите со диазабутадиените, {RN=C(H)} 2, можат да формираат мономери или димери врз основа на супституентите на диазабутадиените. Постерично попречените супституенти како што е Bu t резултирале со формирање на Ga(II) димери, додека реакциите со алкил или арил супституирани диазабутадиени формираа Ga(III) мономери.[8] Два еквиваленти на "GaI" можат да се реагираат со фенил-супституирани 1,4-диазабута-1,3-диени за да се формира Ga хетероцикл со моноанјон на диазабутадиен.[14] Спектроскопијата на EPR открила дека фрагментот на диазабутадиен е парамагнетен моноанјонски вид наместо ен-дијамидо дианион или неутрален лиганд.[14] Така, „GaI“ се подложува на реакција на диспропорционалност за да формира Ga(III) комплекс со таложење на Ga(0) метал.[8][14] По понатамошна реакција со 1,4-дилитиран диазабутадиен, овој Ga хетероцикл формира нов комплекс со дативно врзан фрагмент од моноанион на диазабутадиен (должини на врската Ga-N 1,9678(13) Å) со центарот Ga и ковалентна врска ен-дијамидо дианион (Должини на врската Ga-N 1,8831(13) Å) до центарот Ga.[14] Геометријата за центарот Га сугерира дека електроните во двата диазабутадиенски системи не се делокализираат низ целиот комплекс.
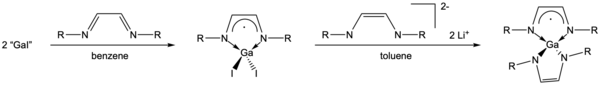
Една многу важна реактивност на овој Ga(III) хетероцикл е неговата способност да пристапи до галиумските аналози на N-хетероцикличните карбени при редукција со калиум метал.[15] Иако претходно бил синтетизиран галиумски аналог на N-хетероциклични карбени,[16] имајќи пристап до потешки аналози на N-хетероцилни карбени од синтетички полесната патека „GaI“ отворил нови патишта во координативната хемија, како што е пристапот до новиот Ga -М.[17][18][19]
„GaI“ може да се користи и за пристап до шестчлени Ga(I) хетероцикли кои имаат паралели со галиумските аналози на N-хетероцикличните карбени. Овие неутрални Ga(I) хетероцикли може да се синтетизираат со реакција на „GaI“ и Li[nacnac].[18][20]
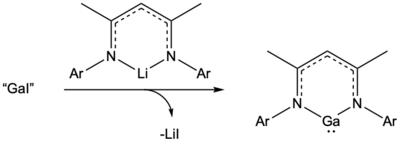
GaCp и GaCp*
[уреди | уреди извор]Друга интересна реакција со „GaI“ е полесниот пристап до комплексите со полусендвич, GaCp* и GaCp. Шнекел прв пристапил до хексамерниот GaCp* користејќи синтетички потешки правци.[21] Сепак, Јуци и соработниците покажале дека GaCp*, многу употребуван лиганд за комплекси на преодни метали, може да се пристапи поедноставно со реакција на „GaI“ со калиумова сол на саканиот лиганд.[22] За да се избегнат страничните производи на бензил јодид, и "GaI" и лигандот GaCp* се синтетизирани во бензен наместо во толуен.[8][22] Користејќи ја оваа методологија, и Cp*Ga и (C 5 Me 4 Et)Ga се чисто синтетизирани под попрактични услови на реакција.
Понатаму, Шенк и соработниците покажале дека GaCp, кој е помалку стерично попречен од GaCp*, може да се пристапи и со помош на „GaI“ претходник. Овој лиганд може да се синтетизира со реакција на метатеза на NaCp со „GaI“.[23] Овој GaCp лиганд се користи за пристап до комплекс GaCp 2 I со дативно врзан GaCp. Овој комплекс покажува невообичаена врска донор-акцептор Ga-Ga. GaCp може да се користи и за пристап до комплекс на Луисовата киселина B(C<sub id="mwAY0">6</sub>F<sub id="mwAY4">5</sub>)<sub id="mwAY8">3</sub> со дативно врзан GaCp.[23] За двата од овие два комплекса, аналозите GaCp* се синтетизирани, а кристалографијата со рендген потврди дека, како што се очекувало, GaCp* е малку посилен донатор од GaCp.
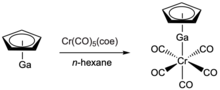
Како и GaCp*, GaCp може да се координира и со комплекси на преодни метали како што се Cr(CO) 5 (циклооктен) или Co2 (CO) 8 за да се добие CpGa–Cr(CO) 5 или (thf)GaCp{Co(CO) 4}2.[24] За CpGa–Cr(CO) 5, должината на врската Ga-Cr (239,6 pm) е слична на онаа за аналогот GaCp* (240,5 pm). За овој комплекс, транс ефектот е исто така забележан, каде што Cr-CO врската транс со лигандот GaCp се собира (186 pm) во однос на cis Cr-CO врските (189,5 pm). Додека GaCp може да дејствува како терминален лиганд сличен на GaCp*, било утврдено дека аналозите на GaCp реагираат побрзо од нивните колеги GaCp*. Ова може да се припише на долниот стеричен дел од GaCp, а Наглав и соработниците сугерираат дека работата на пониски температури може да помогне да се пристапи до стабилни комплекси со лиганди на GaCp.[24]
За разлика од реактивноста со Cr(CO) 5 (циклооктен), реактивноста на GaCp* и GaCp со Co 2 (CO) 8 значително се разликуваат.[24] Дикобалт октакарбонил, или Co2 (CO)8, постои во различни изомерни состојби. Еден таков изомер содржи два премостувачки CO лиганди. Кога GaCp* реагира со Co2 (CO)8, се ослободуваат два еквиваленти на CO гас, формирајќи (CO) 3 Co[ μ 2 -( η 5 -GaCp*)] 2 -Co(CO)3. Ова е дериват на дикобалт октакарбонилниот комплекс каде премостувачките делови на CO се заменуваат со премостувачките делови на GaCp*.[25] Од друга страна, GaCp овозможува оксидативно додавање на Co 2 (CO) 8 да формира (thf)GaCp{Co(CO)4}2, каде што галиумот има сигма интеракции со две Co(CO) 4 единици. Просечната должина на Ga-Co врската е248,5 pm, а галиумот е во формално +3 оксидациона состојба во овој нов комплекс.[25] Севкупно, јасната синтеза на GaCp од претходник „GaI“ има многу заслуги во проширувањето на опсегот на хемијата на преодните метали со видови со пониска валентни видови.
Галиумски кластери
[уреди | уреди извор]
Различни кластери на галиум се исто така синтетизирани од претходник „GaI“. Многу кластери базирани на галиум се претходно синтетизирани од прекурсори на GaX, како што биле подготвени од Шнекел и соработниците.[28] Сепак, подготвени се и нови кластери со полесно достапниот почетен материјал „GaI“. Овие кластери честопати биле изолирани како соли со гломазни силил или гермилски анјони, како што е [Si(SiMe3) 3] - .[8] Пример за изолирано галиумско јато е [Ga 9 {Si(SiMe 3 ) 3 } 6] −, која има пентагонална бипирамидална полиедарна структура. Се синтетизира со реакција на „GaI“ со Li(thf) 3 Si (SiMe 3)3 во толуен на -78 ˚C.[8][27] Се покажало дека оваа реакција има пристап до широк спектар на производи, што може да се припише на широкиот опсег на „GaI“ композиции кои потоа биле испитани од Малбрехт и соработниците. Од овие производи, [Ga 9 {Si(SiMe 3 ) 3 } 6] − е особено уникатен затоа што било откриено дека Ga има многу ниска просечна оксидациска состојба (0,56) и исто така затоа што овој кластер има помалку R супституенти од полиедарските темиња.[27] Други кластери кои биле изолирани преку слични патеки на реакција вклучуваат [Ga 10 {Si(SiMe 3 ) 3 } 6], што е конјункто- полиедрален кластер и анјон -силаттрагалан, кој содржи три2-електрон-2-центар и три 2-електронски-3-централни врски.[8][26][29] Интересно е што овој последен вид може да се синтетизира само кога се користат суб-стехиометриски количества од I2 за пристап до „Ga 2 I 3 “ меѓу видот.[26] Ова е еквивалентно на реакцијата на течен галиум метал и јод на претходно завршување, што, како што е објаснето погоре, пристапува до [Ga0] 2 [Ga +] 2 [Ga 2 I 6 2-] варијантата на „GaI“. Ова ја нагласува разновидноста на претходникот „GaI“ во пристапот до широк опсег на комплекси базирани на галиум.
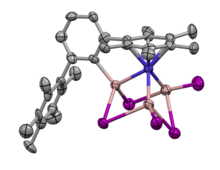
„GaI“ може да формира и соединенија од типот на кластер со прекурсори на преодни метали. Еден пример е реакцијата помеѓу „GaI“ и (2,6-Pmp 2 C 6 H 3 ) 2 Co, (Pmp = C 6 Me 5 ), што дава кластер од нидо-тип.[30] Оваа молекула е опишана како слична на кубана, каде што аглите се метални и премостуваат атоми на јод, а еден агол е отстранет. Ова е особено уникатен кластер Co-GaI поради неговата необична геометрија за соединенија на преодни метали кои содржат атоми од тешка група 13, како што е галиумот. Критичните точки и патеките на врската, како што се пресметани со QTAIM анализата, поддржуваат дека додека има Co-Ga обврзници, нема Ga-Ga обврзници.[30]

„GaI“ успева да формира кластери со атоми на тешко злато со тоа што делува како редукционен реагенс кога се комбинира со GaCp* и LAuX (т.е. AuI (PPh 3 ) или AuCl (PPh 3 )).[8][32] Овој кластер ги содржел првите кристалографски потврдени Ga-Au. Врз основа на критичните точки на врската на врските Ga-Au и Au-Au на овој кластер, како и NBO анализата на атомските полнежи, било утврдено дека овој кластер најдобро може да се опише како кластер Au3 поврзан со Ga лиганди. Покрај тоа, NBO анализата покажала дека полнењето на галиумите во GaCp* лигандите е многу повисоко од полнењето на атомите на Au и полнењето на атомите на галиум во мотивите GaI2. Ова сугерира дека непремостувачките Ga-Au врски се високо поларизирани, додека μ-премостувачките Ga-Au врски се понеполарно ковалентни по карактер.[32] Иако хемијата на кластерот на галиум е детално истражена, можноста да се пристапи до кластери со прекурсорот „GaI“ може да овозможи откривање на нови видови до кои не може да се пристапи од други прекурсори на GaX.

Наводи
[уреди | уреди извор]- ↑ 1,0 1,1 Dohmeier, Carsten; Loos, Dagmar; Schnöckel, Hansgeorg (1996). „Aluminum(I) and Gallium(I) Compounds: Syntheses, Structures, and Reactions“. Angewandte Chemie International Edition in English (англиски). 35 (2): 129–149. doi:10.1002/anie.199601291. ISSN 1521-3773.
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 2,10 2,11 2,12 2,13 Malbrecht, Brian J.; Dube, Jonathan W.; Willans, Mathew J.; Ragogna, Paul J. (2014-09-15). „Addressing the Chemical Sorcery of "GaI": Benefits of Solid-State Analysis Aiding in the Synthesis of P→Ga Coordination Compounds“. Inorganic Chemistry. 53 (18): 9644–9656. doi:10.1021/ic501139w. ISSN 0020-1669. PMID 25184621.
- ↑ 3,0 3,1 3,2 3,3 3,4 Green, Malcolm L. H.; Mountford, Philip; Smout, Geoffrey J.; Speel, S. Robert (1990-01-01). „New synthetic pathways into the organometallic chemistry of gallium“. Polyhedron (англиски). 9 (22): 2763–2765. doi:10.1016/S0277-5387(00)86809-6. ISSN 0277-5387.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 Widdifield, Cory M.; Jurca, Titel; Richeson, Darrin S.; Bryce, David L. (2012-03-16). „Using 69/71Ga solid-state NMR and 127I NQR as probes to elucidate the composition of "GaI"“. Polyhedron (англиски). 35 (1): 96–100. doi:10.1016/j.poly.2012.01.003. ISSN 0277-5387.
- ↑ 5,0 5,1 Wilkinson, M.; Worrall, I. J. (1975-07-01). „Synthesis of alkylgallium diiodides“. Journal of Organometallic Chemistry (англиски). 93 (1): 39–42. doi:10.1016/S0022-328X(00)94142-1. ISSN 0022-328X.
- ↑ Okuda, Tsutomu; Hamamoto, Hiroshi; Ishihara, Hideta; Negita, Hisao (1985-09-01). „79Br and 127I Nuclear Quadrupole Resonance of Mixed Valency Compounds Ga2X4(X=Br, I)“. Bulletin of the Chemical Society of Japan. 58 (9): 2731–2732. doi:10.1246/bcsj.58.2731. ISSN 0009-2673.
- ↑ 7,0 7,1 Beamish, J. C.; Wilkinson, M.; Worrall, I. J. (1978-07-01). „Facile synthesis of the lower valent halides of gallium, Ga2X4 (X = chloride, bromide, iodide) and tetragallium hexaiodide“. Inorganic Chemistry. 17 (7): 2026–2027. doi:10.1021/ic50185a069. ISSN 0020-1669.
- ↑ 8,00 8,01 8,02 8,03 8,04 8,05 8,06 8,07 8,08 8,09 8,10 8,11 8,12 8,13 8,14 8,15 8,16 8,17 Baker, Robert J.; Jones, Cameron (2005-04-11). „"GaI": A versatile reagent for the synthetic chemist“. Dalton Transactions (англиски) (8): 1341–1348. doi:10.1039/B501310K. ISSN 1477-9234. PMID 15824768.
|hdl-access=бара|hdl=(help) - ↑ 9,0 9,1 9,2 9,3 Baker, Robert J.; Bettentrup, Helga; Jones, Cameron (2003). „The Reactivity of Primary and Secondary Amines, Secondary Phosphanes and N-Heterocyclic Carbenes towards Group-13 Metal(I) Halides“. European Journal of Inorganic Chemistry (англиски). 2003 (13): 2446–2451. doi:10.1002/ejic.200300068. ISSN 1099-0682.
- ↑ 10,0 10,1 Schnepf, Andreas; Doriat, Clemens (1997-01-01). „A simple synthesis for donor-stabilized Ga2I4 and Ga3I5 species and the X-ray crystal structure of Ga3I5·3PEt3“. Chemical Communications (англиски) (21): 2111–2112. doi:10.1039/A703776G. ISSN 1364-548X.
- ↑ 11,0 11,1 Cameron Jones; Christian Schulten; Andreas Stasch (2005-04-01). „[Gal2Ph(SbPh3)]: A Rare Tertiary Stibane-Gallium Complex Formed via a Reductive Sb-C Bond Cleavage Reaction“. Main Group Metal Chemistry (англиски). 28 (2): 89–92. doi:10.1515/MGMC.2005.28.2.89. ISSN 0792-1241.
- ↑ 12,0 12,1 12,2 12,3 Baker, Robert J.; Jones, Cameron; Kloth, Marc; Mills, David P. (2004-02-03). „The reactivity of gallium(I) and indium(I) halides towards bipyridines, terpyridines, imino-substituted pyridines and bis(imino)acenaphthenes“. New Journal of Chemistry (англиски). 28 (2): 207–213. doi:10.1039/B310592J. ISSN 1369-9261.
- ↑ Beran, G.; Carty, A. J.; Patel, H. A.; Palenik, Gus J. (1970-01-01). „A trans-effect in gallium complexes: the crystal structure of trichloro-(2,2′,2"-terpyridyl)gallium(III)“. Journal of the Chemical Society D: Chemical Communications (англиски) (4): 222–223. doi:10.1039/C29700000222. ISSN 0577-6171.
- ↑ 14,0 14,1 14,2 14,3 14,4 Pott, Thomas; Jutzi, Peter; Kaim, Wolfgang; Schoeller, Wolfgang W.; Neumann, Beate; Stammler, Anja; Stammler, Hans-Georg; Wanner, Matthias (July2002). „Reactivity of "GaI" TowardN-Substituted 1,4-Diazabuta-1,3-dienes: Synthesis and Characterization of Gallium Heterocycles Containing Paramagnetic Diazabutadiene Monoanions“. Organometallics. 21 (15): 3169–3172. doi:10.1021/om0200510. ISSN 0276-7333. Проверете ги датумските вредности во:
|date=(help) - ↑ Baker, Robert J.; Farley, Robert D.; Jones, Cameron; Kloth, Marc; Murphy, Damien M. (2002-10-03). „The reactivity of diazabutadienes toward low oxidation state Group 13 iodides and the synthesis of a new gallium(I) carbene analogue“. Journal of the Chemical Society, Dalton Transactions (англиски) (20): 3844–3850. doi:10.1039/B206605J. ISSN 1364-5447.
- ↑ Schmidt, Eva S.; Jockisch, Alexander; Schmidbaur, Hubert (1999-10-01). „A Carbene Analogue with Low-Valent Gallium as a Heteroatom in a quasi-Aromatic Imidazolate Anion“. Journal of the American Chemical Society. 121 (41): 9758–9759. doi:10.1021/ja9928780. ISSN 0002-7863.
- ↑ Baker, Robert J.; Jones, Cameron; Mills, David P.; Murphy, Damien M.; Hey-Hawkins, Evamarie; Wolf, Robert (2006-12-14). „The reactivity of gallium-(I), -(II) and -(III) heterocycles towards Group 15 substrates: attempts to prepare gallium–terminal pnictinidene complexes“. Dalton Transactions (англиски) (1): 64–72. doi:10.1039/B511451A. ISSN 1477-9234. PMID 16357962.
- ↑ 18,0 18,1 18,2 Baker, Robert J.; Jones, Cameron (2005-09-01). „The coordination chemistry and reactivity of group 13 metal(I) heterocycles“. Coordination Chemistry Reviews. 36th International Conference on Coordination Chemistry, Merida, Mexico, July2004 (англиски). 249 (17): 1857–1869. doi:10.1016/j.ccr.2004.12.016. ISSN 0010-8545.
- ↑ Jones, Cameron; Rose, Richard P.; Stasch, Andreas (2007-07-10). „Synthesis and characterisation of zinc gallyl complexes: First structural elucidations of Zn–Ga bonds“. Dalton Transactions (англиски) (28): 2997–2999. doi:10.1039/B706402K. ISSN 1477-9234. PMID 17622416.
- ↑ 20,0 20,1 Hardman, Ned J.; Eichler, Barrett E.; Power, Philip P. (2000-01-01). „Synthesis and characterization of the monomer Ga{(NDippCMe)2CH} (Dipp = C6H3Pri2-2,6): a low valent gallium(I) carbene analogue“. Chemical Communications (англиски) (20): 1991–1992. doi:10.1039/B005686N. ISSN 1364-548X.
- ↑ Loos, Dagmar; Baum, Elke; Ecker, Achim; Schnöckel, Hansgeorg; Downs, Anthony J. (1997). „Hexameric Aggregates in Crystalline (Pentamethylcyclopentadienyl)gallium(I) at200 K“. Angewandte Chemie International Edition in English. 36 (8): 860–862. doi:10.1002/anie.199708601. ISSN 1521-3773.
- ↑ 22,0 22,1 Jutzi, Peter; Schebaum, Lars Oliver (2002-07-15). „A novel synthetic route to pentaalkylcyclopentadienylgallium(I) compounds“. Journal of Organometallic Chemistry (англиски). 654 (1): 176–179. doi:10.1016/S0022-328X(02)01429-8. ISSN 0022-328X.
- ↑ 23,0 23,1 Schenk, Christian; Köppe, Ralf; Schnöckel, Hansgeorg; Schnepf, Andreas (2011). „A Convenient Synthesis of Cyclopentadienylgallium – The Awakening of a Sleeping Beauty in Organometallic Chemistry“. European Journal of Inorganic Chemistry (англиски). 2011 (25): 3681–3685. doi:10.1002/ejic.201100672. ISSN 1099-0682.
- ↑ 24,0 24,1 24,2 24,3 Naglav, Dominik; Tobey, Briac; Schnepf, Andreas (2013). „Application of GaCp as a Ligand in Coordination Chemistry: Similarities and Differences to GaCp*“. European Journal of Inorganic Chemistry (англиски). 2013 (24): 4146–4149. doi:10.1002/ejic.201300401. ISSN 1099-0682.
- ↑ 25,0 25,1 Jutzi, Peter; Neumann, Beate; Reumann, Guido; Stammler, Hans-Georg (1998-03-01). „Pentamethylcyclopentadienylgallium (Cp*Ga): Alternative Synthesis and Application as a Terminal and Bridging Ligand in the Chemistry of Chromium, Iron, Cobalt, and Nickel“. Organometallics. 17 (7): 1305–1314. doi:10.1021/om970913a. ISSN 0276-7333.
- ↑ 26,0 26,1 26,2 Linti, Gerald; Köstler, Wolfgang; Piotrowski, Holger; Rodig, Alexander (1998). „A Silatetragallane—Classical Heterobicyclopentane or closo-Polyhedron?“. Angewandte Chemie International Edition (англиски). 37 (16): 2209–2211. doi:10.1002/(SICI)1521-3773(19980904)37:16<2209::AID-ANIE2209>3.0.CO;2-3. ISSN 1521-3773. PMID 29711437.
- ↑ 27,0 27,1 27,2 Köstler, Wolfgang; Linti, Gerald (1997). „Synthesis and Structure of a Tetragallane [R4Ga4I3]− and a Polyhedral Nonagallane [R6Ga9]“. Angewandte Chemie International Edition in English. 36 (23): 2644–2646. doi:10.1002/anie.199726441. ISSN 1521-3773.
- ↑ Schnepf, Andreas; Schnöckel, Hansgeorg (2002). „Metalloid Aluminum and Gallium Clusters: Element Modifications on the Molecular Scale?“. Angewandte Chemie International Edition (англиски). 41 (19): 3532–3554. doi:10.1002/1521-3773(20021004)41:19<3532::AID-ANIE3532>3.0.CO;2-4. ISSN 1521-3773. PMID 12370894.
- ↑ Kehrwald, Michael; Köstler, Wolfgang; Rodig, Alexander; Linti, Gerald; Blank, Thomas; Wiberg, Nils (2001-03-01). „Ga10[Si(SiMe3)3]6, [Ga10(SitBu3)6]-, and [Ga13(SitBu3)6]-Syntheses and Structural Characterization of Novel Gallium Cluster Compounds“. Organometallics. 20 (5): 860–867. doi:10.1021/om000703p. ISSN 0276-7333.
- ↑ 30,0 30,1 30,2 30,3 Blundell, Toby J.; Taylor, Laurence J.; Valentine, Andrew J.; Lewis, William; Blake, Alexander J.; McMaster, Jonathan; Kays, Deborah L. (2020-07-21). „A transition metal–gallium cluster formed via insertion of "GaI"“. Chemical Communications (англиски). 56 (58): 8139–8142. doi:10.1039/D0CC03559A. ISSN 1364-548X. PMID 32691803.
- ↑ Lu, Tian; Chen, Feiwu (2012). „Multiwfn: A multifunctional wavefunction analyzer“. Journal of Computational Chemistry (англиски). 33 (5): 580–592. doi:10.1002/jcc.22885. ISSN 1096-987X. PMID 22162017.
- ↑ 32,0 32,1 32,2 Anandhi, U.; Sharp, Paul R. (2004). „A Gallium-Coated Gold Cluster“. Angewandte Chemie International Edition. 43 (45): 6128–6131. doi:10.1002/anie.200461295. ISSN 1521-3773. PMID 15549757.
| ||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
