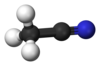
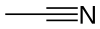Ацетонитрил
| |||
| |||
| Систематско име | Етаннитрил[1] | ||
| Назнаки | |||
|---|---|---|---|
| 75-05-8 | |||
| Бајлштајн | 741857 | ||
| ChEBI | CHEBI:38472 | ||
| ChEMBL | ChEMBL45211 | ||
| ChemSpider | 6102 | ||
| EC-број | 200-835-2 | ||
| 895 | |||
| 3Д-модел (Jmol) | Слика | ||
| MeSH | ацетонитрил | ||
| PubChem | 6342 | ||
| RTECS-бр. | AL7700000 | ||
| |||
| UNII | Z072SB282N | ||
| ОН-бр. | 1648 | ||
| Својства | |||
| Хемиска формула | |||
| Моларна маса | 0 g mol−1 | ||
| Изглед | Безбојна течност | ||
| Мирис | Слабо, изразено, овошно | ||
| Густина | 0.786 g/cm3 при 25°C | ||
| Точка на топење | |||
| Точка на вриење | |||
| Мешлив | |||
| log P | −0.334 | ||
| Парен притисок | 9.71 kPa (при 20,0 °C) | ||
Хенриева константа (kH)
|
530 μmol/(Pa·kg) | ||
| Киселост (pKa) | 25 | ||
| UV-vis (λmax) | 195 nm | ||
| −28,0⋅10-6 cm3/mol | |||
| Показател на прекршување (nD) | 1.344 | ||
| Термохемија | |||
| Ст. енталпија на образување ΔfH |
40.16–40.96 kJ/mol | ||
| Ст. енталпија на согорување ΔcH |
−1256.03 – −1256.63 kJ/mol | ||
| Стандардна моларна ентропија S |
149.62 J/(K·mol) | ||
| Специфичен топлински капацитет, C | 91.69 J/(K·mol) | ||
| Опасност | |||
| GHS-ознаки: | |||
Пиктограми
|
 
| ||
Сигнални зборови
|
Опасност | ||
Изјави за опасност
|
H225, H302, H312, H319, H332 | ||
Изјави за претпазливост
|
P210, P280, P305+P351+P338 | ||
| NFPA 704 | |||
| Температура на запалување | 2.0 °C (35.6 °F; 275.1 K) | ||
| 523.0 °C (973.4 °F; 796.1 K) | |||
| Граници на запалливост | 4.4–16.0% | ||
| Смртоносна доза или концентрација: | |||
LD50 (средна доза)
|
| ||
LC50 (средна концентрација)
|
5655 ppm (морско прасе, 4 ч) 2828 ppm (зајак, 4 ч) 53,000 ppm (стаорец, 30 min) 7500 ppm (стаорец, 8 ч) 2693 ppm (глушец, 1 ч)[4] | ||
LCLo (најниска објавена)
|
16,000 ppm (куче, 4 ч)[4] | ||
| NIOSH (здравствени граници во САД): | |||
PEL (дозволива)
|
TWA 40 ppm (70 mg/m3)[3] | ||
REL (препорачана)
|
TWA 20 ppm (34 mg/m3)[3] | ||
IDLH (непосредна опасност)
|
500 ppm[3] | ||
| Дополнителни податоци | |||
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |||
| Наводи | |||
Ацетонитрил, чести скратено како MeCN (метил цијанид), е хемиско соединение со формула CH
3CN и структурна формула H
3C–C≡N. Оваа безбојна течност е наједноставниот органски нитрил (цијановодородот е поедноставен нитрил, но цијанидниот анјон не е класифициран како органски). Се произведува главно како нуспроизвод од производството на акрилонитрил. Се користи како поларен апротичен растворувач во органската синтеза и во прочистувањето на бутадиен.[5] N≡C–C скелетот е линеарен со кратко растојание C≡N од 1,16 Å.[6]
Ацетонитрил првпат бил подготвен во 1847 година од францускиот хемичар Жан-Батист Думас.[7]
Употреба
[уреди | уреди извор]Ацетонитрил се користи главно како растворувач за прочистување на бутадиен во рафинериите. Поточно, ацетонитрилот се внесува во горниот дел од колоната за дестилација исполнета со јаглеводороди, вклучително и бутадиен и како што ацетонитрилот паѓа низ колоната, го апсорбира бутадиенот кој потоа се испраќа од дното на кулата до втора разделна кула. Потоа се користи топлина во разделната кула за да се одвои бутадиенот.
Во лабораторија се користи како растворувач со среден поларитет кој се меша со вода и низа органски растворувачи, но не и со заситени јаглеводороди. Бидејќи има удобен опсег на течност и висока диелектрична константа од 38,8. Со диполен момент од 3,92 D,[8] ацетонитрил раствора широк опсег на јонски и неполарни соединенија и е корисен како мобилна фаза во HPLC и LC-MS.
Широко се користи во апликациите на батериите поради неговата релативно висока диелектрична константа и способноста да раствори електролити. Од слични причини тој е популарен растворувач во цикличната волтаметрија.
Неговиот прекин на ултравиолетова транспарентност, нискиот вискозитет и ниската хемиска реактивност го прават популарен избор за течна хроматографија со високи перформанси (HPLC).
Ацетонитрилот игра значајна улога како доминантен растворувач кој се користи во синтезата на олигонуклеотиди од нуклеозидни фосфорамидити.
Индустриски, се користи како растворувач за производство на фармацевтски производи и фотографски филм.[9]
Органски синтези
[уреди | уреди извор]Ацетонитрилот е вообичаен двојаглероден градежен блок во органската синтеза[10] од многу корисни хемикалии, вклучувајќи ацетамидин хидрохлорид, тиамин и α-нафтален оцетна киселина.[11] Неговата реакција со цијаноген хлорид дава малонитрил.[5]
Како донатор на електронски пар
[уреди | уреди извор]Ацетонитрилот има слободен електронски пар во азотниот атом, кој може да формира многу нитрилни комплекси со преоден метал. Бидејќи е слабо базен, тој е лесно заменлив лиганд. На пример, бис(ацетонитрил)паладиум дихлорид се подготвува со загревање на суспензија од паладиум хлорид во ацетонитрил:[12]
Сроден комплекс е тетракис (ацетонитрил) бакар(I) хексафлуорофосфат [Cu(CH
3CN)
4]+
. CH
3CN групите во овие комплекси се брзо поместени од многу други лиганди.
Исто така, формира луисови адукти со луисови киселини од групата 13 како бор трифлуорид.[13] Во суперкиселините, можно е да се протонира ацетонитрил.[14]
Производство
[уреди | уреди извор]Ацетонитрил е нуспроизвод од производството на акрилонитрил. Повеќето се согоруваат за да се поддржи планираниот процес, но се проценува дека неколку илјади тони се задржани за горенаведените апликации.[15] Така, трендовите на производство на ацетонитрил генерално ги следат оние на акрилонитрилот. Ацетонитрил, исто така, може да се произведува со многу други методи, но тие не се од комерцијална важност од 2002 година. Илустративни начини се со дехидрација на ацетамид или со хидрогенирање на мешавини од јаглерод моноксид и амонијак.[16] Во 1992 година, во САД беа произведени 14.700 тони (32.400.000 lb) ацетонитрил.
Истражувана е и каталитичката амоксидација на етилен.[17]
Недостаток на ацетонитрил во 2008-2009 година
[уреди | уреди извор]Почнувајќи од октомври 2008 година, светската понуда на ацетонитрил беше мала бидејќи кинеското производство беше затворено за Олимпијадата. Понатаму, една американска фабрика беше оштетена во Тексас за време на ураганот Ајк.[18] Поради глобалното економско забавување, производството на акрилонитрил што се користи во акрилни влакна и во смоли на акрилонитрил бутадиен стирен (ABS) се намали. Ацетонитрилот е нуспроизвод во производството на акрилонитрил и неговото производство исто така се намали, што дополнително го зголемува недостигот на ацетонитрил.[19] Глобалниот недостиг на ацетонитрил продолжи до почетокот на 2009 година.[потребно е ажурирање]
Безбедност
[уреди | уреди извор]Токсичност
[уреди | уреди извор]Ацетонитрил има само скромна токсичност во мали дози.[11][20] Може да се метаболизира за да произведе цијановодород, кој е извор на забележаните токсични ефекти.[9][21][22] Генерално, почетокот на токсичните ефекти е одложен, поради времето потребно за телото да го метаболизира ацетонитрилот во цијанид (обично околу 2-12 часа).[11]
Случаите на труење со ацетонитрил кај луѓето (или, поконкретно, на труење со цијанид по изложување на ацетонитрил) се ретки, но не се непознати, со вдишување, голтање и (можеби) со апсорпција на кожата.[21] Симптомите, кои обично не се појавуваат неколку часа по изложувањето, вклучуваат тешкотии со дишењето, бавен пулс, гадење и повраќање. Конвулзии и кома може да се појават во сериозни случаи, проследени со смрт од респираторна инсуфициенција. Третманот е како за труење со цијанид, со кислород, натриум нитрит и натриум тиосулфат меѓу најчесто користените итни третмани.[21]
Се користи во формулации за отстранувач на лак за нокти и покрај неговата токсичност. Најмалку два случаи се пријавени на случајно труење на мали деца со отстранувач на лак на база на ацетонитрил, од кои еден бил фатален.[23] Ацетонот и етил ацетатот често се претпочитаат како побезбедни за домашна употреба, а ацетонитрилот е забранет во козметичките производи во Европската економска област од март 2000 година.[24]
Метаболизам и екскреција
[уреди | уреди извор]| Соединение | Цијанид, концентрација во мозокот (μg/kg) | Орално LD50 (mg/kg) |
|---|---|---|
| Калиум цијанид | 748 ± 200 | 10 |
| Пропионитрил | 508 ± 84 | 40 |
| Бутиронитрил | 437 ± 106 | 50 |
| Малононитрил | 649 ± 209 | 60 |
| Акрилонитрил | 395 ± 106 | 90 |
| Ацетонитрил | 28 ± 5 | 2460 |
| Готварска сол (NaCl) | Н/П | 3000 |
| Концентрациите на јонски цијанид измерени во мозокот на стаорци Спраг-Доли еден час по орална администрација на of an LD50 на различни нитрили.[25] | ||
Заеднички со другите нитрили, ацетонитрилот може да се метаболизира во микрозомите, особено во црниот дроб, за да произведе цијановодород, како што беше првпат прикажано од Поцани и сор. во 1959 година.[26] Првиот чекор во оваа патека е оксидација на ацетонитрил во гликолонитрил со помош на NADPH-зависна цитохром P450 монооксигеназа. Гликолонитрилот потоа се подложува на спонтано распаѓање за да добие цијановодород и формалдехид.[20][21] Формалдехид, токсин и канцероген сам по себе, дополнително се оксидира до мравја киселина, која е уште еден извор на токсичност.
Метаболизмот на ацетонитрилот е многу побавен од оној на другите нитрили, што е причина за неговата релативно ниска токсичност. Оттука, еден час по администрацијата на потенцијално смртоносна доза, концентрацијата на цијанид во мозокот на стаорецот беше 1⁄20 од онаа за доза на пропионитрил 60 пати помала (види табела).[25]
Релативно бавниот метаболизам на ацетонитрил во цијановодород овозможува поголем дел од произведениот цијанид да се детоксицира во телото до тиоцијанат (патот на родан). Исто така, овозможува поголем дел од ацетонитрилот да се излачува непроменет пред да се метаболизира. Главните патишта на екскреција се со издишување и со урина.[20][21][22]
Наводи
[уреди | уреди извор]- ↑ 1,0 1,1 Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. стр. 902. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ↑ 2,0 2,1 2,2 2,3 „Material Safety Data Sheet: Acetonitrile“ (PDF). TedPella.com. Архивирано од изворникот (PDF) на 2016-11-17. Посетено на 2023-03-08.
- ↑ 3,0 3,1 3,2 „Џебен водич за опасните хемиски материи #0006“. Национален институт за безбедност и здравје при работа (NIOSH). (англиски)
- ↑ 4,0 4,1 „Acetonitrile“. Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ 5,0 5,1 „Архивиран примерок“ (PDF). Ashford's Dictionary of Industrial Chemicals, Third edition. стр. 76. Архивирано од изворникот (PDF) на 2011-05-16. Посетено на 2011-03-31.
- ↑ Karakida, Ken'ichi; Fukuyama, Tsutomu; Kuchitsu, Kozo (1974). „Molecular Structures of Hydrogen Cyanide and Acetonitrile as Studied by Gas Electron Diffraction“. Bulletin of the Chemical Society of Japan. 47 (2): 299–304. doi:10.1246/bcsj.47.299.
- ↑ Dumas, J.-B. (1847). „Action de l'acide phosphorique anhydre sur les sels ammoniacaux“ [Action of anhydrous phosphoric acid on ammonium salts]. Comptes rendus. 25: 383–384.
- ↑ Steiner, P. A.; Gordy, W. (1966). „Journal of Molecular Spectroscopy“. 21: 291. Наводот journal бара
|journal=(help) - ↑ 9,0 9,1 Spanish Ministry of Health (2002), Acetonitrile. Summary Risk Assessment Report (PDF), Ispra (VA), Italy: European Chemicals Bureau, Special Publication I.01.65, Архивирано од изворникот (PDF) на 2008-12-17
- ↑ DiBiase, S. A.; Beadle, J. R.; Gokel, G. W. „Synthesis of α,β-Unsaturated Nitriles from Acetonitrile: Cyclohexylideneacetonitrile and Cinnamonitrile“. Organic Syntheses.; Collective Volume, 7, стр. 108
- ↑ 11,0 11,1 11,2 Philip Wexler, уред. (2005), Encyclopedia of Toxicology, 1 (2. изд.), Elsevier, стр. 28–30, ISBN 0-12-745354-7
- ↑ Jürgen-Hinrich., Fuhrhop (2003). Organic synthesis : concepts and methods. Li, Guangtao, Dr. (3rd, completely rev. and enl.. изд.). Weinheim: Wiley-VCH. стр. 26. ISBN 9783527302727. OCLC 51068223.
- ↑ B. Swanson, D. F. Shriver, J. A. Ibers, "Nature of the donor-acceptor bond in acetonitrile-boron trihalides. The structures of the boron trifluoride and boron trichloride complexes of acetonitrile", Inorg. Chem., 2969., volume 8, pp. 2182-2189, {{doi:10.1021/ic50080a032}}
- ↑ Haiges, Ralf; Baxter, Amanda F.; Goetz, Nadine R.; Axhausen, Joachim A.; Soltner, Theresa; Kornath, Andreas; Christe, Kalr O. (2016). „Protonation of nitriles: isolation and characterization of alkyl- and arylnitrilium ions“. Dalton Transactions. 45 (20): 8494–8499. doi:10.1039/C6DT01301E. PMID 27116374.
- ↑ Pollak, Peter; Romeder, Gérard; Hagedorn, Ferdinand; Gelbke, Heinz-Peter, „Nitriles“, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a17_363
- ↑ US 4179462, Olive, G. & Olive, S., "Process for preparing acetonitrile", published 1979-12-18, assigned to Monsanto Company
- ↑ Rhimi, B.; Mhamdi, M.; Ghorbel, A.; Narayana Kalevaru, V.; Martin, A.; Perez-Cadenas, M.; Guerrero-Ruiz, A. (15 May 2016). „Ammoxidation of ethylene to acetonitrile over vanadium and molybdenum supported zeolite catalysts prepared by solid-state ion exchange“. Journal of Molecular Catalysis A: Chemical. 416: 127–139. doi:10.1016/j.molcata.2016.02.028.
- ↑ Lowe, Derek (2009). „The Great Acetonitrile Shortage“. Science Translational Medicine.
- ↑ A. Tullo (2008). „A Solvent Dries Up“. Chemical & Engineering News. 86 (47): 27. doi:10.1021/cen-v086n047.p027.
- ↑ 20,0 20,1 20,2 Institut national de recherche et de sécurité (INRS) (2004), Fiche toxicologique no. 104 : Acétonitrile (PDF), Paris: INRS, ISBN 2-7389-1278-8, Архивирано од изворникот (PDF) на 2011-07-28, Посетено на 2008-08-19
- ↑ 21,0 21,1 21,2 21,3 21,4 International Programme on Chemical Safety (1993), Environmental Health Criteria 154. Acetonitrile, Geneva: World Health Organization
- ↑ 22,0 22,1 Greenberg, Mark (1999), Toxicological Review of Acetonitrile (PDF), Washington, DC: U.S. Environmental Protection Agency
- ↑ Caravati, E. M.; Litovitz, T. (1988). „Pediatric cyanide intoxication and death from an acetonitrile-containing cosmetic“. J. Am. Med. Assoc. 260 (23): 3470–73. doi:10.1001/jama.260.23.3470. PMID 3062198.
- ↑ „Twenty-Fifth Commission Directive 2000/11/EC of 10 March 2000 adapting to technical progress Annex II to Council Directive 76/768/EEC on the approximation of laws of the Member States relating to cosmetic products“. Official Journal of the European Communities. L65: 22–25. 2000-03-14.
- ↑ 25,0 25,1 Ahmed, A. E.; Farooqui, M. Y. H. (1982), „Comparative toxicities of aliphatic nitriles“, Toxicol. Lett., 12 (2–3): 157–64, doi:10.1016/0378-4274(82)90179-5, PMID 6287676
- ↑ Pozzani, U. C.; Carpenter, C. P.; Palm, P. E.; Weil, C. S.; Nair, J. H. (1959), „An investigation of the mammalian toxicity of acetonitrile“, J. Occup. Med., 1 (12): 634–642, doi:10.1097/00043764-195912000-00003, PMID 14434606
Надворешни врски
[уреди | уреди извор]- WebBook page for C2H3N
- International Chemical Safety Card 0088
- National Pollutant Inventory - Acetonitrile fact sheet
- NIOSH Pocket Guide to Chemical Hazards
- Chemical Summary for Acetonitrile (CAS No. 75-05-8), Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency
- Simulation of acetonitrile
- How Did Organic Matter Reach Earth? Cosmic Detectives Trace Origin of Complex Organic Molecules, on: SciTechDaily. September 10, 2020. Source: Tokyo University of Science: Acetonitrile found in molecular cloud Sgr B2(M) at the center of our galaxy.
|