Рибозомопатија
Рибозомопатии ― болести предизвикани од абнормалности во структурата или функцијата на белковините на рибозомните составници или гени на рибозомна РНК или други гени чии производи се вклучени во биогенезата на рибозомите.[1][2][3]
Рибозоми
[уреди | уреди извор]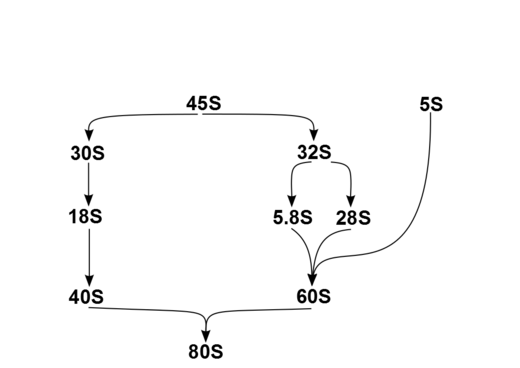
Рибозомите се неопходни за синтеза на белковините кај сите живи организми. Прокариотските и еукариотските рибозоми содржат скеле од рибозомна РНК на кое се наредени широк спектар на рибозомни белковини.[4] Рибозомопатиите може да произлезат од абнормалности или на рибозомна РНК или на различните рибозомни белковини.[се бара извор]
Номенклатурата на подединиците на рибозомна РНК е изведена од Сведберговата единица на секоја составница, која е коефициент на седиментација на ултрацентрифуга, кој е под влијание на масата и обликот. Овие единици (S) на подединиците на рибозомна РНК не можат едноставно да бидат додадени бидејќи тие претставуваат мерки за стапката на седиментација наместо за масата. Еукариотските рибозоми се нешто поголеми и посложени од прокариотските рибозоми. Целокупната 80S еукариотска структура на рибозомна РНК е составена од голема 60S подединица и мала подединица 40S.[5]
Кај луѓето, една единица за транскрипција одделена со 2 внатрешно транскрибирани разделувачи шифрира претходник, 45S. Претходникот 45S на рибозомна РНК е организиран во 5 кластери (секоја има 30-40 повторувања) на хромозомите 13, 14, 15, 21 и 22. Тие се транскрибирани во јадренцето со РНК полимераза I. 45S е обработувана во јадренцето преку 32S на рибозомна РНК до 28S[6] и 5.8S,[7] и преку 30S до 18S,[8] како што е прикажано на дијаграмот. 18S е составница на рибозомната подединица 40S. 28S, 5.8S и 5S,[9] кои се транскрибирани независно, се составници на 60S. 5S ДНК се јавува во тандемски низи (~200-300 вистински 5S гени и многу расеани псевдогени); најголемиот е на хромозомот 1q41-42. 5S на рибозомна РНК се транскрибирана со РНК полимераза III.[5] Не е целосно јасно зошто рибозомната РНК е обработувана на овој начин наместо директно да се транскрибира како зрела рибозомна РНК, но секвенцијалните чекори може да имаат улога во правилното превиткување на рибозомната РНК или во последователното склопување на рибозомните белковини.
Производите од оваа обработка во клеточното јадро се четирите главни видови цитоплазматска рибозомна РНК: подединици 28S, 5.8S, 18S и 5S.[10]:291 Клетките на цицачите имаат и 2 вида митохондриски молекули на рибозомна РНК, 12S и 16S. Кај луѓето, како и кај повеќето еукариоти, 18S на рибозомна РНК е составница на 40S рибозомната подединица, а големата подединица 60S содржи три видови рибозомна РНК ( 5S, 5.8S и 28S кај цицачите, 25S кај растенијата). 60S на рибозомна РНК делува како рибозим, катализирајќи го образувањето на пептидна врска, додека 40S ја следи комплементарноста помеѓу антикодонот на преносната РНК и информациската РНК.[се бара извор]
Болести
[уреди | уреди извор]Абнормалната биогенеза на рибозомите е поврзана со неколку човечки генетски болести.[се бара извор]
Рибозомопатијата е поврзана со атрофија на скелетните мускули,[11] и ја поткрепува повеќето Дајмонд-Блекфановата анемија,[2] X-поврзаниот подвид на вродена дискератоза,[12][13] Тричер Колинсов синдром,[2][14] Швахман-Дајмондов синдром[15] и 5q-миелодиспластичен синдром, северноамериканска индијанска детска цироза,[16] изолирана конгенитална аспленија,,[16][17][18][19] и Бовен-Конрадиев синдром, CHARGE синдромот[20][21][22][23] и ANE синдромот.[24]
Прикажани се поврзаниот хромозом, генотипот при каталогот наречен Семрежни Менделови закон кај човекот, фенотипот и можните точки на нарушување:
| Име | Хромозом | Генотип[25] | Фенотип | Белковина | Нарушување |
| DBA1[25] | 19q13.2 | 603474 | 105650 | RPS19 | 30S до 18S[10]:291 |
| DBA2 | 8p23-p22 | unknown | 606129 | ||
| DBA3 | 10q22-q23 | 602412 | 610629 | RPS24[26] | 30S до 18S[10]:291 |
| DBA4 | 15q | 180472 | 612527 | RPS17[27] | 30S до 18S[10]:291 |
| DBA5 | 3q29-qter | 180468 | 612528 | RPL35A[28] | 32S до 5.8S/28S[10]:291 |
| DBA6 | 1p22.1 | 603634 | 612561 | RPL5[29] | 32S до 5.8S/28S[10]:291 |
| DBA7 | 1p36.1-p35 | 604175 | 612562 | RPL11[29] | 32S до 5.8S/28S[10]:291 |
| DBA8 | 2p25 | 603658 | 612563 | RPS7[29] | 30S до 18S[10]:291 |
| DBA9 | 6p | 603632 | 613308 | RPS10[25] | 30S до 18S[30] |
| DBA10 | 12q | 603701 | 613309 | RPS26 | 30S до 18S[31] |
| DBA11 | 17p13 | 603704 | 614900 | RPS26 | 30S до 18S[31] |
| DBA12 | 3p24 | 604174 | 615550 | RPL15 | 45S до 32S[32] |
| DBA13 | 14q | 603633 | 615909 | RPS29 | |
| DKCX | Xq28 | 300126 | 305000 | дискерин | поврзано и со H/ACA мала нуклеусна РНК и со составницата теломераза на РНК[33] |
| TCS | |||||
| 5q- | 5q33.1 | 130620 | 153550 | RPS14 | 30S до 18S[10]:291 |
| SDS | 7q11.21 | 607444 | 260400 | SBDS | 60S до 80S[10]:291 |
| CHH | 9p13.3 | 157660 | 250250 | RMRP | митохондриска обработка на РНК |
| NAIC | 16q22.1 | 607456 | 604901 | цирхин | делумна загуба на заемодејството меѓу цирхинот и NOL11[34] |
| ICAS | 3p22.1 | 150370 | 271400 | RPSA | |
| BWCNS | 12p13.31 | 611531 | 211180 | EMG1 | 18S до 40S |
| CHARGE | 8q12.1-q12.2; also 7q21.11 | 608892 | 214800 | CHD7; исто така SEMA3E | |
| ACES | xxx | xxx | RBM28 |
Неколку рибозомопатии споделуваат особини како што е наследниот недостиг на коскената срцевина, која се одликува со намален број на крвни зрнца и со предиспозиција за рак.[5] Други особини може да вклучуваат скелетни абнормалности и уназадување на растот.[16] Сепак, клинички овие болести се различни и не покажуваат доследен сет на особини.[16]
Дајмонд-Блекфанова анемија
[уреди | уреди извор]Со исклучок на ретките генотипови GATA1, Дајмонд-Блекфанова анемија произлегува од различни мутации кои предизвикуваат рибозомопатии.[35]
Вродена дискератоза
[уреди | уреди извор]Швахман-Дајмондов синдром
[уреди | уреди извор]Швахман-Дајмондовиот синдром е предизвикан од двоалелни мутации во белковината SBDS што влијае на неговата способност да ја спои хидролизата на гванин трифосфат преку гванин-трифосфатаза EFL1 со ослободување на eIF6 од подединицата 60S.[36] Клинички, синдромот влијае на повеќе системи, предизвикувајќи коскени абнормалности и панкреасна и неврокогнитивна нефункционалност.[37] Синдромот се поврзува со подединицата 60S во човечките клетки и има улога во спојувањето на подединицата и преведувачкото активирање во моделите на квасец.[се бара извор]
5q-миелодиспластичен синдром
[уреди | уреди извор]5q-миелодиспластичен синдром[37] е поврзан со стекната хаплонедостиг на RPS14,[37] составница на еукариотската мала рибозомна подединица (40S).[5] RPS14 е критичен за склопувањето на 40S, а намалувањето на RPS14 во човечките клетки CD34 (+) е доволно за да биде рекапитулиран 5q-дефектот на еритропоезата со поштеда на мегакариоцити.[5]
Тричер Колинсов синдром
[уреди | уреди извор]Тричер Колинсовиот синдром е генетско нарушување кое се одликува со деформитети на ушите, очите, јаболчната коска и брадата.
Хипоплазија на 'рскавица-коса
[уреди | уреди извор]Хипоплазија на 'рскавица-коса - некои извори самоуверено наведуваат како рибозомопатија, други се сомневаат.[се бара извор]
Северноамериканска индијанска детска цироза
[уреди | уреди извор]Оваа цироза е автосомно рецесивна абнормалност на генот UTP4, кој го кодира цирхинот. Неонаталната жолтица напредува со текот на времето до билијарна цироза со тешка фиброза на црниот дроб.
Изолирана вродена аспленија
[уреди | уреди извор]Бовен-Конрадиев синдром
[уреди | уреди извор]Бовен-Конрадиевиот синдром[38][39] е автосомно рецесивна абнормалност на генот EMG1, кој игра улога во составувањето на малата рибозомна подединица.[38][40][41] Најмногу погодени деца биле од северноамерикански хутеритски семејства, но синдромот може да влијае на другите групи на население.[39][42] Забележувана е скелетна дисморфологија[39][42] и тешката преднатален и посленатален недостиг на растот обично доведува до смрт до една година.[43]
Останато
[уреди | уреди извор]Семеен рак на дебелото црево од тип X
[уреди | уреди извор]За разлика од мутациите на петте гени поврзани со поправка на неусогласеноста на ДНК, кои се поврзани со Линчовиот синдром со наследен неполипозен рак на дебелото црево поради микросателитска нестабилност, семејниот рак на дебелото црево од тип X предизвикува наследен неполипозен рак на дебелото црево и покрај микросателитската стабилност.[44] Семејниот рак на дебелото црево од тип X е најверојатно етиолошки хетероген, но RPS20 може да биде вмешан во некои случаи.[44]
p53
[уреди | уреди извор]Патот p53 е главна појава за фенотипот на рибозомопатија.[45] Рибозомниот стрес предизвикува активирање на сигналната патека p53.[46][47]
Рак
[уреди | уреди извор]Клетките на ракот имаат неправилен облик, големи јадра, кои може да одговараат на нагорна регулација на транскрипцијата на рибозомскиот ген, а со тоа и висока клеточна пролиферација. Онкогените, како c-Myc, можат да ја регулираат транскрипцијата на рибозомна ДНК на директен и индиректен начин. Туморските сузбивачи како Rb и p53, од друга страна, можат да ја потиснат биогенезата на рибозомите. Дополнително, јадренцето е важен клеточен сензор за стрес и игра клучна улога во активирањето на p53.
Рибозомопатијата е поврзана со патологијата на различни малигни тумори.[45] Неколку рибозомопатии се поврзани со зголемена стапка на рак. На пример, и SDS и 5q-синдромот доведуваат до нарушена хематопоеза и предиспозиција за леукемија.[37] Дополнително, стекнатите дефекти во рибозомните белковини кои не биле вмешани во вродени рибозомопатии се пронајдени кај Т-лимфобластна леукемија/лимфом, рак на желудникот и рак на јајниците.[3]
Наводи
[уреди | уреди извор]- ↑ Nakhoul H, Ke J, Zhou X, Liao W, Zeng SX, Lu H (2014). „Ribosomopathies: mechanisms of disease“. Clin Med Insights Blood Disord. 7: 7–16. doi:10.4137/CMBD.S16952. PMC 4251057. PMID 25512719.
- ↑ 2,0 2,1 2,2 Narla A, Ebert BL (април 2010). „Ribosomopathies: human disorders of ribosome dysfunction“. Blood. 115 (16): 3196–205. doi:10.1182/blood-2009-10-178129. PMC 2858486. PMID 20194897.
- ↑ 3,0 3,1 De Keersmaecker K, Sulima SO, Dinman JD (февруари 2015). „Ribosomopathies and the paradox of cellular hypo- to hyperproliferation“. Blood. 125 (9): 1377–82. doi:10.1182/blood-2014-10-569616. PMC 4342353. PMID 25575543.
- ↑ Ban N, Beckmann R, Cate JH, Dinman JD, Dragon F, Ellis SR, и др. (февруари 2014). „A new system for naming ribosomal proteins“. Curr Opin Struct Biol. 24: 165–9. doi:10.1016/j.sbi.2014.01.002. PMC 4358319. PMID 24524803.
- ↑ 5,0 5,1 5,2 5,3 5,4 Ruggero D, Shimamura A (октомври 2014). „Marrow failure: a window into ribosome biology“. Blood. 124 (18): 2784–92. doi:10.1182/blood-2014-04-526301. PMC 4215310. PMID 25237201.
- ↑ „Homo sapiens 28S ribosomal RNA“. National Center for Biotechnology Information. 4 февруари 2017.
- ↑ „Homo sapiens 5.8S ribosomal RNA“. National Center for Biotechnology Information. 10 февруари 2017.
- ↑ „Homo sapiens 18S ribosomal RNA“. National Center for Biotechnology Information. 4 февруари 2017.
- ↑ „Homo sapiens 5S ribosomal RNA“. National Center for Biotechnology Information. 3 септември 2020.
- ↑ 10,00 10,01 10,02 10,03 10,04 10,05 10,06 10,07 10,08 10,09 Hoffbrand AV, Moss PH (2011). Essential Haematology (6th. изд.). Wiley-Blackwell. ISBN 978-1-4051-9890-5.
- ↑ Connolly, Martin (2017). „miR-424-5p reduces ribosomal RNA and protein synthesis in muscle wasting“. Journal of Cachexia, Sarcopenia and Muscle. 9 (2): 400–416. doi:10.1002/jcsm.12266. PMC 5879973. PMID 29215200.
- ↑ Online Mendelian Inheritance in Man. OMIM entry 305000: Dyskeratosis congenita, X–linked; DKCX. Johns Hopkins University. [1]
- ↑ Stumpf CR, Ruggero D (август 2011). „The cancerous translation apparatus“. Curr Opin Genet Dev. 21 (4): 474–83. doi:10.1016/j.gde.2011.03.007. PMC 3481834. PMID 21543223.
- ↑ Dauwerse JG, Dixon J, Seland S, Ruivenkamp CA, van Haeringen A, Hoefsloot LH, и др. (јануари 2011). „Mutations in genes encoding subunits of RNA polymerases I and III cause Treacher Collins syndrome“. Nat Genet. 43 (1): 20–2. doi:10.1038/ng.724. PMID 21131976. S2CID 205357102.
- ↑ Narla A, Hurst SN, Ebert BL (февруари 2011). „Ribosome defects in disorders of erythropoiesis“. Int J Hematol. 93 (2): 144–149. doi:10.1007/s12185-011-0776-0. PMC 3689295. PMID 21279816.
- ↑ 16,0 16,1 16,2 16,3 McCann KL, Baserga SJ (август 2013). „Genetics. Mysterious ribosomopathies“. Science. 341 (6148): 849–50. doi:10.1126/science.1244156. PMC 3893057. PMID 23970686.
- ↑ Online Mendelian Inheritance in Man. OMIM entry 271400: Asplenia, isolated congenital; ICAS. Johns Hopkins University. [2]
- ↑ Online Mendelian Inheritance in Man. OMIM entry 150370: Ribosomal protein SA; RPSA. Johns Hopkins University. [3]
- ↑ Bolze A, Mahlaoui N, Byun M, Turner B, Trede N, Ellis SR, и др. (мај 2013). „Ribosomal protein SA haploinsufficiency in humans with isolated congenital asplenia“. Science. 340 (6135): 976–8. Bibcode:2013Sci...340..976B. doi:10.1126/science.1234864. PMC 3677541. PMID 23579497.
- ↑ Wong, M. T.; Schölvinck, E. H.; Lambeck, A. J.; Van Ravenswaaij-Arts, C. M. (2015). „CHARGE syndrome: A review of the immunological aspects“. European Journal of Human Genetics. 23 (11): 1451–9. doi:10.1038/ejhg.2015.7. PMC 4613462. PMID 25689927.
- ↑ Martin, D. M. (2015). „Epigenetic Developmental Disorders: CHARGE syndrome, a case study“. Current Genetic Medicine Reports. 3 (1): 1–7. doi:10.1007/s40142-014-0059-1. PMC 4325366. PMID 25685640.
- ↑ Hsu, P; Ma, A; Wilson, M; Williams, G; Curotta, J; Munns, C. F.; Mehr, S (2014). „CHARGE syndrome: A review“. Journal of Paediatrics and Child Health. 50 (7): 504–11. doi:10.1111/jpc.12497. PMID 24548020.
- ↑ Janssen, N; Bergman, J. E.; Swertz, M. A.; Tranebjaerg, L; Lodahl, M; Schoots, J; Hofstra, R. M.; Van Ravenswaaij-Arts, C. M.; Hoefsloot, L. H. (2012). „Mutation update on the CHD7 gene involved in CHARGE syndrome“. Human Mutation. 33 (8): 1149–60. doi:10.1002/humu.22086. PMID 22461308.
- ↑ 612079
- ↑ 25,0 25,1 25,2 Online Mendelian Inheritance in Man. OMIM entry 105650: Diamond-Blackfan anemia. Johns Hopkins University. [4]
- ↑ Gazda HT, Grabowska A, Merida-Long LB, Latawiec E, Schneider HE, Lipton JM, и др. (декември 2006). „Ribosomal protein S24 gene is mutated in Diamond-Blackfan anemia“. Am J Hum Genet. 79 (6): 1110–8. doi:10.1086/510020. PMC 1698708. PMID 17186470.
- ↑ Cmejla R, Cmejlova J, Handrkova H, Petrak J, Pospisilova D (декември 2007). „Ribosomal protein S17 gene (RPS17) is mutated in Diamond-Blackfan anemia“. Hum Mutat. 28 (12): 1178–82. doi:10.1002/humu.20608. PMID 17647292. S2CID 22482024.
- ↑ Farrar JE, Nater M, Caywood E, McDevitt MA, Kowalski J, Takemoto CM, и др. (септември 2008). „Abnormalities of the large ribosomal subunit protein, Rpl35a, in Diamond-Blackfan anemia“. Blood. 112 (5): 1582–92. doi:10.1182/blood-2008-02-140012. PMC 2518874. PMID 18535205.
- ↑ 29,0 29,1 29,2 Gazda HT, Sheen MR, Vlachos A, Choesmel V, O'Donohue MF, Schneider H, и др. (декември 2008). „Ribosomal protein L5 and L11 mutations are associated with cleft palate and abnormal thumbs in Diamond-Blackfan anemia patients“. Am J Hum Genet. 83 (6): 769–80. doi:10.1016/j.ajhg.2008.11.004. PMC 2668101. PMID 19061985.
- ↑ Online Mendelian Inheritance in Man. OMIM entry 603632: Ribosomal protein S10; RPS10. Johns Hopkins University. [5]
- ↑ 31,0 31,1 Online Mendelian Inheritance in Man. OMIM entry 603701: Ribosomal protein S26; RPS26. Johns Hopkins University. [6]
- ↑ Online Mendelian Inheritance in Man. OMIM entry 604174: Ribosomal protein L15; RPL15. Johns Hopkins University. [7]
- ↑ 300126
- ↑ Freed EF, Prieto JL, McCann KL, McStay B, Baserga SJ (2012). „NOL11, implicated in the pathogenesis of North American Indian childhood cirrhosis, is required for pre-rRNA transcription and processing“. PLOS Genet. 8 (8): e1002892. doi:10.1371/journal.pgen.1002892. PMC 3420923. PMID 22916032.
- ↑ Boria I, Garelli E, Gazda HT, Aspesi A, Quarello P, Pavesi E, и др. (декември 2010). „The ribosomal basis of Diamond-Blackfan Anemia: mutation and database update“. Hum Mutat. 31 (12): 1269–79. doi:10.1002/humu.21383. PMC 4485435. PMID 20960466.
- ↑ Finch AJ, Hilcenko C, Basse N, Drynan LF, Goyenechea B, Menne TF, и др. (мај 2011). „Uncoupling of GTP hydrolysis from eIF6 release on the ribosome causes Shwachman-Diamond syndrome“. Genes Dev. 25 (9): 917–29. doi:10.1101/gad.623011. PMC 3084026. PMID 21536732.
- ↑ 37,0 37,1 37,2 37,3 Burwick N, Shimamura A, Liu JM (април 2011). „Non-Diamond Blackfan anemia disorders of ribosome function: Shwachman Diamond syndrome and 5q- syndrome“. Semin Hematol. 48 (2): 136–43. doi:10.1053/j.seminhematol.2011.01.002. PMC 3072806. PMID 21435510.
- ↑ 38,0 38,1 Sondalle SB, Baserga SJ (јуни 2014). „Human diseases of the SSU processome“. Biochim Biophys Acta. 1842 (6): 758–64. doi:10.1016/j.bbadis.2013.11.004. PMC 4058823. PMID 24240090.
- ↑ 39,0 39,1 39,2 Online Mendelian Inheritance in Man. OMIM entry 211180: XXX. Johns Hopkins University. [8]
- ↑ Online Mendelian Inheritance in Man. OMIM entry 611531: Essential for mitotic growth 1, S. cervevisiae, Homolog of; EMG1. Johns Hopkins University. [9]
- ↑ De Souza RA (февруари 2010). „Mystery behind Bowen-Conradi syndrome solved: a novel ribosome biogenesis defect“. Clin Genet. 77 (2): 116–8. doi:10.1111/j.1399-0004.2009.01304.x. PMID 20096068. S2CID 140113474.
- ↑ 42,0 42,1 Armistead J, Khatkar S, Meyer B, Mark BL, Patel N, Coghlan G, и др. (јуни 2009). „Mutation of a gene essential for ribosome biogenesis, EMG1, causes Bowen-Conradi syndrome“. Am J Hum Genet. 84 (6): 728–39. doi:10.1016/j.ajhg.2009.04.017. PMC 2694972. PMID 19463982.
- ↑ Armistead J, Patel N, Wu X, Hemming R, Chowdhury B, Basra GS, и др. (мај 2015). „Growth arrest in the ribosomopathy, Bowen-Conradi syndrome, is due to dramatically reduced cell proliferation and a defect in mitotic progression“. Biochim Biophys Acta. 1852 (5): 1029–37. doi:10.1016/j.bbadis.2015.02.007. PMID 25708872.
- ↑ 44,0 44,1 Stoffel EM, Eng C (септември 2014). „Exome sequencing in familial colorectal cancer: searching for needles in haystacks“. Gastroenterology. 147 (3): 554–6. doi:10.1053/j.gastro.2014.07.031. PMID 25075943.
- ↑ 45,0 45,1 Raiser DM, Narla A, Ebert BL (март 2014). „The emerging importance of ribosomal dysfunction in the pathogenesis of hematologic disorders“. Leuk Lymphoma. 55 (3): 491–500. doi:10.3109/10428194.2013.812786. PMID 23863123. S2CID 1259487.
- ↑ Zhou X, Liao WJ, Liao JM, Liao P, Lu H (април 2015). „Ribosomal proteins: functions beyond the ribosome“. J Mol Cell Biol. 7 (2): 92–104. doi:10.1093/jmcb/mjv014. PMC 4481666. PMID 25735597.
- ↑ Wang W, Nag S, Zhang X, Wang MH, Wang H, Zhou J, Zhang R (март 2015). „Ribosomal proteins and human diseases: pathogenesis, molecular mechanisms, and therapeutic implications“. Med Res Rev. 35 (2): 225–85. doi:10.1002/med.21327. PMC 4710177. PMID 25164622.
