Хидролиза: Разлика помеѓу преработките
| [проверена преработка] | [проверена преработка] |
с Робот: Автоматизирана замена на текст (-== Видете исто така == +== Поврзано ==) |
с Правописна исправка, replaced: антанид → антаноид |
||
| Ред 1: | Ред 1: | ||
::''Да не се помеша со [[електролиза]], честиот метод за производство на гасовит водород од вода.'' |
::''Да не се помеша со [[електролиза]], честиот метод за производство на гасовит водород од вода.'' |
||
[[Податотека:Hidroliza.jpg|мини|300px|десно|При хидролизата, една молекула под влијанието на контактот со водата се дели на два помали фрагменти, од кои едниот добива OH<sup>-</sup> јон, а другиот добива H<sup>+</sup> јон.]] |
[[Податотека:Hidroliza.jpg|мини|300px|десно|При хидролизата, една молекула под влијанието на контактот со водата се дели на два помали фрагменти, од кои едниот добива OH<sup>-</sup> јон, а другиот добива H<sup>+</sup> јон.]] |
||
| Ред 6: | Ред 5: | ||
'''Хидролиза''' е [[хемиска реакција]] во која една [[молекула]] се дели на два дела при реакција со молекула на [[вода]], која има [[хемиска формула]] [[Водород|H]]<sub>2</sub>[[Кислород|O]]. Еден од деловите на поделената молекула добива OH<sup>-</sup> [[јон]] од молекулата на водата, додека другиот дел добива H<sup>+</sup> јон од водата. |
'''Хидролиза''' е [[хемиска реакција]] во која една [[молекула]] се дели на два дела при реакција со молекула на [[вода]], која има [[хемиска формула]] [[Водород|H]]<sub>2</sub>[[Кислород|O]]. Еден од деловите на поделената молекула добива OH<sup>-</sup> [[јон]] од молекулата на водата, додека другиот дел добива H<sup>+</sup> јон од водата. |
||
Оваа реакција е различна од реакцијата на [[хидратација]], во која водените молекули се [[Адиција|адираат]] на супстанца, но делење на молекулата воопшто не се случува. Во [[Органска хемија|органската хемија]], хидролизата може да се смета како спротивен процес на [[Реакција на кондензација|реакцијата на кондензација]], процес во кој два молекуларни фрагменти се спојуваат за сметка на секоја молекула вода која се создава. Бидејќи хидролизата е повратна реакција, кондензацијата и хидролизата може да се случат во исто време, со положбата на рамнотежа која ја детерминира количината на секој продукт. Во [[Неорганска хемија|неорганската хемија]], овој збор често се користи за [[раствор]]и на [[соли]] и реакциите при кои тие се претвораат во нови јонски соединенија или во талози ([[оксид]]и, [[хидроксид]]и или соли). Некои примери на хидролиза се објаснети подолу. |
Оваа реакција е различна од реакцијата на [[хидратација]], во која водените молекули се [[Адиција|адираат]] на супстанца, но делење на молекулата воопшто не се случува. Во [[Органска хемија|органската хемија]], хидролизата може да се смета како спротивен процес на [[Реакција на кондензација|реакцијата на кондензација]], процес во кој два молекуларни фрагменти се спојуваат за сметка на секоја молекула вода која се создава. Бидејќи хидролизата е повратна реакција, кондензацијата и хидролизата може да се случат во исто време, со положбата на рамнотежа која ја детерминира количината на секој продукт. Во [[Неорганска хемија|неорганската хемија]], овој збор често се користи за [[раствор]]и на [[соли]] и реакциите при кои тие се претвораат во нови јонски соединенија или во талози ([[оксид]]и, [[хидроксид]]и или соли). Некои примери на хидролиза се објаснети подолу. |
||
== Примери на хидролиза == |
== Примери на хидролиза == |
||
| Ред 15: | Ред 14: | ||
[[Податотека:Al_ion_hydrolysis.gif|thumb|300px|center|Хидролиза на хидриран Al<sup>3+</sup> јон.]] |
[[Податотека:Al_ion_hydrolysis.gif|thumb|300px|center|Хидролиза на хидриран Al<sup>3+</sup> јон.]] |
||
Ова значи дека доколку растворите на AlCl<sub>3</sub> евапорираат, [[Хлороводородна киселина|хлороводородната киселина]] се губи и резултатот е базна сол (во овој случај, ''оксихлорид'') наместо AlCl<sub>3</sub>. Вакво хемиско однесување се огледува и кај други метални хлориди, како [[Цинк хлорид|ZnCl<sub>2</sub>]], [[Калај(II) хлорид|SnCl<sub>2</sub>]], [[Железо(III) хлорид|FeCl<sub>3</sub>]] и |
Ова значи дека доколку растворите на AlCl<sub>3</sub> евапорираат, [[Хлороводородна киселина|хлороводородната киселина]] се губи и резултатот е базна сол (во овој случај, ''оксихлорид'') наместо AlCl<sub>3</sub>. Вакво хемиско однесување се огледува и кај други метални хлориди, како [[Цинк хлорид|ZnCl<sub>2</sub>]], [[Калај(II) хлорид|SnCl<sub>2</sub>]], [[Железо(III) хлорид|FeCl<sub>3</sub>]] и лантаноидните халиди, како [[Диспрозиум(III) хлорид|DyCl<sub>3</sub>]]. Со некои соединенија, како [[Титаниум тетрахлорид|TiO<sub>4</sub>]], хидролизата може целосно да се одвива и се формира чист хидроксид или оксид, во овој случај [[Титаниум диоксид|TiO<sub>2</sub>]]. |
||
=== Хидролиза на естерска врска === |
=== Хидролиза на естерска врска === |
||
| Ред 21: | Ред 20: | ||
Во хидролитичка реакција при која се раскинува [[естер]]ска врска, еден хидролитички продукт содржи [[хидроксилна група|хидроксилна]] [[функционална група]], додека другиот содржи [[карбоксилна група]]. |
Во хидролитичка реакција при која се раскинува [[естер]]ска врска, еден хидролитички продукт содржи [[хидроксилна група|хидроксилна]] [[функционална група]], додека другиот содржи [[карбоксилна група]]. |
||
Делот (фрагментот) од родителската молекула кој првобитно бил [[карбоксилат]] добива [[водород]]ен јон од додатна молекула на вода. Делот, пак, кој бил првобитно [[алкил]] група ја собира останатата хидроксилна група од водената молекула. Ова е ефективно обратен процес на [[естерификација]]та, при што се добива оригиналниот [[алкохол]] и [[карбоксилна киселина]] повторно. |
Делот (фрагментот) од родителската молекула кој првобитно бил [[карбоксилат]] добива [[водород]]ен јон од додатна молекула на вода. Делот, пак, кој бил првобитно [[алкил]] група ја собира останатата хидроксилна група од водената молекула. Ова е ефективно обратен процес на [[естерификација]]та, при што се добива оригиналниот [[алкохол]] и [[карбоксилна киселина]] повторно. |
||
Постојат два главни методи за хидролиза на естери, [[База (хемија)|базната]] хидролиза и [[Киселина|киселинско]] - [[Катализатор|катализираната]]. При киселинско - катализираната хидролиза се користи разредена киселина за да ја протонира [[Карбонилна група|карбонилната група]] со цел да ја активира кон [[нуклеофил]]ен напад од молекула на вода. Но, повообичаениот метод за естерска хидролиза вклучува рефлуксирање на естерот со водеста база, како штп се [[Натриум хидроксид|NaOH]] или [[Калиум хидроксид|KOH]]. Кога реакцијата е завршена, карбоксилатната сол се [[Ацидификација|закиселува]] при што ја ослободува слободната карбоксилна киселина. |
Постојат два главни методи за хидролиза на естери, [[База (хемија)|базната]] хидролиза и [[Киселина|киселинско]] - [[Катализатор|катализираната]]. При киселинско - катализираната хидролиза се користи разредена киселина за да ја протонира [[Карбонилна група|карбонилната група]] со цел да ја активира кон [[нуклеофил]]ен напад од молекула на вода. Но, повообичаениот метод за естерска хидролиза вклучува рефлуксирање на естерот со водеста база, како штп се [[Натриум хидроксид|NaOH]] или [[Калиум хидроксид|KOH]]. Кога реакцијата е завршена, карбоксилатната сол се [[Ацидификација|закиселува]] при што ја ослободува слободната карбоксилна киселина. |
||
| Ред 35: | Ред 34: | ||
=== Неповратноста на хидролизата под физиолошки услови === |
=== Неповратноста на хидролизата под физиолошки услови === |
||
Под физиолошки услови (т.е. во разредени водени раствори), хидролитичката реакција на раскинување, каде концентрацијата на метаболитички прекурсор е ниска (од редот на 10<sup> |
Под физиолошки услови (т.е. во разредени водени раствори), хидролитичката реакција на раскинување, каде концентрацијата на метаболитички прекурсор е ниска (од редот на 10<sup>−3</sup> до 10<sup>−6</sup> молови), е есенцијално термодинамички [[Термодинамика|неповратна]]. На пример: |
||
:A + H<sub>2</sub>O → X + Y |
:A + H<sub>2</sub>O → X + Y |
||
| Ред 47: | Ред 46: | ||
нека K<sub>d</sub>×W = k: |
нека K<sub>d</sub>×W = k: |
||
тогаш <math> x = \frac {-k + \sqrt {k^2 + 4kC} } {2} </math> |
тогаш <math> x = \frac {-k + \sqrt {k^2 + 4kC} } {2} </math> |
||
За вредност од C = 0,001 мола, и k = 1 мол, ''x''/C > 0,999. Помалку од 0,1% од првобитниот реактант ќе биде присутен штом реакцијата ќе заврши. |
За вредност од C = 0,001 мола, и k = 1 мол, ''x''/C > 0,999. Помалку од 0,1% од првобитниот реактант ќе биде присутен штом реакцијата ќе заврши. |
||
| Ред 62: | Ред 61: | ||
{{Нормативна контрола}} |
{{Нормативна контрола}} |
||
[[Категорија:Хемиски реакции]] |
[[Категорија:Хемиски реакции]] |
||
Преработка од 00:49, 18 јуни 2021
- Да не се помеша со електролиза, честиот метод за производство на гасовит водород од вода.

Хидролиза е хемиска реакција во која една молекула се дели на два дела при реакција со молекула на вода, која има хемиска формула H2O. Еден од деловите на поделената молекула добива OH- јон од молекулата на водата, додека другиот дел добива H+ јон од водата.
Оваа реакција е различна од реакцијата на хидратација, во која водените молекули се адираат на супстанца, но делење на молекулата воопшто не се случува. Во органската хемија, хидролизата може да се смета како спротивен процес на реакцијата на кондензација, процес во кој два молекуларни фрагменти се спојуваат за сметка на секоја молекула вода која се создава. Бидејќи хидролизата е повратна реакција, кондензацијата и хидролизата може да се случат во исто време, со положбата на рамнотежа која ја детерминира количината на секој продукт. Во неорганската хемија, овој збор често се користи за раствори на соли и реакциите при кои тие се претвораат во нови јонски соединенија или во талози (оксиди, хидроксиди или соли). Некои примери на хидролиза се објаснети подолу.
Примери на хидролиза
Хидролиза на метални соли
Многу метални јони се силни Луисови киселини и во вода тие може да подлежат на хидролиза при што се образуваат базни соли. Таквите соли содржат хидроксилна група која е директно поврзана со металниот јон на местото на водна лиганда. На пример, алуминиум хлоридот подлежи на екстензивна хидролиза во вода, таква што pH на растворот постанува мошне кисела:

Ова значи дека доколку растворите на AlCl3 евапорираат, хлороводородната киселина се губи и резултатот е базна сол (во овој случај, оксихлорид) наместо AlCl3. Вакво хемиско однесување се огледува и кај други метални хлориди, како ZnCl2, SnCl2, FeCl3 и лантаноидните халиди, како DyCl3. Со некои соединенија, како TiO4, хидролизата може целосно да се одвива и се формира чист хидроксид или оксид, во овој случај TiO2.
Хидролиза на естерска врска
Во хидролитичка реакција при која се раскинува естерска врска, еден хидролитички продукт содржи хидроксилна функционална група, додека другиот содржи карбоксилна група.
Делот (фрагментот) од родителската молекула кој првобитно бил карбоксилат добива водороден јон од додатна молекула на вода. Делот, пак, кој бил првобитно алкил група ја собира останатата хидроксилна група од водената молекула. Ова е ефективно обратен процес на естерификацијата, при што се добива оригиналниот алкохол и карбоксилна киселина повторно.
Постојат два главни методи за хидролиза на естери, базната хидролиза и киселинско - катализираната. При киселинско - катализираната хидролиза се користи разредена киселина за да ја протонира карбонилната група со цел да ја активира кон нуклеофилен напад од молекула на вода. Но, повообичаениот метод за естерска хидролиза вклучува рефлуксирање на естерот со водеста база, како штп се NaOH или KOH. Кога реакцијата е завршена, карбоксилатната сол се закиселува при што ја ослободува слободната карбоксилна киселина.
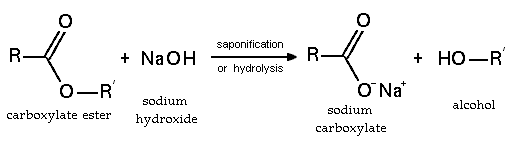
Важен пример на оваа реакција е ослободувањето на масни киселини од глицерол во триглицеридната хидролиза, што се случува за време на сапонификацијата.
Хидролиза на амидни врски
Во друга хидролитичка реакција, како што е хидролизата на амидна врска во карбоксилна киселина и амински продукт амонијак, само продуктот карбоксилна киселина има хидроксилна група добиена од водата. Аминскиот продукт (т.е. амонијакот) го добива останатиот водороден јон. Поспецифичен случај на хидролизата на амидна врска е хидролизирање на пептидните врски на аминокиселините.
Неповратноста на хидролизата под физиолошки услови
Под физиолошки услови (т.е. во разредени водени раствори), хидролитичката реакција на раскинување, каде концентрацијата на метаболитички прекурсор е ниска (од редот на 10−3 до 10−6 молови), е есенцијално термодинамички неповратна. На пример:
- A + H2O → X + Y
Претпоставувајќи дека x е крајната концентрација на продуктите и дека C е почетната концентрација на A, и W = = [H2O] = 55.5 мола, тогаш x може да се пресмета со равенката:
нека Kd×W = k:
тогаш
За вредност од C = 0,001 мола, и k = 1 мол, x/C > 0,999. Помалку од 0,1% од првобитниот реактант ќе биде присутен штом реакцијата ќе заврши.
Темата за физиолошката неповратност на хидролизата се користи главно во метаболитичките патишта, бидејќи многу биолошки процеси се водени од цепењето на анхидридните пирофосфатни врски.
Поврзано
|

![{\displaystyle K_{d}={\frac {\left[X\right]\left[Y\right]}{\left[H_{2}O\right]\left[A\right]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b8fea205c065386d62449014cdc8b36d8cb12857)

