Цезиум бромид
| |

| |
Назив според МСЧПХ Цезиум бромид | |
Други називи Цезиум бромид, | |
| Назнаки | |
|---|---|
| 7787-69-1 | |
| ChemSpider | 22994 |
| EC-број | 232-130-0 |
| |
| 3Д-модел (Jmol) | Слика |
| PubChem | 24592 |
| |
| UNII | 06M25EDM3F |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | Бела кристална супстанца |
| Густина | 4.43 g/cm3[1] |
| Точка на топење | |
| Точка на вриење | |
| 1230 g/L (25 °C)[1] Спорно.
420 g/L (11 °C) | |
| -67.2·10−6 cm3/mol[2] | |
| Показател на прекршување (nD) | 1.8047 (0.3 µm) 1.6974 (0.59 µm) 1.6861 (0.75 µm) 1.6784 (1 µm) 1.6678 (5 µm) 1.6439 (20 µm)[3] |
| Структура | |
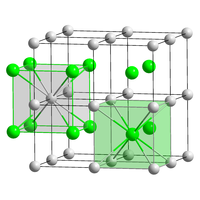
| Кристална структура | CsCl, cP2 |
| Pm3m, No. 221[4] | |
| Кубична (Cs+) Кубична (Br−) | |
| Опасност | |
| GHS-ознаки: | |
Пиктограми
|

|
Сигнални зборови
|
Предупредување |
Изјави за опасност
|
H302, H315, H319, H335 |
Изјави за претпазливост
|
P261, P264, P270, P271, P280, P301+P312, P302+P352, P304+P340, P305+P351+P338, P312, P321, P330, P332+P313, P337+P313, P362, P403+P233, P405, P501 |
| NFPA 704 | |
| Температура на запалување | Non-flammable |
| Смртоносна доза или концентрација: | |
LD50 (средна доза)
|
1400 mg/kg (орално, стаорец)[5] |
| Слични супстанци | |
| Други анјони | Цезиум флуорид Цезиум хлорид Цезиум јодид Цезиум астатид |
| Други катјони | Натриум бромид Натриум бромид Натриум бромид Натриум бромид |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Цезиум бромид — јонско соединение на цезиум и бром со хемиска формула CsBr. Тоа е бела или провидна цврста супстанца со точка на топење од 636 °C што лесно се раствара во вода. Неговите кристали имаат кубична структура на CsCl, но структурата се менува во типот кој го има камената сол кога е во нанометарски тенок филм кој се одгледува на супстрати од микашист, LiF, KBr или NaCl.[6]
Synthesis
[уреди | уреди извор]Цезиум бромид може да се подготви преку следните реакции:
- CsOH (aq) + HBr (aq) → CsBr (aq) + H2O (l)
- Cs2(CO3) (aq) + 2 HBr (aq) → 2 CsBr (aq) + H2O (l) + CO2 (g)
- Дирекртна синтеза:
- 2 Cs (s) + Br2 (g) → 2 CsBr (s)
Директната синтеза е енергична реакција на цезиумот со други халогени. Поради високата цена, не се користи за подготовка.
Употреба
[уреди | уреди извор]Цезиум бромидот понекогаш се користи во оптика како компонента на разделувачот на зракот во спектрофотометрите со широк опсег.
Наводи
[уреди | уреди извор]- ↑ 1,0 1,1 1,2 Haynes, p. 4.57
- ↑ Haynes, p. 4.132
- ↑ Haynes, p. 10.240
- ↑ Vallin, J.; Beckman, O.; Salama, K. (1964). „Elastic Constants of CsBr and CsI from 4.2°K to Room Temperature“. Journal of Applied Physics. 35 (4): 1222. Bibcode:1964JAP....35.1222V. doi:10.1063/1.1713597.
- ↑ Caesium bromide. nlm.nih.gov
- ↑ Schulz, L. G. (1951). „Polymorphism of cesium and thallium halides“. Acta Crystallographica. 4 (6): 487–489. doi:10.1107/S0365110X51001641.
Цитирани извори
[уреди | уреди извор]- Haynes, William M., уред. (2011). CRC Handbook of Chemistry and Physics (XCII. изд.). Boca Raton, FL: CRC Press. ISBN 1439855110.
Надворешни врски
[уреди | уреди извор] Цезиум бромид на Ризницата ?
Цезиум бромид на Ризницата ?- MSDS at Oxford University Архивирано на 17 октомври 2007 г.
- Crystran Physical data Архивирано на 18 декември 2012 г., IR transmission spectrum
- Ultra-violet photoabsorption measurements in alkali iodide and caesium bromide evaporated films
| ||||||
| ||||||||||||||||||||||||||||||||||
|

