Хипохлорит
Во хемијата, хипохлоритот е анјон со хемиска формула ClO- . Се комбинира со голем број катјони и формира хипохлоритни соли. Вообичаени примери вклучуваат натриум хипохлорит ( белило за домаќинство) и калциум хипохлорит (компонента на прашок за белење, базен „хлор“).[1] Растојанието Cl-O во ClO − е 1,69 Å.[2]
Името може да се однесува и на естри на хипохлорна киселина, имено органски соединенија со ClO- група ковалентно врзана за остатокот од молекулата. Главниот пример е терц-бутил хипохлорит, кој е корисен агенс за хлорирање.[3]
Повеќето хипохлоритни соли се постапуваат како водени раствори . Нивната примарна примена се како средства за белење, дезинфекција и третман на вода . Тие се користат и во хемијата за реакции на хлорирање и оксидација .
Реакции[уреди | уреди извор]
Кисела реакција[уреди | уреди извор]
Закиселувањето на хипохлоритите генерира хипохлорна киселина, која постои во рамнотежа со хлорот. Високата pH вредност ја придвижува реакцијата налево:
- 2 H+</br> + ClO−</br> + Cl−</br> ⇌ Cl2</br> Cl2 + H2O</br> H2O
Стабилност[уреди | уреди извор]
Хипохлоритите се генерално нестабилни и многу соединенија постојат само во раствор. Литиум хипохлорит LiOCl, калциум хипохлорит Ca(OCl) 2 и бариум хипохлорит Ba(ClO) 2 се изолирани како чисти безводни соединенија. Сите се цврсти. Може да се произведат уште неколку како водени раствори . Општо земено, колку е поголемо разредувањето, толку е поголема нивната стабилност. Не е можно да се одредат трендовите за соли на алкалните метали, бидејќи многу од нив не можат да се формираат. Берилиум хипохлорит е нечуен. Не може да се подготви чист магнезиум хипохлорит; сепак, цврстиот Mg(OH)OCl е познат.[4] Калциум хипохлоритот се произведува на индустриско ниво и има добра стабилност. Стронциум хипохлоритот, Sr(OCl) 2, не е добро карактеризиран и неговата стабилност сè уште не е одредена.[5]
При загревање, хипохлоритот се разградува до мешавина од хлорид, кислород и хлорати :
- 2 ClO−</br> → 2 Cl−</br> + O2</br> O2
- 3 ClO−</br> → 2 Cl−</br> + ClO−
3</br> ClO−
3
Оваа реакција е егзотермна и во случај на концентрирани хипохлорити, како што се LiOCl и Ca(OCl) 2, може да доведе до опасно термичко бегство и потенцијални експлозии.[6][7]
Хипохлоритите на алкалните метали ја намалуваат стабилноста низ групата . Безводниот литиум хипохлорит е стабилен на собна температура; сепак, натриум хипохлоритот не е подготвен посув од пентахидратот (NaOCl·( H2O ) 5 ). Ова е нестабилно над 0 °C;[8] иако поразредените раствори што се среќаваат како белило за домаќинство имаат подобра стабилност. Калиум хипохлорит (KOCl) е познат само во раствор.[4]
Хипохлоритите на лантанид се исто така нестабилни; сепак, тие се пријавени како постабилни во нивните безводни форми отколку во присуство на вода.[9] Хипохлоритот се користи за оксидација на цериум од неговата оксидациска состојба +3 до +4.[10]
Самата хипохлорна киселина не е стабилна изолирано бидејќи се распаѓа и формира хлор . Неговото распаѓање резултира и со некаква форма на кислород.
Реакции со амонијак[уреди | уреди извор]
Хипохлоритите реагираат со амонијак прво давајќи монохлорамин ( NH2Cl</br> NH2Cl ), потоа дихлорамин ( NHCl2</br> NHCl2 ), и на крајот азот трихлорид ( NCl3</br> NCl3 ).[1]
- NH3 + ClO− → HO− + NH2Cl
- NH2Cl + ClO− → HO− + NHCl2
- NHCl2 + ClO− → HO− + NCl3
Подготовка[уреди | уреди извор]
Хипохлоритни соли[уреди | уреди извор]
Хипохлоритни соли настанати од реакцијата помеѓу хлорот и хидроксидите на алкалните и земноалкалните метали. Реакцијата се изведува на блиску до собна температура за да се потисне формирањето на хлорати . Овој процес е широко користен за индустриско производство на натриум хипохлорит (NaClO) и калциум хипохлорит (Ca(ClO) 2 ).
- Cl 2 + 2 NaOH → NaCl + NaClO + H 2 O
- 2 Cl 2 + 2 Ca(OH) 2 → CaCl 2 + Ca(ClO) 2 + 2 H 2 O
Големи количини на натриум хипохлорит се произведуваат и електрохемиски преку неразделен процес на хлоралкали . Во овој процес саламурата се електролизира за да се формира Cl2</br> Cl2 кој се дисоцира во вода за да формира хипохлорит. Оваа реакција мора да се спроведе во некисели услови за да се спречи ослободување на хлор:
- 2 Cl−</br> → Cl2</br> Cl2 + 2 e −
- Cl2 + H2O ⇌ HClO + Cl− + H+
Некои хипохлорити може да се добијат и со реакција на метатеза на сол помеѓу калциум хипохлорит и разни метални сулфати . Оваа реакција се изведува во вода и се потпира на формирање на нерастворлив калциум сулфат, кој ќе таложи надвор од растворот, доведувајќи ја реакцијата до крај.
- Ca(ClO) 2 + MSO 4 → M(ClO) 2 + CaSO 4
Органски хипохлорити[уреди | уреди извор]
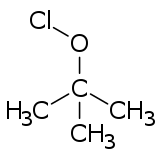
Хипохлоритните естери генерално се формираат од соодветните алкохоли, со третман со кој било од голем број реагенси (на пр. хлор, хипохлорна киселина, дихлор моноксид и разни закиселени хипохлоритни соли).[3]
Биохемија[уреди | уреди извор]
Биосинтеза на органохлорни соединенија[уреди | уреди извор]
Хлоропероксидазите се ензими кои го катализираат хлорирањето на органските соединенија. Овој ензим ги комбинира неорганските супстрати хлорид и водород пероксид за да произведе еквивалент на Cl +, кој заменува протон во јаглеводородна супстрат:
- RH + Cl − + H 2 O 2 + H + → R-Cl + 2 H 2 O
Изворот на "Cl + " е хипохлорна киселина (HOCl).[12] Многу органохлорни соединенија се биосинтетизираат на овој начин.
Имунолошки одговор[уреди | уреди извор]
Како одговор на инфекцијата, човечкиот имунолошки систем генерира мали количества хипохлорит во посебни бели крвни зрнца, наречени неутрофилни гранулоцити .[13] Овие гранулоцити ги голтаат вирусите и бактериите во внатреклеточната вакуола наречена фагозом, каде што се вари.
Дел од механизмот за варење вклучува ензимски респираторен излив, кој произведува реактивни соединенија добиени од кислород, вклучително и супероксид (кој се произведува од NADPH оксидаза ). Супероксидот се распаѓа до кислород и водород пероксид, кој се користи во реакција катализирана од миелопероксидаза за претворање на хлоридот во хипохлорит.[14][15][16]
Утврдено е дека ниските концентрации на хипохлорит стапуваат во интеракција со белковините од топлински шок на микробите, стимулирајќи ја нивната улога како интра-клеточен придружник и предизвикувајќи бактериите да се формираат во грутки (слично како јајце што е варено) кои на крајот ќе изумрат.[17] Истата студија покажа дека ниските (микромоларни) нивоа на хипохлорит предизвикуваат E. coli и Vibrio cholerae да активираат заштитен механизам, иако неговите импликации не беа јасни.[17]
Во некои случаи, базната киселост на хипохлоритот ја загрозува липидната мембрана на бактеријата, реакција слична на пукање на балон.
Индустриска и домашна употреба[уреди | уреди извор]
Хипохлоритите, особено на натриумот („течно белило“, „вода од џавел“) и калциумот („прашок за белење“) се широко користени, индустриски и домашно, за избелување на облеката, осветлување на бојата на косата и отстранување на дамки . Тие беа првите комерцијални производи за белење, развиени набргу откако тој имот беше откриен во 1785 година од францускиот хемичар Клод Бертоле .
Хипохлоритите се исто така широко користени како средства за дезинфекција со широк спектар и дезодоранси . Таа примена започнала набргу откако францускиот хемичар Лабарак ги открил тие својства, околу 1820 година (сè уште пред Пастер да ја формулира својата бактериска теорија за болеста).
Лабораториски употреби[уреди | уреди извор]
Како оксидирачки агенси[уреди | уреди извор]
Хипохлоритот е најсилниот оксидирачки агенс на хлор оксијаните. Ова може да се види со споредување на стандардните потенцијали на половина ќелии низ серијата; Податоците покажуваат и дека хлор оксијаните се посилни оксидатори во кисели услови.
| Јон | Кисела реакција | E ° (V) | Неутрална/основна реакција | E ° (V) |
|---|---|---|---|---|
| Хипохлорит | H + + HOCl + e − → Cl 2 ( g ) + H 2 O | 1.63 | ClO − + H 2 O + 2 e − → Cl − + 2OH − | 0,89 |
| Хлорит | 3 H + + HOClO + 3 e − → Cl 2 ( g ) + 2 H 2 O | 1.64 | ClO− 2</br> ClO− 2 + 2 H 2 O + 4 e − → Cl − + 4 О − |
0,78 |
| Хлорат | 6 H + + ClO− 3</br> ClO− 3 + 5 e − → Cl 2 ( g ) + 3 H 2 O |
1.47 | ClO− 3</br> ClO− 3 + 3 H 2 O + 6 e − → Cl − + 6 О − |
0,63 |
| Перхлорат | 8 H + + ClO− 4</br> ClO− 4 + 7 e − → Cl 2 ( g ) + 4 H 2 O |
1.42 | ClO− 4</br> ClO− 4 + 4 H 2 O + 8 e − → Cl − + 8 О − |
0,56 |
Хипохлоритот е доволно силен оксидатор за претворање на Mn(III) во Mn(V) за време на реакцијата на епоксидација на Јакобсен и за претворање Ce3+</br> до Ce4+</br> .[10] Оваа оксидирачка моќ е она што ги прави ефективни средства за белење и средства за дезинфекција.
Во органската хемија, хипохлоритите може да се користат за оксидација на примарните алкохоли до карбоксилни киселини .[18]
Како средства за хлорирање[уреди | уреди извор]
Хипохлоритните соли можат да послужат и како средства за хлорирање . На пример, тие ги претвораат фенолите во хлорофеноли. Калциум хипохлоритот го претвора пиперидин во <i id="mwAaI">N</i> -хлоропиперидин .
Поврзани оксијаниони[уреди | уреди извор]
Хлорот може да биде јадро на оксианиони со оксидациски состојби од -1, +1, +3, +5 или +7. (Елементот може да претпостави и состојба на оксидација од +4 се гледа во неутралното соединение хлор диоксид ClO 2 ).
| Состојба на оксидација на хлор | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| Име | хлорид | хипохлорит | хлорит | хлорат | перхлорат |
| Формула | Cl − | ClO - | ClO− 2</br> ClO− 2 |
ClO− 3</br> ClO− 3 |
ClO− 4</br> ClO− 4 |
| Структура | 
|

|

|
Поврзано[уреди | уреди извор]
- ↑ 1,0 1,1 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. изд.). Butterworth-Heinemann. ISBN 0080379419.
- ↑ Topić, Filip; Marrett, Joseph M.; Borchers, Tristan H.; Titi, Hatem M.; Barrett, Christopher J.; Friščić, Tomislav (2021). „After 200 Years: The Structure of Bleach and Characterization of Hypohalite Ions by Single-Crystal X-Ray Diffraction“. Angew. Chem. Int. Ed. 60 (46): 24400–24405. doi:10.1002/anie.202108843. PMID 34293249 Проверете ја вредноста
|pmid=(help). - ↑ 3,0 3,1 Mintz, M. J.; C. Walling (1969). „t-Butyl hypochlorite“. Organic Syntheses. 49: 9. doi:10.15227/orgsyn.049.0009.
- ↑ 4,0 4,1 Aylett, founded by A.F. Holleman ; continued by Egon Wiberg ; translated by Mary Eagleson, William Brewer ; revised by Bernhard J. (2001). Inorganic chemistry (1 English ed., [edited] by Nils Wiberg.. изд.). San Diego, Calif. : Berlin: Academic Press, W. de Gruyter. стр. 444. ISBN 978-0123526519.
- ↑ Ropp, Richard (2012). Encyclopedia of the Alkaline Earth Compounds. Newnes. стр. 76. ISBN 978-0444595539.
- ↑ Ropp, Richard C. (2012-12-31). Encyclopedia of the alkaline earth compounds. Oxford: Elsevier Science. стр. 75. ISBN 978-0444595539.
- ↑ Clancey, V.J. (1975). „Fire hazards of calcium hypochlorite“. Journal of Hazardous Materials. 1 (1): 83–94. doi:10.1016/0304-3894(75)85015-1.
- ↑ Brauer, G. (1963). Handbook of Preparative Inorganic Chemistry; Vol. 1 (2. изд.). Academic Press. стр. 309.
- ↑ Vickery, R. C. (1 April 1950). „Some reactions of cerium and other rare earths with chlorine and hypochlorite“. Journal of the Society of Chemical Industry. 69 (4): 122–125. doi:10.1002/jctb.5000690411.
- ↑ 10,0 10,1 V. R. Sastri; и др. (2003). Modern Aspects of Rare Earths and their Complexes (1. изд.). Burlington: Elsevier. стр. 38. ISBN 978-0080536682.
- ↑ Simpkins, Nigel S.; Cha, Jin K. (2006). „t-Butyl Hypochlorite“. Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rb388.pub2. ISBN 0471936235.
- ↑ Hofrichter, M.; Ullrich, R.; Pecyna, Marek J.; Liers, Christiane; Lundell, Taina (2010). „New and classic families of secreted fungal heme peroxidases“. Appl Microbiol Biotechnol. 87 (3): 871–897. doi:10.1007/s00253-010-2633-0. PMID 20495915.
- ↑ Marcinkiewicz, Janusz; Kontny, Ewa (2014). „Taurine and inflammatory diseases“. Amino Acids. 46 (1): 7–20. doi:10.1007/s00726-012-1361-4. PMC 3894431. PMID 22810731.
- ↑ Harrison, J. E.; J. Schultz (1976). „Studies on the chlorinating activity of myeloperoxidase“. Journal of Biological Chemistry. 251 (5): 1371–1374. doi:10.1016/S0021-9258(17)33749-3. PMID 176150.
- ↑ Thomas, E. L. (1979). „Myeloperoxidase, hydrogen peroxide, chloride antimicrobial system: Nitrogen-chlorine derivatives of bacterial components in bactericidal action against Escherichia coli“. Infect. Immun. 23 (2): 522–531. doi:10.1128/IAI.23.2.522-531.1979. PMC 414195. PMID 217834.
- ↑ Albrich, JM; McCarthy, CA; Hurst, JK (January 1981). „Biological reactivity of hypochlorous acid: implications for microbicidal mechanisms of leukocyte myeloperoxidase“. Proceedings of the National Academy of Sciences of the United States of America. 78 (1): 210–4. Bibcode:1981PNAS...78..210A. doi:10.1073/pnas.78.1.210. PMC 319021. PMID 6264434.
- ↑ 17,0 17,1 Jakob, U.; J. Winter; M. Ilbert; P.C.F. Graf; D. Özcelik (14 November 2008). „Bleach Activates A Redox-Regulated Chaperone by Oxidative Protein Unfolding“. Cell. Elsevier. 135 (4): 691–701. doi:10.1016/j.cell.2008.09.024. PMC 2606091. PMID 19013278.
- ↑ Warren, Jonathan Clayden, Nick Greeves, Stuart (2012-03-15). Organic chemistry (2. изд.). Oxford: Oxford University Press. стр. 195. ISBN 978-0-19-927029-3.
