Хлорат
| |

| |
Други називи хлорат(V) | |
| Назнаки | |
|---|---|
| 14866-68-3 | |
| ChEBI | CHEBI:49709 јон CHEBI:23109 класа на соли |
| ChemSpider | 94578 |
| 1491 | |
| |
| 3Д-модел (Jmol) | Слика |
| PubChem | 104770 |
| |
| UNII | 08Z8093742 |
| ОН-бр. | 1461 |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Структура | |
| Геометрија на молекулата | триаголна пирамидална |
| Опасност | |
| Безбедност при работа: | |
Главни опасности
|
оксиданс |
| Слични супстанци | |
| Други анјони | |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Хлорати — хемиски соединенија, соли на хлорната киселина[1] кои го содржат хлоратниот анјон (ClO3-). Хлорниот атом има оксидациски број +5. Кога е проследен од римска бојка во загради се однесува на даден оксианјон на хлорот.
Хлоратните анјони имаат триаголни пирамидални структури.
Хлоратите се моќни оксиданси и треба да се чуваат подалеку од органски или лесно оксидирачки материјали. Смесите на хлоратни соли со било кој запалив материјал (шеќер, дрвесина, дрвен јаглен, органски растворувачи, метали итн.) лесно дефлагрираат. Од оваа причина, хлоратите своевремено се користеле во пиротехниката, но денес претежно се заменети со перхлорати поради нивната нестабилност.
Структура и врски
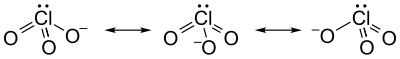
[уреди | уреди извор]Хлоратниот јон не може да се претстви задоволително со само една Луисова структура бидејќи сите врски Cl–O имаат иста должина (1,49 Å во калиум хлоратот[2]), а хлорниот атом е хипервалентен. Наместо тоа, овој јон се смета за мешавина од повеќе резонантни структури:
Добивање
[уреди | уреди извор]Лабораториско
[уреди | уреди извор]Металните хлорати се добиваат со додавање на хлор во врели метални хидроксиди како KOH:
- 3 Cl2 + 6 KOH → 5 KCl + KClO3 + 3 H2O
Во оваа реакција, хлорот претрпува диспропорционирање — редукција и оксидација. Хлорот (оксид. бр.) образува хлорид Cl− (оксид. бр. −1) и хлорат(V) ClO−
3 (оксид. бр. +5). Реакцијата на ладни водести метални хидроксиди со хлород дава хлорид и хипохлорит (оксид. бр. +1).
Индустриско
[уреди | уреди извор]Индустриското добивање на натриум хлорат почнува со воден раствор на натриум хлорид (расол) наместо хлорен гас. Ако електролизната опрема допушта мешање на хлорот со натриум хидроксид, тогаш се јавува гореопишаната реакција на диспропорционирање. Загревањето на реактансите на 50–70 °C го прави струјата во електролизата.
Природна застапеност
[уреди | уреди извор]Во поново време е утврдено присуството на природни лежишта на хлорати во светот, а релативно големи концентрации се застапени во суви и хиперсуви подрачја.[3] Хлоратот измерен во дождовница покажува слична количина како перхлоратот. Се претпоставува дека хлоратот и перхлоратот може да имаат заеднички механизам на образување и да бидат дел од природен хлорен биохемиски циклус. Присуството на природен хлорат може да биде образложение за способноста на разни микроорганизми да го редуцираат хлоратот во хлорид. Еволуцијата на хлоратната редукција може да биде прастара појава бидејќи сите бактерии што редуцираат перхлорат исто така користат хлорат како завршен електронски прифатник.[4] Засега не се познати минерали во кои преовладува хлорат. Ова значи декахлоратниот анјон постои само како замена во познатите минерални видови или, во крајна мера, е присутен во пороисполнителните раствори.[5]
Во 2011 г. Технолошкиот институт на Џорџија извршил проучување во кое е утврдено присуството на магнезиум хлорат на планетата Марс.[6]
Соединенија (соли)
[уреди | уреди извор]Examples of chlorates include
- калиум хлорат, KClO3
- натриум хлорат, NaClO3
- магнезиум хлорат, Mg(ClO3)2
Други оксианјони
[уреди | уреди извор]Ако по зборот „хлорат“ следи римска бројка во загради, таа го означува оксидациската состојба (оксидавискиот број) на оксианјонот:
| Обично име | Систематско име | Оксид. бр. | Формула |
|---|---|---|---|
| хипохлорит | хлорат(I) | +1 | ClO− |
| хлорит | хлорат(III) | +3 | ClO− 2 |
| хлорат | хлорат(V) | +5 | ClO− 3 |
| перхлорат | хлорат(VII) | +7 | ClO− 4 |
Со овој запис, „хлорат“ значи било кој хлорен оксианјон. Обично „хлорат“ се однесува само на хлорот во оксидациска состојба +5.
Токсичност
[уреди | уреди извор]Хлоратите се релативно токсични, иако при редукција образуваат начелно безопасни хлориди.
Наводи
[уреди | уреди извор]- ↑ „хлорат“ — Лексикон на македонскиот јазик
- ↑ J. Danielsen; A. Hazell; F. K. Larsen (1981). „The structure of potassium chlorate at 77 and 298 K“. Acta Crystallogr. B. 37 (4): 913–915. doi:10.1107/S0567740881004573.
- ↑ Rao, B.; Hatzinger, P. B.; Böhlke, J. K.; Sturchio, N. C.; Andraski, B. J.; Eckardt, F. D.; Jackson, W. (2010). „Natural Chlorate in the Environment: Application of a New IC-ESI/MS/MS Method with a Cl18O3− Internal Standard“. Environ. Sci. Technol. 44 (22): 8429–8434. Bibcode:2010EnST...44.8429R. doi:10.1021/es1024228. PMID 20968289.
- ↑ Coates, J. D.; Achenbach, L. A. (2004). „Microbial perchlorate reduction: rocket-fuelled metabolism“. Nature Reviews Microbiology. 2 (July): 569–580. doi:10.1038/nrmicro926. PMID 15197392. S2CID 21600794.
- ↑ „Home“. mindat.org.
- ↑ „De l'EAU liquide répérée sur les pentes martiennes“. Le Temps. 28 септември 2015. Архивирано од изворникот на 2017-01-18. Посетено на 2023-02-11.
Надворешни врски
[уреди | уреди извор]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|