Олово(II) сулфид
| |

| |
Други називи Плумбус сулфид | |
| Назнаки | |
|---|---|
| 1314-87-0 | |
| ChemSpider | 14135 |
| EC-број | 215-246-6 |
| 3Д-модел (Jmol) | Слика |
| PubChem | 14819 |
| RTECS-бр. | OG4550000 |
| |
| UNII | 2425D15SYM |
| ОН-бр. | 3077 |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | Црно |
| Густина | 7.60 g/cm3[1] |
| Точка на топење | |
| Точка на вриење | |
| 2.6×10−11 kg/kg (calculated, at pH=7)[2] 8.6×10−7 kg/kg[3] | |
| −83.6·10−6 cm3/mol[4] | |
| Показател на прекршување (nD) | 3.91[5] |
| Структура | |
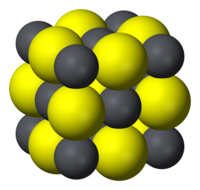
| Кристална структура | Халит (кубична), cF8 |
| Fm3m, No. 225 | |
| Octahedral (Pb2+) Octahedral (S2−) | |
| Диполен момент | 3.59 D[6] |
| Термохемија | |
| Ст. енталпија на формирање ΔfH |
-100.4 kJ/mol |
| Стандардна моларна ентропија S |
91.2 J/mol |
| Специфичен топлински капацитет, C | 49.5 J/mol⋅K |
| Опасност | |
| GHS-ознаки: | |
Пиктограми
|
  
|
Сигнални зборови
|
Опасност |
Изјави за опасност
|
H302, H332, H360, H373, H410 |
Изјави за претпазливост
|
P201, P202, P260, P261, P264, P270, P271, P273, P281, P301+P312, P304+P312, P304+P340, P308+P313, P312, P314, P330, P391, P405, P501 |
| NFPA 704 | |
| Температура на запалување | {{{value}}} |
| Безбедносен лист | External MSDS |
| Слични супстанци | |
| Други анјони | Олово(II) оксид Олово селенид Олово телурид |
| Други катјони | Јаглерод моносулфид Silicon monosulfide Германиум(II) сулфид Калај(II) сулфид |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Олово(II) сулфид е неорганска супстанца со формула PbS. Галена е главната руда и најважното соединение на олово. Тоа е полупроводен материјал со битна употреба.
Формирање, основни својства, сродни материјали[уреди | уреди извор]
Додавањето на водород сулфид или сулфидни соли во раствор кој содржи сол на олово, како што е PbCl2, gдава црн талог од олово сулфид.
- Pb2+ + H2S → PbS↓ + 2 H+
Оваа реакција се користи во квалитативна неорганска анализа. Присуството на водород сулфид или сулфидни јони може да се тестира со употреба на „олово ацетатна хартија“.
Како и сродните материјали PbSe и PbTe, PbS е полупроводник..[7] Всушност, оловниот сулфид бил еден од најраните материјали што се користел како полупроводник.[8] Оловото сулфид кристализира во присуство на мотиф од натриум хлорид, за разлика од многу други полупроводници од IV-VI група.
Со оглед на тоа што PbS е главната руда на олово, голем напор е насочен кон неговата конверзија. Главниот процес вклучува топење на PbS проследено со редукција на добиениот оксид. Идеализираните равенки за овие два чекори се:[9]
- 2 PbS + 3 O2 → 2 PbO + 2 SO2
- PbO + C → Pb + CO
Сулфур диоксидот се претвора во сулфурна киселина.
Наночестички[уреди | уреди извор]
Наночестичките и квантните точки што содржат олово сулфид се добро проучени.[10] Традиционално, таквите материјали се произведуваат со комбинирање на оловни соли со различни извори на сулфиди.[11][12] Во 2009 година, наночестичките PbS беа испитани за употреба во соларни ќелии.[13]
Употреба[уреди | уреди извор]


PbS беше еден од првите материјали користени за електрични диоди кои можеа да детектираат електромагнетно зрачење, вклучително и инфрацрвена светлина.[14] PbS беше еден од првите материјали користени за електрични диоди кои можеа да детектираат електромагнетно зрачење, вклучително и инфрацрвена светлина.[16] Како инфрацрвен сензор, PbS директно ја детектира светлината, за разлика од термичките детектори, кои реагираат на промената на температурата на елементот на детекторот предизвикана од зрачењето. Елементот PbS може да се користи за мерење на зрачењето на кој било од двата начина: со мерење на ситната фотоструја што ја предизвикуваат фотоните кога удираат во материјалот PbS или со мерење на промената во електричниот отпор на материјалот што ја предизвикуваат фотоните. Мерењето на промената на отпорот е најчесто користен метод. На собна температура, PbS е чувствителен на зрачење на бранови должини помеѓу приближно 1 и 2.5 μm. Овој опсег одговара на пократките бранови должини во инфра-црвениот дел од спектарот, таканаречениот инфрацрвен спектар на кратки бранови должини (SWIR). Само многу жешки објекти испуштаат зрачење во овие бранови должини.
Ладењето на PbS елементите, на пример, со користење на течен азот или систем со елементи на Пелтие, го менува опсегот на неговата чувствителност помеѓу приближно 2 и 4 μm. Објектите што испуштаат зрачење во овие бранови должини сè уште треба да бидат прилично жешки - неколку стотици степени Целзиусови - но не толку жешки како оние што можат да се забележат со неизладени сензори. (Други соединенија кои се користат за оваа намена вклучуваат индиум антимонид (InSb) и жива-кадмиум телурид (HgCdTe), кои имаат нешто подобри својства за откривање на подолгите IR бранови должини.) Високата диелектрична константа на PbS доведува до релативно бавни детектори (во споредба со силиконот, германиумот, InSb или HgCdTe).
Планетарна наука[уреди | уреди извор]
Висините над 2.6 km (1.63 mi) на планетата Венера се обложени со сјајна материја. Иако составот на овој слој не е сосема сигурен, една теорија е дека Венера „снежи“ кристализиран сулфид на олово исто како што на Земјата паѓа замрзната вода. Ако ова е случај, тоа ќе биде прв пат супстанција да биде идентификувана на друга планета. Други помалку веројатни кандидати за „снегот“ на Венера се бизмут сулфид и телур.[15]
Безбедност[уреди | уреди извор]
Оловото (II) сулфид е толку нерастворлив што е речиси нетоксичен, но пиролизата на материјалот, како и при топењето, дава опасни испарувања.[16] Оловото сулфид е нерастворлив и е стабилно соединение во pH вредноста на крвта и затоа веројатно е една од помалку токсичните форми на олово.[17] Голем безбедносен ризик се јавува при синтезата на PbS со користење на оловни карбоксилати, бидејќи тие се особено растворливи и може да предизвикаат негативни физиолошки состојби.
Наводи[уреди | уреди извор]
- ↑ 1,0 1,1 Haynes, p. 4.69
- ↑ Linke, W. (1965). Solubilities. Inorganic and Metal-Organic Compounds. 2. Washington, D.C.: American Chemical Society. стр. 1318.
- ↑ Ronald Eisler (2000). Handbook of Chemical Risk Assessment. CRC Press. ISBN 978-1-56670-506-6.
- ↑ Haynes, p. 4.128
- ↑ Haynes, p. 4.135
- ↑ Haynes, p. 9.63
- ↑ Vaughan, D. J.; Craig, J. R. (1978). Mineral Chemistry of Metal Sulfides. Cambridge: Cambridge University Press. ISBN 978-0-521-21489-6.;
- ↑ Hogan, C. Michael (2011). "Sulfur". in Encyclopedia of Earth, eds. A. Jorgensen and C.J. Cleveland, National Council for Science and the environment, Washington DC. Архивирано на 28 октомври 2012 г.
- ↑ Sutherland, Charles A.; Milner, Edward F.; Kerby, Robert C.; Teindl, Herbert; Melin, Albert; Bolt, Hermann M. (2005). „Lead“. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a15_193.pub2. ISBN 978-3527306732.
- ↑ „The Quantum Mechanics of Larger Semiconductor Clusters ("Quantum Dots")“. Annual Review of Physical Chemistry. 41 (1): 477–496. 1990-01-01. Bibcode:1990ARPC...41..477B. doi:10.1146/annurev.pc.41.100190.002401.
- ↑ Zhou, H. S.; Honma, I.; Komiyama, H.; Haus, Joseph W. (2002-05-01). „Coated semiconductor nanoparticles; the cadmium sulfide/lead sulfide system's synthesis and properties“. The Journal of Physical Chemistry (англиски). 97 (4): 895–901. doi:10.1021/j100106a015.
- ↑ Wang, Wenzhong; Liu, Yingkai; Zhan, Yongjie; Zheng, Changlin; Wang, Guanghou (2001-09-15). „A novel and simple one-step solid-state reaction for the synthesis of PbS nanoparticles in the presence of a suitable surfactant“. Materials Research Bulletin. 36 (11): 1977–1984. doi:10.1016/S0025-5408(01)00678-X.
- ↑ Lee, HyoJoong; Leventis, Henry C.; Moon, Soo-Jin; Chen, Peter; Ito, Seigo; Haque, Saif A.; Torres, Tomas; Nüesch, Frank; Geiger, Thomas (2009-09-09). „PbS and CdS Quantum Dot-Sensitized Solid-State Solar Cells: "Old Concepts, New Results"“. Advanced Functional Materials (англиски). 19 (17): 2735–2742. doi:10.1002/adfm.200900081. ISSN 1616-3028. S2CID 98631978.
- ↑ Putley, E H; Arthur, J B (1951). „Lead Sulphide – An Intrinsic Semiconductor“. Proceedings of the Physical Society. Series B. 64 (7): 616–618. doi:10.1088/0370-1301/64/7/110.
- ↑ „'Heavy metal' snow on Venus is lead sulfide“. Washington University in St. Louis. Архивирано од изворникот 2008-04-15. Посетено на 2009-07-07.
- ↑ „Lead sulfide MSDS“ (PDF). Архивирано од изворникот (PDF) на 2006-11-11. Посетено на 2009-11-20.
- ↑ Bischoff, Fritz; Maxwell, L. C.; Evens, Richard D.; Nuzum, Franklin R. (1928). „Studies on the Toxicity of Various Lead Compounds Given Intravenously“. Journal of Pharmacology and Experimental Therapeutics. 34 (1): 85–109.
Цитирани извори[уреди | уреди извор]
- Haynes, William M., уред. (2016). CRC Handbook of Chemistry and Physics (97th. изд.). CRC Press. ISBN 9781498754293.
Надворешни врски[уреди | уреди извор]
 Олово(II) сулфид на Ризницата ?
Олово(II) сулфид на Ризницата ?- Case Studies in Environmental Medicine (CSEM): Lead Toxicity
- ToxFAQs: Lead Архивирано на 5 октомври 1999 г.
- National Pollutant Inventory – Lead and Lead Compounds Fact Sheet
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

