Протеом
Протеом ― целокупниот сет на белковини што е, или може да биде изразен од геном, клетка, ткиво или организам во одредено време. Тоа е збир на изразени белковини во дадена врста на клетка или организам, во дадено време, под дефинирани услови. Протеомиката е проучување на протеомот.
Видови протеоми[уреди | уреди извор]
Додека протеомот воглавно се однесува на протеомот на организмот, многуклеточните организми може да имаат многу различни протеоми во различни клетки, па затоа е важно да бидат разликувани протеомите во клетките и организмите.
Клеточен протеом е збир на белковини кои се наоѓаат во одредена врста на клетка под одреден сет на услови во животната средина како што е изложеноста на стимулација на хормони.
Исто така, може да биде корисно да биде земен во предвид целосниот протеом на организмот, кој може да се конципира како целосен сет на белковини од сите различни клеточни протеоми. Ова е многу приближно белковински еднаков на геномот.
Поимот протеом исто така е користен за да се однесува на собирање на белковини во одредени подклеточни системи, како што се органелите. На пример, митохондрискиот протеом може да се состои од повеќе од 3000 различни белковини.[1] [2][3]
Белковините во вирусот можат да бидат наречени вирусен протеом. Обично вирусните протеоми се предвидуваат од вирусниот геном[4] но направени се некои обиди да бидат утврдени сите белковини изразени од геномот на вирусот, т.е. вирусниот протеом.[5] Почесто, сепак, вирусната протеомика ги анализира промените на белковините на домаќинот при вирусна инфекција, така што всушност се проучувани два протеома (на вирусот и неговиот домаќин).[6]
Важност кај ракот[уреди | уреди извор]
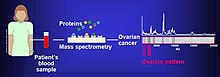
Протеомот може да биде користен за споредбена анализа на различни клеточни линии на рак. Користени се протеомски студии со цел да биде идентификувана веројатноста за метастази во клеточните линии на рак на мочниот меур KK47 и YTS1 и било откриено дека имаат 36 нерегулирани и 74 надолу регулирани белковини.[7] Разликите во белковинското изразување можат да помогнат да бидат идентификувани новите механизми за сигнализација за рак.
Биомаркерите на ракот се пронајдени со протеомски анализи засновани на масовна спектрометрија. Употребата на протеомика или проучувањето на протеомот е чекор напред во персонализираната медицина за приспособување на комбинирани лекови на специфичниот протеомски и геномски профил на пациентот.[8] Анализата на клеточните линии на рак на јајниците покажала дека наводните биомаркери за рак на јајниците се „α-енолаза, фактор на издолжување Tu, митохондриски (EFTU), глицералдехид-3-фосфатна дехидрогеназа, стрес-70 белковина, митохондриски (GRP75 ), аполипобелковина А-1 (APOA1), пероксиредоксин (PRDX2) и анексин А (ANXA)“.[9]
Споредбенитепротеомски анализи на 11 клеточни линии ја покажале сличноста помеѓу метаболичките постапки на секоја клеточна линија; 11.731 белковини биле целосно идентификувани од оваа студија. Белковините за домаќинство имаат тенденција да покажуваат поголема варијабилност помеѓу клеточните линии.[10]
Отпорноста на одредени лекови за рак сè уште не е добро разбрана. Протеомската анализа е користена со цел да бидат идентификувани белковините кои може да имаат антиканцерогени лекови, особено за лекот за рак на дебелото црево, иринотекан.[11] Студиите на клеточната линија на аденокарцином LoVo покажале дека 8 белковини биле нерегулирани, а 7 белковини биле надолно регулирани. Белковините кои покажале диференцијално изразување биле вклучени во постапки како што се транскрипција, апоптоза и клеточна пролиферација/диференцијација меѓу другите.
Протеомот во бактериските системи[уреди | уреди извор]
Извршени се протеомски анализи кај различни врсти бактерии за да бидат проценети нивните метаболички реакции на различни состојби. На пример, кај бактериите како што се Clostridium и Bacillus, биле користени протеомски анализи со цел да ги испитуваат како различните белковини помагаат на секоја од овие бактериски спори да виреат после подолг период на мирување.[12] Со цел подобро да биде разбрано како правилно да бидат елиминирани спорите, мора да биде извршена протеомска анализа.
Историја[уреди | уреди извор]
Марк Вилкинс го измислил поимот протеом (proteome)[13] во 1994 година во симпозиум на тема „Дводимензионална електрофореза: од белковински карти до геном“ (изворно: 2D Electrophoresis: from protein maps to genomes) одржан во Сиена во Италија. Зборот бил појавен во печатен облик во 1995 година,[14] со објавување на дел од неговата докторска теза. Вилкинс го користел поимот за да го опише целиот комплемент на белковини изразени од геном, клетка, ткиво или организам.
Големина и содржина[уреди | уреди извор]
Геномите на вирусите и прокариотите кодираат релативно добро дефиниран протеом бидејќи секоја белковина може да биде предвидена со голема сигурност, врз основа на неговата отворена рамка за читање (кај вируси кои се движат од ~3 до ~1000, кај бактерии кои се движат од околу 500 белковини до околу 10.000).[15] Сепак, повеќето алгоритми за предвидување на белковини користат одредени прекини, како што се 50 или 100 аминокиселини, така што малите белковини честопати се пропуштани од таквите предвидувања.[16] Кај еукариотите ова станува многу посложено бидејќи повеќе од една белковина може да биде произведена од повеќето гени поради алтернативно спојување (на пр. човечки протеом кодира околу 20.000 белковини, но некои проценки предвидувале 92.179 белковини од кои 71.173 се варијанти на спојување).[17]
Поврзаност на големината на протеомот со способноста за поправка на ДНК
Концептот на „протеомско ограничување“ е дека капацитетот за поправка на ДНК е во позитивна корелација со информациската содржина на геномот, што, пак, е приближно поврзано со големината на протеомот.[18] Кај бактериите, археите и ДНК вирусите, способноста за поправка на ДНК е позитивно поврзана со содржината на информации за геномот и со големината на геномот.[18] „Протеомско ограничување“ предлага модулаторите на стапките на мутации, како што се гените за поправка на ДНК, да подлежат на притисок на селекција пропорционален на количината на информации во геномот.[18]
Протеоформи
Постојат различни фактори кои можат да додадат варијабилност на белковините. Единечните аминокиселински полиморфизми) и несинонимни единечни нуклеотидни полиморфизми може да доведат до различни „протеоформи“[19] или „протеоморфи“. Неодамнешните проценки откриле околу 135.000 потврдени несинонимни планови за посебни потреби за хронична состојба моментално сместени во SwissProt. Во на податоци за единечен нуклеотиден полиморфизам, има 4,7 милиони кандидати со планови за посебни потреби за хронична состојба, но сепак само ~670.000 планови за посебни потреби за хронична состојба се потврдени во 1.000-геноми поставени како несинонимни планови за посебни потреби за хронична состојба кои го менуваат идентитетот на аминокиселина во белковината.[19]
Темен протеом
Поимот темен протеом измислен од Пердигао и неговите колеги, дефинира региони на белковини кои немаат хомологија на забележлива секвенца со други белковини со позната тродимензионална структура и затоа не можат да бидат моделирани со хомологија. За 546.000 белковини на Swiss-Prot, 44-54% од протеомот во еукариотите и вирусите било откриено дека е „темен“, во споредба со само ~14% во археите и бактериите.[20]
Човечки протеом
Во моментов, неколку проекти имаат за цел да го картираат човечкиот протеом, вклучувајќи ги и Картата на човечкиот протеом, ProteomicsDB, isoform.io и Проектот за човечки протеом. Слично како и Проектот за човечки геном, овие проекти се обидуваат да најдат и соберат докази за сите предвидени гени за кодирање на белковини во човечкиот геном. Картата на човечкиот протеом, согласно октомври 2020 година, тврди дека има 17.294 белковини и ProteomicsDB 15.479, користејќи различни критериуми. На 16 октомври 2020 година, Проектот за човечкиот геном објавил план со висока строгост[21] што опфаќа повеќе од 90% од предвидените гени за кодирање на белковини. Белковините се идентификувани од широк спектар на фетусни и возрасни ткива и врсти на клетки, вклучувајќи ги и хематопоетските клетки.
Методи за проучување на протеомот[уреди | уреди извор]

Анализата на белковините се покажува како потешка од анализата на секвенците на нуклеинските киселини. Додека има само 4 нуклеотиди кои ја сочинуваат ДНК, постојат најмалку 20 различни аминокиселини кои можат да сочинуваат белковина. Дополнително, во моментов не постои позната технологија со висока пропусна моќ за да се направат копии од една белковина. Достапни се бројни методи за проучување на белковина, групи на белковини или целиот протеом. Всушност, белковините често се проучувани индиректно, на пр. со помош на сметачки методи и анализи на геномите. Само неколку примери се дадени подолу.
Техники на одделување и електрофореза[уреди | уреди извор]
Протеомиката, проучувањето на протеомот, во голема мера е практикувана преку одвојување на белковините со дводимензионална гелска електрофореза. Во првата димензија, белковините се одделени со изоелектрично насочување, кое ги разрешува белковините врз основа на полнење. Во втората димензија, белковините се одвојувани по молекуларна тежина со помош на SDS-PAGE. Гелот е обоен со боите кумасиско брилијантно сина или сребрена за да бидат видени белковините. Точките на гелот се белковините кои се преселиле на одредени места.
Масена спектрометрија[уреди | уреди извор]

Масената спектрометрија е еден од клучните методи за проучување на протеомот.[22] Некои важни методи за масена спектрометрија вклучуваат масена спектрометрија со Orbitrap, матрично помогната ласерска десорпција/јонизација) и јонизација со електроспреј. Отпечатокот на пептидната маса ја идентификува белковината со негово расцепување на кратки пептиди и потоа го заклучува идентитетот на белковината со усогласување на набљудуваните пептидни маси со базата на податоци за секвенци. Од друга страна, тандемската масена спектрометрија може да добие информации за низата од поединечни пептиди со нивно изолирање, судир со нереактивен гас и потоа каталогизирање на произведените јони на фрагментот.[23]
Во мај 2014 година, нацрт-картата на човечкиот протеом била објавена во списанието Nature.[24] Оваа карта била создадена со помош на масена спектрометрија со Фурјева преобразба со висока резолуција. Оваа студија профилирала 30 хистолошки нормални човечки примероци што резултирало со идентификација на белковини кодирани од 17.294 гени. Ова претставува околу 84% од вкупните означени гени за кодирање на белковини.
Хроматографија[уреди | уреди извор]
Течната хроматографија е важна алатка во проучувањето на протеомот. Овозможува многу чувствително раздвојување на различни врсти белковини врз основа на нивниот афинитет за матрица. Некои понови методи за одвојување и идентификација на белковини вклучуваат употреба на едноделни капиларни столбови, хроматографија со висока температура и капиларна електрохроматографија.[25]
Саутернов метод[уреди | уреди извор]
Западниот Саутернов метод може да биде користен со цел да биде измерено изобилството на одредени белковини. Со користење на антитела специфични за белковината од интерес, можно е да биде испитано присуството на специфични белковини од мешавина на белковини.
Анализи за комплементација на белковини и меѓудејствувачки прегледи[уреди | уреди извор]
Тестовите за комплементација на белковински фрагмент често се користени за откривање на меѓудејствието белковина со белковина. Двохибридниот преглед на квасец е најпопуларен од нив, но има бројни варијации, и користени ин витро и ин виво. Тестовите за повлекување се метод за одредување со какви видови на белковини општи белковината.[26]
Предвидување на структурата на белковините[уреди | уреди извор]
Предвидувањето на структурата на белковините може да биде користено за да бидат обезбедени тридимензионални предвидувања на структурата на белковините на цели протеоми. Во 2022 година, големата соработка помеѓу EMBL-EBI и DeepMind обезбедила предвидени структури за над 200 милиони белковини од дрвото на животот.[27] Помалите проекти користеле и предвидување на структурата на белковините за да помогнат во картирањето на протеомот на поединечни организми, на пример, isoform.io обезбедува покривање на повеќе белковински изоформи за над 20.000 гени во човечкиот геном.[28]
Бази на податоци за белковини[уреди | уреди извор]
Атласот на човечките белковини содржи информации за човечките белковини во клетките, ткивата и органите. Сите податоци во ресурсот на знаење се отворени за да им овозможат на научниците и во академството и во индустријата слободно да пристапат до податоците за истражување на човечкиот протеом. Организацијата ELIXIR го избрала овој белковински атлас како основен ресурс поради неговата фундаментална важност за пошироката заедница на науката за животот.
Базата на податоци на плазмен протеом Архивирано на 27 јануари 2021 г. содржи информации за 10.500 белковина на крвната плазма. Бидејќи опсегот на содржината на белковини во плазмата е многу голем, тешко е да бидат забележани белковини кои имаат тежнеење да бидат ретки во споредба со изобилството белковини. Ова е аналитичка граница која можеби е пречка за откривање на белковини со крајно ниски концентрации.[29]
Базите на податоци како што се neXtprot и UniProt се средишни ресурси за човечки протеомски податоци.
Поврзано[уреди | уреди извор]
- Метаболом
- Цитом
- Биоинформатика
- Список на теми за омика во биологијата
- База на податоци за растителниот протеом
- Транскриптом
- Интерактом
- Проект за човечкиот протеом
- BioPlex
- Атлас на човечките белковини
Наводи[уреди | уреди извор]
- ↑ Johnson, D. T.; Harris, R. A.; French, S.; Blair, P. V.; You, J.; Bemis, K. G.; Wang, M.; Balaban, R. S. (2006). „Tissue heterogeneity of the mammalian mitochondrial proteome“. American Journal of Physiology. Cell Physiology. 292 (2): c689–c697. doi:10.1152/ajpcell.00108.2006. PMID 16928776.
- ↑ Morgenstern, Marcel; Stiller, Sebastian B.; Lübbert, Philipp; Peikert, Christian D.; Dannenmaier, Stefan; Drepper, Friedel; Weill, Uri; Höß, Philipp; Feuerstein, Reinhild (јуни 2017). „Definition of a High-Confidence Mitochondrial Proteome at Quantitative Scale“. Cell Reports. 19 (13): 2836–2852. doi:10.1016/j.celrep.2017.06.014. ISSN 2211-1247. PMC 5494306. PMID 28658629.
- ↑ Gómez-Serrano, M (ноември 2018). „Mitoproteomics: Tackling Mitochondrial Dysfunction in Human Disease“. Oxid Med Cell Longev. 2018: 1435934. doi:10.1155/2018/1435934. PMC 6250043. PMID 30533169.
- ↑ Uetz, P. (2004-10-15). „From ORFeomes to Protein Interaction Maps in Viruses“. Genome Research (англиски). 14 (10b): 2029–2033. doi:10.1101/gr.2583304. ISSN 1088-9051. PMID 15489322.
- ↑ Maxwell, Karen L.; Frappier, Lori (јуни 2007). „Viral proteomics“. Microbiology and Molecular Biology Reviews. 71 (2): 398–411. doi:10.1128/MMBR.00042-06. ISSN 1092-2172. PMC 1899879. PMID 17554050.
- ↑ Viswanathan, Kasinath; Früh, Klaus (декември 2007). „Viral proteomics: global evaluation of viruses and their interaction with the host“. Expert Review of Proteomics. 4 (6): 815–829. doi:10.1586/14789450.4.6.815. ISSN 1744-8387. PMID 18067418.
- ↑ Yang, Ganglong; Xu, Zhipeng; Lu, Wei; Li, Xiang; Sun, Chengwen; Guo, Jia; Xue, Peng; Guan, Feng (2015-07-31). „Quantitative Analysis of Differential Proteome Expression in Bladder Cancer vs. Normal Bladder Cells Using SILAC Method“. PLOS ONE. 10 (7): e0134727. Bibcode:2015PLoSO..1034727Y. doi:10.1371/journal.pone.0134727. ISSN 1932-6203. PMC 4521931. PMID 26230496.
- ↑ An, Yao; Zhou, Li; Huang, Zhao; Nice, Edouard C.; Zhang, Haiyuan; Huang, Canhua (2019-05-04). „Molecular insights into cancer drug resistance from a proteomics perspective“. Expert Review of Proteomics. 16 (5): 413–429. doi:10.1080/14789450.2019.1601561. ISSN 1478-9450. PMID 30925852.
- ↑ Cruz, Isa N.; Coley, Helen M.; Kramer, Holger B.; Madhuri, Thumuluru Kavitah; Safuwan, Nur a. M.; Angelino, Ana Rita; Yang, Min (2017-01-01). „Proteomics Analysis of Ovarian Cancer Cell Lines and Tissues Reveals Drug Resistance-associated Proteins“. Cancer Genomics & Proteomics (англиски). 14 (1): 35–51. doi:10.21873/cgp.20017. ISSN 1109-6535. PMC 5267499. PMID 28031236.
- ↑ Geiger, Tamar; Wehner, Anja; Schaab, Christoph; Cox, Juergen; Mann, Matthias (March 2012). „Comparative Proteomic Analysis of Eleven Common Cell Lines Reveals Ubiquitous but Varying Expression of Most Proteins“. Molecular & Cellular Proteomics. 11 (3): M111.014050. doi:10.1074/mcp.M111.014050. ISSN 1535-9476. PMC 3316730. PMID 22278370.
- ↑ Peng, Xing-Chen; Gong, Feng-Ming; Wei, Meng; Chen, Xi; Chen, Ye; Cheng, Ke; Gao, Feng; Xu, Feng; Bi, Feng (December 2010). „Proteomic analysis of cell lines to identify the irinotecan resistance proteins“. Journal of Biosciences (англиски). 35 (4): 557–564. doi:10.1007/s12038-010-0064-9. ISSN 0250-5991. PMID 21289438.
- ↑ Chen, Yan; Barat, Bidisha; Ray, W. Keith; Helm, Richard F.; Melville, Stephen B.; Popham, David L. (2019-03-15). „Membrane Proteomes and Ion Transporters in Bacillus anthracis and Bacillus subtilis Dormant and Germinating Spores“. Journal of Bacteriology (англиски). 201 (6). doi:10.1128/JB.00662-18. ISSN 0021-9193. PMC 6398275. PMID 30602489.
- ↑ Wilkins, Marc (декември 2009). „Proteomics data mining“. Expert Review of Proteomics. Англија. 6 (6): 599–603. doi:10.1586/epr.09.81. PMID 19929606.
- ↑ „Progress with gene-product mapping of the Mollicutes: Mycoplasma genitalium“. Electrophoresis. 16 (1): 1090–94. 1995. doi:10.1002/elps.11501601185. PMID 7498152.
- ↑ Kozlowski, LP (26 октомври 2016). „Proteome-pI: proteome isoelectric point database“. Nucleic Acids Research. 45 (D1): D1112–D1116. doi:10.1093/nar/gkw978. PMC 5210655. PMID 27789699.
- ↑ Leslie, Mitch (2019-10-18). „Outsize impact“. Science (англиски). 366 (6463): 296–299. Bibcode:2019Sci...366..296L. doi:10.1126/science.366.6463.296. ISSN 0036-8075. PMID 31624194.
- ↑ Uniprot, Consortium (2014). „UniProt: a hub for protein information“. Nucleic Acids Research. 43 (D1): D204–D212. doi:10.1093/nar/gku989. ISSN 0305-1048. PMC 4384041. PMID 25348405.
- ↑ 18,0 18,1 18,2 Acosta S, Carela M, Garcia-Gonzalez A, Gines M, Vicens L, Cruet R, Massey SE. DNA Repair Is Associated with Information Content in Bacteria, Archaea, and DNA Viruses. J Hered. септември-октомври 2015;106(5):644-59. doi: 10.1093/jhered/esv055. Epub 2015 Aug 29. PMID: 26320243
- ↑ 19,0 19,1 Aebersold, Ruedi; Agar, Jeffrey N; Amster, I Jonathan; Baker, Mark S; Bertozzi, Carolyn R; Boja, Emily S; Costello, Catherine E; Cravatt, Benjamin F; Fenselau, Catherine (март 2018). „How many human proteoforms are there?“. Nature Chemical Biology (англиски). 14 (3): 206–214. doi:10.1038/nchembio.2576. ISSN 1552-4450. PMC 5837046. PMID 29443976.
- ↑ Perdigão, Nelson; и др. (2015). „Unexpected features of the dark proteome“. PNAS. 112 (52): 15898–15903. Bibcode:2015PNAS..11215898P. doi:10.1073/pnas.1508380112. PMC 4702990. PMID 26578815.
- ↑ Adhikari, S (октомври 2020). „A high-stringency blueprint of the human proteome“. Nature Communications. 11 (1): 5301. Bibcode:2020NatCo..11.5301A. doi:10.1038/s41467-020-19045-9. PMC 7568584 Проверете ја вредноста
|pmc=(help). PMID 33067450 Проверете ја вредноста|pmid=(help). - ↑ Altelaar, AF; Munoz, J; Heck, AJ (јануари 2013). „Next-generation proteomics: towards an integrative view of proteome dynamics“. Nature Reviews Genetics. 14 (1): 35–48. doi:10.1038/nrg3356. PMID 23207911.
- ↑ Wilhelm, Mathias; Schlegl, Judith; Hahne, Hannes; Gholami, Amin Moghaddas; Lieberenz, Marcus; Savitski, Mikhail M.; Ziegler, Emanuel; Butzmann, Lars; Gessulat, Siegfried (2014). „Mass-Spectrometry-Based Draft of the Human Proteome“. Nature. 509 (7502): 582–7. Bibcode:2014Natur.509..582W. doi:10.1038/nature13319. PMID 24870543. Архивирано од изворникот на 2018-08-20. Посетено на 2024-02-04.
- ↑ Kim, Min-Sik; и др. (мај 2014). „A draft map of the human proteome“. Nature. 509 (7502): 575–81. Bibcode:2014Natur.509..575K. doi:10.1038/nature13302. PMC 4403737. PMID 24870542.
- ↑ Shi, Yang; Xiang, Rong; Horváth, Csaba; Wilkins, James A. (2004-10-22). „The role of liquid chromatography in proteomics“. Journal of Chromatography A. Bioanalytical Chemistry: Perspectives and Recent Advances with Recognition of Barry L. Karger. 1053 (1): 27–36. doi:10.1016/j.chroma.2004.07.044. ISSN 0021-9673. PMID 15543969.
- ↑ „Pull-Down Assays - US“. www.thermofisher.com (англиски). Посетено на 4 февруари 2024.
- ↑ Callaway, Ewen (2022-07-28). „'The entire protein universe': AI predicts shape of nearly every known protein“. Nature (англиски). 608 (7921): 15–16. Bibcode:2022Natur.608...15C. doi:10.1038/d41586-022-02083-2. PMID 35902752 Проверете ја вредноста
|pmid=(help). - ↑ Sommer, Markus J.; Cha, Sooyoung; Varabyou, Ales; Rincon, Natalia; Park, Sukhwan; Minkin, Ilia; Pertea, Mihaela; Steinegger, Martin; Salzberg, Steven L. (2022-12-15). „Structure-guided isoform identification for the human transcriptome“. eLife (англиски). 11: e82556. doi:10.7554/eLife.82556. PMC 9812405 Проверете ја вредноста
|pmc=(help). PMID 36519529 Проверете ја вредноста|pmid=(help). - ↑ Ponomarenko, Elena A.; Poverennaya, Ekaterina V.; Ilgisonis, Ekaterina V.; Pyatnitskiy, Mikhail A.; Kopylov, Arthur T.; Zgoda, Victor G.; Lisitsa, Andrey V.; Archakov, Alexander I. (2016). „The Size of the Human Proteome: The Width and Depth“. International Journal of Analytical Chemistry. 2016: 7436849. doi:10.1155/2016/7436849. ISSN 1687-8760. PMC 4889822. PMID 27298622.
Надворешни врски[уреди | уреди извор]
- База на податоци на PIR
- База на податоци на UniProt
- Архивирано на 6 мај 2011 г.
