Лимонска батерија
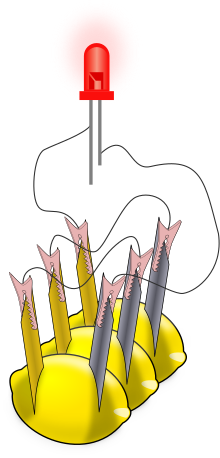
Лимонска батерија ― едноставна батерија која често се прави за образование. Вообичаено, парче цинков метал (како што е галванизирана шајка) и парче бакар (како монета) се вметнуваат во лимон и се поврзуваат со жици. Моќта створена од реакција на металите се користи за напојување на мал уред како што е светлечката диода.
Лимонската батерија е слична на првата електрична батерија измислена во 1800 година од Алесандро Волта, кој користел саламура (солена вода) наместо сок од лимон.[1] Батеријата со лимон го илустрира видот на хемиска реакција (оксидација-редукција) што се случува во батериите.[2][3][4] Цинкот и бакарот се наречени електроди, а сокот во лимонот е наречен електролит. Постојат многу врсти на лимонската ќелија кои користат различни плодови (или течности) како електролити и метали, освен цинк и бакар како електроди.
Употреба во училишни проекти[уреди | уреди извор]
Постојат бројни целосни инструкции за правење батерии од лимон и за добивање состојки како што се светлечки диоди, електрични броила (мултиметри) и клинци и завртки обложени со цинк (галванизирани).[5][6] Комерцијалните научни комплети „компиров часовник“ имаат електроди и нисконапонски дигитален часовник. Откако ќе се склопи една ќелија, може да се користи мултиметар за мерење на напонот или електричната струја од напонската ќелија; типичен напон е 0,9 V со лимони. Струите се попроменливи, но се движат до околу 1 mA (колку се поголеми површините на електродата, толку е поголема струјата). За повидлив ефект, ќелиите од лимон може да се поврзат во серија за да напојуваат светлечка диода (види илустрација) или други уреди. Низното поврзување го зголемува напонот достапен на уредите. Свартлинг и Морган објавиле список на уреди со низок напон заедно со соодветниот број на лимонски ќелии кои биле потребни за нивно напојување; тие вклучуваа светлечки диоди, пиезоелектрични звучници и мали дигитални часовници. Со електродите од цинк/бакар, потребни се најмалку две ќелии од лимон за кој било од овие уреди.[7] Замената на електрода од магнезиум за цинковата електрода прави ќелија со поголем напон (1,5−1,6 V), а една магнезиумска/бакарна ќелија ќе напојува некои уреди.[7] Забележете дека блескавите светилки од батериските ламби не се користени бидејќи батеријата со лимон не е дизајнирана да произведува доволно електрична струја за да ги запали. Со множење на просечната струја на лимонот (0,001A/ 1mA) со просечниот (најмал) напон (потенцијална разлика) на лимонот (0,7V) можеме да заклучиме дека ќе бидат потребни повеќе од 6 милиони лимони за да ни ја даде моќта на просечна батерија за автомобил од 4320 W.
Хемија[уреди | уреди извор]
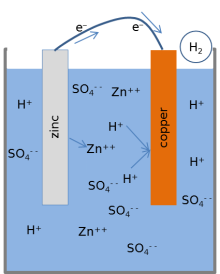
Повеќето учебници го прикажуваат следниов модел за хемиски реакции на батерија од лимон.[1][3][8] Кога ќелијата обезбедува електрична струја преку надворешно коло, металниот цинк на површината на цинковата електрода се раствора во растворот. Атомите на цинкот се раствораат во течниот електролит како електрично наелектризирани јони (Zn2+), оставајќи 2 негативно наелектризирани електрони (e−) во металот:
Оваа реакција е наречена оксидација. Додека цинкот влегува во електролитот, два позитивно наелектризирани водородни јони (H+) од електролитот се комбинираат со два електрони на површината на бакарната електрода и образуваат ненаполнета молекула на водород (H2):
Оваа реакција е наречена редукција. Електроните што се користени во бакарот за да се образуваат молекулите на водородот се пренесуваат од цинкот преку надворешна жица што се поврзува помеѓу бакарот и цинкот. Молекулите на водородот образувани на површината на бакарот со редукциската реакција на крајот се извлекуваат како водороден гас.
Опитни резултати[уреди | уреди извор]
Овој модел на хемиски реакции дава неколку предвидувања кои беа испитани во опитите објавени од Џери Гудисман во 2001 година. Гудисман забележува дека бројни неодамнешни автори предлагаат хемиски реакции за лимонската батерија кои вклучуваат растворање на бакарната електрода во електролитот. Гудисман ја исклучува оваа реакција како недоследна со опитите и забележува дека правилната хемија, која вклучува еволуција на водород во бакарната електрода, но исто така може да користи сребро наместо бакар, е позната многу години.[4] Повеќето од подробните предвидувања на моделот се однесуваат на напонот на батеријата што се мери директно со мултиметар; ништо друго не е поврзано со батеријата. Кога електролитот бил модифициран со додавање на цинк сулфат (ZnSO4), напонот од ќелијата бил намален како што било предвидено со користење на Нернстовата равенка за моделот. Нернстовата равенка суштински кажува колку напонот паѓа кога се додава повеќе цинк сулфат. Додавањето на бакар сулфат (CuSO4) не влијаело на напонот. Овој резултат е во согласност со фактот дека атомите на бакар од електродата не се вклучени во моделот на хемиска реакција за ќелијата.
Кога батеријата е приклучена на надворешно коло и тече значителна електрична струја, цинковата електрода губи маса, како што е предвидено со реакцијата на оксидација на цинкот погоре. Слично на тоа, водородниот гас еволуира како меурчиња од бакарната електрода. Конечно, напонот од ќелијата зависел од киселоста на електролитот, мерена со неговата pH вредност; намалувањето на киселоста (и зголемувањето на рН) предизвикува пад на напонот. Овој ефект е предвиден и со Нернстовата равенка; Конкретната киселина што била користена (лимонска, хлороводородна, сулфурна итн.) не влијае на напонот освен преку pH вредноста.
Предвидувањето на Нерстовата равенка не успеала поради електролити со силна киселина (pH < 3,4), кога цинковата електрода се раствора во електролитот дури и кога батеријата не дава струја на колото. Двете реакции на оксидација-намалување наведени погоре се случуваат само кога електричното полнење може да се транспортира низ надворешното коло. Дополнителната реакција на отворено коло може да се забележи со формирање на меурчиња на цинковата електрода под отворено коло..Овој ефект на крајот го ограничи напонот на ќелиите на 1,0 V во близина на собна температура при највисоките нивоа на киселост.
Извор на енергија[уреди | уреди извор]
Енергијата доаѓа од хемиската промена на цинкот кога се раствора во киселина. Енергијата не доаѓа од лимонот или компирот. Цинкот се оксидира во внатрешноста на лимонот, разменувајќи дел од неговите електрони со киселината со цел да достигне пониска енергетска состојба, а ослободената енергија ја обезбедува енергијата.[4]
Во сегашната практика, цинкот се произведува со електродобивање на цинк сулфат или пирометалуршка редукција на цинкот со јаглерод, што бара внес на енергија. Енергијата произведена во батеријата со лимон доаѓа од промена на оваа реакција, враќање на дел од внесот на енергија за време на производството на цинк.
Смиева ќелија[уреди | уреди извор]
Од 1840 година до крајот на 19 век, големи, напонски ќелии со помош на цинкова електрода и електролит на сулфурна киселина биле широко користени во печатарската индустрија. Додека понекогаш биле користени бакарни електроди како оние во батериите со лимон, во 1840 година Алфред Сми измислил рафинирана верзија на оваа ќелија која користела сребро со груба платинска облога наместо бакарна електрода.[9][10] Водородниот гас кој се прилепува на површината на сребрена или бакарна електрода ја намалувал електричната струја што може да се извлече од ќелијата; феноменот е наречен „поларизација“.[8][11] Огрубената, „платинизирана“ површина го забрзува клокотот на водородниот гас и ја зголемува струјата од ќелијата. За разлика од цинковата електрода, бакарните или платинизираните сребрени електроди не се трошат со користење на батеријата, а деталите на оваа електрода не влијаат на напонот на ќелијата. Смиевата ќелија била погодна за електропишување, која произведувала бакарни плочи за печатење на весници и книги, како и статуи и други метални предмети.[10][12][13][14][15]
Смиевата ќелијата користела амалгамиран цинк наместо чист цинк; површината на амалгамираниот цинк е обработена со жива.[14] Очигледно амалгамираниот цинк бил помалку склон кон разградување со кисел раствор отколку чистиот цинк.[16] Споените цинк и обичните цинкови електроди во суштина даваат ист напон кога цинкот е чист.[17] Со несовршено рафинираниот цинк во лабораториите од 19 век тие обично давале различни напони.[16]
Поврзано[уреди | уреди извор]
- Список на видови батерии
- Алесандро Волта
- Електрохемиска ќелија
- Галвански елемент
- Галванска корозија
- Лазањска ќелија
- Монетска батерија
Наводи[уреди | уреди извор]
- ↑ 1,0 1,1 Decker, Franco (January 2005). „Volta and the 'Pile'“. Electrochemistry Encyclopedia. Case Western Reserve University. Архивирано од изворникот на 2012-07-16. Volta used silver, not copper, in his first cells; the chemical reactions involved in zinc/copper and zinc/silver cells are the same.
- ↑ Snyder, Carl H. (2004). The Extraordinary Chemistry of Ordinary Things, with Late Nite Labs: Edition 4. John Wiley & Sons. ISBN 9780471588399.
- ↑ 3,0 3,1 Oon, Hock Leong (2007). Chemistry Expression: An Inquiry Approach. Panpac Education Pte Ltd. стр. 236. ISBN 978-981-271-162-5.
- ↑ 4,0 4,1 4,2 Goodisman, Jerry (2001). „Observations on Lemon Cells“. Journal of Chemical Education. 78 (4): 516–518. Bibcode:2001JChEd..78..516G. doi:10.1021/ed078p516.
- ↑ „Lemon Battery“. Pembroke, Ontario: Hila Science Camp. Посетено на 2012-10-02. This webpage describes experiments starting with a single lemon cell that is studied with a multimeter, and then leads to a lemon battery capable of lighting an LED. Hila Science Camp has also posted a video showing how to build the battery and light an LED; see Create a Lemon Battery на YouTube.
- ↑ „Lemon Battery Project“. Burlington, Iowa: How Things Work Science Projects. Архивирано од изворникот на 2012-10-24. Посетено на 2012-10-11. This webpage contains instructions for elementary school teachers. The project uses the voltmeter to show that the battery is working. A key element is that several pairs of electrodes are used (iron/zinc, iron/copper, as well as zinc/copper) to yield different voltages.
- ↑ 7,0 7,1 Swartling, Daniel J.; Morgan, Charlotte (1998). „Lemon Cells Revisited—The Lemon-Powered Calculator“. Journal of Chemical Education. 75 (2): 181–182. Bibcode:1998JChEd..75..181S. doi:10.1021/ed075p181. Посетено на 2020-12-22. These authors note that hydrogen evolves from the zinc electrode. As described somewhat later by Goodisman, this effect is unrelated to the evolution of hydrogen that occurs when the cell is providing electric current to an external circuit; the hydrogen associated with these currents evolves from the copper electrode.
- ↑ 8,0 8,1 Naidu, M. S.; Kamakshiaih, S. (1995). Introduction to Electrical Engineering. Tata McGraw-Hill Education. стр. 50. ISBN 9780074622926.
- ↑ „Mr. Smee's Galvanic Battery“. The Magazine of Science and School of Arts. II: 22. April 18, 1840.
Formerly, a galvanic battery was a stupendous, and an expensive, machine occupying a large space and costing a considerable sum to keep it in its short-lived action. Now, a far more powerful instrument may be made in a snuff box and carried in the pocket. These remarks are forced upon us by the astonishing platinum batteries of Mr. Grove, and the chemico-mechanical batteries invented by Mr. Smee ...
- ↑ 10,0 10,1 Bottone, Selimo Romeo (1902). Galvanic batteries, their theory, construction and use, comprising primary, single and double fluid cells, secondary and gas batteries. Whittaker & Co. стр. 88.
The first real improvement over the plain zinc-copper in acid cell was due to Dr. Alfred Smee, who noticed that the hydrogen gas liberated at the negative plate was evolved from it much more readily, hence polarization took place much less rapidly if the surface of this plate were roughened instead of being quite smooth; and the means he found most efficient was that of coating the silver sheet or sheets with finely divided platinum ...
- ↑ Watt, Charles; Watt, John, уред. (1840). „Review: Proceedings of the London Electrical Society, 1841-1842 Session“. The Chemist; Or, Reporter of Chemical Discoveries and Improvements, Volume 1. London: R. Hastings.
Of the application of this cell a very important modification can be arranged, by converting it into an ACID battery, analogous to the platinized silver of Mr. Smee. Those who are acquainted with the ingenious device of that gentleman, are aware that the characteristic of his arrangement is, that the negative plate, where hydrogen is released, shall part with this hydrogen very readily. Under ordinary circumstances, the hydrogen adheres very much to the plates of an acid battery, and throws a considerable portion of the plates out of the action, by its presence on their surfaces. To remedy this, he has, as he terms it, "platinized" the surfaces.
- ↑ Gordon, James Edward Henry (1880). A physical treatise on electricity and magnetism, Volume 1. D. Appleton and Company. стр. 207.
- ↑ Hatch, Harris B.; Stewart, Alexander A. (1918). „History of Electrotype Making“. Electrotyping and stereotyping. Chicago: United Typothetae of America. стр. 2–4.
In 1840 Smee invented a battery which made electrotyping possible commercially. ... Perhaps one of the greatest forward steps in connection with electrotyping was made when the plating dynamo was invented. The first adoption of a dynamo, in place of the Smee type of battery, was by Leslie, of New York, in 1872.
Primer for apprentices in the printing industry. Good short introduction to the history of electrotyping. - ↑ 14,0 14,1 Sprague, J. T. (July 1, 1874). „Electro-deposition of Metals“. The Telegraphic Journal and Electrical Review. II (34): 237–239.
The Smee cell is the cell most commonly employed because of its extreme simplicity of construction and management.
A detailed discussion of the construction and maintenance of Smee cells, c. 1874. - ↑ Scott, David A. (2002). Copper and bronze in art: corrosion, colorants, conservation. Getty Publications. стр. 22. ISBN 978-0-89236-638-5.
Some extremely important commissions were made in electrotypes, such as the "bronzes" that adorn the Opera, Paris, and the 320 cm high statue of Prince Albert and four accompanying figures, erected behind the Albert Hall in London as a memorial to the Great Exhibition of 1851.
- ↑ 16,0 16,1 Park, Benjamin (1893). The Voltaic Cell: its Construction and its Capacity. J. Wiley. стр. 347. OCLC 7399515.
The singular property possessed by amalgamated zinc of not being attacked by sulphuric acid diluted with water is due to the adhesion of hydrogen on the plate in the acid solution
- ↑ The standard electrode potential is 0.76 V for both pure zinc and for amalgamated zinc.
Дополнителна книжевност[уреди | уреди извор]
- „Maglab - Simple Electrical Cell Tutorial“. US National High Magnetic Field Laboratory. Посетено на 2012-11-30. Description of an acid cell with zinc & copper electrodes, including a JAVA-based animation. The animation shows zinc dissolving into the electrolyte, electrons flowing from the zinc to the copper electrodes, and little hydrogen bubbles coming off the copper electrode. The animation also suggests that a single cell can light an LED, which is not possible for LEDs that emit visible light.
- Margles, Samantha (2011). „Does a Lemon Battery Really Work?“. Mythbusters Science Fair Book. Scholastic. стр. 104–108. ISBN 9780545237451. Посетено на 21 февруари 2023. Online preview only.
Надворешни врски[уреди | уреди извор]
- Видео со лимонска батерија.
- Видео со портокалска батерија Архивирано на 18 април 2021 г. .
- Видео со компирова батерија на YouTube. Три ќелии од компир во низа го напојуваат калкулаторот.
