Големина на геномот

Големина на геномот ― вкупната количина на ДНК, содржани во една копија од еден целосенгеном. Обично се мери во однос на маса во пикограми (трилионити (10−12) од грам, скратено pg) или помала честота во далтоните, или како вкупен број на нуклеотидни базни парови, обично во мегабази (милиони базни парови, скратено Mb или Mbp). Еден пикограм е еднаков на 978 мегабази.[1] Во диплоидните организми, големината на геномот често е користена наизменично со поимот вредност Ц.
Сложеноста на организмот не е директно пропорционална со големината на неговиот геном; вкупната содржина на ДНК е широко променлива помеѓу биолошките таксони. Некои едноклеточни организми имаат многу повеќе ДНК од луѓето, поради причини кои остануваат нејасни (види некодирачка ДНК и енигма со вредност Ц).
Потекло на поимот[уреди | уреди извор]

Поимот „големина на геномот“ честопати погрешно е припишувано кон труд од 1976 година на Ралф Хинегарднер,[2] дури и во дискусиите кои се занимаваат конкретно со терминологијата во оваа област на истражување (на пр., Грајлхубер, 2005 година[3]). Имено, Хинегарднер[2] го употребил поимот само еднаш: во насловот. Поимот всушност се чини дека првпат бил појавен во 1968 година, кога Хинегарднер се запрашал, во последниот пасус од друга статија, дали „содржината на клеточната ДНК, всушност, ја одразува големината на геномот“.[4] Во овој контекст, „големината на геномот“ била користена во смисла на генотип за да значи број на гени.
Во труд поднесен само два месеци подоцна, Волф и колегите (1969 година)[5] го користел поимот „големина на геномот“ во текот и во неговата сегашна употреба; затоа на овие автори веројатно треба да им биде припишана заслуга за потеклото на поимот во неговата современа смисла. До раните 1970-ти, „големината на геномот“ била во вообичаена употреба со нејзината сегашна дефиниција, веројатно како резултат на нејзиното вклучување во влијателната книга на Сусуму Оно, „Еволуција од генско удвојување“, објавена во 1970 година.[6]
Варијација во големината на геномот и содржината на генот[уреди | уреди извор]
Со појавата на различни молекуларни техники во изминатите 50 години, биле анализирани големини на геномот на илјадници еукариоти, а овие податоци се достапни во семрежните бази на податоци за животни, растенија и габи. Големината на јадрениот геном вообичаено е мерена кај еукариотите со користење на дензитометриски мерења на јадра обоени со Фојлгенов метод (претходно користеле специјализирани дензитометри, сега почесто со помош на сметачка анализа на слики[7]) или проточна цитометрија. Кај прокариотите, гелната електрофорезата со импулсно поле и целосното секвенционирање на геномот се доминантни методи за одредување на големината на геномот.
Познато е дека големини на јадрениот геном енормно варираат меѓу еукариотските видови. Кај животните тие се движат повеќе од 3.300 пати, а кај копнените растенија се разликуваат за фактор од околу 1.000.[8][9] Пријавено е дека геномите на протистите варираат повеќе од 300.000 пати во големина, но високиот крај на овој опсег (амеба) е доведен во прашање. Кај еукариотите (но не и прокариотите), големината на геномот не е пропорционална со бројот на гени присутни во геномот, набљудување што било сметано за целосно контраинтуитивно пред откривањето на некодирачка ДНК и кое станал познато како „парадокс на вредноста Ц“ како резултат. Сепак, иако повеќе не постои парадоксален аспект на несовпаѓањето помеѓу големината на геномот и бројот на генот, поимот останува во вообичаена употреба. Заради концептуално појаснување, различните загатки кои остануваат во однос на варијацијата на големината на геномот, наместо тоа, биле предложени од еден автор за попрецизно да сочинуваат загатка или енигма (т.н. „Енигма на вредност Ц“).
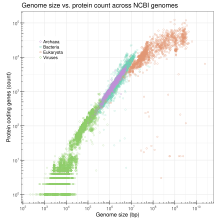
Големината на геномот е во корелација со низа мерливи особини на нивоата на клетката и организмот, вклучувајќи ја големината на клетките, стапката на клеточна делба и, во зависност од таксонот, големината на телото, стапката на метаболизам, стапката на развој, сложеноста на органите, географската распространетост или ризикот од исчезнување.[8][9] Врз основа на моментално достапните целосно секвенцирани податоци за геномот (од април 2009 година), лог-преобразениот број на гени прави линеарна корелација со лог-преобразената големина на геномот во бактерии, археи, вируси и комбинирани органели, додека кај нелинеарен (полу-природен логаритам) е гледана корелација за еукариотите.[10] Иако второто е во спротивност со претходниот став дека не постои корелација за еукариотите, забележаната нелинеарна корелација за еукариотите може да одразува несразмерно брзо растечка некодирачка ДНК во сè поголемите еукариотски геноми. Иако секвенцираните податоци од геномот се практично пристрасни кон малите геноми, што може да ја загрози точноста на емпириски изведената корелација, а конечниот доказ за корелацијата останува да се добие со секвенционирање на некои од најголемите еукариотски геноми, сегашните податоци се чини дека не исклучуваат можна корелација.
Големина на човечкиот геном[уреди | уреди извор]

Кај луѓето, вкупниот женски диплоиден нуклеарен геном по клетка се протега за 6,37 гигабазни парови (Gbp), е 208,23 цм долга и тежина од 6,51 пикограми (pg.).[11] Машките вредности се 6,27 Gbp, 205,00 цм, 6,41 pg.[11] Секој полимер на ДНК може да содржи стотици милиони нуклеотиди, како на пример во хромозомот 1. Хромозомот 1 е најголемиот човечки хромозом со приближно 220 милиони базни парови и би бил 85 долга ако се исправи.[12]
Во еукариотите, покрај нуклеарната ДНК, постои и митохондриска ДНК која кодира одредени белковини што ги користат митохондриите. митохондриската ДНК е обично релативно мала во споредба со нуклеарната ДНК. На пример, човечката митохондриска ДНК создава затворени кружни молекули, од кои секоја содржи 16.569[13][14] базни парови на ДНК,[15] при што секоја таква молекула нормално содржи целосен сет на митохондриски гени. Секој човечки митохондрион содржи, во просек, приближно 5 такви молекули на митохондриска ДНК.[15] Секоја човечка клетка содржи приближно 100 митохондрии, што дава вкупен број на молекули на митохондриска ДНК по човечка клетка од приближно 500.[15] Сепак, количината на митохондрии по клетка, исто така, варира во зависност од видот клетка, а една јајце-клетка може да содржи 100.000 митохондрии, што одговара на до 1.500.000 копии од митохондрискиот геном (што сочинува до 90% од ДНК на клетката).[16]
Намалување на геномот[уреди | уреди извор]
Намалувањето на геномот, познато и како разградување на геномот, е постапка со кој геномот на организмот е намалуван во однос на неговите предци. Геномите варираат во големината редовно, а намалувањето на големината на геномот е најзначајно кај бактериите.
Еволуциски најзначајните случаи на редукција на геномот може да бидат забележани кај еукариотските органели за кои е познато дека потекнуваат од бактерии: митохондриите и пластидите. Овие органели потекнуваат од исконските ендосимбионти, кои биле способни да преживеат во клетката домаќин и кои на клетката домаќин исто така и биле потребни за опстанок. Многу денешни митохондрии имаат помалку од 20 гени во целиот свој геном, додека современата бактерија која живее во слободен живот, воглавно има најмалку 1.000 гени. Многу гени очигледно се префрлани во јадрото на домаќинот, додека други едноставно се изгубени и нивната функција е заменета со постапките на домаќинот.
Други бактерии станале ендосимбионти или задолжителни интрацелуларни патогени и доживеале екстензивно намалување на геномот како резултат. Се чини дека оваа постапка е доминирана од генетското поместување што произлегува од малата големина на населението, ниските стапки на рекомбинација и високите стапки на мутации, наспроти одбирањето за помали геноми. Некои морски бактериопланктони кои слободно живеат, исто така покажуваат знаци на намалување на геномот, за кои се претпоставува дека се водени од природното одбирање.[17][18][19]
Кај облигационите ендосимбиотски видови[уреди | уреди извор]
Задолжителните ендосимбиотски видови се одликуваат со целосна неспособност да преживеат надвор од околината на нивниот домаќин. Овие видови станале значителна закана за човековото здравје, бидејќи честопати се способни да го избегнат човечкиот имунолошки систем и да манипулираат со околината домаќин за да се здобијат со хранливи материи. Вообичаено објаснување за овие манипулативни способности е нивната постојано збиена и ефикасна геномска структура. Овие мали геноми се резултат на огромни загуби на необична ДНК, појава која е исклучиво поврзана со губење на фазата на слободно живеење. Дури 90% од генетскиот материјал може да се изгуби кога еден вид ќе направи еволутивен преод од слободно живеење во задолжителен интрацелуларен начин на живот. За време на оваа постапка, идниот паразит е подложен на средина богата со метаболит каде што некако треба да биде скриен во клетката домаќин, тие фактори го намалуваат задржувањето и го зголемуваат генетскиот нанос што доведува до забрзување на губењето на несуштинските гени.[20][21][22] Вообичаени примери на видови со намален геном се Buchnera aphidicola, Rickettsia prowazekii и Mycobacterium leprae. Еден задолжителен ендосимбионт на лиснатици, Nasuia deltocephalinicola, го има најмалиот геном моментално познат меѓу клеточните организми со 112 kb.[23] И покрај патогеноста на повеќето ендосимбионти, некои задолжителни интрацелуларни видови имаат позитивни кондициски ефекти врз нивните домаќини.
Моделот на редуктивна еволуција е предложен како обид да бидат дефинирани геномските заеднички нешта што се гледани во сите облигациони ендосимбиони.[24] Овој модел илустрира четири општи особини на намалените геноми и задолжителните интрацелуларни видови:
- „рационализирање на геномот“ како резултат на релаксирано одбирање на гените кои се излишни во интрацелуларната средина;
- пристрасност кон бришења (наместо вметнувања), што силно влијае на гените кои се нарушени со насобирање мутации (псевдогени); [25]
- многу мала или никаква способност за стекнување на нова ДНК; и
- значително намалување на големината на ефективното население кај ендосимбиотските групи на население, особено кај видовите кои се потпираат на вертикален пренос на генетски материјал.
Врз основа на овој модел, јасно е дека ендосимбионите се соочуваат со различни прилагодливи предизвици од слободните видови и, како што произлезе од анализата помеѓу различни паразити, нивните генски инвентари се крајно различни, што нè води до заклучок дека минијатуризацијата на геномот следи различна шема за различните симбиони.[26][27][28]
Претворање од пикограми (pg) во базни парови (bp)[уреди | уреди извор]
или едноставно:
Дрејково правило[уреди | уреди извор]
Во 1991 година, Џон В. Дрејк предложил општо правило: дека стапката на мутација во геномот и неговата големина се во обратна корелација.[29] Утврдено е дека ова правило е приближно точно за едноставни геноми како што се оние во вирусите со ДНК и едноклеточните организми. Неговата основа е непозната.
Предложено е дека малата големина на вирусите со РНК е заклучена во триделна врска помеѓу верноста на репликацијата, големината на геномот и генетската сложеност. Поголемиот дел од вирусите со РНК немаат капацитет за читање на РНК, што ја ограничува нивната верност на репликација, а со тоа и нивната големина на геном. Ова, исто така, е опишано како „Aјгенов парадокс“.[30] Исклучок од правилото за мали димензии на геном кај РНК вирусите се наоѓа во нидовирусите. Овие вируси се чини дека стекнале 3'-до-5' егзорибонуклеаза што овозможило зголемување на големината на геномот.[31]
Минијатуризација на геномот и оптимална големина[уреди | уреди извор]
Во 1972 година, Мајкл Дејвид Бенет[32] претпостави дека постои корелација со содржината на ДНК и волуменот на јадрото, додека Комонер и вант Хоф и Спероу пред него постулирале дека дури и големината на клетката и должината на клеточниот циклус се контролирани од количината на ДНК.[33][34] Поновите теории навеле за отворање разговор за можноста за присуство на механизам кој физички го ограничува развојот на геномот до оптимална големина.[35]
Тие објаснувања се оспорени од написот на Кавалир-Смит[36] каде авторот посочи дека начинот на разбирање на врската помеѓу големината на геномот и волуменот на клетките е поврзан со теоријата на скелетот. Јадрото на оваа теорија е поврзано со волуменот на клетките, одреден со рамнотежата на прилагодување помеѓу предностите и недостатоците на поголемата големина на клетките, оптимизацијата на односот јадро:цитоплазма (кариоплазматски сооднос)[37][38] и концептот дека поголемите геноми обезбедува се повеќе склони кон насобирање на дупликативни транспозони како последици од повисока содржина на некодирачка скелетна ДНК.[36] Кавалир-Смит, исто така, предложил дека, како последователна реакција на редукција на клетките, јадрото ќе биде повеќе склоно кон избор во корист на бришењето во споредба со удвојувањето.[36]
Од економскиот начин на размислување, бидејќи фосфорот и енергијата се во недостиг, намалувањето на ДНК треба секогаш да биде во фокусот на еволуцијата, освен ако не биде стекната корист. Случајното бришење тогаш ќе биде главно штетно и нема да биде избрано поради намалувањето на стекнатата кондиција, но повремено и елиминацијата ќе биде поволна. Оваа размена помеѓу економичноста и насобирањето на некодирачка ДНК е клучот за одржување на кариоплазматскиот сооднос.
Механизми на минијатуризација на геномот[уреди | уреди извор]
Основното прашање зад постапката на минијатуризација на геномот е дали тоа се случува преку големи чекори или поради постојана ерозија на содржината на генот. За да биде проценета еволуцијата на оваа постапка, неопходно е да биде спореден геномот на предците со оној каде што се претпоставува дека се случило намалувањето. Благодарение на сличноста меѓу содржината на генот на Buchnera aphidicola и ентеробактеријата Escherichia coli, 89% идентитет за 16S на рибозомна РНК и 62% за ортологни гени било можно да биде расветлен механизмот на минијатуризација на геномот.[39] Геномот на ендосимбионтот B. aphidicola се одликува со големина на геном што е седум пати помала од E. coli (643 kb во споредба со 4,6 Mb)[40][41] и може да биде гледано како подмножество на инвентар на гените на ентеробактерии.[41] Од соочувањето на двата генома произлегло дека некои гени опстојуваат како делумно разградени.[41] што укажува дека функцијата била изгубена за време на постапката и дека последователните настани на ерозија ја скратиле должината како што е документирано во Rickettsia.[42][43][44] Оваа хипотеза е потврдена со анализата на псевдогените на Buchnera каде бројот на бришења бил повеќе од десет пати поголем во споредба со вметнувањето.[44]
Во Rickettsia prowazekii, како и кај другите мали геномски бактерии, овој меѓусебен ендосимбионт доживеал огромно намалување на функционалната активност со голем исклучок во споредба со другите паразити сè уште ја задржува биосинтетичката способност за производство на аминокиселина што му е потребна на неговиот домаќин.[45][46][41] Вообичаените ефекти од намалувањето на геномот помеѓу овој ендосимбионт и другите паразити се намалување на способноста за производство на фосфолипиди, поправка и рекомбинација и севкупно претворање на составот на генот во побогата содржина на A-T[47] поради мутација и замена.[20][45] Доказ за бришење на функцијата на поправка и рекомбинација е губењето на генот rec A, ген вклучен во патот на рекомбиназата. Овој настан бил сторен за време на отстранувањето на поголем регион кој содржи десет гени за вкупно речиси 10 kb.[41][45] Истата појава била случена и uvr A, uvr B и uvr C, гени кои кодираат за ензими за ексцизија вклучени во поправка на оштетената ДНК поради изложеност од ултравиолетово зрачење.[39]
Еден од најверодостојните механизми за објаснување на намалувањето на геномот е хромозомското преуредување бидејќи вметнување/бришење на поголем дел од низата полесно може да биде видена при хомологна рекомбинација во споредба со нелегитимната, затоа ширењето на транспозоните позитивно ќе влијае на стапката на бришење.[36] Губењето на тие гени во раните фази на минијатуризацијата не само на оваа функција, туку мора да одигра улога во еволуцијата на последователните бришења. Доказите за фактот дека поголем настан на отстранување се случил пред помалото бришење произлезе од споредбата на геномот на Bucknera и реконструираниот предок, каде што генот што е изгубен всушност не е случајно расеан во генот на предците, туку насобрани и негативна врска помеѓу бројот на изгубени гени и должината на разделувачите.[39] Настанот на мали месни индели игра маргинална улога во намалувањето на геномот[48] особено во раните фази каде што поголем број гени станале излишни.[49][39]
Наместо тоа, поединечни настани се случиле поради недостаток на притисок за одбирање за задржување на гените, особено ако дел од патеката што ја изгубила својата функција за време на претходното бришење. Пример за ова е бришењето на rec F, генот потребен за функцијата на rec A, и неговите странични гени.[50] Една од последиците од елиминацијата на таква количина низи влијаеше дури и на регулацијата на преостанатите гени. Губењето на голем дел од геномите всушност може да доведе до губење на промоторните низи. Ова всушност би можело да го поттикне изборот за еволуција на полицистронските региони со позитивен ефект и за намалување на големината[51] и за ефикасност на транскрипцијата.[52]
Доказ за минијатуризација на геномот[уреди | уреди извор]
Еден пример за минијатуризација на геномот, настанал во микроспоридиите, анаеробен интрацелуларен паразит на членконоги што еволуирале од аеробни габи.
За време на оваа постапка, митозомите[53] биле создадени како последица на редукцијата на митохондриите во предмет без геноми и метаболичка активност, освен на производството на центри за железен сулфур и капацитетот да навлезе во клетките домаќини.[54][55] Освен рибозомите, исто така минијатуризирани, многу други органели се речиси изгубени за време на постапката на создавање на најмалиот геном пронајден во еукариотите.[36] Од нивниот можен предок, зигомикотинската габа, микроспоридиите го намалиле својот геном елиминирајќи речиси 1000 гени и ја намалиле дури и големината на белковината и на белковинско кодирачки гени.[56] Оваа крајна постапка била возможна благодарение на поволното одбирање за помала големина на клетките наметната од паразитизмот.
Друг пример за минијатуризација е претставен со присуството на нуклеоморфи, поробени јадра, во внатрешноста на клетката на две различни алги, криптофити и хлорарахнеа.[57]
Нуклеоморфите се одликуваат со еден од најмалите познати геноми (551 и 380 kb) и како што е забележано за микроспоридиите, некои геноми се забележително намалени во должина во споредба со другите еукариоти поради виртуелниот недостаток на некодирачка ДНК.[36] Најинтересниот фактор е претставен со заемно постоење на тие мали јадра внатре во клетка која содржи друго јадро кое никогаш не доживеало такво намалување на геномот. Покрај тоа, дури и ако клетките домаќини имаат различни волумени од вид до вид и последователна варијабилност во големината на геномот, нуклеоморфот останува непроменлив што означува двоен ефект на одбирање во истата клетка.
Поврзано[уреди | уреди извор]
- База на податоци за големината на животински геном
- Бактериски геном
- Вредност Ц
- Клеточно јадро
- Споредбена геномика
- Споредба на различни големини на геноми
- Човечки геном
- Отпадна ДНК
- Список на секвенционирани еукариотски геноми
- Некодирачка ДНК
- База на податоци за C-вредности на растителна ДНК
- Себичен генетски елемент
- Транспозон
Наводи[уреди | уреди извор]
- ↑ 1,0 1,1 „Nuclear DNA content and genome size of trout and human“. Cytometry Part A. 51 (2): 127–128. 2003. doi:10.1002/cyto.a.10013. PMID 12541287.
- ↑ 2,0 2,1 Hinegardner R (1976). „Evolution of genome size“. Во F.J. Ayala (уред.). Molecular Evolution. Sinauer Associates, Inc., Sunderland. стр. 179–199.
- ↑ „The origin, evolution and proposed stabilization of the terms 'genome size' and 'C-value' to describe nuclear DNA contents“. Annals of Botany. 95 (1): 255–260. 2005. doi:10.1093/aob/mci019. PMC 4246724. PMID 15596473.
- ↑ Hinegardner R (1968). „Evolution of cellular DNA content in teleost fishes“. American Naturalist. 102 (928): 517–523. doi:10.1086/282564.
- ↑ „Polyploidization in the fish family Cyprinidae, Order Cypriniformes. I. DNA-content and chromosome sets in various species of Cyprinidae“. Humangenetik. 7 (3): 240–244. 1969. doi:10.1007/BF00273173. PMID 5800705.
- ↑ Ohno S (1970). Evolution by Gene Duplication. New York: Springer-Verlag. ISBN 0-04-575015-7.
- ↑ „From pixels to picograms: a beginners' guide to genome quantification by Feulgen image analysis densitometry“. Journal of Histochemistry and Cytochemistry. 50 (6): 735–749. 2002. doi:10.1177/002215540205000601. PMID 12019291.
- ↑ 8,0 8,1 Bennett MD, Leitch IJ (2005). „Genome size evolution in plants“. Во T.R. Gregory (уред.). The Evolution of the Genome. San Diego: Elsevier. стр. 89–162.
- ↑ 9,0 9,1 Gregory TR (2005). „Genome size evolution in animals“. Во T.R. Gregory (уред.). The Evolution of the Genome. San Diego: Elsevier. стр. 3–87.
- ↑ Redfield, Rosemary Jeanne, уред. (2009). „Distinct Gene Number- Genome Size Relationships for Eukaryotes and Non-Eukaryotes: Gene Content Estimation for Dinoflagellate Genomes“. PLOS ONE. 4 (9): e6978. Bibcode:2009PLoSO...4.6978H. doi:10.1371/journal.pone.0006978. PMC 2737104. PMID 19750009.
- ↑ 11,0 11,1 „On the length, weight and GC content of the human genome“. BMC Res Notes. 12 (1): 106. 2019. doi:10.1186/s13104-019-4137-z. PMC 6391780. PMID 30813969.
- ↑ „The DNA sequence and biological annotation of human chromosome 1“. Nature. 441 (7091): 315–21. мај 2006. Bibcode:2006Natur.441..315G. doi:10.1038/nature04727. PMID 16710414.CS1-одржување: display-автори (link)
- ↑ Anderson, S.; Bankier, A. T.; Barrell, B. G.; de Bruijn, M. H. L.; Coulson, A. R.; Drouin, J.; Eperon, I. C.; Nierlich, D. P.; Roe, B. A. (април 1981). „Sequence and organization of the human mitochondrial genome“. Nature. 290 (5806): 457–465. Bibcode:1981Natur.290..457A. doi:10.1038/290457a0. PMID 7219534.
- ↑ „Untitled“. Архивирано од изворникот на 2011-08-13. Посетено на 29 февруари 2024.
- ↑ 15,0 15,1 15,2 Satoh, M; Kuroiwa, T (септември 1991). „Organization of multiple nucleoids and DNA molecules in mitochondria of a human cell“. Experimental Cell Research. 196 (1): 137–140. doi:10.1016/0014-4827(91)90467-9. PMID 1715276.
- ↑ „Mitochondria in oocyte aging: current understanding“. Facts Views Vis Obgyn. 9 (1): 29–38. 2017. PMC 5506767. PMID 28721182.
- ↑ „Accelerated evolution associated with genome reduction in a free-living prokaryote“. Genome Biol. 6 (2): R14. 2005. doi:10.1186/gb-2005-6-2-r14. PMC 551534. PMID 15693943.
- ↑ Giovannoni SJ; и др. (2005). „Genome streamlining in a cosmopolitan oceanic bacterium“. Science. 309 (5738): 1242–1245. Bibcode:2005Sci...309.1242G. doi:10.1126/science.1114057. PMID 16109880.
- ↑ Giovannoni SJ; и др. (2008). „The small genome of an abundant coastal ocean methylotroph“. Environmental Microbiology. 10 (7): 1771–1782. doi:10.1111/j.1462-2920.2008.01598.x. PMID 18393994.
- ↑ 20,0 20,1 Moran, N. A. (1996-04-02). „Accelerated evolution and Muller's rachet in endosymbiotic bacteria“. Proceedings of the National Academy of Sciences. 93 (7): 2873–2878. Bibcode:1996PNAS...93.2873M. doi:10.1073/pnas.93.7.2873. ISSN 0027-8424. PMC 39726. PMID 8610134.
- ↑ Wernegreen, J. J.; Moran, N. A. (1999-01-01). „Evidence for genetic drift in endosymbionts (Buchnera): analyses of protein-coding genes“. Molecular Biology and Evolution. 16 (1): 83–97. doi:10.1093/oxfordjournals.molbev.a026040. ISSN 0737-4038. PMID 10331254.
- ↑ Spaulding, Allen W.; Dohlen, Carol D. von (2001). „Psyllid endosymbionts exhibit patterns of co-speciation with hosts and destabilizing substitutions in ribosomal RNA“. Insect Molecular Biology. 10 (1): 57–67. doi:10.1046/j.1365-2583.2001.00231.x. ISSN 1365-2583. PMID 11240637.
- ↑ And the Genomes Keep Shrinking…
- ↑ Wernegreen J (2005). „For better or worse: Genomic consequences of genomic mutualism and parasitism“ (PDF). Current Opinion in Genetics & Development. 15 (6): 1–12. doi:10.1016/j.gde.2005.09.013. PMID 16230003. Архивирано од изворникот (PDF) на 2011-07-22.
- ↑ „Genomic changes following host restriction in bacteria“. Current Opinion in Genetics & Development. 14 (6): 627–633. 2004. doi:10.1016/j.gde.2004.09.003. PMID 15531157.
- ↑ Mushegian, A. R.; Koonin, E. V. (1996-09-17). „A minimal gene set for cellular life derived by comparison of complete bacterial genomes“. Proceedings of the National Academy of Sciences. 93 (19): 10268–10273. Bibcode:1996PNAS...9310268M. doi:10.1073/pnas.93.19.10268. ISSN 0027-8424. PMC 38373. PMID 8816789.
- ↑ Huynen, Martijn A.; Bork, Peer (1998-05-26). „Measuring genome evolution“. Proceedings of the National Academy of Sciences. 95 (11): 5849–5856. Bibcode:1998PNAS...95.5849H. doi:10.1073/pnas.95.11.5849. ISSN 0027-8424. PMC 34486. PMID 9600883.
- ↑ Maniloff, J (1996-09-17). „The minimal cell genome: "on being the right size"“. Proceedings of the National Academy of Sciences of the United States of America. 93 (19): 10004–10006. Bibcode:1996PNAS...9310004M. doi:10.1073/pnas.93.19.10004. ISSN 0027-8424. PMC 38325. PMID 8816738.
- ↑ Drake, J W (1991). „A constant rate of spontaneous mutation in DNA-based microbes“. Proc Natl Acad Sci USA. 88 (16): 7160–7164. Bibcode:1991PNAS...88.7160D. doi:10.1073/pnas.88.16.7160. PMC 52253. PMID 1831267.
- ↑ Kun, A; Santos, M; Szathmary, E (2005). „Real ribozymes suggest a relaxed error threshold“. Nat Genet. 37 (9): 1008–1011. doi:10.1038/ng1621. PMID 16127452.
- ↑ Lauber, C; Goeman, JJ; Parquet Mdel, C; Thi Nga, P; Snijder, EJ; Morita, K; Gorbalenya, AE (јули 2013). „The footprint of genome architecture in the largest genome expansion in RNA viruses“. PLOS Pathog. 9 (7): e1003500. doi:10.1371/journal.ppat.1003500. PMC 3715407. PMID 23874204.
- ↑ Bennett, Michael David; Riley, Ralph (1972-06-06). „Nuclear DNA content and minimum generation time in herbaceous plants“. Proceedings of the Royal Society of London. Series B. Biological Sciences. 181 (1063): 109–135. Bibcode:1972RSPSB.181..109B. doi:10.1098/rspb.1972.0042. PMID 4403285.
- ↑ Hof, J. Van't; Sparrow, A. H. (јуни 1963). „A relationship between DNA content, nuclear volume, and minimum mitotic cycle time“. Proceedings of the National Academy of Sciences of the United States of America. 49 (6): 897–902. Bibcode:1963PNAS...49..897V. doi:10.1073/pnas.49.6.897. ISSN 0027-8424. PMC 300029. PMID 13996145.
- ↑ Commoner, Barry (јуни 1964). „Roles Of Deoxyribonucleic Acid in Inheritance“. Nature. 202 (4936): 960–968. Bibcode:1964Natur.202..960C. doi:10.1038/202960a0. ISSN 1476-4687. PMID 14197326.
- ↑ Orgel, L. E.; Crick, F. H. C. (април 1980). „Selfish DNA: the ultimate parasite“. Nature. 284 (5757): 604–607. Bibcode:1980Natur.284..604O. doi:10.1038/284604a0. ISSN 1476-4687. PMID 7366731.
- ↑ 36,0 36,1 36,2 36,3 36,4 36,5 Cavalier-Smith, Thomas (2005-01-01). „Economy, Speed and Size Matter: Evolutionary Forces Driving Nuclear Genome Miniaturization and Expansion“. Annals of Botany. 95 (1): 147–175. doi:10.1093/aob/mci010. ISSN 0305-7364. PMC 4246715. PMID 15596464.
- ↑ Strasburger, Eduard (1893). Ueber die wirkungssphäre der Kerne und die Zellgrösse (германски). OCLC 80359142.
- ↑ Huxley, J. S. (мај 1925). „The Cell in Development and Heredity“. Nature. 115 (2897): 669–671. Bibcode:1925Natur.115..669H. doi:10.1038/115669a0. ISSN 1476-4687.
- ↑ 39,0 39,1 39,2 39,3 Moran, Nancy A.; Mira, Alex (2001-11-14). „The process of genome shrinkage in the obligate symbiont Buchnera aphidicola“. Genome Biology. 2 (12): research0054.1. doi:10.1186/gb-2001-2-12-research0054. ISSN 1474-760X. PMC 64839. PMID 11790257.
- ↑ Blattner, Frederick R.; Plunkett, Guy; Bloch, Craig A.; Perna, Nicole T.; Burland, Valerie; Riley, Monica; Collado-Vides, Julio; Glasner, Jeremy D.; Rode, Christopher K. (1997-09-05). „The Complete Genome Sequence of Escherichia coli K-12“. Science. 277 (5331): 1453–1462. doi:10.1126/science.277.5331.1453. ISSN 0036-8075. PMID 9278503.
- ↑ 41,0 41,1 41,2 41,3 41,4 Shigenobu, Shuji; Watanabe, Hidemi; Hattori, Masahira; Sakaki, Yoshiyuki; Ishikawa, Hajime (септември 2000). „Genome sequence of the endocellular bacterial symbiont of aphids Buchnera sp. APS“. Nature. 407 (6800): 81–86. Bibcode:2000Natur.407...81S. doi:10.1038/35024074. ISSN 1476-4687. PMID 10993077.
- ↑ Andersson, J. O.; Andersson, S. G. (1999-09-01). „Genome degradation is an ongoing process in Rickettsia“. Molecular Biology and Evolution. 16 (9): 1178–1191. doi:10.1093/oxfordjournals.molbev.a026208. ISSN 0737-4038. PMID 10486973.
- ↑ Andersson, Jan O.; Andersson, Siv G. E. (2001-05-01). „Pseudogenes, Junk DNA, and the Dynamics of Rickettsia Genomes“. Molecular Biology and Evolution. 18 (5): 829–839. doi:10.1093/oxfordjournals.molbev.a003864. ISSN 0737-4038. PMID 11319266.
- ↑ 44,0 44,1 Mira, Alex; Ochman, Howard; Moran, Nancy A. (2001-10-01). „Deletional bias and the evolution of bacterial genomes“. Trends in Genetics. 17 (10): 589–596. doi:10.1016/S0168-9525(01)02447-7. ISSN 0168-9525. PMID 11585665.
- ↑ 45,0 45,1 45,2 Andersson, Siv G. E.; Zomorodipour, Alireza; Andersson, Jan O.; Sicheritz-Pontén, Thomas; Alsmark, U. Cecilia M.; Podowski, Raf M.; Näslund, A. Kristina; Eriksson, Ann-Sofie; Winkler, Herbert H. (ноември 1998). „The genome sequence of Rickettsia prowazekii and the origin of mitochondria“. Nature. 396 (6707): 133–140. Bibcode:1998Natur.396..133A. doi:10.1038/24094. ISSN 1476-4687. PMID 9823893.
- ↑ Tamas, Ivica; Klasson, Lisa M.; Sandström, Jonas P.; Andersson, Siv G. E. (2001). „Mutualists and parasites: how to paint yourself into a (metabolic) corner“. FEBS Letters. 498 (2–3): 135–139. doi:10.1016/S0014-5793(01)02459-0. ISSN 1873-3468. PMID 11412844.
- ↑ Wernegreen, J. J.; Moran, N. A. (2000-07-22). „Decay of mutualistic potential in aphid endosymbionts through silencing of biosynthetic loci: Buchnera of Diuraphis“. Proceedings of the Royal Society of London. Series B: Biological Sciences. 267 (1451): 1423–1431. doi:10.1098/rspb.2000.1159. PMC 1690690. PMID 10983826.
- ↑ Petrov, Dmitri A. (2002-06-01). „Mutational Equilibrium Model of Genome Size Evolution“. Theoretical Population Biology. 61 (4): 531–544. doi:10.1006/tpbi.2002.1605. ISSN 0040-5809. PMID 12167373.
- ↑ Gregory, T. Ryan (2003-09-01). „Is small indel bias a determinant of genome size?“. Trends in Genetics. 19 (9): 485–488. doi:10.1016/S0168-9525(03)00192-6. ISSN 0168-9525. PMID 12957541.
- ↑ Gasior, Stephen L.; Olivares, Heidi; Ear, Uy; Hari, Danielle M.; Weichselbaum, Ralph; Bishop, Douglas K. (2001-07-17). „Assembly of RecA-like recombinases: Distinct roles for mediator proteins in mitosis and meiosis“. Proceedings of the National Academy of Sciences. 98 (15): 8411–8418. Bibcode:2001PNAS...98.8411G. doi:10.1073/pnas.121046198. ISSN 0027-8424. PMC 37451. PMID 11459983.
- ↑ Selosse, M.-A.; Albert, B.; Godelle, B. (2001-03-01). „Reducing the genome size of organelles favours gene transfer to the nucleus“. Trends in Ecology & Evolution. 16 (3): 135–141. doi:10.1016/s0169-5347(00)02084-x. ISSN 1872-8383. PMID 11179577.
- ↑ Scherbakov, D. V.; Garber, M. B. (2000-07-01). „Overlapping genes in bacterial and phage genomes“. Molecular Biology. 34 (4): 485–495. doi:10.1007/BF02759558. ISSN 1608-3245.
- ↑ Williams, Bryony A. P.; Hirt, Robert P.; Lucocq, John M.; Embley, T. Martin (август 2002). „A mitochondrial remnant in the microsporidian Trachipleistophora hominis“. Nature. 418 (6900): 865–869. Bibcode:2002Natur.418..865W. doi:10.1038/nature00949. ISSN 1476-4687. PMID 12192407.
- ↑ Keeling, Patrick J.; Fast, Naomi M. (2002). „Microsporidia: Biology and Evolution of Highly Reduced Intracellular Parasites“. Annual Review of Microbiology. 56 (1): 93–116. doi:10.1146/annurev.micro.56.012302.160854. PMID 12142484.
- ↑ Cavalier-Smith, T. (2001). „What are Fungi?“. Во McLaughlin, David J.; McLaughlin, Esther G.; Lemke, Paul A. (уред.). Systematics and Evolution. Systematics and Evolution: Part A. The Mycota. Springer Berlin Heidelberg. стр. 3–37. doi:10.1007/978-3-662-10376-0_1. ISBN 978-3-662-10376-0.
- ↑ Vivarès, Christian P; Gouy, Manolo; Thomarat, Fabienne; Méténier, Guy (2002-10-01). „Functional and evolutionary analysis of a eukaryotic parasitic genome“. Current Opinion in Microbiology. 5 (5): 499–505. doi:10.1016/S1369-5274(02)00356-9. ISSN 1369-5274. PMID 12354558.
- ↑ Douglas, Susan; Zauner, Stefan; Fraunholz, Martin; Beaton, Margaret; Penny, Susanne; Deng, Lang-Tuo; Wu, Xiaonan; Reith, Michael; Cavalier-Smith, Thomas (април 2001). „The highly reduced genome of an enslaved algal nucleus“. Nature. 410 (6832): 1091–1096. Bibcode:2001Natur.410.1091D. doi:10.1038/35074092. ISSN 1476-4687. PMID 11323671.
Дополнителна книжевност[уреди | уреди извор]
- Еволуција на Chlamydiaceae
- Andersson JO Andersson SG; Andersson (1999). „Genome degradation is an ongoing process in Rickettsia“. Molecular Biology and Evolution. 16 (9): 1178–1191. doi:10.1093/oxfordjournals.molbev.a026208. PMID 10486973. Архивирано од изворникот на 2005-04-17. Посетено на 29 февруари 2024.
Надворешни врски[уреди | уреди извор]
- База на податоци за големината на животинскиот геном
- База на податоци за вредности Ц на растителна ДНК Архивирано на 10 март 2019 г.
- База на податоци за големина на геном на габи
- База на податоци за габи Архивирано на 10 март 2008 г. — од CBS


