Хемиска кинетика
Хемиската кинетика, позната и како реакциона кинетика, е наука за брзината на хемиските реакции. Во хемиската кинетика се вклучени истражувања за тоа како различни ескпериментални услови би можеле да влијаат на брзината на една хемиска реакција и да даде податоци за механизмот на реакцијата и преодните состојби, како и да создаде математички модели кои би можеле да ги опишат одликите на хемиската реакција. Во 1864, Питер Ваге и Като Максимилијан Гулдберг биле првите истражувачи кои го започнале развитокот на хемиската кинетика со формулирањето на законот за дејството на масата, кој вели дека брзината на хемиската реакција е пропорционална со квантитетот на реагирачките супстанци.
Теории во хемиската кинетика[уреди | уреди извор]
Теориите во хемиската кинетика имаат двојна улога: од една страна, да го објаснат влијанието на концентрацијата на учесниците, особено влијанието на температурата, врз брзината на хемиските реакции, а од друга страна, да објаснат како се одвиваат хемиските реакции на молекуларно ниво.[1]
Теорија на судири[уреди | уреди извор]
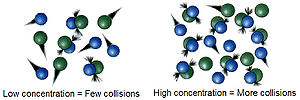
Според оваа теорија, предуслов за да се случи хемиска транформација е постоењето судир меѓу честичките на реактантите. Во зависност од тоа на каков начин ќе се судрат и колкава енергија носат честичките може да дојде до прераспределба на атомите до честичките на реактантите и до образување на честички од продуктите (судирот да биде ефикасен во поглед на остварувањето на елементарниот акт на хемиската трансформација) или, пак, да не дојде то тоа, туку честичките од реактантите едноставно да се одбијат и да се оддалечат едни од други (судирот е неефикасен). Со помош на оваа теорија може да се објасни забрзувањето на реакциите при покачувањето на температурата. Имено, на повисока температура, честичките се движат побрзо и имаат поголема кинетичка енергија, па кога ќе се судрат, кинетичката енергија полесно преминува во потенцијална енергија со што врските меѓу честичките се кинат и се образуваат нови честички. Од друга страна, зачестеноста на судирите е непосредно поврзана со концентрацијата на учесниците во хемиската реакција. Ако се работи за неповратна реакција, важни се само концентрациите на реактантите, додека кај повратните реакции важни се концентрациите и на реактантите и на продуктите на реакцијата. Оваа теорија е поставена по аналогија на законистостите на големите тела, меѓутоа малите честички не се однесуваат по тие законитости. Освен тоа, теоријата која се заснова врз условот дали ќе дојде до судир или нема да дојде, не е во согласност со она што се знае за хемиското сврзување и за веројатноста електронот да се најде каде и да било во просторот. Оттука, оваа теорија не е целосно задоволителна.[2]
Теорија на активираниот комплекс[уреди | уреди извор]
Според оваа теорија, пред да дојде до претворање на честичките од реактантите во честички на продуктите, најпрвин се образува групација на атоми што е наречена активиран комплекс во кој влегуваат во целост (со сите атоми) честичките од реактантите кои учествуваат во елементарниот акт на хемиската трансформација. Притоа, за да се образува активираниот комплекс, доволно е честичките од реактантите да се приближат на мало растојание кое овозможува размена на електроните. Тогаш, дел од електроните што учествувале во образувањето на врските во честичките од реактантите се прераспределуваат и започнуваат да ги поврзуваат атомите кои дотогаш не биле сврзани. Меѓутоа, за да дојде до образување на честичките од активираниот комплекс, мора да се совлада една енергетска бариера, а за тоа е потребна енергија. Имено, со намалувањето на рстојанието меѓу честичките, енергијата на системот се покачува и добива максимална вредност тогаш кога ќе се образува активираниот комплекс. Потоа, кога со прегрупирањето на честичките во активираниот комплекс ќе се образуваат честичките од продуктите и кога тие меѓусебно ќе се оддалечуваат, енергијата во системот почнува да опаѓа. Активираниот комплекс е нестабилен и многу брзо се претвора во честички од продуктите на хеиската реакција. Активирани комплеки се образуваат и кога се распаѓа само една честичка, која или се распаѓа или се претвора во честичка од изомер (соединение со иста општа форнула, но со различна градба). Поради постоењето на енергетската бариера, честичките на реактантите мора да имаат енергија што е доволно голема да се совлада таа бариера. Бидејќи кинетичката енергија на честичките се зголемува со покачување на температурата, образувањето на активираните комплекси е поверојатно на повисоки температури. Во врска со висината на бариерата е таканаречената енергија на активацијата која ја претставува енергијата која треба да им се доведе на реактантите за реакцијата да може да го зголеми својот досег за еден мол. Енергијата на активацијата се означува со Ea и се мери во J/mol или во kJ/mol. Разликата, пак, меѓу енергијата на продуктите и енергијата на реактантите ја дава вредноста на реакционата енталпија.[3]
Поврзано[уреди | уреди извор]
Наводи[уреди | уреди извор]
- ↑ Бојан Шоптрајанов, Хемија за втора година на реформираното гимназиско образование (петто изменето и дополнето издание). Скопје: Просветно дело, 2009, стр. 32.
- ↑ Бојан Шоптрајанов, Хемија за втора година на реформираното гимназиско образование (петто изменето и дополнето издание). Скопје: Просветно дело, 2009, стр. 33-34.
- ↑ Бојан Шоптрајанов, Хемија за втора година на реформираното гимназиско образование (петто изменето и дополнето издание). Скопје: Просветно дело, 2009, стр. 34-37.
| ||||||||||||||||||||||
|
