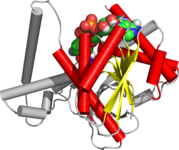
Розманов склоп

Розмановиот склоп е структурен мотив кој влегува во состав на белковините кои врзуваат нуклеотиди (ензимските кофактори FAD, NAD+ и NADP+). Склопот е изграден од наизменични бета нишки и алфа-завојницаи, каде бета нишките се врзуваат меѓусебе со водородни врски за да формираат бета-плоча, а алфа-завојниците ги опкружуваат двете страни (лица) на плочата. Класичниот Розманов склоп содржи шест бета нишки, додека Розман-сличните склопови, понекогаш наречени Розманоидни склопови, содржат само пет нишки. Почетниот бета-алфа-бета (bab) склоп е најсочуваниот сегмент од целиот Розманов склоп.[1] Мотивот е именуван по германско-американскиот научник Мајкл Розман, кој за првпат го забележал во состав на ензимот лактат дехидрогеназа, во 1970 година. Тој подоцна забележал дека овој мотив често се јавува во составот на белковините кои врзуваат нуклеотиди.[1]
Историја[уреди | уреди извор]
Розмановиот склоп за првпат бил опишан од д-р. Мајкл Розман и соработниците во 1974 година.[2] Тој прв ја одгонетнал структурата на лактат дехидрогеназата и го карактеризирал структурниот мотив во составот на овој ензим. Подоцна било откриено дека повеќето дехидрохенази кои користат NAD или NADP како кофактори, го содржат истиот структурен мотив.[2][3]
Во 1989 година, Израел Ханукоглу од научниот институт Вајцман открил дека консензус низата за врзувачкото место на NADP+ кај некои ензими кои користат NADP+, се разликува од NAD+-врзувачкиот мотив.[4] Ова откритие било искористено за ре-инженерство на коензимските специфичности на ензими.[5]
Структура[уреди | уреди извор]

Розмановиот склоп е составен од шест паралелни бета нишки кои градат издолжена бета-плоча. Првите три нишки се поврзани преку α-завојници што резултира со бета-алфа-бета-алфа-бета структура. Оваа шема се дуплицира еднаш за да се добие превртено тандемско повторување кое содржи вкупно шест бета нишки. Генерално, нишките го имаат редоследот 321456 (1 = N-терминалот, 6 = C-терминалот).[6] Розман-сличните склопови со пет бета нишки имаат редослед 32145.[7] Целокупната третична структура на склопот личи на трослоен сендвич, каде внатрешноста ја чини издолжената бета-плоча, а двете „парчиња леб“ ги чинат поврзаните и паралелни алфа-завојници.[8]
Една од одликите на Розмановиот склоп е неговата специфичност за врзување на кофактор. Преку анализа на четири NADH-врзувачки ензими, било откриено дека во сите четири ензими нуклеотидниот кофактор ја заземал истата конформација и ориентација во однос на полипептидниот синџир.[8]
Розмановиот склоп може да содржи дополнителни бета нишки поврзани преку кратки алфа-завојници или навои.[8] Најсочуваниот сегмент од целиот Розманов склоп е првиот бета-алфа-бета сегмент. Бидејќи овој сегмент е во контакт со ADP делот од динуклеотидите, како што се FAD, NAD и NADP, тој исто така се нарекува и „ADP-врзувачки бета-бета склоп“.
Функција[уреди | уреди извор]
Функцијата на Розмановиот склоп во ензимите е врзување на нуклеотидни кофактори. Тој, исто така, често придонесува за врзување на супстратот.
Ензимот UDP-гликоза 6-дехидрогеназа ја катализира NAD(+)-зависната оксидација на UDP-гликоза во UDP-гликуронска киселина.[9] Барбас и соработниците откриле дека бактериската UDP-гликоза дехидрогеназа (UgdG) од Sphingomonas elodea ATCC 31461, која создава UDP-гликуронска киселина за синтеза на егзополисахаридот гелан, има способност да врзува РНК и да делува како рибонуклеаза.[10] Исто така N- и C-терминалните домени на UgdG споделуваат структурни одлики со древни митохондријални рибонуклеази наречени MAR. MAR рибонуклеазите се присутни во нижи еукариотски микроорганизми, имаат Розманоиден склоп и припаѓаат на натсемејството на изохоризматаза. Оваа опсервација укажува на тоа дека Розмановите структурни мотиви во состав на NAD(+)-зависните дехидрогенази можат да имаат двојна функција на врзувачи на нуклеотидни кофактори и рибонуклеази.
Еволуција[уреди | уреди извор]
Еволуциониот однос помеѓу Розмановиот склоп и Розманоидните склопови е нејасен. Постои хипотеза дека сите овие склопови потекнуваат од еден заеднички склоп-предок, кој имал способност да врзува нуклеотиди, а исто така поседувал и неспецифични каталитички активности.[2]
Филогенетските анализи на NADP-врзувачкиот ензим адренодоксин редуктаза откриле дека од прокариотите па сѐ до човекот разликата во низниот мотив од повеќето FAD и NAD-врзувачки места е строго сочувана.[11]
Во многу статии и учебници, Розмановиот склоп е дефиниран како строго повторувачка серија на βαβ структура. Сепак, испитувањата на Розмановите склопови во многу NAD(P) и FAD врзувачки места покажале дека само првата βα структура е строго сочувана. Во некои ензими, можат да постојат многу петелки и неколку завојници (или ниту една завојница) помеѓу бета нишките кои ја градат бета-плочата.[8][11] И покрај оваа дивергенција, сочуваната низа и сочуваните структурни одлики имплицираат заедничко еволутивно потекло на Розмановите склопови.[11]
Наводи[уреди | уреди извор]
- ↑ 1,0 1,1 Cox MM, Nelson DL (2013). Lehninger Principles of Biochemistry (6. изд.). New York: W.H. Freeman. ISBN 978-1-4292-3414-6.
- ↑ 2,0 2,1 2,2 Kessel A (2010). Introduction to Proteins: Structure, Function, and Motion. Florida: CRC Press. стр. 143. ISBN 978-1-4398-1071-2.
- ↑ „Comparison of super-secondary structures in proteins“. Journal of Molecular Biology. 76 (2): 241–56. May 1973. doi:10.1016/0022-2836(73)90388-4. PMID 4737475.
- ↑ „cDNA sequence of adrenodoxin reductase. Identification of NADP-binding sites in oxidoreductases“. European Journal of Biochemistry. 180 (2): 479–84. March 1989. doi:10.1111/j.1432-1033.1989.tb14671.x. PMID 2924777.
- ↑ „Redesign of the coenzyme specificity of a dehydrogenase by protein engineering“. Nature. 343 (6253): 38–43. January 1990. doi:10.1038/343038a0. PMID 2296288.
- ↑ „NAD(P)-binding Rossmann-fold domains“. SCOP: Structural Classification of Proteins. Архивирано од изворникот на 2018-11-21. Посетено на 2018-11-24.
- ↑ „Nucleotide-binding domain“. SCOP: Structural Classification of Proteins. Архивирано од изворникот на 2018-12-07. Посетено на 2018-11-24.
- ↑ 8,0 8,1 8,2 8,3 „Proteopedia: Rossmann fold: A beta-alpha-beta fold at dinucleotide binding sites“. Biochemistry and Molecular Biology Education. 43 (3): 206–9. 2015. doi:10.1002/bmb.20849. PMID 25704928.
- ↑ „Interaction signatures stabilizing the NAD(P)-binding Rossmann fold: a structure network approach“. PLOS One. 7 (12): e51676. 2012. doi:10.1371/journal.pone.0051676. PMC 3524241. PMID 23284738.
- ↑ Barbas, Ana; Popescu, Alma; Frazão, Carlos; Arraiano, Cecília M.; Fialho, Arsénio M. (2013-01-04). „Rossmann-fold motifs can confer multiple functions to metabolic enzymes: RNA binding and ribonuclease activity of a UDP-glucose dehydrogenase“. Biochemical and Biophysical Research Communications. 430 (1): 218–224. doi:10.1016/j.bbrc.2012.10.091. ISSN 1090-2104. PMID 23137539.
- ↑ 11,0 11,1 11,2 „Conservation of the Enzyme-Coenzyme Interfaces in FAD and NADP Binding Adrenodoxin Reductase-A Ubiquitous Enzyme“. Journal of Molecular Evolution. 85 (5): 205–218. 2017. doi:10.1007/s00239-017-9821-9. PMID 29177972.