Аденозинтрифосфатаза
| Аденозинтрифосфатаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Назнаки | |||||||||
| EC-број | 3.6.1.3 | ||||||||
| CAS-број | 9000-83-3 | ||||||||
| Бази на податоци | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| PDB структури | RCSB PDB PDBj PDBe PDBsum | ||||||||
| |||||||||

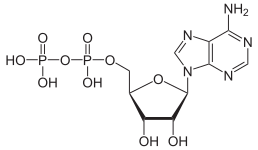
Аденозинтрифосфатази (EC број 3.6.1.3, аденилпирофосфатаза, ATP монофосфатаза, трифосфатаза, SV40 Т-антиген, аденозин 5'-трифосфатаза, ATP хидролаза, комплекс V (митохондриски транспорт на електрони), (Ca2+ + Mg2+)-ATPаза, HCO3−-ATPаза, ATPаза) се класа на ензими кои го катализираат хемиското разградување на ATP во ADP и слободен фосфатен јон.[1][2][3][4][5][6] Оваа реакција на дефосфорилација ослободува енергија, која ензимот (во повеќето случаи) ја користи за покренување на други хемиски реакции кои инаку спонтано не би се одвивале. Овој процес се одвива во сите познати форми на живот.
Некои од овие ензими се интегрални мембрански белковини и служат за пренос на растворени супстанци низ мембраната, најчесто спротивно од нивниот концентрациски градиент. Овие ензими се нарекуваат трансмембрански ATPази.
Функции[уреди | уреди извор]

Трансмембранските ATPази служат за внес на многу од неопходните метаболити за клеточниот метаболизам, како и за изнесување на отпадни материи и токсини надвор од клетката. Значаен пример е натриум-калиумовата пумпа (наречена уште и Na+/К+ATPаза), која служи за одржување на мембранскиот потенцијал на клетката. Друг пример е водород-калиумовата ATPаза (H+/К+ATPаза или гастрична протонска пумпа), која ја закиселува содржината на желудникот.
Механизам на дејство[уреди | уреди извор]
Спрегнувањето на хидролизата на ATP со клеточниот транспорт е реакција во која точно одреден број на молекули (или јони) од растворената супстанца се транспортираат за секоја ATP молекула која се хидролизира; на пример, кај Na+/К+ATPазата, при хидролиза на една ATP молекула се изнесуваат 3 Na+ јони надвор од клетката, а се внесуваат 2 K+ јони внатре во клетката.
Трансмембранските ATPази ја користат хемиската потенцијална енергија на ATP за извршување на механичка работа: тие ги транспортираат растворените супстанци во насока спротивна на термодинамички-претпочитаната насока на движење — т.е., од страната на мембраната каде се наоѓаат со пониска концентрација кон страната на мембраната каде се наоѓаат со повисока концентрација. Овој процес се нарекува активен транспорт.
Трансмембрански ATP синтази[уреди | уреди извор]
АТФ-синтазата на митохондриите и хлоропластите е анаболичен ензим кој ја искористува енергијата на трансмембранскиот протонски градиент за врзување на неоргански фосфат за молекула на аденозин дифосфат (ADP), со што се добива ATP.
Движењето на протоните во насоката на нивниот електрохемиски градиент предизвикува кружно движење (ротација) на интегралниот мембрански домен на АТФ-синтазата. Ова уникатно вртежно движење во биолошкиот свет се искористува за хемиско врзување на ADP и P за да се добие ATP.
Меѓутоа, АТФ-синтазата може да функционира и во обратна насока; т.е. да ја искористува енергијата ослободена од хидролиза на ATP за да ги движи протоните спротивно од насоката на нивниот електрохемиски градиент.
Класификација[уреди | уреди извор]
Постојат различни видови на ATPази, кои се разликуваат по нивната функција, структура (F-, V- и A-ATPазите содржат вртежни мотори) и типот на јони кои ги транспортираат.
- F-ATPазите (F1FO-ATPази) се наоѓаат во митохондриите, хлоропластите и бактериските цитоплазматски мембрани, и служат за синтеза на ATP.
- V-ATPазите (V1VO-ATPази) се наоѓаат во еукариотските вакуоли, и ја користат хидролизата на ATP за транспорт на молекули и за намалување на pH вредноста во одредени органели, како што се лизозомите.
- A-ATPазите (A1AO-ATPаза) се среќаваат кај археите и функционираат слично како F-ATPазите.
- P-ATPазите (E1E2-ATPази) се среќаваат кај бактериите, габите и во клеточните мембрани и органели на еукариотите. Служат за транспорт на различни јони низ мембраните.
- E-ATPазите се ензими кои се наоѓаат на клеточната површина и служат за хидролиза на различни NTP (нуклеотид трифосфати), вклучувајќи го и вонклеточниот ATP.
Поврзано[уреди | уреди извор]
Наводи[уреди | уреди извор]
- ↑ „Proteins controlling the helical structure of DNA“. Annual Review of Biochemistry. 50: 233–60. 1981. doi:10.1146/annurev.bi.50.070181.001313. PMID 6267987.
- ↑ Kielley, WW (1961). „Myosin adenosine triphosphatase“. Во Boyer, P. D.; Lardy, H.; Myrbäck, K. (уред.). The Enzymes. 5 (2. изд.). New York: Academic Press. стр. 159–168.
- ↑ „Membrane adenosine triphosphatase activities in rat pancreas“. Biochimica et Biophysica Acta. 602 (2): 401–18. November 1980. doi:10.1016/0005-2736(80)90320-x. PMID 6252965.
- ↑ Njus, D.; Knoth, J.; Zallakian, M. (1981). „Proton-linked transport in chromaffin granules“. Curr. Top. Bioenerg. 11: 107–147.
- ↑ „The localization of the anion-sensitive ATPase activity in corneal endothelium“. Biochimica et Biophysica Acta. 644 (2): 251–6. June 1981. doi:10.1016/0005-2736(81)90382-5. PMID 6114746.
- ↑ „Regulation of viral transcription and DNA replication by the SV40 large T antigen“. Current Topics in Microbiology and Immunology. Current Topics in Microbiology and Immunology. 93: 5–24. 1981. doi:10.1007/978-3-642-68123-3_2. ISBN 978-3-642-68125-7. PMID 6269805.
