Триметилсилил група

Триметилсилил група (скратено TMS) е функционална група во органската хемија . Оваа група се состои од три метил групи поврзани со атом на силициум [ − ( CH3 ) 3 ], кој пак е поврзан со остатокот од молекулата. Оваа структурна група се одликува со хемиска инертност и голем молекуларен волумен, што ја прави корисна во голем број на апликации.
Триметилсилил група е поврзана за метил група која формира тетраметилсилан, кој е скратено име и како TMS.
Соединенијата со триметилсилил групи вообичаено не се наоѓаат во природата. Хемичарите понекогаш користат триметилсилилирачки реагенс за да дериватизираат прилично неиспарливи соединенија како што се одредени алкохоли, феноли или карбоксилни киселини со замена на триметилсилил група за водород во хидроксилните групи на соединенијата. На овој начин на молекулата се формираат триметилсилокси групи [ − O-Si(CH 3 ) 3 ]. Неколку примери на триметилсилилирачки агенси вклучуваат триметилсилил хлорид и бис(триметилсилил)ацетамид . Триметилсилил групите на молекулата имаат тенденција да ја направат поиспарлива, што често ги прави соединенијата поподложни за анализа со гасна хроматографија или голема спектрометрија . Пример за таква триметилсилилација е споменат во статијата Brassicasterol. Ваквите дериватизации често се прават во мали размери во специјални ампули.
Кога се прикачени на одредени функционални групи во молекула на реактант, триметилсилил групи може да се користат и како привремени заштитни групи за време на хемиска синтеза или некои други хемиски реакции .
Во хроматографијата, деривизацијата на пристапните силинолни групи во врзана стационарна фаза со триметилсилил групи се нарекува крајно покривање .
Во спектарот NMR, сигналите од атомите во триметилсилил групите во соединенијата вообичаено ќе имаат хемиски поместувања блиску до референтниот врв на тетраметилсилан со 0 ppm. Исто така, соединенијата, како што е високотемпературната силиконска маст „ заштитник “, кои имаат полисилоксани (често наречени силикони) во нив вообичаено ќе покажат врвови од нивните метил групи (прикачени на атоми на силициумот) кои имаат хемиски поместувања NMR блиску до стандардниот врв на тетраметилсилан, како на пр. како на 0,07 ppm во CDCl3 .
Во спротивно, многу реактивни молекули може да се изолираат кога се обвиени со гломазни триметилсилил групи. Овој ефект може да се забележи кај тетрахедраните .
Супер силил групи[уреди | уреди извор]

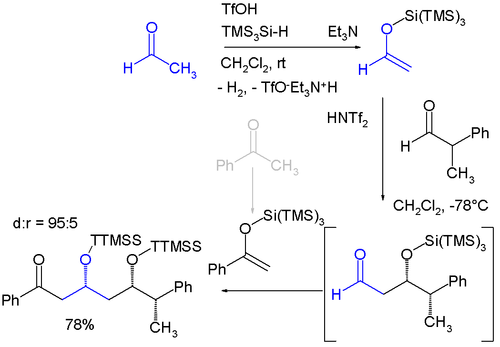
Поврзани со триметилсилил групи се „супер“ силил групи од кои постојат две варијанти: силициумска група поврзана со три триметилсилил групи прави три(триметилсилил)силил група (TTMSS или TMS 3 Si) и силициумска група поврзана со три терц-бутил. групи. Групата TTMSS беше предложена во 1993 година од Ханс Бок . Со волумен на ван дер Валс до 7 кубни ангстроми, тој ја надминува поврзаната група TIPS (околу 2) [1] и една потенцијална примена е неговата употреба како привремен супституент кој промовира асиметрична индукција, на пример во овој дијастереоселективен едно-тенџере реакција која вклучува две последователни реакции на Мукајама алдол :[2]
TTMSS, исто така, може да значи трис(триметилсилил)силан,[3][4] кој е споредлив како хемиски реагенс со трибутилтин хидрид без поврзаната загриженост за токсичност на органотините и соединенијата на трибутилкал .[5][6] Реагенсот се користи во радикални редукции, хидросилилација и последователни радикални реакции .[7]
Заштита од алкохол[уреди | уреди извор]

Во органската синтеза, групата TMS се користи како заштитна група за алкохоли .
Најчестите методи на заштита[уреди | уреди извор]
- Триметилсилил хлорид (TMSCl) или триметилсилил трифлуорометансулфонат (TMSOTf) и база (т.е. пиридин, триетиламин или 2,6-лутидин ) во дихлорометан [8][9][10][11][12]
- TMSCl и литиум сулфид (Li 2 S) во ацетонитрил
Најчести методи за дезаштита[уреди | уреди извор]
- TMS групите се подложни на расцепување при третман со реагенси базирани на HF
- Тетрабутиламониум флуорид (Bu 4 NF) во THF
- Флуоросилициумска киселина (H 2 SiF 6 )
- Третман со HCl во THF/воден раствор
Поврзано[уреди | уреди извор]
- Триметилсиланол
- Триметилсилил хлорид
- Тетраметилсилан
- Триметилсилил флуорид е нуспроизвод во подготовката на диетиламиносулфур трифлуорид (DAST) од сулфур тетрафлуорид:[13]
- Et 2 NSiMe 3 + SF 4 → Et 2 NSF 3 + Me 3 SiF
Поврзано[уреди | уреди извор]
- ↑ Tris(trimethylsilyl)silyl-Governed Aldehyde Cross-Aldol Cascade Reaction Boxer, M. B.; Yamamoto, H. J. Am. Chem. Soc.; (Communication); 2006; 128(1); 48-49. doi:10.1021/ja054725k
- ↑ The starting materials are acetaldehyde and benzophenone which are both converted to silyl enol ether by reaction with tris(trimethylsilyl)silane and triflic acid with evolution of hydrogen. The aldol reaction is catalyzed by bis(trifluoromethane)sulfonimide
- ↑ „Tris(trimethylsilyl)silane 97%“. Sigma-Aldrich Co. LLC. Посетено на 2014-05-05.
- ↑ Chatgilialoglu, Chryssostomos; Ferreri, Carla; Landais, Yannick; Timokhin, Vitaliy I. (25 June 2018). „Thirty Years of (TMS)3SiH: A Milestone in Radical-Based Synthetic Chemistry“. Chemical Reviews. 118 (14): 6516–6572. doi:10.1021/acs.chemrev.8b00109. PMID 29938502.
- ↑ Brook, Michael A. (2000). Silicon in Organic, Organometallic, and Polymer Chemistry. New York: John Wiley & Sons, Inc. стр. 172–173.
- ↑ „Tris(trimethylsilyl)silane, TTMSS“. https://www.organic-chemistry.org. Посетено на 2014-05-05. Надворешна врска во
|publisher=(help) - ↑ Recent Applications of the (TMS)3SiH Radical-Based Reagent Chryssostomos Chatgilialoglu, Jacques Lalevée Molecules 2012, 17, 527-555; doi:10.3390/molecules17010527
- ↑ Nicolaou, K. C.; Liu, J. J.; Hwang, C.-K.; Dai, W.-M.; Guy, R. K. (1992-01-01). „Synthesis of a fully functionalized CD ring system of taxol“. Journal of the Chemical Society, Chemical Communications (англиски) (16): 1118. doi:10.1039/c39920001118. ISSN 0022-4936.
- ↑ Nicolaou, K. C.; Yang, Zhen; Sorensen, Erik J.; Nakada, Masahisa (1993-01-01). „Synthesis of ABCtaxoid ring systems via a convergent strategy“. Journal of the Chemical Society, Chemical Communications (англиски) (12): 1024. doi:10.1039/c39930001024. ISSN 0022-4936.
- ↑ Nicolaou, K. C.; Hwang, C.-K.; Soresen, E. J.; Clairborne, C. F. (1992-01-01). „A convergent strategy towards taxol. A facile enantioselective entry into a fully functionalized ring A system“. Journal of the Chemical Society, Chemical Communications (англиски) (16): 1117. doi:10.1039/c39920001117. ISSN 0022-4936.
- ↑ Nicolaou, K. C.; Yang, Z.; Liu, J. J.; Ueno, H.; Nantermet, P. G.; Guy, R. K.; Claiborne, C. F.; Renaud, J.; Couladouros, E. A. (1994-02-17). „Total synthesis of taxol“. Nature (англиски). 367 (6464): 630–634. Bibcode:1994Natur.367..630N. doi:10.1038/367630a0. PMID 7906395.
- ↑ Nicolaou, K. C.; Claiborne, Christopher F.; Nantermet, Philippe G.; Couladouros, Elias A.; Sorensen, Erik J. (1994-02-01). „Synthesis of Novel Taxoids“. Journal of the American Chemical Society. 116 (4): 1591–1592. doi:10.1021/ja00083a063. ISSN 0002-7863.
- ↑ W. J. Middleton, E. M. Bingham "Diethylaminosulfur Trifluoride" Organic Syntheses, Coll. Vol. 6, p.440; Vol. 57, p.50. Online version