Пи-врска


Пи-врска (π-врска) — ковалентна хемиска врска, во која две резни на орбитала на еден атом се преклопува со две резни на орбиталата на друг, и каде преклопот е страничен. Секоја од овие атомски орбитали има електронска густина нула и заедничка јазолна рамнина која минува низ двете сврзани јадра. Таа е јазолна рамнина и за молекулската орбитала на пи-врската. Пи-врските можат да образуваат во двојни и тројни врски, но не се образуваат во единечни врски во највеќето случаи.
Грчката буква π во името на врската се однесува на p-орбитали, бидејќи орбиталната симетрија на пи-врската е иста со онаа на p-орбиталата гледана надолу долж оската на врската. Еден чест облик на ваквото сврзување ги вклучува самите p-орбитали, иако d-орбиталите исто така прават пи-сврзување. Второспоменатиот режим сочинува дел од основата на повеќекратното сврзување на метал со метал.
Пи-врските обично се послаби од сигма-врските. Двојната јаглеродно-јаглеродна врска (C-C), сочинета од една сигма- и една пи-врска,[1] има помала енергија на врската од онаа на единечната врска C-C, што укажува на тоа дела стабилноста која ја додава пи-врска е помала од стабилноста на сигма-врска. Гледано квантномеханички, слабоста на оваа врска се должи на значително помалиот преклоп помеѓу составните p-орбитали поради нивната напоредна насоченост. Ова се разликува од сигма-врските кои образуваат сврзувачки орбитали непосредно помеѓу јадрата на атомите, поради што се добива поголем преклоп и силна сигма-врска.
Пи-врските настануваат со преклоп на атомски орбитали кои се во допир преку две подрачја на преклоп. Пи-врските се пораширени врски отколку сигма-врските. Електроните во пи-врските понекогаш се нарекуваат пи-електрони. Молекулските фрагменти споени со пи-врска не можат да се вртат околу таа врска без да ја нарушат пи-врската, бидејќи со вртењето би ја уништиле напоредноста на составните p-орбитали.
Кај еднојадрените двоатомски молекули, само една јазолна рамнина минува низ π-сврзаните атоми, а немаат јазолни рамнини помеѓу сврзаните атоми. Соодветната антисврзувачка или π* молекулска орбитала, е дефинирана од присуството на дополнителната јазолна рамнина помеѓу овие два сврзани атоми.
Повеќекратни врски
[уреди | уреди извор]Типична двојна врска се состои од една сигма-врска и една пи-врска — на пример, двојната врска C=C во етиленот (H2C=CH2). Типична тројна врска, на пример. ацетиленот (HC≡CH), има една сигма-врска и две пи-врски на две заемно нормални рамнини каде лежи оската на сврзаност. Даден пар атоми може да има највеќе две пи-врски. Четворните врски се крајно ретки и се образуваат само помеѓу атоми на преодни метали; тие имаат една сигма-врска, две пи-врски и една делта-врска.
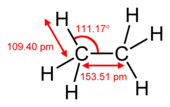
Пи-врската е послаба од сигма-врска, но комбонацијата од пи- и сигма-врска е посилна од секоја од нив одделно. Поголемата јачина на повеќекратната врска наспроти единечната (сигма-врска) се забележува на разни начини, од кои најочигледен е скусувањето на нивната должина. На пример, должината на јаглеродно-јаглеродната врска изнесува 154 пм кај етанот,[2][3] 134 пм кај етиленот, а 120 пм кај ацетиленот. Повеќе врски даваат покуса и посилна вкупна врска.
|

|

|
| етан (1 σ-врска) | етилен (1 σ-врска + 1 π-врска) | ацетилен (1 σ-врска + 2 π-врска) |
Посебни случаи
[уреди | уреди извор]Пи-врска може да постои меѓу два атома кои меѓусебно немаат нето-ефект на сигма-врзување.
Кај извесни метални комплекси, пи-замодејствата помеѓу металниот атом и пи-антиврзувачки орбитали на алкин и алкен образуваат пи-врски.
Во некои случаи на повеќекратни врски меѓу атоми, не постои нето сигма-врзување, туку само пи-врски. Такви примери се дижелезо хексакарбонилот (Fe2(CO)6), дијаглеродот (C2) и диборанот(2) (B2H2). Кај овие соединенија средишната врска се состои само од пи-сврзување бидејќи самата сигма-врска е придружена од сигма-антиврска. Овие соединенија служат како пресметковни модели за анализирање на самото пи-сврзување кои покажуваат дека максимален орбитален преклоп се добива со многу пократки врски отколку очекуваното.[4]
Поврзано
[уреди | уреди извор]Наводи
[уреди | уреди извор]- ↑ Streitwieser, Andrew; Heathcock, Clayton H.; Kosower, Edward M. (1992). Introduction to organic chemistry. Heathcock, Clayton H., Kosower, Edward M. (4. изд.). New York: Macmillan. стр. 250. ISBN 978-0024181701. OCLC 24501305.
- ↑ Veillard, A. (1970). „Relaxation during internal rotation ethane and hydrogen peroxyde“. Theoretica Chimica Acta. 18 (1): 21–33. doi:10.1007/BF00533694. S2CID 94310101.
- ↑ Harmony, Marlin D. (1990). „The equilibrium carbon–carbon single‐bond length in ethane“. J. Chem. Phys. 93 (10): 7522–7523. Bibcode:1990JChPh..93.7522H. doi:10.1063/1.459380.
- ↑ Jemmis, Eluvathingal D.; Pathak, Biswarup; King, R. Bruce; Schaefer III, Henry F. (2006). „Bond length and bond multiplicity: σ-bond prevents short π-bonds“. Chemical Communications (20): 2164–2166. doi:10.1039/b602116f. PMID 16703142.
| ||||||||||||||||||||||||||||||||||||||||
