Циметна киселина

| |

| |

| |
Претпочитано име по МСЧПХ: (2E)-3-фенилпроп-2-енонска киселина | |
| Систематско име | Cinnamic acid |
Други називи транс-Cinnamic киселина | |
| Назнаки | |
|---|---|
| 140-10-3 | |
| 3DMet | B00108 |
| Бајлштајн | 1905952 |
| ChEBI | CHEBI:35697 |
| ChEMBL | ChEMBL27246 |
| ChemSpider | 392447 |
| EC-број | 205-398-1 |
| 3731 | |
| |
| 3203 | |
| 3Д-модел (Jmol) | Слика |
| KEGG | C00423 |
| PubChem | 444539 |
| |
| UNII | U14A832J8D |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | Бели моноклинички кристали |
| Мирис | Налик на мед[2] |
| Густина | 1.2475 g/cm3[3] |
| Точка на топење | |
| Точка на вриење | |
| 500 mg/L[3] | |
| Киселост (pKa) | 4.44 |
| −0 cm3/mol | |
| Опасност | |
| GHS-ознаки: | |
Пиктограми
|

|
Сигнални зборови
|
Предупредување |
Изјави за опасност
|
H315, H319, H335 |
Изјави за претпазливост
|
P261, P264, P271, P280, P302+P352, P304+P340, P305+P351+P338, P312, P321, P332+P313, P337+P313, P362, P403+P233, P405, P501 |
| NFPA 704 | |
| Температура на запалување | {{{value}}} |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Cinnamic киселина е органско соединение со формула C 6 H 5 -CH=CH- COOH. Тоа е бело кристално соединение кое е малку растворливо во вода и слободно растворливо во многу органски растворувачи. Класифицирана како незаситена карбоксилна киселина, таа природно се наоѓа во голем број растенија. Тој постои и како цис и како транс изомер, иако вториот е почест.[4]
Појава и производство[уреди | уреди извор]
Биосинтеза[уреди | уреди извор]
Циномичната киселина е централен посредник во биосинтезата на огромен број природни производи, вклучувајќи лигноли (прекурсори на лигнин и лигноцелулоза), флавоноиди, изофлавоноиди, кумарини, аурони, стилбени, катехини и фенилпропаноиди. Неговата биосинтеза вклучува дејство на ензимот фенилаланин амонијак-лиаза (PAL) на фенилаланин.[5]
Природна појава[уреди | уреди извор]
Се добива од масло од цимет или од балсами како што е сторакс. Го има и во шеа путерот. Циметна киселина има мирис како мед ;[2] тој и неговиот поиспарлив етил естер ( етил цинамат ) се ароматични компоненти во есенцијалното масло од цимет, во кое сродниот цинамалдехид е главната состојка.
Синтеза[уреди | уреди извор]
Циномичната киселина најпрво била синтетизирана со базно катализирана кондензација на ацетил хлорид и бензалдехид, проследена со хидролиза на киселинскиот хлорид на производот. Во 1890 година, Рајнер Лудвиг Клајзен ја опишал синтезата на етил цинамат преку реакција на етил ацетат со бензалдехид во присуство на натриум како база.[6] Друг начин за подготовка на циметната киселина е реакцијата на кондензација Кновенгел.[7] Реактантите за ова се бензалдехид и маланска киселина во присуство на слаба база, проследени со декарбоксилација катализирана со киселина. Може да се подготви и со оксидација на цинамалдехид, кондензација на бензал хлорид и натриум ацетат (проследена со кисела хидролиза) и реакција на Перкин. Најстариот комерцијално користен пат до циметната киселина ја вклучува реакцијата на Перкин, која е дадена во оваа следна шема [4]
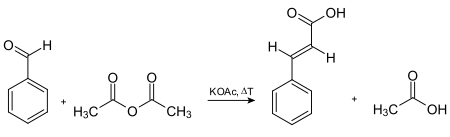
Синтеза на цинаминска киселина преку реакцијата на Перкин.[8]
Метаболизам[уреди | уреди извор]
Циноматската киселина, добиена од автооксидација на цинамалдехид, се метаболизира во натриум бензоат во црниот дроб.[9]
Користење[уреди | уреди извор]
Циметна киселина се користи во ароми, синтетички индиго и одредени фармацевтски производи. Главна употреба е како претходник за производство на метил цинамат, етил цинамат и бензил цинамат за парфемската индустрија. Cinnamic киселина е претходник на засладувачот аспартам преку ензимски катализирана аминација за да се добие фенилаланин. Циномичната киселина може да се димерира во неполарни растворувачи што резултира со различни линеарни врски со слободна енергија.[10]
Наводи[уреди | уреди извор]
- ↑
 . Encyclopædia Britannica (11. изд.). 1911. стр. 376.
. Encyclopædia Britannica (11. изд.). 1911. стр. 376.
- ↑ 2,0 2,1 „Cinnamic acid“. flavornet.org.
- ↑ 3,0 3,1 Запис во Базата на супстанции GESTIS на Институтот за безбедност и здравје при работа
- ↑ 4,0 4,1 „Cinnamic Acid“, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a07_099
- ↑ Vogt, T. (2010). „Phenylpropanoid Biosynthesis“. Molecular Plant. 3 (1): 2–20. doi:10.1093/mp/ssp106. PMID 20035037.
- ↑ Claisen, L. (1890). „Zur Darstellung der Zimmtsäure und ihrer Homologen“ [On the preparation of cinnamic acid and its homologues]. Berichte der Deutschen Chemischen Gesellschaft. 23: 976–978. doi:10.1002/cber.189002301156.
- ↑ Tieze, L. (1988). Reactions and Synthesis in the Organic Chemistry Laboratory. Mill Vall, CA. стр. 1988.
- ↑ F. K. Thayer (1925). „m-Nitrocinnamic Acid“. Organic Syntheses. 5: 83. doi:10.15227/orgsyn.005.0083.
- ↑ „Up-regulation of neurotrophic factors by cinnamon and its metabolite sodium benzoate: therapeutic implications for neurodegenerative disorders“. Journal of Neuroimmune Pharmacology. 8 (3): 739–55. June 2013. doi:10.1007/s11481-013-9447-7. PMC 3663914. PMID 23475543.
- ↑ Bradley, J.-C.; Abraham, M. H.; Acree, W. E.; Lang, A.; Beck, S. N.; Bulger, D. A.; Clark, E. A.; Condron, L. N.; Costa, S. T. (2015). „Determination of Abraham model solute descriptors for the monomeric and dimeric forms of trans-cinnamic acid using measured solubilities from the Open Notebook Science Challenge“. Chemistry Central Journal. 9: 11. doi:10.1186/s13065-015-0080-9. PMC 4369286. PMID 25798191.


