Хемиска гликозилација
Хемиска реакција на гликозилација вклучува спојување на донатор на гликозил, со акцептор на гликозил што формира гликозид .[1][2][3] Ако и донаторот и примачот се шеќери, тогаш производот е олигосахарид . Реакцијата бара активирање со соодветен реагенс за активирање. Реакциите често резултираат со мешавина на производи поради создавање на нов стереоген центар на аномерната положба на донаторот на гликозил. Формирањето на гликозидна врска овозможува синтеза на комплексни полисахариди кои можат да играат важна улога во биолошките процеси и патогенезата и затоа имањето синтетички аналози на овие молекули овозможува понатамошни студии во однос на нивното биолошко значење.
Терминологија[уреди | уреди извор]
Реакцијата на гликозилација вклучува спојување на донатор на гликозил и акцептор на гликозил преку иницирање со користење на активатор под соодветни услови на реакција.
- Донатор на гликозил е шеќер со соодветна група за заминување на аномерната положба. Оваа група, во услови на реакција, се активира и преку формирање на оксокарбениум се елиминира оставајќи електрофилен аномерен јаглерод.
- Акцептор на гликозил е шеќер со незаштитена нуклеофилна хидроксилна група која може да го нападне јаглеродот на јонот на оксокарбениум формиран за време на реакцијата и да овозможи формирање на гликозидна врска.
Активаторот е вообичаено Луисова киселина која овозможува напуштањето на групата во аномерната положба да замине и резултира со формирање на јоксокарбениум.
Стереохемија[уреди | уреди извор]
Формирањето на гликозидна врска резултира со формирање на нов стереоген центар и затоа може да се очекува да резултира со мешавина од производи. Формираната врска може да биде или аксијална или екваторијална (α или β во однос на гликозата). За подобро да се разбере ова, мора да се земе предвид механизмот на реакција на гликозилација.

Учество во соседната група[уреди | уреди извор]
Стереохемискиот исход на реакцијата на гликозилација во одредени случаи може да биде засегнат од типот на заштитната група употребена на позиција 2 од донорот на гликозил. Групата на учесници, типично онаа со присутна карбоксилна група, претежно ќе резултира со формирање на β-гликозид. Додека група која не учествува, тоа е група обично без карбоксилна група, често ќе резултира со α-гликозид.
Подолу може да се види дека имањето ацетил заштитна група на позиција 2 ќе овозможи формирање на ацетоксониум јонски посредник кој го блокира нападот на долната страна на прстенот, со што овозможува формирање на β-гликозид претежно.
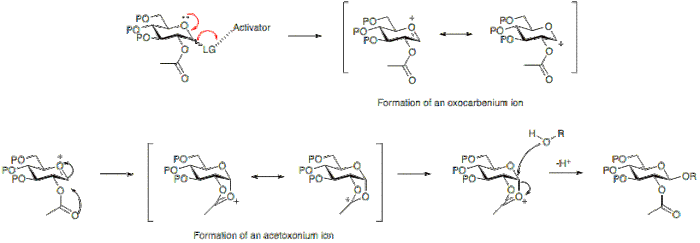
Алтернативно, отсуството на група учесничка на позиција 2 овозможува напад или од долната или од горната страна. Бидејќи производот на α-гликозид ќе биде фаворизиран од аномерниот ефект, а-гликозидот обично преовладува.

Заштитни групи[уреди | уреди извор]
Различни заштитни групи или на донаторот на гликозил или на акцепторот на гликозил [4][5] може да влијаат на реактивноста и приносот на реакцијата на гликозилација. Вообичаено, групите што повлекуваат електрони, како што се ацетил или бензоил групи, ја намалуваат реактивноста на донаторот/акцепторот и затоа се нарекуваат групи за „разоружување“. Утврдено е дека групите кои донираат електрони, како што е бензилната група, ја зголемуваат реактивноста на донаторот/акцепторот и затоа се нарекуваат групи „вооружување“.
Тековни методи во синтезата на гликозиди[уреди | уреди извор]
Гликозил јодиди[уреди | уреди извор]
Гликозил јодидите првпат беа воведени за употреба во реакции на гликозилација во 1901 година од страна на Коенигс и Нор [6][7] иако често се сметаа за премногу реактивни за синтетичка употреба. Неодамна, неколку истражувачки групи покажаа дека овие донатори имаат уникатни реактивни својства и може да се разликуваат од другите гликозил хлориди или бромиди во однос на времето на реакција, ефикасноста и стереохемијата .[8][9][10][11] Гликозил јодидите може да се направат под различни услови, еден од методите за одбележување е реакцијата на 1- О -ацетилпиранозид со TMSI.[12]

Донорите на јодид обично може да се активираат под основни услови за да дадат β-гликозиди со добра селективност. Употребата на соли на тетраалкиламониум јодид, како што е тетрабутиламониум јодид ( TBAI ) овозможува in-situ аномеризација на α-гликозил халидот во β-гликозил халидот и го обезбедува α-гликозидот со добра селективност.[13][14][15][16]

Тиогликозиди[уреди | уреди извор]
Тиогликозидите првпат биле пријавени во 1909 година од Фишер [17] и оттогаш биле постојано истражувани овозможувајќи развивање на бројни протоколи за нивна подготовка. Предноста на користењето на тиогликозидите е нивната стабилност при широк опсег на реакциони услови што овозможуваат заштита на групните манипулации. Дополнително, тиогликозидите дејствуваат како привремени заштитни групи на аномерната положба, дозволувајќи им на тиогликозидите да бидат корисни и како донатори на гликозил и како акцептори на гликозил.[13] Тиогликозидите обично се подготвуваат со реакција на перацетилирани шеќери со BF3•OEt2</br> BF3•OEt2</br> BF3•OEt2 и соодветниот тиол.[18][19][20]
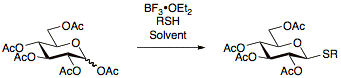
Тиогликозидите кои се користат во реакциите на гликозилација како донатори може да се активираат под широк опсег на услови, особено со користење на NIS/AgOTf.[21]

Трихлороацетимиди[уреди | уреди извор]
Трихлороацетимидите првпат биле воведени и истражени од Шмит во 1980 година [22][23] и оттогаш станаа многу популарни за синтеза на гликозиди. Употребата на трихлороацетимиди дава многу предности, вклучувајќи леснотија на формирање, реактивност и стереохемиски исход.[13] О -гликозил трихлороацетимидите се подготвуваат преку додавање на трихлороацетонитрил ( Cl3CCN</br> Cl3CCN ) под основни услови до слободна аномерна хидроксилна група.

Типични групи за активирање за реакции на гликозилација со употреба на трихлороацетимиди се BF3•OEt2</br> BF3•OEt2</br> BF3•OEt2 или TMSOTf .[24]

Хроматографското прочистување на колоната на реакционата смеса понекогаш може да биде предизвик поради нуспроизводот на трихлороацетамид. Сепак, ова може да се надмине со миење на органскиот слој со 1 M раствор на NaOH во сепараторна инка пред хроматографијата. Утврдено е дека заштитните групи на ацетил се стабилни во текот на оваа постапка.[25]
Забележителни синтетички производи[уреди | уреди извор]
Подолу се дадени неколку примери на некои значајни цели добиени преку серија реакции на гликозилација. И тоа:


Поврзано[уреди | уреди извор]
Поврзано[уреди | уреди извор]
- ↑ Boons, Geert-Jan; Karl J. Hale (2000). Organic synthesis with carbohydrates. Blackwell. ISBN 978-1-85075-913-3.
- ↑ Crich, D.; Lim, L. (2004). „Glycosylation with Sulfoxides and Sulfinates as Donors or Promoters“. Org. React. 64: 115–251. doi:10.1002/0471264180.or064.02. ISBN 0471264180.
- ↑ Bufali, S.; Seeberger, P. (2006). „Glycosylation on Polymer Supports“. Org. React. 68: 115–251. doi:10.1002/0471264180.or068.02. ISBN 0471264180.
- ↑ Vorm, Stefan van der; Hansen, Thomas; Hengst, Jacob M. A. van; S. Overkleeft, Herman; Marel, Gijsbert A. van der; C. Codée, Jeroen D. (2019). „Acceptor reactivity in glycosylation reactions“. Chemical Society Reviews (англиски). 48 (17): 4688–4706. doi:10.1039/C8CS00369F. PMID 31287452.
- ↑ Vorm, S. van der; Hansen, T.; S. Overkleeft, H.; Marel, G. A. van der; C. Codée, J. D. (2017). „The influence of acceptor nucleophilicity on the glycosylation reaction mechanism“. Chemical Science (англиски). 8 (3): 1867–75. doi:10.1039/C6SC04638J. PMC 5424809. PMID 28553477.
- ↑ Koenigs, Wilhelm; Knorr, Edward (1901). „Ueber einige Derivate des Traubenzuckers und der Galactose (p )“. Berichte der deutschen chemischen Gesellschaft. 34 (1): 957–981. doi:10.1002/cber.190103401162.
- ↑ Fischer, E. (1893). „Ueber die Glucoside der Alkohole“. Ber. Dtsch. Chem. Ges. 26 (3): 2400–12. doi:10.1002/cber.18930260327.
- ↑ Gervay, J.; Hadd, M. J. (1997). „Anionic Additions to Glycosyl Iodides: Highly Stereoselective Syntheses of β C-, N-, and O-Glycosides1“. J. Org. Chem. 62 (20): 6961–67. doi:10.1021/jo970922t.
- ↑ Hadd, M.J.; Gervay, J. (1999). „Glycosyl iodides are highly efficient donors under neutral conditions“. Carbohydr. Res. 320 (1–2): 61–69. doi:10.1016/S0008-6215(99)00146-9.
- ↑ Miquel, N.; Vignando, S.; Russo, G.; Lay, L. (2004). „Efficient Synthesis of O-, S-, N- and C-Glycosides of 2-Amino-2-Deoxy-d-Glucopyranose from Glycosyl Iodides“. Synlett. 2004 (2): 341–3. doi:10.1055/s-2003-44978.
- ↑ van Well, R.M.; Kartha, K.P.R.; Field, R.A. (2005). „Iodine Promoted Glycosylation with Glycosyl Iodides: α‐Glycoside Synthesis“. J. Carbohydr. Chem. 24 (4–6): 463–474. doi:10.1081/CAR-200067028.
- ↑ Gervay, J.; Nguyen, T.N.; Hadd, M.J. (1997). „Mechanistic studies on the stereoselective formation of glycosyl iodides: first characterization of β-d-glycosyl iodides“. Carbohydr. Res. 300 (2): 119–125. doi:10.1016/S0008-6215(96)00321-7.
- ↑ 13,0 13,1 13,2 „New principles for glycoside-bond formation“. Angew Chem Int Ed Engl. 48 (11): 1900–34. 2009. doi:10.1002/anie.200802036. PMID 19173361.
- ↑ „Efficient route to 2-deoxy beta-O-aryl-d-glycosides via direct displacement of glycosyl iodides“. Org Lett. 5 (22): 4219–22. October 2003. doi:10.1021/ol035705v. PMID 14572289.
- ↑ „Efficient synthesis of alpha-galactosyl ceramide analogues using glycosyl iodide donors“. Org Lett. 7 (10): 2063–5. May 2005. doi:10.1021/ol050659f. PMID 15876055.
- ↑ „Efficient, one-pot syntheses of biologically active alpha-linked glycolipids“. Chem Commun. 23 (23): 2336–8. June 2007. doi:10.1039/b702551c. PMID 17844738.
- ↑ Fischer, E.; Delbrück, K. (1909). „Über Thiophenol-glucoside“. Ber. Dtsch. Chem. Ges. 42 (2): 1476–82. doi:10.1002/cber.19090420210.
- ↑ „Facile Cu(OTf)2-catalyzed preparation of per-O-acetylated hexopyranoses with stoichiometric acetic anhydride and sequential one-pot anomeric substitution to thioglycosides under solvent-free conditions“. J Org Chem. 68 (22): 8719–22. October 2003. doi:10.1021/jo030073b. PMID 14575510.
- ↑ „One-pot synthesis of per-O-acetylated thioglycosides from unprotected reducing sugars“. Carbohydr Res. 340 (7): 1393–6. May 2005. doi:10.1016/j.carres.2005.02.027. PMID 15854611.
- ↑ „The application of phenylmethanethiol and benzenethiol derivatives as odorless organosulfur reagents in the synthesis of thiosugars and thioglycosides“. Carbohydr Res. 340 (15): 2360–8. October 2005. doi:10.1016/j.carres.2005.07.011. PMID 16143318.
- ↑ Veeneman, G.H.; van Leeuwen, S.H.; van Boom, J.H. (1990). „Iodonium ion promoted reactions at the anomeric centre. II an efficient thioglycoside mediated approach toward the formation of 1,2-trans linked glycosides and glycosidic esters“. Tetrahedron Lett. 31 (9): 1331–4. doi:10.1016/S0040-4039(00)88799-7.
- ↑ Schmidt, R.R.; Michel, J. (1980). „Einfache Synthese von α-und β-O-Glykosylimidaten; Herstellung von Glykosiden und Disacchariden“. Angew. Chem. 92 (9): 763–4. Bibcode:1980AngCh..92..763S. doi:10.1002/ange.19800920933.
- ↑ Schmidt, R.R.; Michel, J. (1980). „Facile Synthesis of α- and β-O-Glycosyl Imidates; Preparation of Glycosides and Disaccharides“. Angew. Chem. Int. Ed. Engl. 19 (9): 731–2. doi:10.1002/anie.198007311.
- ↑ „Differentiation between structurally homologous Shiga 1 and Shiga 2 toxins by using synthetic glycoconjugates“. Angew Chem Int Ed Engl. 47 (7): 1265–8. 2008. doi:10.1002/anie.200703680. PMID 18172842.
- ↑ Heuckendorff, Mads; Jensen, Henrik H. (2017). „Removal of some common glycosylation by-products during reaction work-up“. Carbohydrate Research. 439: 50–56. doi:10.1016/j.carres.2016.12.007. PMID 28107657.
- ↑ „Synthesis of the docosanasaccharide arabinan domain of mycobacterial arabinogalactan and a proposed octadecasaccharide biosynthetic precursor“. J Am Chem Soc. 129 (32): 9885–901. August 2007. doi:10.1021/ja072892+. PMID 17655235.
- ↑ „Synthesis of glycoconjugate vaccines for Candida albicans using novel linker methodology“. J Org Chem. 70 (18): 7381–8. September 2005. doi:10.1021/jo051065t. PMID 16122263.
