Заздравување на рана
| Абразија на раката | ||||
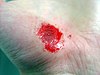
|
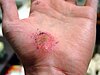
|
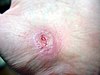
|
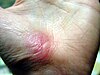
| |
| Приближно денови по повредата | ||||
| 0 | 2 | 17 | 30 | |
Заздравување на рана или цикатризација е сложен процес во кој кожата (или друго ткиво на орган) закрепнува по повреда[1]. Кај нормалната кожа, епидермата (последниот слој) и дермисот (внатрешниот или подлабокиот слој) се урамнотежени и формираат заштитна бариера од надворешната средина. Нормалниот (физиолошки) процес на заздравување на раната започнува веднаш штом се скине заштитната бариера. Класичниот модел на заздравување на рани е поделен на три или четири последователни епати кои се вкрстуваат: хемостаза (некои автори не ја сметаат како фаза), воспалителна фаза, фаза на размножување и фаза на реконструирање. По настанатата повреда на кожата, група од сложени биохемиски елементи почнува да ја поправа штетата по организиран шаблон. По неколку минути од повредата, крвните плочки (тромбоцитите) се насобираат кај местото на повредата за да ја згрутчат крвта. Згрутчувањето го контролира активното крварење (хемостаза).
При воспалителната фаза, бактериите и отпадоците се фагоцитозираат и отстрануваат, а се испуштаат фактори кои ја започнуваат миграцијата и делбата на клетките кои се дел од фазата на размножување.
Фазата на размножување се одликува со ангиогенеза, таложење на колаген, создавање на гранулациско ткиво, епителизација и собирање на раната. Кај ангиогенезата се формираат нови крвни садови од васкуларни ендотелни клетки. При фиброплазијата и формирањето на гранулациско ткиво, фибробластите растат и создаваат нов привремен вонклеточна матрица (ECM) со излачување на колаген и фибронектин. Во исто време, настанува повторна епитализација на епидермата при која епителните клетки се размножуваат и се редат над раната за да обезбедат заштита за новото ткиво.
При собирањето, раната се смалува поради дејството на миофибробласти кои ги зграпчуваат краевите на раната и се собираат користејќи механизам сличен како кај мазните мускулни клетки. Кога улогата на клетките е при крај, непотребните клетки се подвргнуваат на апоптоза. Во етапите на созревање и реконструирање, колагенот се реконструира и повторно се соединува долж линиите на лангер, а клетките кои повеќе не се потребни се отстрануваат со апоптоза.
Сепак, овој процес не е само сложен туку и кревок, а е подложен и на прекини или може да биде неуспешен со што доаѓа до формирање на хронични рани кои не заздравуваат. Фактори кои можат да влијаат на ова се дијабетесот, венска или артериска болест старост и инфекција.
Рана наспроти клеточна фаза[уреди | уреди извор]
Како што е наведено погоре, заздравувањето на раните е поделено на хемостаза, воспалителна фаза, епата на размножување и фаза на реконструкција. Иако се покажал како корисен, кај овој метод одредени етапи многу се поклопуваат. Неодамна бил прикажан дополнителен метод кај кој голем број од елементите при заздравувањето на раната подетално се објаснети. Очигледно е дека овој модел е поважен бидејќи се покажал корисен во полињата на регенеративната медицина и маневрирање со ткиво (погледни го делот за Истражување и развој подолу). Со новиот метод, процесот на заздравување на рани е поделен на две главни етапи: рана фаза и клеточна фаза.
Раната фаза, која започнува во моментот по настанувањето на повредата, опфаќа серија на молекуларни и клеточни настани кои водат до хемостаза и формирање на рана, привремена вонклеточна матрица со што се овозможува структурна поддршка за спојување на клетките и нивно понатаможно размножување.
По раната фаза следува клеточната при која повеќе видови на клетки работат заедно за да го зголемат воспалителниот одговор, да го синтезираат гранулациското ткиво и да го обноват епителниот слој. Клеточната фаза се дели на:
- Макрофаги и воспалителни компоненти (за време на првиот и вториот ден)
- Епително-мезенхимска интеракција – повторна епителизација (фенотипот се менува за неколку часа, миграцијата започнува на првиот или вториот ден)
- Фибробласти и миофибробласти – постепено порамнување, создавање на колаген и собирање на матрицата (помеѓу четвртиот и четиринаестиот ден)
- Ендотелни клетки и ангиогенеза (започнуваат на четвртиот ден)
- Дермална матрица – елементи на составување (започнуваат на четвртиот ден, траат две седмици) и реконструирање (започнува по втората седмица, може да трае од седмици до месеци зависно од големината на раната).
Фаза на воспаление[уреди | уреди извор]
Точно пред да започне фазата на воспаление, настанува згрутчување на крвта со цел да се постигне хемостаза или да се запре губењето на крвта преку формирање на фибрин. Потоа се испуштаат разни растворливи фактори (вклучувајќи ги и хемокините и цитокините) за да привлечат клетки кои ќе ги фагоцитизираат отпадоците, бактериите и оштетеното ткиво и ќе ослободат сигнални молекули кои ќе ја започнат фазата на размножување од заздравувањето на раните.
Серија на згрутчување[уреди | уреди извор]
Кога ткивото ќе се оштети, крвта доаѓа во контакт со колагенот активирајќи ги тромбоцитите да почнат да лачат воспалителни фактори.[2] Тромбоцитите своите клеточни мембрани испуштаат и гликобелковини на кои им овозможуваат да се залепат едни на други, да се соединат и да формираат маса.[3]
Фибринот и фибронектинот се вкрстуваат и формираат чеп кој ги заробува белковините и честичките и спречува понатамошна загуба на крв.[4] Чепот од фибрин и фибронектин е исто така и главната структурна поддршка за раната додека не се наталожи колагенот.[3] Миграциските клетки го користат овој чеп како матрица на која можат да ползат, а тромбоцитите се прилепени до неа и лачат фактори.[3] Згрутчувањето со текот на времето се разложува и се заменува со гранулациско ткиво, а подоцна и со колаген.
Тромбоцитите, клетките кои кратко време по повредата ги има во најголем број, испуштаат повеќе работи во крвта како што се белковини на ЕЦМ, цитокини како и фактори на раст.[2] Факторите на раст ги стимулираат клетките побргу да се делат. Тромбоцитите исто така испуштаат други проинфламаторни фактори како што се серотонин, брадикинин, простагландин, простациклин, тромбоксан и хистамин.[5] Тие имаат повеќе улоги меѓу кои и забрзување на размножувањето на клетките и нивна миграција до областа, ги прошируваат крвните садови и ги прават порозни.
Вазоконстрикција и вазодилатација[уреди | уреди извор]
Веднаш по пукањето на крвниот сад, дупнатите клеточни мембрани испуштаат воспалителни фактори како што се тромбоксани и простагландини кои го згрчуваат крвниот сад за да се спречи губење на крвта и да се соберат воспалителните клетки и фактори од областа.[5] Вазоконстрикцијата трае од пет до десет минути и е проследена со вазодилатација односно размножување на крвните садови, која врвот го достигнува на околу 20 минути по настанувањето на раната.[5] Вазодилатацијата е резултат на факторите кои ги испуштаат тромбоцитите и другите клетки. Главниот фактор за настанување на вазодилатацијата е хистаминот.[2][5] Хистаминот ги прави и крвните садови порозни, а ткивото станува едематозно бидејќи белковините од крвта истекуваат во екстраваскуларниот простор со што се зголемува осмоларниот товар и надоаѓа вода во областа.[5] Зголемената порозност на крвните садови го олеснува и примањето на воспалителните клетки како што се леукоцитите од крвта во областа околу раната.[6][7]
Полиморфонуклеарни неутрофили[уреди | уреди извор]
Во рок од еден час по настанувањето на раната, на местото на раната доаѓаат полиморфонуклеарни неутрофили (ПМН). Тие стануваат најдоминантни клетки во период од два дена по повредата, а особено се изразени вториот ден кога ги има во најголем број.[8] Фибронектинот, факторите на раст и материи како што се кинините, ги привлекуваат неутрофилите на областа кај раната. Неутрофилите ги фагоцитизираат отпадоците и бактериите, а исто така испуштаат и слободни радикали во процес кој се нарекува „респираторна експлозија“ при што ги убиваат бактериите.[9][10] Покрај тоа, лачат и протеази кои ја дезинфицираат раната и го делат оштетеното ткиво. Неутрофилите обично се подвргнуваат на апоптоза штом ја завршат својата задача и штом микофагите ги разложат и преземат.[11]
Други леукоцити кои навлегуваат во областа на раната се помошни Т клетки кои лачат цитокини кои помагаат во разложувањето на Т клетки, го зголемуваат воспалението и ја зголемуваат вазодилацијата и порозноста на крвните садови.[6][12] Т клетките ја зголемуваат и активноста на микрофагите.[6]
Микрофаги[уреди | уреди извор]
Микрофагите се од основно значење за заздравување на раната.[8][13][14] Тие ги заменуваат ПМН како клетки кои доминираат два дена по повредата. Моноцитите од крвта навлегуваат во раната преку ѕидовите на крвните садови, а ги привлекуваат факторите на раст кои ги испуштаат тромбоцитите и другите клетки. Голем број од моноцитите во раната поединечно го достигнуваат врвот половина ден откако ќе настане повредата. Моноцитите созреваат во макрофаги штом се најдат кај раната. Слезината ја содржи половината од моноцитите на телото како резерва која е спремна да се употреби за оштетеното ткиво.
Главната улога на микрофагите е да ги фагоцитизираат бактериите и оштетеното ткиво кое го и отстрануваат испуштајќи протеази. Макрофагите исто така лачат голем број на фактори како што се факторите на раст и други цитокини особено на третиот и четвртиот ден по повредата. Овие фактори ги привлекуваат клетките кои се вклучени во фазата на размножување иако можат да се задржат и во фазата на собирање. Макрофагите се стимулирани од ниското ниво на кислород во нивното окружување да произведуваат фактори кои ја поттикнуваат и забрзуваат ангиогенезата. Тие исто така ги стимулираат и клетките кои повторно ја епителизираат раната, создаваат гранулациско ткиво и поставуваат нова вонклеточна матрица. Со лачењето на овие фактори, микрофагите придонесуваат за забрзување на процесот на заздравување.
Пад на фазата на воспаление[уреди | уреди извор]
Како што се намалува воспалението така се лачат помалку воспалителни фактори, оние кои веќе ги има се разложуваат, а се намалува и бројот на неутрофили и микрофаги кај раната.[8] Овие промени навестуваат дека фазата на воспаление завршува и дека започнува фазата на размножување.[8] Резултати од ин витро, кои биле обезбедени со дермалниот еквивалентен модел, покажуваат дека просуството на микрофаги всушност го одложува собирањето на раната, а со тоа и исчезнувањето на микрофагите од раната може да биде од суштинско значење за почетокот на наредните фази.[14]
Отстранувањето на отпадоците и започнувањето на фазата на размножување е неопходен дел од заздравувањето бидејќи воспалението помага при борбата со инфекција. Сепак, доколку трае предолго, воспалението може да доведе до оштетување на ткивото. Поради тоа, честопати главна цел на лековите е намалување на воспалението. Воспалението трае сè додека има отпадоци во раната. Како резултат на тоа, присуството на нечистотија или други предмети може премногу да ја продолжи фазата на воспаление и да доведе до хронична рана.
Фаза на размножување[уреди | уреди извор]
Два или три дена по настанувањето на раната, фибробластите навлегуваат во раната со што го означуваат почетокот на фазата на размножување дури и пред да заврши вопалителната фаза.[15] Како и кај другите фази на заздравување на раната, чекорите кај фазата на размножување не настануваат во серии, туку делумно се преклопуваат.
Ангиогенеза[уреди | уреди извор]
Позната и како неоваскуларизација ангиогенезата настанува во исто време со размножувањето на фибробластите кога ендотелните клетки мигрираат накај местото на раната.[16] Ангиогенезата е задолжителна за другите етапи од заздравувањето како што се епидермалната и миграцијата на фибробластите бидејќи активноста на епителните клетки и фибробластите бара кислород и хранливи материи. Ткивото кај кое настанува ангиогенезата обично е црвено (еритематозно) поради капиларите.[16]
Матичните клетки на ендотелните клетки, кои доаѓаат од делови од неоштетените крвни садови, развиваат псевдоподија и го туркаат ЕЦМ на местото на кое е раната за да се оформат нови крвни садови.[9]
Ендотелните клетки се примамени од фибронектинот кој се наоѓа на лишајот, а хемотаксички и од ангиогенски фактори кои, пак, ги испуштаат други клетки,[17] на пример микрофагите и тромбоцитите кога во окружувањето има ниско ниво на кислород. Растењето и размножувањето на ендотелот е директно стимулиран од хипоксијата и од лактичната киселина во раната.[15]
За да можат ендотелните клетки да мигрираат, потребно е колагеназите и плазминоген активаторот да го разложат згрутчувањето и да се одделат од ЕЦМ.[5][8] Металопротеиназите зависни од цинк ја варат базалната мембрана и ЕЦМ за да ја овозможат миграцијата на клетките, размножувањето и ангиогенезата.[18]
Кога микрофагите и другите фактори на раст кои произведуваат клетки повеќе не се во хипоксичка средина исполнета со лактична киселина, престануваат да произведуваат ангиогенски фактори.[9] Како резултат на тоа, кога ткивото е соодветно перфузирано, миграцијата и размножувањето на ендотелните клетки се намалува. На крајот, крвните садови кои веќе не се потребни умираат преку апоптоза.[17]
Фиброплазија и формирање на гранулациско ткиво[уреди | уреди извор]
Фибробластите почнуваат да се насобираат на местото на раната во исто време со ангиогенезата. Тие навлегуваат во раната два до пет дена по настанувањето на повредата односно при завршувањето на воспалителната фаза, а ги има во најголем број по една до две седмици по создавањето на раната. На крајот на првата седмица, фибробластите се главните клетки во раната. Фиброплазијата завршува по две до четири седмици по повредата.
Во првите два до три дена по настанувањето на повредата, фибробластите главно мигрират и се шират, а подоцна се главните клетки кои поставуваат матрица од колаген во раната. Се смета дека фибробластите потекнуваат од околното неоштетено кожно ткиво (иако постојат нови докази дека дел од нив доаѓаат од возрасни матични клетки/претходници кои циркулираат во крвта). Фибробластите отпрвин ги користат вкрстените влакна на фибрините (кои се добро оформени на крајот на воспалителната фаза) за да мигрираат низ раната, а потоа се прилепуваат за фибронектинот. Фибробластите потоа ја нанесуваат основната материја врз раната, а подоцна и колагенот кон кој можат да се залепат поради миграцијата.
Гранулациското ткиво функционира како основно ткиво и веќе почнува да се појавува во раната за време на воспалителната фаза, односно два до пет дена по настанувањето на повредата, и продолжува да расте сè додека раната не се покрие. Гранулациското ткиво се состои од нови крвни садови, фибробласти, воспалителни клетки, ендотелни клетки, миофибробласти и од составните делови на новиот вонклеточен матрица (ЕЦМ). Привремениот ЕЦМ се разликува по состав од ЕЦМ кај нормалното ткиво, а неговите состојки доаѓаат од фибробластите. Во таквите состојки спаѓаат фибронектин, колаген, гликозаминогликани, еластин, гликобелковини и протеогликани. Неговите главни составни делови се фибронектинот и хијалуронот кои создаваат добро хидриран матрица и ја олеснуваат миграцијата на клетките. Овој привремен матрица подоцна се заменува со ЕЦМ кој е посличен на оној кај неоштетено ткиво.
Факторите на раст (ТФР, ТФР-β) и фибронектинот го поттикнуваат размножувањето, миграцијата кај раната и создавањето на молекули на ЕЦМ од страна на фибробластите. Фибробластите исто така лачат фактори на раст кои ги привлекуваат епителните клетки на местото на раната. Хипоксијата исто така прионесува кон размножувањето на фибробластите и излачувањето на фактори на раст иако ниското ниво на кислород ќе го наруши нивниот раст, како и таложењето на составните делови на ЕЦМ и ќе доведе до појава на прекумерни фиброзни лузни.
Таложење на колаген[уреди | уреди извор]
Една од најважните задачи на фибробластите е производството на колаген.[16]
Таложењето на колагенот е важно бидејќи се зголемува издржливоста на раната. Пред да се наталожи колагенот, единственото нешто што ја држи раната затворена е засирената крв од фибрин и фибронектин која не е многу отпорна на повреди.[9] Покрај тоа, клетките кои се вклучени во воспалението, ангиогенезата и составувањето на сврзното ткиво се прикачуваат, растат и се преобразуваат на матрицата од колаген кој е поставен од фибробластите.[19]
Колагенот тип 3 и фибронектинот, почнуваат да се произведуваат во забележителни количини обично некаде помеѓу 10 часа[20] и 3 дена,[17] зависно од големината на раната. Нивното таложење го достигнува врвот на една до три седмици.[21] Тие се еластични супстанци кои преовладуваат сè до подоцнежната фаза на созревањето при која се заменуваат со посилниот колаген тип 1.
Како што фибробластите создаваат нов колаген, колагеназите и другите фактори го разложуваат. Кратко време по настанувањето на повредата, синтезата го надминува разложувањето поради што нивоата на колаген во раната растат, но подоцна производството и разложувањето се изедначуваат така што нема вишок колаген.[9] Оваа хомеостаза го најавува почетокот на последната фаза на созревање. Гранулацијата полека се прекинува, а штом ќе заврши задачата на фибробластите, нивниот број се намалува.[22] На крајот на гранулациската фаза, фибробластите извршуваат апоптоза со што гранулациското ткиво од средина богата со клетки се преозбразува во средина која се состои главно од колаген.[5]
Епителизација[уреди | уреди извор]
Формирањето на гранулациско ткиво кај отворена рана овозможува да се изврши повторна епителизација бидејќи епителните клетки мигрираат низ новото ткиво за да формираат бариера помеѓу раната и надворешната средина.[17] Базалните кератиноцити од краевите на раната и дермалните додатоци како што се фоликулите на влакната, потните и лојните жлезди се главните клетки одговорни за фазата на епителизација од заздравувањето на раните.[22] Тие бргу напредуваат низ раната и се размножуваат на нејзините краеви, а престануваат да се движат кога ќе се најдат во средината. Иако при заздравувањето ќе се создаде лузна, не се формираат потни жлезди и фоликули на влакната.[23][24]
Кератиноцитите мигрираат без првин да се размножат.[25] Миграцијата може да почне дури и неколку часа по настанувањето на повредата. Сепак, епителните клетки бараат ткиво на кое ќе можат да опстанат за да мигрираат преку него така што ако раната е длабока, мора првин да се исполни со гранулациско ткиво.[26] Поради тоа, не се знае кога точно ќе започне миграцијата, а може да започне еден ден по повредата.[27] Клетките на краевите на раната се размножуваат на вториот и третиот ден по создавањето на раната за да обезбедат повеќе клетки за миграцијата.[21]
Доколку не се пробие базалната мембрана, епителните клетки се заменуваат во рок од три дена преку поделба и нагорна миграција во базалниот слој на ист начин како кај неоштетената кожа.[17] Сепак, доколку базалната мембрана на местото на раната се уништи, повторната епителизација мора да настане од краевите на раната и од додатоците на кожата како што се фоликулите на влакната и потните и лојните жлезди кои навлегуваат во дермисот и се поврзани со кератиноцити кои можат да опстанат.[21] Доколку раната е премногу длабока, можат да се уништат и додатоците на кожата, а миграцијата може да настане само од краевите на раната.[26]
Миграцијата на кератиноцитите преку местото на раната е поттикната од недостатокот на контактна инхибиција и од хемикалии како што е азот оксид.[28] Пред да почнат да мигрираат, клетките мора да ги растворат своите дезмосоми и хемидезмосоми кои обично ги прицврстуваат интермедијарните филаменти од нивниот цитоскелет со други клетки и со ЕЦМ.[12] Белковините на трансмембранскиот рецептор наречени интегрини се испуштаат од интермедијарните филаменти на клетката и се преместуваат кај актинските филаменти за да служат како додатоци на ЕЦМ за псевдоподијата за време на миграцијата.[12] Интегрините се направени од гликобелковини и обично ги прицврстуваат клетките преку нивниот цитоскелет за базалната мембрана. Како резултат на тоа, кератиноцитите се одделуваат од базалната мембрана и можат да навлезат во местото на раната.[15]
Пред да почнат да мигрираат, кератиноцитите го менуваат обликот, стануваат подолги и порамни и ги продолжуваат клеточните процеси како што е ламелиподијата и ги прошируваат израстоците кои личат на набори.[29] Се формираат актински филаменти и псевдоподијата.[15] За време на миграцијата, интегрините на псевдоподот се прикачуваат за ЕЦМ, а актинските филаменти во израстокот ја повлекуваат клетката.[12] Интеракцијата со молекулите во ЕЦМ преку интегрините уште повеќе го поттикнуваат формирањето на актинските филаменти, ламелиподијата и филоподијата.[12]
Епителните клетки се качуваат една врз друга за да можат да мигрираат.[22] Ширењето на епителните клетки честопати се нарекува епителен јазик.[25] Првите клетки кои ќе се прикачат на базалната мембрана го формираат базалниот слој. Овие клетки продолжуваат да мигрираат низ раната, а епителните клетки исто така се лизгаат во чекор со нив.[25] Колку побрзо настане миграцијата, толку помала лузна ќе се формира.[30]
Фибринот, колагенот и фибронектинот во ЕЦМ можат да им помогнат на сигналните клетки да се делат и да мигрираат. Како и фибробластите, кератиноцитите кои мигрираат ги користат фибронектините вкрстени со наталожениот фибрин при воспалението како место за прилепување на кое можат да ползат.[22][29][31]
Кератиноцитите, при мигрирањето, се движат над гранулациското ткиво но под лишајот (ако се формира) со што го одвојува од основното ткиво.[22][27] Епителните клетки имаат способност да ги фагоцитизираат отпадоците како што се мртвото ткиво и бактериите кои би им само пречеле. Миграцијата на кератиноцитите се подобрува доколку средината е влажна бидејќи сувата средина доведува до формирање на поголем и поцврст лишај, а кератиноцитите мора да ги разложат сите лишаи што ќе се појават.[17][22][31][32] За да можат да го продолжат својот пат, кератиноцититте мора да го разложат згрутчувањето, отпадоците и делови од ЕЦМ за да можат да поминат.[27][33] Тие лачат плазминоген активатор кој го активира плазминогенот и го претвора во плазмин за да го разложи лишајот. Клетките можат да мигрираат само на живо ткиво.[22] Поради тоа мораат да лачат колагенази и протеази како што се матрица металопротеинази (ММП) за да ги разложат оштетените делови од ЕЦМ на кои наидуваат особено на почетокот на мигрирањето.[27] Кератиноцитите ја разложуваат и базалната мембрана наместо која го користат новиот ЕЦМ наталожен од фибробластите за да ползат наоколу.[12]
Со понатамошната миграција на кератиноцитите, на краевите на раната мора да се формираат нови епителни клетки за да ги заменат и да обезбедат повеќе клетки за прекривањето.[31] По мигрирањето на кератиноцитите, размножувањето обично започнува неколку дена по настанувањето на повредата[26] и во оваа етапа од епителизацијата е 17 пати повисоко отколку кај нормалните ткива.[31] Единствените клетки кои се размножуваат додека да се прекрие целата рана се клетките кои се наоѓаат на рабовите на раната.[25]
Факторите на раст, поттикнати од интегрините и ММП, ги стимулираат клетките на рабовите да се размножуваат. И самите кератиноцити исто така произведуваат и лачат фактори вклучувајќи ги и факторите на раст и белковините на базалната мембрана, кои помагаат при епителизацијата и другите фази на заздравувањето.[34] Факторите на раст се исто така важни за природната имунолошка одбрана на раните на кожата бидејќи го стимулираат создавањето на антимикробски пептиди и неутрофилски хемотаксички цитокини кај кератиноцитите.
Кератиноцитите продолжуваат да мигрираат низ раната сè додека клетките од двете страни не се сретнат на средината при што контактната инхибиција го стопира нивното мигрирање.[29] Кога ќе завршат со мигрирањето, кератиноцитите лачат белковини кои ја формираат новата базална мембрана.[29] Клетките ги враќаат морфолошките промени на кои беа подвргнати за да можат да мигрираат. Повторно ги воспоставуваат дезмосомите и хедезмосомите и пак се вкотвуваат кај базалната мембрана.[12] Бзалните клетки се делат и преобразуваат на ист начин како кај нормалната кожа за повторно да го воспостават слојот кај реепитализираната кожа.[29]
Собирање[уреди | уреди извор]
Собирањето е главната фаза од заздравувањето на раната. Доколку собирањето трае предолго, може да доведе до изобличивање и загуба на функцијата. Поради тоа постои голем интерес за да се разбере биологијата на собирањето на раната. Тоа може да се изведе преку ин витро со гел со колаген за собирање или со демалниот еквивалентен модел.
Собирањето започнува точно една седмица по повредувањето кога фибробластите се преобразуваат во миофибробласти. При подлабоки рани, собирањето го достигнува врвот на 5 до 15 дена по повредата, а може да трае неколку седмици и да продолжи дури и кога раната е целосно реепителизирана. Голема рана може да се смали од 40 до 80 проценти по собирањето. Раните можат да се собираат со брзина од 0.75 мм на ден зависно од тоа колку е лабаво ткивото на местото на раната. Собирањето обично не е симетрично. Повеќето од раните имаат „оска на собирање“ со која клетките подобро се организираат и порамнуваат со колагенот.
Собирањето на почетокот настанува без помошта на миофибробластите. Поттикнати од факторите на раст, фибробластите подосна се преобразуваат во миофибробласти. За собирањето се одговорни миофибробластите кои се слични на мазните мускулни клетки. Миофибробластите го содржат истиот вид на актин како кај мазните мускулни клетки.
Фибронектинот и факторите на раст ги привлекуваат миофибробластите. Тие се движат покрај фибронектинот кој е поврзан со фибринот во привремениот ЕЦМ со цел да стигнат до рабовите на раната. Таму се поврзуваат со ЕЦМ и со помош на дезмосомите се прикачуваат една за друга и за краевите на раната. При сраснувањето наречено фибронексус, актинот кај миофибробластите се поврзува низ клеточната мембрана со молекулите во вонклеточниот матрица како што се фибронекин и колаген. Миофибробластите имаат многу такви сраснувања кои им дозволуваат да го влечат ЕЦМ кога се собираат при што ја намалуваат големината на раната. Затворањето настанува многу побрзо во овој дел од собирањето отколку во првиот дел без миофибробластите.
Како што се собира актинот во миофибробластите, така се соединуваат рабовите на раната. Фибробластите го таложат колагенот за да ја зацврсти раната при собирањето на миофибробластите. Етапата на собирање кај размножувањето завршува така што миофибробластите престануваат со собирањето и извршуваат апоптоза. Раскинувањето на привремениот матрица доведува до намалување на хијалуронската киселина и до зголемување на хондроитин сулфат кој постепено ги поттикнува фибробластите да престанат со миграцијата и размножувањето. Со ова се најавува почетокот на фазата на зреење од заздравувато на раната.
Созревање и реконструкција[уреди | уреди извор]
Кога ќе се изедначат нивоата на колагенот и разложувањето значи дека започнала фазата на созревање од заздравувањето на ткивото. За време на созревањето, колагенот тип 3, кој преовладува за време за размножувањето, е заменет од колаген тип 1. Неорганизираните колагенски влакна се преуредуваат, се вркстуваат и се поредуваат долж лангеровите линии. Почетокот на фазата на созревање може значително да варира зависно од големината на раната и дали во почетокот била затворена или отворена. Почетокот на фазата може да трае од 3 дена до 3 седмици. Фазата на созревање може да трае една година или повеќе што исто така зависи од видот на раната.
По три месеци по повредата, цврстината на затегање на раната се зголемува приближно до 50 проценти од нормалното ткиво, а на крајот достига и до 80 проценти. Лузната го губи црвенилото бидејќи веќе не е потребна активност на местото на раната и затоа крвните садови кои повеќе не се потребни се отстрануваат преку апоптоза.
Фазите од заздравувањето на раните обично имаат предвиден, временски рок. Сепак, доколку траат повеќе од предвиденото, може да прераснат во хронична рана како што е венскиот улкус или патолошка лузна како што е келоидната лузна.
Истражување и развој[уреди | уреди извор]
До пред една деценија, класичната парадигма на заздравувањето на рани која ги вклучува матичните клетки кои потекнуваат од одреден орган, никогаш не била доведена во прашање. Оттогаш, како алтернативно решени е се појави концепцијата на возрасни матични клетки со клеточна пластичност или со способност да се преобразуваат во клетки без потомство. Поточно кажано, хематопоетичните прогениторни клетки (кои ги зајакнуваат зрелите клетки во крвта) имаат способност да се преобразат назад во хематопоетични матични клетки и/или да се трансдиференцираат во клетки без потомство како што се фибробластите.
Матични клетки и клеточна пластичност[уреди | уреди извор]
Мултипотентните возрасни матични клетки имаат способност самите да се обновуваат и да создаваат различни видови на клетки. Матичните клетки создаваат прогениторни клетки односно клетки кои не се обновуваат самите, но можат да создадат неколку видови на клетки. Мерата во која матичните клетки се застапени во заздравувањето на кожата на раната е сложена и не е целосно разбрана.
Се смета дека епидермата и дермисот се преструктуираат од митозни матични клетки кои живеат на врвот на кожата (базални матични клетки или БМК), на испакнатините на фоликулите на влакната (матични клетки на фоликулите на влаката или МКФВ) и на папиларниот дермис (дермални матични клетки). Покрај тоа, коскената срж исто така може да содржи матични клетки кои играат важна улога во заздравувањето на кожното ткиво.
Во ретки случаи, како што е голема повреда на кожата, суппопулациите во коскената срж кои сами се обновуваат се поттикнати да учествуваат во процесот на заздравување каде што произведуваат клетки кои лачат колаген кои наизглед играат улога при зазравувањето на раната. Двете суппопулации кои сами се обновуваат се мезенхимални матични клетки (ММК) од коскената срж и хематопоетски матични клетки (ХМК). Во коскената срж има и прогениторни суппопулации (ендотелни прогениторни клетки или ЕПК) кои на ист начин помагаат при реконструкцијата на крвните садови. Покрај тоа, се смета дека голема повреда на кожата ја поттикнува раната размена на ретка поткласа на леукоцити (циркулирачки фиброцити) до местото на раната каде што помагаат при заздравувањето.
Заздравување на рана наспроти регенерација[уреди | уреди извор]
Постои суптилна разлика помеѓу „заздравување“ и „регенерација“. Повредата претставува прекин на морфологијата и/или функционалноста на одредено ткиво. Заздравувањето се однесува на физиолошкото приспособување на орган по повредата со цел повторно да се воспостави континуитет без да се земе предвид точната замена на изгубеното/оштетено ткиво. Вистинската регенерација на ткивото се однесува на замена на изгубеното/оштетено ткиво со „иста“ копија така што морфологијата и функционалноста. Цицачите не ја регенерираат кожата спонтано. Во некои случаи може да настане „делумна регенерација“ со користење на биолошко разградливо скеле (колаген-гликозаминогликан). Скелето е слично по структура на вонклеточниот матрица (ЕЦМ) кај нормалниот, неоштетен дермис. Интересно е тоа што основните услови коишто се потребни за регенерација честопати се спротивни на условите кои се потребни за успешно заздравување на раната во кои спаѓаат спречување на активирањето на тромбоцитите, воспалителниот одговор и собирањето на раната. Покрај обезбедување на поддршка за фибробластите и ендотелните клетки, биоразградливите скелиња го спречуваат собирањето на раната, со што процесот на заздравување продолжува со поголемо ниво на регенерација, а со помалку лузни. Фармацевтските агенси биле истражувани и би можеле да го отстранат преобразувањето на миофибробластите.
Нов начин на размислување произлезе од концепцијата дека хепаран сулфатите имаа главна улога кај хомеостаза на ткивото односно процесот во кој ткивото ги заменува мртвите клетки со идентични клетки. На местото на раната нема хомеостаза на ткивото бидејќи хепаран сулфатите се разложуваат со што мртвите клетки не можат да се заменат со идентични. Полимерите слични на хепаран сулфат не можат да бидат разложени од сите хепаранази и гликанази или, пак, да се врзат за слободните точки за сврзување на хепарин сулфат на ЕЦМ и со тоа да ја зачуваат хомеостазата на нормалното ткиво и да ги спречат лузните.
Поттикнување на заздравувањето на раната од перспектива на раст[уреди | уреди извор]
Вложен е значаен напор за да се разберат главните физички односи на заздравувањето на раните, а со тоа и на создавањето на лузни. Притоа биле користени математички модели и симулации за да се разјаснат овие односи. Растењето на ткивото околу раната е резултат на миграцијата на клетките и на нивното таложење на колаген. Порамнувањето на колагенот го објаснува степенот на создавање на лузни. Колагенот во вид на плетена кошница е карактеристичен за нормална кожа, а од порамнетите колагенски влакна настануваат големи лузни. Растењето на ткивото и големината на лузната може да се контролира со прилагодување на напнатоста кај раната.
Растот на ткивото, од биохемиска и биомеханичка гледна точка, може да се стимулира со помош на горенаведените односи. Биолошки активните хемикали кои играат важна улога при заздравувањето на раната се оформени со Фиковата дифузија за да се создадат концентрациски профили. Равенката за баланс за отворени системи при заздравување на рана опфаќа голем раст како резултат на миграцијата и размножувањето на клетките. Се користи следнава равенка:
Dtρ0 = Div (R) + R0
каде што, ρ претставува голема густина, R претставува голем прилив, а R0 претставува голем извор (од размножување на клетките, делење или зголемување).
Видови[уреди | уреди извор]
Прва намера[уреди | уреди извор]
ја опфаќа епидермата и дермисот без целосно продирање на заздравувањето на дермисот од процесот на епителизација
- Кога рабовите на раната се зближуваат за да граничат едни со други (да се соединат)
- Минимално создавање на лузни
- При лекување со прва намера заздравуваат повеќето хируршки рани
- Затворањето на раната се врши со шевови (конци), спојници или леплива лента
- Примери: добро заздравени рани и фрактури на коски, заздравување по флап-операција
Втора намера[уреди | уреди извор]
- Раната може да гранулира
- Хирургот може да ја обвитка раната со газа или да користи систем за дренажа
- Гранулацијата доведува со поголема лузна
- Присуството на дренажа од инфекција може да го забави процесот на заздравување
- Раната мора да се негува секој ден за да се отстранат отпадоците од раната и да се овозможи формирање на гранулациско ткиво
- Примери: гингивектомија, гингивопластика, алвеоли за вадење заби, лошо заздравени фрактури
Трета намера[уреди | уреди извор]
(одложено затворање на рана при прва намера или шев при втора намера)
- Раната е исчистена, нема отпадоци и е под набљудување обично 4 до 5 дена пред да се затвори
- Раната намерно е оставена отворена
- Примери: заздравување на рани со користење на ткивни графтови
Доколку рабовите на раната не се соединат веднаш, доаѓа до одложено заздравување на рана при прва намера. При инфицирани рани пожелен е ваквиот тип на заздравување. Фагоцитозата на инфицираното ткиво до четвртиот ден веќе е во тек, а започнуваат и процесите на епителизација, таложење на колаген и созревање. Макрофагите, кои можат да се преобразат во епителоидни клетки, ги одвојуваат туѓите тела кои се опкружени со мононуклеарни леукоцити и формираат грануломи. Во ваков случај, раната обично се затвора хируршки, а доколку „прочистувањето“ на раната не е се уште завршено, може да настане хронична инфекција со што настануваат јасно видливи лузни.
Компликации при заздравување на рана[уреди | уреди извор]
Постојат многу компликации кои можат да настанат при заздравување на раната:
- Несоодветно формирање на лузна: може да доведе до повторно отворање или до пукање на раната поради несоодветно формирање на гранулациско ткиво.
- Формирање на голема лузна: хипертрофична лузна, келоид, дезмоид.
- Прекумерна гранулација (диво месо)
- Недоволно собирање на раната (кај кожните графтови) или прекумерно собирање (кај изгореници).
- Други: дистрофична калцификација, промени во пигментот, болни лузни, хернија како последица на царски рез итн.
Краток преглед на вмешаните фактори на раст[уреди | уреди извор]
Главните фактори на раст вклучени во заздравување на раната се:
| Фактор на раст | Кратенка | Главен извор | Ефекти |
|---|---|---|---|
| Епидермален фактор на раст | ЕФР |
|
|
| Трансформирачки фактор на раст - α | ТФР - α |
|
|
| Хепатоцитен фактор на раст | ХФР |
|
|
| Васкуларно ендотелен фактор на раст | ВЕФР |
|
|
| Тромбоцитен фактор на раст | ТФР |
|
|
| Фактор на раст на фибробласти 1 и 2 | ФРФ -1, -2 |
|
|
| Трансформирачки фактор на раст - β | ТФР - β |
|
|
| Фактор на раст на кератиноцити | ФРК |
|
|
Наводи[уреди | уреди извор]
- ↑ Nguyen DT, Orgill DP, Murphy GT (2009). „4 The Pathophysiologic Basis for Wound Healing and Cutaneous Regeneration“. Biomaterials for Treating Skin Loss. Elsevier. стр. 25–57. Orgill DP, Blanco C (editors). ISBN 978-1-84569-554-5.
- ↑ 2,0 2,1 2,2 Rosenberg L., de la Torre J. (2006). Wound Healing, Growth Factors Архивирано на 21 ноември 2008 г.. Emedicine.com. Accessed January 20, 2008.
- ↑ 3,0 3,1 3,2 Midwood KS, Williams LV, Schwarzbauer JE (June 2004). „Tissue repair and the dynamics of the extracellular matrix“. The International Journal of Biochemistry & Cell Biology. 36 (6): 1031–7. doi:10.1016/j.biocel.2003.12.003. PMID 15094118.
- ↑ Sandeman SR, Allen MC, Liu C, Faragher RG, Lloyd AW (November 2000). „Human keratocyte migration into collagen gels declines with in vitro ageing“. Mechanisms of Ageing and Development. 119 (3): 149–57. doi:10.1016/S0047-6374(00)00177-9. PMID 11080534. S2CID 21115977.
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 5,6 Stadelmann WK, Digenis AG, Tobin GR (August 1998). „Physiology and healing dynamics of chronic cutaneous wounds“. American Journal of Surgery. 176 (2A Suppl): 26S–38S. doi:10.1016/S0002-9610(98)00183-4. PMID 9777970.
- ↑ 6,0 6,1 6,2 Dealey C. (1999). The care of wounds: A guide for nurses. Oxford; Malden, Mass. Blackwell Science. Electronic book.
- ↑ Theoret CL (2004). „Update on wound repair“. Clinical Techniques in Equine Practice. 3 (2): 110–122. doi:10.1053/j.ctep.2004.08.009.
- ↑ 8,0 8,1 8,2 8,3 8,4 de la Torre J., Sholar A. (2006). Wound healing: Chronic wounds Архивирано на 29 октомври 2008 г.. Emedicine.com. Accessed January 20, 2008.
- ↑ 9,0 9,1 9,2 9,3 9,4 Greenhalgh DG (September 1998). „The role of apoptosis in wound healing“. The International Journal of Biochemistry & Cell Biology. 30 (9): 1019–30. doi:10.1016/S1357-2725(98)00058-2. PMID 9785465.
- ↑ Muller MJ, Hollyoak MA, Moaveni Z, Brown TL, Herndon DN, Heggers JP (December 2003). „Retardation of wound healing by silver sulfadiazine is reversed by Aloe vera and nystatin“. Burns. 29 (8): 834–6. doi:10.1016/S0305-4179(03)00198-0. PMID 14636760.
- ↑ Martin P, Leibovich SJ (November 2005). „Inflammatory cells during wound repair: the good, the bad and the ugly“. Trends in Cell Biology. 15 (11): 599–607. doi:10.1016/j.tcb.2005.09.002. PMID 16202600.
- ↑ 12,0 12,1 12,2 12,3 12,4 12,5 12,6 Santoro MM, Gaudino G (March 2005). „Cellular and molecular facets of keratinocyte reepithelization during wound healing“. Experimental Cell Research. 304 (1): 274–86. doi:10.1016/j.yexcr.2004.10.033. PMID 15707592.
- ↑ Ovchinnikov DA (September 2008). „Macrophages in the embryo and beyond: much more than just giant phagocytes“. Genesis. 46 (9): 447–62. doi:10.1002/dvg.20417. PMID 18781633. S2CID 38894501.
Macrophages are present essentially in all tissues, beginning with embryonic development and, in addition to their role in host defense and in the clearance of apoptotic cells, are being increasingly recognized for their trophic function and role in regeneration.
- ↑ 14,0 14,1 Newton PM, Watson JA, Wolowacz RG, Wood EJ (August 2004). „Macrophages restrain contraction of an in vitro wound healing model“. Inflammation. 28 (4): 207–14. doi:10.1023/B:IFLA.0000049045.41784.59. PMID 15673162. S2CID 9612298.
- ↑ 15,0 15,1 15,2 15,3 Falanga V. (2005). Wound Healing. American Academy of Dermatology (AAD).
- ↑ 16,0 16,1 16,2 Kuwahara R.T. and Rasberry R. 2007. Chemical Peels Архивирано на 25 октомври 2008 г.. Emedicine.com. Accessed September 15, 2007.
- ↑ 17,0 17,1 17,2 17,3 17,4 17,5 Romo T. and Pearson J.M. 2005. Wound Healing, Skin Архивирано на 7 декември 2008 г.. Emedicine.com. Accessed December 27, 2006.
- ↑ Lansdown AB, Sampson B, Rowe A (February 2001). „Experimental observations in the rat on the influence of cadmium on skin wound repair“. International Journal of Experimental Pathology. 82 (1): 35–41. doi:10.1046/j.1365-2613.2001.00180.x. PMC 2517695. PMID 11422539.
- ↑ Ruszczak Z (November 2003). „Effect of collagen matrices on dermal wound healing“. Advanced Drug Delivery Reviews. 55 (12): 1595–611. doi:10.1016/j.addr.2003.08.003. PMID 14623403.
- ↑ Fig. 9-1. The cellular, biochemical, and mechanical phases of wound healing. Pollock, Raphael E.; Brunicardi, F. Charles; Andersen, Dana K.; Billiar, Timothy R.; Dunn, David; Hunter, John G.; Matthews, Jeffrey J. (2009). Schwartz's Principles of Surgery, Ninth Edition. McGraw-Hill Professional. ISBN 978-0-07-154769-7. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ 21,0 21,1 21,2 Mercandetti M, Cohen AJ (2005). „Wound Healing: Healing and Repair“. Emedicine.com. Архивирано од изворникот 21 November 2008. Посетено на 20 January 2008.
- ↑ 22,0 22,1 22,2 22,3 22,4 22,5 22,6 DiPietro LA, Burns AL, уред. (2003). Wound Healing: Methods and Protocols. Methods in Molecular Medicine. Totowa, N.J.: Humana Press.
- ↑ Fu XB, Sun TZ, Li XK, Sheng ZY (February 2005). „Morphological and distribution characteristics of sweat glands in hypertrophic scar and their possible effects on sweat gland regeneration“. Chinese Medical Journal. 118 (3): 186–91. PMID 15740645. Архивирано од изворникот на 2018-06-20. Посетено на 2014-06-18.
- ↑ „BURN INJURIES“. nationaltraumainstitute.org. Архивирано од изворникот на 3 March 2016. Посетено на 13 July 2016.
When the dermis is destroyed, the scars do not regrow hair, nerves or sweat glands, providing additional challenges to body temperature control.
- ↑ 25,0 25,1 25,2 25,3 Bartkova J, Grøn B, Dabelsteen E, Bartek J (February 2003). „Cell-cycle regulatory proteins in human wound healing“. Archives of Oral Biology. 48 (2): 125–32. doi:10.1016/S0003-9969(02)00202-9. PMID 12642231.
- ↑ 26,0 26,1 26,2 Mulvaney M. and Harrington A. 1994. Chapter 7: Cutaneous trauma and its treatment. In, Textbook of Military Medicine: Military Dermatology. Office of the Surgeon General, Department of the Army. Virtual Naval Hospital Project. Accessed through web archive on September 15, 2007.
- ↑ 27,0 27,1 27,2 27,3 Larjava H., Koivisto L., and Hakkinen L. 2002. Chapter 3: Keratinocyte Interactions with Fibronectin During Wound Healing. In, Heino, J. and Kahari, V.M. Cell Invasion. Medical Intelligence Unit; 33. Georgetown, Tex., Austin, Tex Landes Bioscience, Inc. Electronic book.
- ↑ Witte MB, Barbul A (April 2002). „Role of nitric oxide in wound repair“. American Journal of Surgery. 183 (4): 406–12. doi:10.1016/S0002-9610(02)00815-2. PMID 11975928.
- ↑ 29,0 29,1 29,2 29,3 29,4 Lorenz HP, Longaker MT (2003). „Wounds: Biology, Pathology, and Management“ (PDF). Во Norton JA (уред.). Surgery. New York, NY: Springer. стр. 191–208. doi:10.1007/978-0-387-68113-9_10. ISBN 978-0-387-30800-5. S2CID 83849346. Архивирано од изворникот (PDF) на 24 August 2014.
- ↑ Son, Hyun Joo; Bae, Hyun Chul; Kim, Hyun Jeong; Lee, Dong Hee; Han, Dong-Wook; Park, Jong-Chul (2005). „Effects of β-glucan on proliferation and migration of fibroblasts“. Current Applied Physics. 5 (5): 468–71. Bibcode:2005CAP.....5..468S. doi:10.1016/j.cap.2005.01.011. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ 31,0 31,1 31,2 31,3 Deodhar AK, Rana RE (1997). „Surgical physiology of wound healing: a review“. Journal of Postgraduate Medicine. 43 (2): 52–6. PMID 10740722. Архивирано од изворникот 2011-02-26. Посетено на 2005-10-27.
- ↑ Falanga V (2004). „The chronic wound: impaired healing and solutions in the context of wound bed preparation“. Blood Cells, Molecules & Diseases. 32 (1): 88–94. doi:10.1016/j.bcmd.2003.09.020. PMID 14757419.
- ↑ Etscheid M, Beer N, Dodt J (December 2005). „The hyaluronan-binding protease upregulates ERK1/2 and PI3K/Akt signalling pathways in fibroblasts and stimulates cell proliferation and migration“. Cellular Signalling. 17 (12): 1486–94. doi:10.1016/j.cellsig.2005.03.007. PMID 16153533.
- ↑ Bayram Y, Deveci M, Imirzalioglu N, Soysal Y, Sengezer M (October 2005). „The cell based dressing with living allogenic keratinocytes in the treatment of foot ulcers: a case study“. British Journal of Plastic Surgery. 58 (7): 988–96. doi:10.1016/j.bjps.2005.04.031. PMID 16040019.
