Азотни оксиди: Разлика помеѓу преработките
| [проверена преработка] | [проверена преработка] |
с отстранета Категорија:Неорганска соединенија на азотот; додадена Категорија:Неоргански соединенија на азотот користејќи го HotCat |
Поправка на печатни и граматички грешки |
||
| Ред 8: | Ред 8: | ||
(Последните три од спискот се нестабилни соединенија.) |
(Последните три од спискот се нестабилни соединенија.) |
||
[[Хемиска реакција|Хемиската реакција]] која доведува до создавање на азотните оксиди може да се |
[[Хемиска реакција|Хемиската реакција]] која доведува до создавање на азотните оксиди може да се произведe од неколку различни соединенија на кислород и азот (различни пропорционални односи), во зависност од условот на самата реакција. Ова е единствена причина зoшто се споредни нус-производите со N<sub>2</sub>O; производството на останатите две стабилни оксиди на азот, кои се патем многу токсични, е регулирано со закон. |
||
<gallery> |
<gallery> |
||
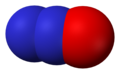
Податотека:Nitric-oxide-3D-vdW.png|<center>'''Азотен моноксид''', NO</center> |
|||
Податотека:Nitrogen-dioxide-3D-vdW.png|<center>'''Азотен диоксид''', NO<sub>2</sub></center> |
|||
Податотека:Nitrous-oxide-3D-vdW.png|<center>'''Диазотен оксид''', N<sub>2</sub>O</center> |
|||
Податотека:Dinitrogen-trioxide-3D-vdW.png|<center>'''Диазотен триоксид''', N<sub>2</sub>O<sub>3</sub></center> |
|||
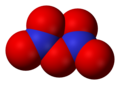
Податотека:Dinitrogen-tetroxide-3D-vdW.png|<center>'''Диазотен тетроксид''', N<sub>2</sub>O<sub>4</sub></center> |
|||
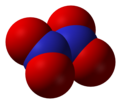
Податотека:Dinitrogen-pentoxide-3D-vdW.png|<center>'''Диазотен пентоксид''', N<sub>2</sub>O<sub>5</sub></center> |
|||
</gallery> |
</gallery> |
||
== NO<sub>x</sub> == |
== NO<sub>x</sub> == |
||
'''NO<sub>x</sub>''' е воопштена форма за моно-азотни |
'''NO<sub>x</sub>''' е воопштена форма за моно-азотни оксиди (NO и NO<sub>2</sub>). Овие оксиди настануваат за време на процесот [[согорување]], најчесто за време на процесот согорување на високи температури.<ref name="CRC">{{RubberBible87th}}</ref><ref name="Merck13th">{{Merck13th}}</ref> |
||
На нормална, амбиентална |
На нормална, амбиентална температура кислородот и азотот не реагираат меѓусебно. За време на работата на [[мотор со внатрешно согорување]], мешавината на [[воздух]]от и горивото произведуваат доволно висока температура за да се предизвика ендотермна реакција на [[земјина атмосфера|атмосферскиот]] азот и кислородот во пламенот. Во градовите каде што сообраќајот е густ, количината на азотни оксиди е зголемена и може да биде дури и штетна. |
||
Во присуство на повеќе кислород (O<sub>2</sub>), [[азотен моноксид]] (NO) ќе реагира и ќе настане [[азотен диоксид]] (NO<sub>2</sub>), а временскиот период на овие реакции зависи од самата концентрација во воздухот, се |
Во присуство на повеќе кислород (O<sub>2</sub>), [[азотен моноксид|азотниот моноксид]] (NO) ќе реагира и ќе настане [[азотен диоксид]] (NO<sub>2</sub>), а временскиот период на овие реакции зависи од самата концентрација во воздухот, што може да се види од табелата: <ref>{{cite web|url=http://www.branchenv.com/nox/nox_info.asp |title=NOx Removal |accessdate = 26. 12. 2007. |publisher=Branch Environmental Corp }}</ref> |
||
{| class=”wikitable” |
{| class=”wikitable” |
||
|- |
|- |
||
! NO концентрација |
! NO концентрација во воздухот |
||
(ppm) |
(ppm) |
||
! Време потребно половина од присутниот NO |
! Време потребно половина од присутниот NO |
||
| Ред 54: | Ред 54: | ||
|3500 |
|3500 |
||
|} |
|} |
||
Кога -<sub>x</sub> и некои од органските испарливи смеси се (VOC) заедно во воздухот |
Кога -<sub>x</sub> и некои од органските испарливи смеси се (VOC) заедно во воздухот и во присуство на сончева светлина, тие формираат фотохемиски смог, кој создава голем дел од загадувањето на природата. Овие загадувања негативно влијаат врз човековото здравје<ref>{{cite web|url=http://www.epa.gov/airprogm/oar/urbanair/nox/hlth.html |title=Health and Environmental Impacts of NOx |accessdate = |publisher=United States Environmental Protection Agency}}</ref>. |
||
1. Азотен диоксид, ако се раствори во влага од воздухот, формира компонента ([[азотна киселина]]) [[кисел дожд]]: |
1. Азотен диоксид, ако се раствори во влага од воздухот, формира компонента ([[азотна киселина]]) [[кисел дожд]]: |
||
| Ред 61: | Ред 61: | ||
(Азотен диоксид + вода → азотеста киселина + азотна киселина). |
(Азотен диоксид + вода → азотеста киселина + азотна киселина). |
||
2. Потоа |
2. Потоа азотната киселина се разложува на: |
||
:'''3HNO<sub>2</sub> → HNO<sub>3</sub> + 2NO + H<sub>2</sub>O''' |
:'''3HNO<sub>2</sub> → HNO<sub>3</sub> + 2NO + H<sub>2</sub>O''' |
||
(азотаста киселина → азотна киселина + азотен моноксид + вода), |
(азотаста киселина → азотна киселина + азотен моноксид + вода), |
||
3. каде што |
3. каде што азотниот моноксид реагира со кислородот, [[оксидо-редукција|оксидира]] и формира азотен диоксид кој повторно реагира со водата и повторно прави азотна киселина: |
||
:'''4NO + 3O<sub>2</sub> + 2H<sub>2</sub>O → 4HNO<sub>3</sub>''' |
:'''4NO + 3O<sub>2</sub> + 2H<sub>2</sub>O → 4HNO<sub>3</sub>''' |
||
(азотен моноксид + |
(азотен моноксид + кислород + вода → азотна киселина). |
||
Азотниот моноксид исто така учествува во создавањето [[Озонската дупка|озонска дупка]] во [[тропосфера]]та.<ref>{{cite journal |author=D. Fowler, ''et al.'' |year=1998 |title=The atmospheric budget of oxidized nitrogen and its role in ozone formation and deposition |journal=New Phytologist |volume=139 |pages=11-23 |doi=10.1046/j.1469-8137.1998.00167.x }}</ref> |
|||
== Биогенетичко потекло == |
== Биогенетичко потекло == |
||
Во [[земјоделство]]то употребата на минерални ѓубрива и |
Во [[земјоделство]]то употребата на минерални ѓубрива и збогатувањето на земјиштето со [[азотно ѓубриво]] исто така помага за збогатување на атмосферските NO<sub>''x''</sub>, преку процесот денитрификација на активните материи од минералното ѓубриво со помош на микроорганизмите кои го забрзуваат на процесот.<ref>{{Cite journal |
||
|author=J.N. Galloway, ''et al.'' |
|author=J.N. Galloway, ''et al.'' |
||
|year=2004 |
|year=2004 |
||
Преработка од 17:53, 23 февруари 2019
Поимот азотни оксиди обично се однесува на бинарните соединенија на кислород и азот или нивните соединенија:
- Азотен моноксид (NO), азот(II) оксид
- Азотен диоксид (NO2), азот(IV) оксид
- Диазотен оксид (N2O), азот (I) оксид
- Диазотен триоксид (N2O3), азот(II, IV) оксид, анхидрид на азотастната киселина.
- Диазотен тетроксид (N2O4), азот(IV) оксид
- Диазотен пентоксид (N2O5), азот(V) оксид, анхидрид на азотната киселина
(Последните три од спискот се нестабилни соединенија.)
Хемиската реакција која доведува до создавање на азотните оксиди може да се произведe од неколку различни соединенија на кислород и азот (различни пропорционални односи), во зависност од условот на самата реакција. Ова е единствена причина зoшто се споредни нус-производите со N2O; производството на останатите две стабилни оксиди на азот, кои се патем многу токсични, е регулирано со закон.
-
Азотен моноксид, NO -
Азотен диоксид, NO2 -
Диазотен оксид, N2O -
Диазотен триоксид, N2O3 -
Диазотен тетроксид, N2O4 -
Диазотен пентоксид, N2O5
NOx
NOx е воопштена форма за моно-азотни оксиди (NO и NO2). Овие оксиди настануваат за време на процесот согорување, најчесто за време на процесот согорување на високи температури.[1][2]
На нормална, амбиентална температура кислородот и азотот не реагираат меѓусебно. За време на работата на мотор со внатрешно согорување, мешавината на воздухот и горивото произведуваат доволно висока температура за да се предизвика ендотермна реакција на атмосферскиот азот и кислородот во пламенот. Во градовите каде што сообраќајот е густ, количината на азотни оксиди е зголемена и може да биде дури и штетна.
Во присуство на повеќе кислород (O2), азотниот моноксид (NO) ќе реагира и ќе настане азотен диоксид (NO2), а временскиот период на овие реакции зависи од самата концентрација во воздухот, што може да се види од табелата: [3]
| NO концентрација во воздухот
(ppm) |
Време потребно половина од присутниот NO
да оксидира во NO2 (мин) |
|---|---|
| 20,000 | 0.175 |
| 10,000 | 0.35 |
| 1,000 | 3.5 |
| 100 | 35 |
| 10 | 350 |
| 1 | 3500 |
Кога -x и некои од органските испарливи смеси се (VOC) заедно во воздухот и во присуство на сончева светлина, тие формираат фотохемиски смог, кој создава голем дел од загадувањето на природата. Овие загадувања негативно влијаат врз човековото здравје[4].
1. Азотен диоксид, ако се раствори во влага од воздухот, формира компонента (азотна киселина) кисел дожд:
- 2NO2 + H2O → HNO2 + HNO3
(Азотен диоксид + вода → азотеста киселина + азотна киселина).
2. Потоа азотната киселина се разложува на:
- 3HNO2 → HNO3 + 2NO + H2O
(азотаста киселина → азотна киселина + азотен моноксид + вода),
3. каде што азотниот моноксид реагира со кислородот, оксидира и формира азотен диоксид кој повторно реагира со водата и повторно прави азотна киселина:
- 4NO + 3O2 + 2H2O → 4HNO3
(азотен моноксид + кислород + вода → азотна киселина).
Азотниот моноксид исто така учествува во создавањето озонска дупка во тропосферата.[5]
Биогенетичко потекло
Во земјоделството употребата на минерални ѓубрива и збогатувањето на земјиштето со азотно ѓубриво исто така помага за збогатување на атмосферските NOx, преку процесот денитрификација на активните материи од минералното ѓубриво со помош на микроорганизмите кои го забрзуваат на процесот.[6][7]
Наводи
- ↑ Lide, David R., уред. (2006). CRC Handbook of Chemistry and Physics (87. изд.). Boca Raton, FL: CRC Press. ISBN 0-8493-0487-3.
- ↑ Предлошка:Merck13th
- ↑ „NOx Removal“. Branch Environmental Corp. Посетено на 26. 12. 2007.. Проверете ги датумските вредности во:
|accessdate=(help) - ↑ „Health and Environmental Impacts of NOx“. United States Environmental Protection Agency.
- ↑ D. Fowler; и др. (1998). „The atmospheric budget of oxidized nitrogen and its role in ozone formation and deposition“. New Phytologist. 139: 11–23. doi:10.1046/j.1469-8137.1998.00167.x. Напосредна употреба на al. во:
|author=(help) - ↑ J.N. Galloway; и др. (2004). „Nitrogen cycles: past, present, and future“. Biogeochemistry. 70 (2): 153–226. doi:10.1007/s10533-004-0370-0. Напосредна употреба на al. во:
|author=(help) - ↑ E.A. Davidson & W. Kingerlee (1997). „A global inventory of nitric oxide emissions from soils“. Nutrient Cycling in Agroecosystems. 48: 37–50. doi:10.1023/A:1009738715891.
Надворешни врски
| „Азотни оксиди“ на Ризницата ? |