Хибридизација (хемија): Разлика помеѓу преработките
| [непроверена преработка] | [непроверена преработка] |
с Бот Мења: uk:Гібридизація орбіталей |
с Бот Додаје: ar:تهجين (كيمياء) |
||
| Ред 50: | Ред 50: | ||
[[Категорија:Стереохемија]] |
[[Категорија:Стереохемија]] |
||
[[ar:تهجين (كيمياء)]] |
|||
[[cs:Hybridizace orbitalů]] |
[[cs:Hybridizace orbitalů]] |
||
[[de:Hybrid-Orbital]] |
[[de:Hybrid-Orbital]] |
||
Преработка од 20:40, 26 октомври 2007


Во хемијата, хибридизацијата е концепт на мешање на атомските орбитали при што се образуваат нови, хибридни орбитали, погодни за квалитативно опишување на атомските сврзувачки својства. Хибридизираните орбитали се многу корисни при објаснувањето на обликот на молекулските орбитали на молекулите. Хибридизацијата е составен дел на Теоријата за валентно сврзување и VSEPR теоријата
Историски развој
Хибридизационата теорија беше промовирана од хемичарот Линус Полинг за да се објасни структурата на молекулите, како оние на метанот (CH4). Историски, овој концепт бил развиен за такви, прости хемиски системи, но подоцна пристапот се употребувал (и сè уште се употребува) пошироко. Денес тој е ефективен при рационализирањето на органските соединенија.
Како и да е, хибридизационата теорија е сметана за помалку корисна и помалку информативна од Теоријата на молекулски орбитали. Проблемите со хибридизацијата се особено забележливи кога d орбиталите се вмешани во сврзувањето, како во координативната хемија и органометалската хемија. Иако шемите за хибридизација можат да се користат во хемијата на транзитивните метали, тие не се прецизни и имаат мала предвидувачка моќ.
Важно е да се забележи дека орбиталите се модел-репрезентација на однесувањето на електроните во молекулите. Во случајот на простата хибридизација, оваа апроксимација е базирана на атомските орбитали на водородот. Хибридизираните орбитали се претпоставува дека се мешавини на овие атомски орбитали, преклопени меѓусебно во најразлични пропорции. Водородните орбитали се користат како основа за едноставни хибридизациони шеми бидејќи се едни од неколкуте примери на орбитали за кои е познато аналитичкото решение на Шредингеровата равенка. Овие орбитали се сметаат за малку, но не значајно изобличени во потешките атоми, како јаглеродот, азотот и кислородот. Под овие претпоставки, теоријата за хибридизација е најприфатлива. Хибридизациониот концепт се применува кај молекулите составени од јаглерод, азот и кислород (во помала мерка и кај сулфурот и фосфорот).
Хибридизационата теорија најмногу се употребува во органската хемија.
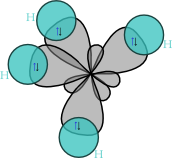
sp3 (тетраедарски) хибриди
Овие хибриди настануваат со мешање (хибридизација) на 2s орбиталата и трите 2p орбитали. Бидејќи орбиталите се всушност електронски облаци, тие меѓу себе се одбиваат. Четирите хибридни орбитали, подеднакво и максимално ќе се оддалечат една од друга доколку се распоредат кон ќошињата на тетраедар. Значи, геометрискиот распоред на sp3 орбиталите во просторот е тетраедарски, па затоа и оваа хибридизација се нарекува тетраедарска. Аголот меѓу тетраедарските орбитали е ист како и оној на аглите во тетраедарот и изнесува 109o28'. Пример за соединенија со sp3 хибридизирани (јаглеродни) атоми се алканите. Кај најпростиот алкан, метан (CH4), ситуацијата е следна: јаглеродот има електронска конфигурација 1s² 2s² 2px¹ 2py¹, или графички:
(Забележите: 1s орбиталата е на пониско енергетско ниво отколку 2s орбиталата, додека 2s орбиталата е на пониско енергетско ниво отколку 2p орбиталите).
При образувањето на молекул од метанот, едниот јаглероден атом кој тој го содржи ја добива конфигурацијата:
Во секоја од новодобиените (хибридни) орбитали има по еден неспарен електрон, што значи дека тие можат да градат четири единечни сигма (σ) врски како со други јаглеродни атоми, така и со атоми од други елементи.
Надворешни врски
- (англиски) Ковалентната врска и молекуларната структура
- (англиски) Флеш-филм за хибридизацијата