Staphylococcus aureus
| Staphylococcus aureus | |
|---|---|
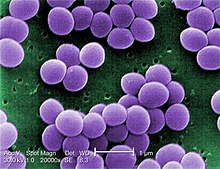
| |
| Скенирачки електронски микрограф на S. aureus со фалс боја | |
| Научна класификација | |
| Домен: | Bacteria |
| Колено: | Firmicutes |
| Класа: | Bacilli |
| Ред: | Bacillales |
| Семејство: | Staphylococcaceae |
| Род: | Staphylococcus |
| Вид: | S. aureus |
| Научен назив | |
| Staphylococcus aureus Rosenbach 1884 | |
Staphylococcus aureus (познат како златен стафилокок) ― Грампозитивна, топчеста бактерија која е дел од нормалната микрофлора на телото, често се наоѓа во носот, респираторниот систем и на кожата. Позитивна е на каталаза и редукција на нитрат и е факултативен анаероб.[1] Иако S. aureus не е секогаш патогена (и најчесто може да се најде како коменсал), таа е честа причина за инфекции на кожата, вклучувајќи апсцеси, респираторни инфекции, како што се синузити, труење со храна и друго. Патогените соеви предизвикуваат инфекции преку создавање на фактори на вирулентност, како што се јаки белковински токсини, и со присуство на површински белковини кои врзуваат и онеспособуваат антитела. Појавата на антибиотски-резистентни соеви од S. aureus како метицилин резистентниот S. aureus (MRSA) е светски проблем во клиничката медицина. И покрај бројните истражувања, сè уште не е одобрена вакцина за S. aureus.
Staphylococcus видот за првпат бил идентификуван во 1880 во Единбург, Шкотска, од страна на хирургот Александар Огстон, во гној од хируршки апсцес во колено.[2] Ова име подоцна било променето во Staphylococcus aureus од страна на Фридрих Јулиј Розенбах.[3] Околу 20% до 30% од човечката популација се носители на S. aureus[4][5] кој се наоѓа како дел од нормалната микрофлора на кожата, во ноздрите,[6] и во долниот репродуктивен тракт на жената.[7][8] S. aureus може да предизвика голем број на болести, од мали инфекции на кожата, како што се акни,[9] импетиго, фурункули, карбункули, целулит, фоликулит, стафилококен ексфолијативен дерматит (Ритерова болест) и животно загрозувачки болести како пневмонија, менингит, остеомиелит, ендокардит, токсичен шок-синдром, бактериемија, и сепса. Сè уште е една од петте најчести причини на болнички инфекции и често е причина за рани постоперативни инфекции. Секоја година, околу 500.000 пациенти во болниците на САД заболуваат од стафилококни инфекции, главно од S. aureus,[10] а 50.000 смртни случаи годишно се резултат на инфекции од истата бактерија.[11]
| Staphylococcus aureus | |
|---|---|
| Специјалност | Infectious disease |
Микробиологија[уреди | уреди извор]
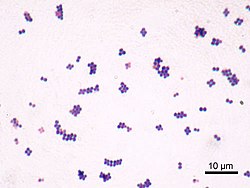

S. aureus (од грчкиот збор: σταφυλόκοκκος, „гроздовидни зрна“ и латинскиот aureus, „златен“[12][13]) е факултативно анаеробна, Грам-позитивна кока, позната како „златен стафилокок“. Тие се неподвижни и не формираат ендоспори.[14] На микроскоп се гледаат како големи, тркалезни топчиња аранжирани во неправилни, гроздовидни структури со златно-жолта боја. Култивирани на крвен агар прават хемолиза.[15] S. aureus се репродуцира бесполово со двоично цепење (проста делба). За комплетно одделување на клетките-ќерки потребен е автолизин и во негово отсуство или инхибиција, клетките-ќерки остануваат поврзани една со друга при што формираат кластери.[16]
S. aureus е каталаза-позитивен затоа што го произведува ензимот каталаза. Тој го разградува водород пероксидот (H2O2) на вода и кислород. Затоа каталаза-тестовите се користат да се направи разлика на стафилококи од ентерококи и стрептококи. Порано, S. aureus бил разликуван од другите стафилококи со помош на коагулаза тестот. Сепак, не сите S. aureus соеви се коагулаза-позитивни[17] и неточната идентификација влијае на ефикасен третман и спроведување на мерките за контрола.[18]
Природна генетска преобразба е размножувачка постапка на пренос на ДНК од една бактерија на друга и интеграција на дарителската секвенца во геномот на реципиентот со хомологна рекомбинација. Било пронајдено дека S. aureus е способен за природна генетска преобразба, но со мала честота под опитните услови кои биле применети.[19] Понатамошните истражувања покажале дека развојот на компетентност за природна генетска преобразба може да биде значително зголемен под соодветни услови, кои допрва треба да бидат откриени.[20]
Улога во здравјето[уреди | уреди извор]
Кај луѓето, S. aureus е дел од нормалната микрофлора присутна во горниот респираторен тракт,[21] на кожата и слузници и во дигестивниот систем.[22]
S. aureus, заедно со сличните видови кои се дел од микрофлората и се однесуваат симбиотски, предизвикаат болест ако почнат да ги инвадираат ткивата. Таквите бактериски заедници се нарекуваат „патобионти“.[21]
Улога во болест[уреди | уреди извор]

Додека S. aureus обично е коменсална бактерија која асимптоматски колонизира околу 30% од човечката популација, понекогаш може да предизвика болест.[23] Таа е една од најчестите причини за појава на бактериемија и инфективен ендокардит. Дополнително, може да предизвика разни инфекции на кожата и меките ткива, особено кога нивните одбранбени бариери се пробиени.
Инфекциите со S. aureus се шират преку директен допир со гној од заразена рана или индиректно со користење на предмети за лична употреба на заразени лица, како пешкири, чаршави, облека, или спортска опрема.
Посебно ранливи пациенти како дијабетичари, пациенти корисници на парентерална терапија и срцево болните, треба да се преземаат дополнителни мерки на претпазливост за да избегнат можност за инфицирање со S. aureus. Претпазливите мерки се често миење на рацете со сапун и често туширање или капење.
S. aureus е причинител на хронични инфекции со создавање на биофилмови на медицински импланти.[24]
Откако симптомите на инфекции со S. aureus ќе се појават, домаќинот е заразен околу две недели, а целокупната болест трае неколку недели. Нелечена, болеста може да биде смртоносна.[25]
Длабокопродирачките инфекции можат да бидат мошне сериозни.
Инфекции на кожата[уреди | уреди извор]
Најчести инфекции со S. aureus се инфекциите на кожата. Можат да се манифестираат како: фоликулит, импетиго, целулит, фурункули, карбункули, апсцеси и други тешки инвазивни мекоткивни инфекции.[5][9]
Предиспонирани лица кон овие инфекции се тие кои веќе имаат некое нарушување на кожата, како на пр. атопичен дерматит. Присуството на S. aureus кај лица со атопичен дерматитис не е секогаш индикација за третман со орални антибиотици и најчесто лечењето започнува со зајакнување на кожната бариера. Кај новороденчиња, стафилококните инфекции можат да доведат до тешко заболување наречено стафилококен ексфолијативен дерматит (SSSS).[26]
Труење со храна[уреди | уреди извор]
S. aureus е исто така одговорен за труења со храна. Бактериите се способни за лачење на токсини кои предизвикуваат труење со храна.[27] Периодот на инкубација трае од еден до шест часа,[28] а болеста може да трае од триесет минути до три дена.[29] Превентивните мерки кои треба да се преземат за да се спречи ширењето на болеста вклучуваат миење на рацете со сапун и вода пред подготовка на храната. Лицата кои работат на подготовка на храна, ако се клицоносители или болни со стафилококна инфекција, треба да носат ракавици доколку имаат отворени рани на рацете или на зглобовите. Доколку храната се чува подолго од 2 часа пред употреба, тоа да се прави на температура над 60°С или под 4°С.[30]
Инфекции на коските и зглобовите[уреди | уреди извор]
S. aureus е бактеријата што најчесто е одговорна за сите поголеми коскени и зглобни инфекции. Овие инфекции се јавуваат во форма на: остеомиелит, септички артритис или инфекции при ортопедски интервенции.[31]
Бактериемија[уреди | уреди извор]
S. aureus е водечка причина за бактериемија во индустријализираните земји.[31] Инфекцијата е поврзана со продор низ кожата и мукозните мембрани при повреди, операции или употреба на интраваскуларни апликатори како што се катетери, при хемодијализа или парентерална терапија. Навлегувањето на бактериите во крвотокот може да доведе до инфективен ендокардит, септички артритис, остеомиелит и сепса.[31] Бактериемијата е најчеста и најтешка кај многу млада и многу стара популација.
Стапката на морталитет од бактериемија со S. aureus, доколку не е третирана со антибиотици, е исклучително висока и изнесува околу 80%.[5] Со антибиотски третман, стапката на морталитет изнесува 15% - 50% во зависност од возраста и здравјето на пациентот, како и на антибиотската резистенција на бактеријата.[5]
Биофилмови[уреди | уреди извор]
S. aureus често може да се најде во биофилмови формирани на медицински уреди имплантирани во телото. Често се среќава заедно со Candida albicans во биофилмовите. Се смета дека Candida albicans му овозможува на S. aureus да навлезе во човековото ткиво.[32] Во вакви случаи стапката на морталитет расте.[33]
Инфекции кај животните[уреди | уреди извор]
S. aureus се среќава кај кучињата,[34] мачките,[35] коњите,[36] и може да предизвика болест на нозе кај птици и глодачи.[37] Некои сметаат дека кучињата на здравствените работници треба да се сметаат за значаен извор на антибиотски-резистентни S. aureus, особено во време на епидемија.[34]
S. aureus е еден од причинителите на маститис кај млечните крави. Бактеријата се штити од имунолошкиот систем на кравата со создавање на големи полисахаридни капсули.[38]
Фактори на вирулентност[уреди | уреди извор]
Ензими[уреди | уреди извор]
S. aureus произведува повеќе ензими: коагулаза (врзана и слободна коагулаза) ја коагулира плазмата, ја прекрива бактериската клетка, веројатно за да се спречи фагоцитоза; хијалуронидаза (позната и како фактор на ширење) ја разградува хијалуронската киселина и помага во ширењето на бактеријата; деоксирибонуклеаза (ДНКаза) ги разградува ДНК молекулите; липаза, ги разградува липидите; стафилокиназа, го раскинува фибринот и помага во ширењето; бета-лактамаза, ензим одговорен за резистентност кон бета-лактамски антибиотици.[39]
Токсини[уреди | уреди извор]
Во зависност од сојот, S. aureus е способен за секреција на неколку егзотоксини, кои може да се категоризираат во три групи. Многу од овие токсини се поврзани со специфични болести.[40]
Суперантигени[уреди | уреди извор]
- Антигените познати како суперантигени можат да предизвикаат токсичен шок-синдром (TSS). Во оваа група спаѓаат токсините TSST-1 и ентеротоксин тип Б, кои се причинители на TSS поврзан со употреба на тампони. Токсичниот шок-синдром се одликува со треска, еритематозен осип, лупење на кожата, пад на крвниот притисок, шокова состојба и дисфункција на повеќе органи. Недостатокот на антитела за TSST-1 игра улога во патогенезата на TSS. Други видови на S. aureus може да продуцираат ентеротоксин, кој е предизвикувачки агенс на еден вид на гастроентеритис. Оваа форма на гастроентеритис е самолимитирачка, се одликува со повраќање и дијареја еден до шест часа по ингестија на токсинот, по што закрепнувањето настапува за осум до 24 часа. Симптомите вклучуваат гадење, повраќање, дијареја, и болки во стомакот.[41][42]
Ексфолијативни токсини[уреди | уреди извор]
- Ексфолијативниот токсин е егзотоксин и е причина за стафилококен ексфолијативен дерматит (SSSS), кој најчесто се јавува кај доенчиња и мали деца. Во облик на ограничена епидемија може да се јави во хоспитални услови во неонатолошки одделенија. Протеазната активност на ексфолијативниот токсин предизвикува лупење (ексфолијација) на кожата типична за SSSS.[42]
Други токсини[уреди | уреди извор]
- Стафилококни токсини кои делуваат на клеточните мембрани се: алфа токсин, бета токсин, делта токсин, и неколку двокомпонентни токсини. Соеви на S. aureus можат да биде носители на бактериофаги, како што е профага Φ-PVL која го продуцира цитотоксинот Panton-Valentine leukocidin (PVL), кој ја зголемува вирулентноста. Двокомпонентниот токсин PVL е асоциран со тешка некротизирачка пневмонија кај деца.[43][44] Гените кои ги кодираат компонентите на PVL потекнуваат од бактериофагот кој е застапен кај MRSA соевите.
Мали РНК молекули[уреди | уреди извор]
Постојат голем број на мали РНК молекули кои се вклучени во контролата на бактериската вирулентност кај S. aureus; на пример, RNAIII,[45] SprD,[46] RsaE,[47] SprA1,[48] SSR42,[49] ArtR,[50] SprX и Teg49.[51]
Стратегии за пост-транскрипциона регулација со 3'нетранслатиран регион[уреди | уреди извор]
Утврдено е дека многу информациски РНК молекули (иРНК) кај S. aureus носат три примарни нетранслатирани региони (3'UTR) подолги од 100 нуклеотиди, кои потенцијално имаат регулаторна функција.[52]
Понатамошното проучување на icaR иРНК (иРНК која кодира за репресорот на главното полисахаридно соединение на матрицата на бактерискиот биофилм) покажало дека 3' UTR врзувањето за 5' UTR може да интерферира со комплексот за иницијација на транслација и да генерира двојно-верижен супстрат за рибонуклеаза III. Се покажало дека интеракцијата е меѓу UCCCCUG мотивот во 3' UTR и Shine-Dalagarno регионот на 5' UTR. Бришењето на мотивот резултира со акумулација на icaR репресорот и инхибиција во создавањето на биофилм. Создавањето на биофилм е главната причина за стафилококни инфекции кај импланти.[53]
Други стратегии за имуноевазија[уреди | уреди извор]
Белковина А[уреди | уреди извор]
Белковината А се зацврстува за пентаглицинските мостови (синџири од пет глицински остатоци) на пептидогликанот со помош на транспептидазата сортаза А.[54] Тој е врзувач на имуноглобулин G (IgG) и се врзува на Fc регионот на антителата. Истражувањата со мутација на гените кои ја кодираат белковината А покажале намалена вирулентност на S. aureus (со мерење на нивно преживување во крв), што доведе до шпекулации дека белковината А придонесува за вирулентноста преку врзување на Fc регионот на антителата.[55]
Белковината А во различни рекомбинантни форми се користи со децении за врзување и пречистување на антитела со имуноафинитетна хроматографија. Транспептидазите, како што се сортазите одговорни за врзување на белковината А за пептидогликанот, се изучуваат со надеж за развој на нови антибиотици кои би ги таргетирале MRSA инфекциите.[56]

Стафилококни пигменти[уреди | уреди извор]
Некои соеви на S. aureus се способни за синтеза на стафилоксантин — златно-обоен каротеноиден пигмент. Овој пигмент делува како фактор на вируленција, на тој начин што како антиоксиданс ги неутрализира реактивните кислородни видови кои имуниот систем ги создава за да го убие патогенот.[57][58]
Мутантите на S. aureus со недостаток на гени за синтеза на стафилоксантин имаат помала веројатност да преживеат инкубација со оксиданси, како што е водород пероксидот, во споредба со нормалните клетки кои го продуцираат пигментот. Мутантните колонии брзо се уништуваат од страна на неутрофилите, додека многу од пигментираните колонии би преживеале.[57] Пигментираните соеви инокулирани во рани на глувци предизвикуваат апсцеси кои бавно заздравуваат, а раните инфицирани со непигментираните соеви брзо исцелуваат.
Овие тестови покажуваат дека Staphylococcus соевите го употребуваат стафилоксантинот како одбрана против човековиот имунолошки систем. Лековите за инхибирање на синтезата на стафилоксантинот ја ослабнуваат бактерија и ја зголемуваат нејзината осетливост кон антибиотици. Поради сличностите во биосинтетските патишта на стафилоксантинот и човековиот холестерол, најдено е дека еден лек за намалување на нивото на холестерол во крвта способен е да ја инхибира пигментацијата на S. aureus и прогресијата на болеста.[59]
Дијагноза[уреди | уреди извор]

Дијагнозата се поставува со земање на соодветен примерок и испраќање во лабораторија за биохемиска идентификација и ензимски тестови. Прво се прави боење по Грам, со кој се докажува типична Грам-позитивна кока, аранжирана во гроздовидна формација. Потоа се прави култивирање на селективен медиум - агар кој содржи манитол и 7-9% NaCl, кој овозможува S. aureus да расте и создава жолти колонии, како резултат на ферментација на манитолот и пад на pH на медиумот.
За диференцирање на видовите се користат ензимските тестови: каталаза тест (позитивен за сите Staphylococcus видови), коагулаза тест (згрутчување на фибринот, позитивен за S. aureus), ДНК-аза тест (зона на расчистување на ДНК-аза агар), липаза тест (жолта боја и мирис на ужегната маст), и фосфатаза тест (розова боја).
Брзи дијагностички тестови[уреди | уреди извор]
Неодамнешните напредоци во генетиката овозможија сигурни и брзи техники за идентификација и карактеризација на клинички изолати на S. aureus во реално време. Овие алатки ги поддржуваат стратегиите за контрола на инфекцијата за да го ограничат ширењето на бактериите и да обезбедат соодветна употреба на антибиотици. Квантитативната полимераза верижна реакција (анг. Real-Time Polymerase Chain Reaction) или скратено RTPCR, сè повеќе се користи за да се идентификуваат епидемии на инфекција.[60][61]
При следење на еволуцијата на S. aureus и неговата способност да се прилагоди на секој изменет антибиотик, се користат два основни методи познати како „бенд-засновани“ или „засновани на секвенца“.[62] Имајќи ги предвид овие две методи, другите методи, како што се multilocus sequence typing (MLST), pulsed-field gel electrophoresis (PFGE), bacteriophage typing, spa locus typing, и SCCmec typing, често се користат повеќе од останатите.[63] Со овие методи може да се утврди каде настанале соевите на MRSA, и каде се во дадениот момент.[64]
Со MLST, оваа техника на типизација користи фрагменти од неколку универзални клеточни гени познати како aroE, glpF, gmk, pta, tip и yqiL. На овие секвенци потоа им се доделува број кој дава низа од неколку броеви кои служат како профил на алели. Иако ова е честа метода, нејзино ограничување е одржувањето на микроарејата која ги детектира новоалелните профили, што го прави експериментот скап и бавен.[62]
Со PFGE, метод кој сè уште е многу користен, а датира од 1980-тите години, овозможено е да се направи диференцијација на изолатите на MRSA.[64] Оваа техника користи повеќекратна гел електрофореза, заедно со напонски градиент за прикажување на јасни резолуции на молекулите. S. aureus фрагментите транзитираат низ гелот, правејќи специфични линиски формации кои подоцна се споредуваат со други изолати со цел идентификување на сродните соеви. Ограничувањата на методот вклучуваат практични тешкотии со униформни линиски формации и неговата чувствителност.
Spa locus typing е популарна техника која користи една локус зона во полиморфен регион на S. aureus за да се разликува каква било форма на мутации.[64] Иако оваа техника е често евтина и одзема помалку време, шансата за губење на дискриминаторската моќ го отежнува диференцирањето помеѓу MLST CCs, што претставува суштинско ограничување.
Третман[уреди | уреди извор]
Третманот од избор за инфекции со S. aureus е пеницилин. Пеницилинот го инхибира формирањето на вкрстени врски кај пептидогликанот, кои обезбедуваат ригидност и јачина на бактерискиот клеточен ѕид. Четиричлениот β-лактамски прстен на пеницилинот се врзува за ензимот DD-транспептидаза, кој, кога е функционален, ги синтетизира вкрстените врски на пептидогликанот кој го формира ѕидот на бактериската клетка. Врзувањето на β-лактамот за DD-транспептидазата ја инхибира функционалноста на ензимот, кој повеќе не може да го катализира формирањето на вкрстените врски. Како резултат на тоа, формирањето и деградацијата на бактерискиот клеточен ѕид стануваат неусогласени процеси, што резултира со смрт на бактеријата. Меѓутоа, во повеќето земји, резистентноста кон пеницилин е многу честа, а прва линија на терапија најчесто е β-лактамски антибиотик резистентен на пеницилиназа (на пример, оксацилин или флуклоксацилин, кои имаат ист механизам на дејство како пеницилинот). Комбинираната терапија со гентамицин може да се користи за лекување на сериозни инфекции, како што е ендокардитот,[65][66] но неговата употреба е контроверзна поради високиот ризик од оштетување на бубрезите.[67] Времетраењето на третманот зависи од местото и тежината на инфекцијата. Рифампициноткој порано се користел како адјуванс на пеницилинскиот третман на бактериемија со S. aureus, покажал дека нема предности во однос на стандардната терапија со антибиотици.[68]
Отпорноста на антибиотици кај S. aureus била невообичаена кога пеницилинот првпат бил воведен во 1943 година. Всушност, првичната Петриева плоча на која Александар Флеминг од Кралскиот колеџ во Лондон ја набљудувал антибактериската активност на габата Penicillium, содржела култура на S. aureus. Веќе до 1950 година, 40% од болничките S. aureus изолати биле отпорни на пеницилин, а до 1960 година, процентот се зголемил на 80%.[69]
MRSA е еден од бројните соеви на S. aureus кои станале отпорни на повеќето β-лактамски антибиотици. Поради оваа причина, ванкомицин, кој е гликопептиден антибиотик, најчесто се користи за борба против MRSA. Ванкомицин ја инхибира синтезата на пептидогликанот, но за разлика од β-лактамските антибиотици, гликопептидните антибиотици целно се врзуваат за аминокиселините во клеточниот ѕид, спречувајќи го формирањето на вкрстените врски во пептидогликанот. MRSA соевите најчесто се наоѓаат поврзани со институции како што се болниците, но стануваат се поприсутни во инфекции стекнати во заедницата.
Малите инфекции на кожата може да се третираат со тројна антибиотска маст.[70]
Антибиотска отпорност[уреди | уреди извор]

Стафилококната отпорност кон пеницилин е посредувана од производство на пеницилиназа (облик на β-лактамаза): ензим кој го расцепува β-лактамскиот прстен на молекулата на пеницилин, правејќи го антибиотикот неефективен. β-лактамските антибиотици отпорни на пеницилиназа, како што се метицилин, нафцилин, оксацилин, клоксацилин, диклоксацилин и флуклоксацилин, се отпорни на разградување со стафилококна пеницилиназа.
Отпорноста кон метицилинот е посредувана преку mec оперонот, кој е дел од стафилококната cassette chromosome mec (SCCmec). Отпорноста се добива од mecA генот, кој кодира изменет пеницилиноврзувачка белковина (PBP2a или PBP2 ') кој има помал афинитет за врзување на β-лактами (пеницилини, цефалоспорини и карбапенеми). Ова дава резистентност кон сите β-лактамски антибиотици и ја спречува нивната клиничка употреба за инфекции со MRSA. Затоа, гликопептидот ванкомицин често се користи против MRSA.
Аминогликозидните антибиотици, како што се канамицин, гентамицин, стрептомицин и други, некогаш биле ефикасни против стафилококните инфекции, сè додека соевите не еволуирале механизми за да го инхибираат дејството на аминогликозидите, кое се случува преку протониран амин и/или хидроксил интеракција со рибозомната РНК на бактериската 30S рибозомна подединица.[71] Во моментов прифатени се три главни механизми за развој на отпорност кон аминогликозидите: ензими кои ги модифицираат аминогликозидите, рибозомни мутации и активно исфрлање на лекот надвор од бактериската клетка.
Аминогликозид-модифицирачките ензими го онеспособуваат аминогликозидот со ковалентно поврзување на фосфат, нуклеотид или ацетилна група за клучната аминска или алкохолна функционална група на антибиотикот. Ова го менува полнежот или стерично го попречува антибиотикот, намалувајќи го афинитетот за врзување за рибозомот. Во S. aureus, најдобро карактеризираниот аминогликозид-модифицирачки ензим е аминогликозид аденилилтрансфераза 4 'IA (ANT (4') IA). Структурата на овој ензим е откриена со рендгенска кристалографија.[72] Ензимот е способен да прикачи аденил група на 4' хидроксилната група на многу аминогликозиди, вклучувајќи ги и камамицин и гентамицин.
Отпорност кон гликопептидите е посредувана со здобивање на vanA генот, кој потекнува од ентерококите и кодира ензим кој произведува алтернативен пептидогликан, за кој ванкомицинот не може да се поврзе.
Денес, S. aureus стана отпорен на често употребуваните антибиотици. Во Велика Британија, само 2% од сите изолати на S. aureus се чувствителни на пеницилин, а слично е и во остатокот од светот. Пеницилините отпорни на β-лактамаза (метицилин, оксацилин, клоксацилин и флуклоксацилин) биле развиени за третман на пеницин-резистентните S. aureus соеви и сè уште се користат како прва линија на третман. Метицилинот бил првиот припадник на оваа класа антибиотици (воведен во 1959 година), но, само две години подоцна, првиот случај на MRSA бил пријавен во Англија.[73]
И покрај тоа, MRSA генерално остана невообичаен наод, дури и во болнички услови, сè до 1990-тите години, кога преваленцата на MRSA во болниците експлодирала и сега е ендемска.[74]
Инфекциите со MRSA во болници и во заедници најчесто се третираат со не-β-лактамски антибиотици, како што се клиндамицин и котримоксазол (исто така познат како триметоприм/сулфаметоксазол). Резистентноста кон овие антибиотици, исто така, доведе до употреба на нови, анти-Грам-позитивни антибиотици со широк спектар, како што е линезолид, поради неговата достапност како орален лек. Терапија од прв избор за сериозни инвазивни инфекции од MRSA, во моментов, се гликопептидни антибиотици (ванкомицин и теикопланин). Сепак, постојат голем број проблеми со овие антибиотици, како што се потребата за интравенска администрација (не е достапна орална примена), токсичност и потреба за редовно следење на нивоата на лековите со крвни тестови. Исто така, гликопептидните антибиотици не пробиваат многу добро во некои инфицирани ткива (ова е особено загрижувачки кај инфекции на мозокот и менингите и кај ендокардитис). Гликопептидите не смеат да се користат за третман на метицилин-чувствителните S. aureus (MSSA), бидејќи резултатите се инфериорни.[75]
Поради високиот степен на резистенција кон пеницилините и поради потенцијалот на MRSA да развие отпорност кон ванкомицин, Американскиот центар за контрола и превенција на болести објави упатства за соодветна употреба на ванкомицинот. Во случаи каде инциденцата на инфекции со MRSA е познато дека е висока, лекарот може да избере да користи гликопептиден антибиотик додека не се открие идентитетот на инфективниот организам. Доколку се потврди дека инфекцијата е резултат на сој на S. aureus чувствителен на метацилин, третманот треба да се смени со флуклоксацилин или пеницилин, како што е соодветно.
Ванкомицин-резистентниот S. aureus (VRSA) е сој кој стана отпорен на гликопептидите. Првиот случај на ванкомицин-интермедиерен S. aureus (VISA) бил пријавен во Јапонија во 1996 година;[76] но првиот случај на S. aureus кој е навистина резистентен кон гликопептидни антибиотици бил објавен во 2002 година.[77] Три случаи на инфекција со VRSA биле пријавени во САД до 2005 година.[78]
Клицоносителство[уреди | уреди извор]
Околу 33% од американската популација се носители на S. aureus и околу 2% се носители на MRSA.[79]
Клицоносителството на S. aureus е важен извор на болнички инфекции (познати и како нозокомијални) и MRSA стекнати во заедницата. Иако S. aureus може да биде присутен на кожата на домаќинот, поважно е клицоносителството во горниот респираторен тракт, а може да биде присутен и во ушите.[80] Можноста на носните канали да се носители на S. aureus е резултат на комбинација од ослабен или дефектен имунитет на домаќинот и способноста на бактеријата да го избегне вродениот имунитет на домаќинот.[81] Носното клицоносителство е, исто така, имплицирано за развој на стафилококни инфекции.[82]
Контрола на инфекции[уреди | уреди извор]
Ширењето на S. aureus (вклучувајќи MRSA) генерално е преку директен контакт човек со човек, иако неодамна некои ветеринари откриле дека инфекцијата може да се шири преку домашните миленици,[83] а загадувањето на животната средина се смета дека не е толку релевантно. Основните начини на миење на рацете се ефикасни во спречувањето на неговото пренесување. Употребата на заштитна облека и ракавици за еднократна употреба од страна на персоналот, го намалува контактот на кожа со кожа, со што се намалува ризикот од пренесување.
Неодамна, бројни случаи на S. aureus се пријавени во болниците низ САД. Преносот на патогенот се олеснува во медицински услови каде хигиената на здравствениот работник е недоволна. S. aureus е неверојатно отпорна бактерија, како што било покажано во една студија каде што бактериите преживеале на полиестер околу три месеци;[84] полиестерот е главниот материјал што се користи во завесите за приватност во болниците.
Бактериите се пренесуваат на рацете на здравствените работници, кои можат да ги соберат од навидум здрав пациент кој носи доброќуден или комензален сој на S. aureus, а потоа го пренесуваат на следниот пациент. Влезот на бактерии во крвотокот може да доведе до разни компликации, вклучувајќи ендокардитис, менингитис и сепса.
Етанолот се покажал како ефикасен топичен дезифициенс против MRSA. Кватенерни амониумови катјони може да се користи заедно со етанолот за да се зголеми времетраењето на дезинфекционото дејство. Превенцијата на нозокомијални инфекции вклучува рутинско и терминално чистење. Незапалива алкохолна пареа во CO2 NAV-CO2 системите имаат предност, бидејќи не оштетуваат метали или пластика што се користат во медицинските средини и не придонесуваат за антибактериска отпорност.
Важен, но претходно несогледан начин за MRSA колонизација и пренос е сексуалниот контакт.[85]
S. aureus се уништува за една минута на 78 °C и за десет минути на 64 °C.[86]
Одредени соеви на S. aureus се опишани како отпорни на дезинфекција со хлор.
Наводи[уреди | уреди извор]
- ↑ Masalha M; и др. (2001). „Analysis of Transcription of the Staphylococcus Aureus Aerobic Class Ib and Anaerobic Class III Ribonucleotide Reductase Genes in Response to Oxygen“. Journal of Bacteriology. 183 (24): 7260–7272. doi:10.1128/jb.183.24.7260-7272.2001. PMC 95576. PMID 11717286.
- ↑ Ogston A (1984). „"On Abscesses". Classics in Infectious Diseases“. Rev Infect Dis. 6 (1): 122–28. doi:10.1093/clinids/6.1.122. PMID 6369479.
- ↑ „Whonamedit - dictionary of medical eponyms“. www.whonamedit.com (англиски).
- ↑ Kluytmans J, van Belkum A, Verbrugh H (July 1997). „Nasal carriage of Staphylococcus aureus: epidemiology, underlying mechanisms, and associated risks“. Clin. Microbiol. Rev. 10 (3): 505–20. PMC 172932. PMID 9227864.
- ↑ 5,0 5,1 5,2 5,3 Tong, Steven Y. C.; Davis, Joshua S.; Eichenberger, Emily; Holland, Thomas L.; Fowler, Vance G. (2015-07-01). „Staphylococcus aureus Infections: Epidemiology, Pathophysiology, Clinical Manifestations, and Management“. Clinical Microbiology Reviews (англиски). 28 (3): 603–661. doi:10.1128/CMR.00134-14. ISSN 0893-8512. PMID 26016486.[мртва врска]
- ↑ Cole, A. M.; Tahk, S.; Oren, A.; Yoshioka, D.; Kim, Y. H.; Park, A.; Ganz, T (November 2001). „Determinants of Staphylococcus aureus nasal carriage“. Clin Diagn Lab Immunol. 8 (6): 1064–9. doi:10.1128/CDLI.8.6.1064-1069.2001. PMC 96227. PMID 11687441.
- ↑ Senok, Abiola C; Verstraelen, Hans; Temmerman, Marleen; Botta, Giuseppe A; Senok, Abiola C (2009). „Probiotics for the treatment of bacterial vaginosis“. Cochrane Database Syst Rev (4): CD006289. doi:10.1002/14651858.CD006289.pub2. PMID 19821358.
- ↑ Hoffman, Barbara (2012). Williams gynecology, 2nd edition. New York: McGraw-Hill Medical. стр. 65. ISBN 0071716726.
- ↑ 9,0 9,1 „Staphylococcal Infections“. MedlinePlus [Internet]. Bethesda, MD: National Library of Medicine, USA.
Skin infections are the most common. They can look like pimples or boils.
- ↑ Bowersox, John (27 May 1999). „Experimental Staph Vaccine Broadly Protective in Animal Studies“. NIH. Архивирано од изворникот на 5 May 2007. Посетено на 28 July 2007.
- ↑ Schlecht LM, Peters BM, Krom BP, Freiberg JA, Hänsch GM, Filler SG, Jabra-Rizk MA, Shirtliff ME. „Systemic Staphylococcus aureus infection mediated by Candida albicans hyphal invasion of mucosal tissue“. Microbiology. 161: 168–81. doi:10.1099/mic.0.083485-0. PMC 4274785. PMID 25332378.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ „the definition of staphylococcus“. Dictionary.com. Посетено на 2018-02-15.
- ↑ „staphylococcus | Definition of staphylococcus in English by Oxford Dictionaries“. Oxford Dictionaries | English. Архивирано од изворникот на 2018-04-21. Посетено на 2018-02-15.
- ↑ "PATHOGEN SAFETY DATA SHEET - INFECTIOUS SUBSTANCES." Staphylococcus cells have a diameter of 0.7-1.2 um. Staphylococcus Aureus. Public Health Agency of Canada, 2011. Web
- ↑ Ryan, KJ; Ray, CG, уред. (2004). Sherris Medical Microbiology (4. изд.). McGraw Hill. ISBN 0-8385-8529-9.
- ↑ Varrone JJ, de Mesy Bentley KL, Bello-Irizarry SN, Nishitani K, Mack S, Hunter JG, Kates SL, Daiss JL, Schwarz EM (2014). „Passive immunization with anti-glucosaminidase monoclonal antibodies protects mice from implant-associated osteomyelitis by mediating opsonophagocytosis of Staphylococcus aureus megaclusters“. Journal of Orthopedic Research. 32 (10): 1389–96. doi:10.1002/jor.22672.
- ↑ PreTest, Surgery, 12th ed., p.88
- ↑ Matthews KR, Roberson J, Gillespie BE, Luther DA, Oliver SP (1997). „Identification and Differentiation of Coagulase-Negative Staphylococcus aureus by Polymerase Chain Reaction“. Journal of Food Protection. 60 (6): 686–8.
- ↑ Morikawa K, Takemura AJ, Inose Y, Tsai M, Nguyen Thi le T, Ohta T, Msadek T (2012). „Expression of a cryptic secondary sigma factor gene unveils natural competence for DNA transformation in Staphylococcus aureus“. PLoS Pathog. 8 (11): e1003003. doi:10.1371/journal.ppat.1003003. PMC 3486894. PMID 23133387.
- ↑ Fagerlund A, Granum PE, Håvarstein LS (2014). „Staphylococcus aureus competence genes: mapping of the SigH, ComK1 and ComK2 regulons by transcriptome sequencing“. Mol. Microbiol. 94 (3): 557–79. doi:10.1111/mmi.12767. PMID 25155269.
- ↑ 21,0 21,1 Schenck, LP; Surette, MG; Bowdish, DM (November 2016). „Composition and immunological significance of the upper respiratory tract microbiota“. FEBS Letters. 590 (21): 3705–3720. doi:10.1002/1873-3468.12455. PMID 27730630.
- ↑ Wollina, U (2017). „Microbiome in atopic dermatitis“. Clinical, Cosmetic and Investigational Dermatology. 10: 51–56. doi:10.2147/CCID.S130013. PMC 5327846. PMID 28260936.
- ↑ Tong SY; Davis JS; Eichenberger E; Holland TL; Fowler VG (July 2015). „Staphylococcus aureus infections: epidemiology, pathophysiology, clinical manifestations, and management“. Clinical Microbiology Reviews. 28 (3): 603–661. doi:10.1128/CMR.00134-14. PMC 4451395. PMID 26016486.
- ↑ Kavanaugh JS, Horswill AR (2016). „Impact of Environmental Cues on Staphylococcal Quorum Sensing and Biofilm Development“. J Biol Chem (Review). 291 (24): 12556–64. doi:10.1074/jbc.R116.722710. PMC 4933443. PMID 27129223.
- ↑ „Staphylococcus aureus in Healthcare Settings | HAI | CDC“. www.cdc.gov (англиски). Посетено на 2017-04-19.
- ↑ Curran JP, Al-Salihi FL (1980). „Neonatal staphylococcal scalded skin syndrome: massive outbreak due to an unusual phage type“. Pediatrics. 66 (2): 285–90. PMID 6447271.
- ↑ „Staphylococcal Food Poisoning“. cdc.gov. hhs.gov. 4 October 2016. Посетено на 23 October 2016.
- ↑ "Staphylococcus." Foodsafety.gov, U.S. Department of Health and Human Services, https://www.foodsafety.gov/poisoning/causes/bacteriaviruses/staphylococcus/.
- ↑ "Staphylococcal Food Poisoning." Food Safety, Centers for Disease Control and Prevention, 4 Oct. 2016, https://www.cdc.gov/foodsafety/diseases/staphylococcal.html.
- ↑ Woodson, James. „Centers for disease control and prevention“. Food Safety. Посетено на 24 October 2017.
- ↑ 31,0 31,1 31,2 Rasmussen, Rasmus V; Jr, Vance G Fowler; Skov, Robert; Bruun, Niels E (2010-12-16). „Future challenges and treatment ofStaphylococcus aureusbacteremia with emphasis on MRSA“. Future Microbiology (англиски). 6 (1): 43–56. doi:10.2217/fmb.10.155.
- ↑ Schlecht, Lisa Marie; Freiberg, Jeffrey A.; Hänsch, Gertrud M.; Peters, Brian M.; Shirtliff, Mark E.; Krom, Bastiaan P.; Filler, Scott G.; Jabra-Rizk, Mary Ann (2015). „Systemic Staphylococcus aureus infection mediated by Candida albicans hyphal invasion of mucosal tissue“. Microbiology. 161 (Pt 1): 168–81. doi:10.1099/mic.0.083485-0. PMC 4274785. PMID 25332378.
- ↑ Zago, Chaiene Evelin; Silva, Sónia; Sanitá, Paula Volpato; Barbugli, Paula Aboud; Dias, Carla Maria Improta; Lordello, Virgínia Barreto; Vergani, Carlos Eduardo (2015). „Dynamics of Biofilm Formation and the Interaction between Candida albicans and Methicillin-Susceptible (MSSA) and -Resistant Staphylococcus aureus (MRSA)“. PLoS ONE. 10 (4): e0123206. doi:10.1371/journal.pone.0123206. PMC 4395328. PMID 25875834.
- ↑ 34,0 34,1 Boost MV, O'Donoghue MM, James A (2008). „Prevalence of Staphylococcus aureus carriage among dogs and their owners“. Epidemiol. Infect. 136 (7): 953–964. doi:10.1017/S0950268807009326. PMC 2870875. PMID 17678561.
- ↑ Hanselman BA, Kruth SA, Rousseau J, Weese JS (2009). „Coagulase positive staphylococcal colonization of humans and their household pets“. Can. Vet. 50 (9): 954–8. PMC 2726022. PMID 19949556.
- ↑ Burton S, Reid-Smith R, McClure JT, Weese JS (2008). „Staphylococcus aureus colonization in healthy horses in Atlantic Canada“. Can. Vet. J. 49 (8): 797–799. PMC 2465786. PMID 18978975.
- ↑ „Staphylococcosis, Staphylococcal Arthritis, Bumble Foot“. The Poultry Site. Посетено на 2013-10-22.
- ↑ Cenci-Goga BT, Karama M, Rossitto PV, Morgante RA, Cullor JS (September 2003). „Enterotoxin production by Staphylococcus aureus isolated from mastitic cows“. Journal of food protection. 66 (9): 1693–6. PMID 14503727.
- ↑ Medical Laboratory Manual For Tropical Countries vol two
- ↑ Dinges MM, Orwin PM, Schlievert PM (January 2000). „Exotoxins of Staphylococcus aureus“. Clin. Microbiol. Rev. 13 (1): 16–34, table of contents. doi:10.1128/cmr.13.1.16-34.2000. PMC 88931. PMID 10627489.
- ↑ Jarraud S, Peyrat MA, Lim A, и др. (January 2001). „egc, a highly prevalent operon of enterotoxin gene, forms a putative nursery of superantigens in Staphylococcus aureus“. J. Immunol. 166 (1): 669–77. doi:10.4049/jimmunol.166.1.669. PMID 11123352.
- ↑ 42,0 42,1 Becker, Karsten; Friedrich, Alexander W.; Lubritz, Gabriele; Weilert, Maria; Peters, Georg; Eiff, Christof von (2003-04-01). „Prevalence of Genes Encoding Pyrogenic Toxin Superantigens and Exfoliative Toxins among Strains of Staphylococcus aureus Isolated from Blood and Nasal Specimens“. Journal of Clinical Microbiology (англиски). 41 (4): 1434–1439. doi:10.1128/JCM.41.4.1434-1439.2003. ISSN 0095-1137. PMID 12682126. Архивирано од изворникот на 2017-09-29. Посетено на 2018-02-15.
- ↑ Lina G, Piémont Y, Godail-Gamot F, и др. (November 1999). „Involvement of Panton-Valentine leukocidin-producing Staphylococcus aureus in primary skin infections and pneumonia“. Clin. Infect. Dis. 29 (5): 1128–32. doi:10.1086/313461. PMID 10524952.
- ↑ Gillet Y, Issartel B, Vanhems P, и др. (March 2002). „Association between Staphylococcus aureus strains carrying gene for Panton-Valentine leukocidin and highly lethal necrotising pneumonia in young immunocompetent patients“. Lancet. 359 (9308): 753–9. doi:10.1016/S0140-6736(02)07877-7. PMID 11888586. As PDF Архивирано на 14 јули 2014 г.
- ↑ Chevalier, Clément; Boisset, Sandrine; Romilly, Cédric; Masquida, Benoit; Fechter, Pierre; Geissmann, Thomas; Vandenesch, François; Romby, Pascale (2010-03-12). „Staphylococcus aureus RNAIII Binds to Two Distant Regions of coa mRNA to Arrest Translation and Promote mRNA Degradation“. PLOS Pathogens. 6 (3): e1000809. doi:10.1371/journal.ppat.1000809. ISSN 1553-7374. PMC 2837412. PMID 20300607.
- ↑ Chabelskaya, Svetlana; Gaillot, Olivier; Felden, Brice (2010-06-03). „A Staphylococcus aureus Small RNA Is Required for Bacterial Virulence and Regulates the Expression of an Immune-Evasion Molecule“. PLOS Pathogens. 6 (6): e1000927. doi:10.1371/journal.ppat.1000927. ISSN 1553-7374. PMC 2880579. PMID 20532214.
- ↑ Bohn, C.; Rigoulay, C.; Chabelskaya, S.; Sharma, C. M.; Marchais, A.; Skorski, P.; Borezee-Durant, E.; Barbet, R.; Jacquet, E. (2010-10-01). „Experimental discovery of small RNAs in Staphylococcus aureus reveals a riboregulator of central metabolism“. Nucleic Acids Research (англиски). 38 (19): 6620–6636. doi:10.1093/nar/gkq462. ISSN 0305-1048. PMC 2965222. PMID 20511587.
- ↑ Sayed, Nour; Jousselin, Ambre; Felden, Brice. „A cis-antisense RNA acts in trans in Staphylococcus aureus to control translation of a human cytolytic peptide“. Nature Structural & Molecular Biology. 19 (1): 105–112. doi:10.1038/nsmb.2193.
- ↑ Morrison, John M.; Miller, Eric W.; Benson, Meredith A.; Alonzo, Francis; Yoong, Pauline; Torres, Victor J.; Hinrichs, Steven H.; Dunman, Paul M. (2012-06-01). „Characterization of SSR42, a Novel Virulence Factor Regulatory RNA That Contributes to the Pathogenesis of a Staphylococcus aureus USA300 Representative“. Journal of Bacteriology (англиски). 194 (11): 2924–2938. doi:10.1128/JB.06708-11. ISSN 0021-9193. PMC 3370614. PMID 22493015.
- ↑ Xue, Ting; Zhang, Xu; Sun, Haipeng; Sun, Baolin (2013-08-18). „ArtR, a novel sRNA of Staphylococcus aureus, regulates α-toxin expression by targeting the 5′ UTR of sarT mRNA“. Medical Microbiology and Immunology (англиски). 203 (1): 1–12. doi:10.1007/s00430-013-0307-0. ISSN 0300-8584.
- ↑ Kim, Samin; Reyes, Dindo; Beaume, Marie; Francois, Patrice; Cheung, Ambrose (2014-10-01). „Contribution of teg49 small RNA in the 5' upstream transcriptional region of sarA to virulence in Staphylococcus aureus“. Infection and Immunity. 82 (10): 4369–4379. doi:10.1128/IAI.02002-14. ISSN 1098-5522. PMC 4187880. PMID 25092913.
- ↑ Ruiz de los Mozos, I; Vergara-Irigaray, M; Segura, V; Villanueva, M; Bitarte, N; Saramago, M; Domingues, S; Arraiano, CM; Fechter, P; Romby, P; Valle, J; Solano, C; Lasa, I; Toledo-Arana, A (2013). „Base pairing interaction between 5'- and 3'-UTRs controls icaR mRNA translation in Staphylococcus aureus“. PLOS Genetics. 9 (12): e1004001. doi:10.1371/journal.pgen.1004001. PMC 3868564. PMID 24367275.
- ↑ Arciola, Carla Renata; Campoccia, Davide; Speziale, Pietro; Montanaro, Lucio; Costerton, John William. „Biofilm formation in Staphylococcus implant infections. A review of molecular mechanisms and implications for biofilm-resistant materials“. Biomaterials. 33 (26): 5967–5982. doi:10.1016/j.biomaterials.2012.05.031.
- ↑ Schneewind O, Fowler A, Faull KF (April 1995). „Structure of the cell wall anchor of surface proteins in Staphylococcus aureus“. Science. 268 (5207): 103–6. doi:10.1126/science.7701329. PMID 7701329.
- ↑ Patel AH, Nowlan P, Weavers ED, Foster T (December 1987). „Virulence of protein A-deficient and alpha-toxin-deficient mutants of Staphylococcus aureus isolated by allele replacement“. Infect. Immun. 55 (12): 3103–10. PMC 260034. PMID 3679545.
- ↑ Zhu J, Lu C, Standland M, и др. (February 2008). „Single mutation on the surface of Staphylococcus aureus Sortase A can disrupt its dimerization“. Biochemistry. 47 (6): 1667–74. doi:10.1021/bi7014597. PMID 18193895.
- ↑ 57,0 57,1 Clauditz A, Resch A, Wieland KP, Peschel A, Götz F (August 2006). „Staphyloxanthin plays a role in the fitness of Staphylococcus aureus and its ability to cope with oxidative stress“. Infection and Immunity. 74 (8): 4950–3. doi:10.1128/IAI.00204-06. PMC 1539600. PMID 16861688.
- ↑ Liu GY, Essex A, Buchanan JT, Datta V, Hoffman HM, Bastian JF, Fierer J, Nizet V (2005). „Staphylococcus aureus golden pigment impairs neutrophil killing and promotes virulence through its antioxidant activity“. J Exp Med. 202 (2): 209–15. doi:10.1084/jem.20050846. PMC 2213009. PMID 16009720.
- ↑ Liu CI, Liu GY, Song Y, Yin F, Hensler ME, Jeng WY, Nizet V, Wang AH, Oldfield E (2008). „A cholesterol biosynthesis inhibitor blocks Staphylococcus aureus virulence“. Science. 319 (5868): 391–94. doi:10.1126/science.1153018. PMC 2747771. PMID 18276850.
- ↑ „Staphylococcus: Molecular Genetics“. www.caister.com (англиски). Посетено на 2018-02-15.
- ↑ Mackay, Ian (2007). Real-Time PCR in Microbiology: From Diagnosis to Characterisation. Caister Academic Press. ISBN 1904455182.
- ↑ 62,0 62,1 „The evolution of Staphylococcus aureus“. Infection, Genetics and Evolution (англиски). 8 (6): 747–763. 2008-12-01. doi:10.1016/j.meegid.2008.07.007. ISSN 1567-1348.
- ↑ Sousa, M. Aires de; Conceição, T.; Simas, C.; Lencastre, H. de (2005-10-01). „Comparison of Genetic Backgrounds of Methicillin-Resistant and -Susceptible Staphylococcus aureus Isolates from Portuguese Hospitals and the Community“. Journal of Clinical Microbiology (англиски). 43 (10): 5150–5157. doi:10.1128/JCM.43.10.5150-5157.2005. ISSN 0095-1137. PMID 16207977. Архивирано од изворникот на 2018-05-04. Посетено на 2018-02-15.
- ↑ 64,0 64,1 64,2 Kim, JiYeon (2009-02-01). „Understanding the Evolution of Methicillin-Resistant Staphylococcus aureus“. Clinical Microbiology Newsletter (англиски). 31 (3): 17–23. doi:10.1016/j.clinmicnews.2009.01.002. ISSN 0196-4399.
- ↑ KORZENIOWSKI, OKSANA (1982-10-01). „Combination Antimicrobial Therapy forStaphylococcus aureusEndocarditis in Patients Addicted to Parenteral Drugs and in Nonaddicts“. Annals of Internal Medicine (англиски). 97 (4). doi:10.7326/0003-4819-97-4-496. ISSN 0003-4819. Архивирано од изворникот на 2018-06-03. Посетено на 2018-02-15.
- ↑ Bayer, Arnold S.; Bolger, Ann F.; Taubert, Kathryn A.; Wilson, Walter; Steckelberg, James; Karchmer, Adolph W.; Levison, Matthew; Chambers, Henry F.; Dajani, Adnan S. (1998-12-22). „Diagnosis and Management of Infective Endocarditis and Its Complications“. Circulation (англиски). 98 (25): 2936–2948. doi:10.1161/01.CIR.98.25.2936. ISSN 0009-7322. PMID 9860802.
- ↑ Cosgrove, Sara E.; Vigliani, Gloria A.; Campion, Marilyn; Fowler, Vance G.; Jr.; Abrutyn, Elias; Corey, G. Ralph; Levine, Donald P.; Rupp, Mark E. (2009-03-15). „Initial Low‐Dose Gentamicin forStaphylococcus aureusBacteremia and Endocarditis Is Nephrotoxic“. Clinical Infectious Diseases (англиски). 48 (6): 713–721. doi:10.1086/597031. ISSN 1058-4838.
- ↑ Thwaites, Guy E; Scarborough, Matthew; Szubert, Alexander; Nsutebu, Emmanuel; Tilley, Robert; Greig, Julia; Wyllie, Sarah A; Wilson, Peter; Auckland, Cressida. „Adjunctive rifampicin for Staphylococcus aureus bacteraemia (ARREST): a multicentre, randomised, double-blind, placebo-controlled trial“. The Lancet (англиски). 0 (0). doi:10.1016/S0140-6736(17)32456-X. ISSN 0140-6736.
- ↑ Chambers, H. F. (2001). „The changing epidemiology of Staphylococcus aureus?“. Emerging Infectious Diseases. 7 (2): 178–182. ISSN 1080-6040. PMC 2631711. PMID 11294701.CS1-одржување: PMC-формат (link)
- ↑ Bonomo, Robert A.; Zile, Peter S. Van; Li, Qing; Shermock, Kenneth M.; McCormick, William G.; Kohut, Bruce (2007-10-01). „Topical triple-antibiotic ointment as a novel therapeutic choice in wound management and infection prevention: a practical perspective“. Expert Review of Anti-infective Therapy. 5 (5): 773–782. doi:10.1586/14787210.5.5.773. ISSN 1478-7210.
- ↑ Ramakrishnan, V.; Carter, Andrew P.; Clemons, William M.; Brodersen, Ditlev E.; Morgan-Warren, Robert J.; Wimberly, Brian T. (2000). „Functional insights from the structure of the 30S ribosomal subunit and its interactions with antibiotics“. Nature (англиски). 407 (6802): 340–348. doi:10.1038/35030019. ISSN 1476-4687.
- ↑ Sakon, Joshua; Liao, Hans H.; Kanikula, Agnes M.; Benning, Matthew M.; Rayment, Ivan; Holden, Hazel M. (1993-11-01). „Molecular structure of kanamycin nucleotidyltransferase determined to 3.0-.ANG. resolution“. Biochemistry. 32 (45): 11977–11984. doi:10.1021/bi00096a006. ISSN 0006-2960.
- ↑ Jevons, M. Patricia (1961-01-14). „"Celbenin" - resistant Staphylococci“. Br Med J (англиски). 1 (5219): 124–125. doi:10.1136/bmj.1.5219.124-a. ISSN 0007-1447.
- ↑ Johnson, A. P. (2001-07-01). „Dominance of EMRSA-15 and -16 among MRSA causing nosocomial bacteraemia in the UK: analysis of isolates from the European Antimicrobial Resistance Surveillance System (EARSS)“. Journal of Antimicrobial Chemotherapy (англиски). 48 (1): 143–144. doi:10.1093/jac/48.1.143. ISSN 0305-7453.
- ↑ Blot, Stijn I.; Vandewoude, Koenraad H.; Hoste, Eric A.; Colardyn, Francis A. (2002-10-28). „Outcome and Attributable Mortality in Critically Ill Patients With Bacteremia Involving Methicillin-Susceptible and Methicillin-Resistant Staphylococcus aureus“. Archives of Internal Medicine (англиски). 162 (19). doi:10.1001/archinte.162.19.2229. ISSN 0003-9926.
- ↑ Hiramatsu, K (1997-07-01). „Methicillin-resistant Staphylococcus aureus clinical strain with reduced vancomycin susceptibility“. Journal of Antimicrobial Chemotherapy (англиски). 40 (1): 135–136. doi:10.1093/jac/40.1.135. ISSN 0305-7453.
- ↑ Chang, Soju; Sievert, Dawn M.; Hageman, Jeffrey C.; Boulton, Matthew L.; Tenover, Fred C.; Downes, Frances Pouch; Shah, Sandip; Rudrik, James T.; Pupp, Guy R. (2003-04-03). „Infection with vancomycin-resistant Staphylococcus aureus containing the vanA resistance gene“. The New England Journal of Medicine. 348 (14): 1342–1347. doi:10.1056/NEJMoa025025. ISSN 1533-4406. PMID 12672861.
- ↑ Menichetti, F. (May 2005). „Current and emerging serious Gram-positive infections“. Clinical Microbiology and Infection: The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases. 11 Suppl 3: 22–28. doi:10.1111/j.1469-0691.2005.01138.x. ISSN 1198-743X. PMID 15811021.
- ↑ „General Information: Community acquired MRSA“ (англиски). CDC. March 25, 2016.
- ↑ Campos, A.; Arias, A.; Betancor, L.; Rodríguez, C.; Hernández, A. M.; López Aguado, D.; Sierra, A. (July 1998). „Study of common aerobic flora of human cerumen“. The Journal of Laryngology and Otology. 112 (7): 613–616. ISSN 0022-2151. PMID 9775288.
- ↑ Quinn, Gerry A.; Cole, Alexander M. (September 2007). „Suppression of innate immunity by a nasal carriage strain of Staphylococcus aureus increases its colonization on nasal epithelium“. Immunology. 122 (1): 80–89. doi:10.1111/j.1365-2567.2007.02615.x. ISSN 0019-2805. PMC 2265977. PMID 17472720.CS1-одржување: PMC-формат (link)
- ↑ Wertheim, Heiman F. L.; Melles, Damian C.; Vos, Margreet C.; van Leeuwen, Willem; van Belkum, Alex; Verbrugh, Henri A.; Nouwen, Jan L. (December 2005). „The role of nasal carriage in Staphylococcus aureus infections“. The Lancet. Infectious Diseases. 5 (12): 751–762. doi:10.1016/S1473-3099(05)70295-4. ISSN 1473-3099. PMID 16310147.
- ↑ Sing, Andreas; Tuschak, Christian; Hörmansdorfer, Stefan (2008-03-13). „Methicillin-resistant Staphylococcus aureus in a family and its pet cat“. The New England Journal of Medicine. 358 (11): 1200–1201. doi:10.1056/NEJMc0706805. ISSN 1533-4406. PMID 18337614.
- ↑ Neely, A. N.; Maley, M. P. (February 2000). „Survival of enterococci and staphylococci on hospital fabrics and plastic“. Journal of Clinical Microbiology. 38 (2): 724–726. ISSN 0095-1137. PMID 10655374.
- ↑ Cook, Heather A.; Furuya, E. Yoko; Larson, Elaine; Vasquez, Glenny; Lowy, Franklin D. (2007-02-01). „Heterosexual transmission of community-associated methicillin-resistant Staphylococcus aureus“. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 44 (3): 410–413. doi:10.1086/510681. ISSN 1537-6591. PMID 17205449.
- ↑ „Thermal Death Time of Staphylococcus Aureus (PTCC=29213) and Staphylococcus Epidermidis (PTCC=1435) in Distilled Water“ (PDF).
Литература[уреди | уреди извор]
- Loskill, Peter; Pereira, Pedro M.; Jung, Philipp; Bischoff, Markus; Herrmann, Mathias; Pinho, Mariana G.; Jacobs, Karin (2 September 2014). „Reduction of the Peptidoglycan Crosslinking Causes a Decrease in Stiffness of the Staphylococcus aureus Cell Envelope“. Biophysical Journal. 107 (5): 1082–1089. doi:10.1016/j.bpj.2014.07.029. PMC 4156677. PMID 25185544. Посетено на 14 November 2014.
- Benson, Meredith A.; Ohneck, Elizabeth A.; Ryan, Chanelle; Alonzo III, Francis; Smith, Hannah (2014). „Evolution of hypervirulence by a MRSA clone through acquisition of a transposable element“. Molecular Microbiology. 93.4: “Evolution of Hypervirulence by a MRSA Clone through Acquisition of a Transposable Element.”. Посетено на 2017-12-05.
Надворешни врски[уреди | уреди извор]
- StopMRSANow.org — Дискутира како да се спречи ширењето на MRSA.
- TheMRSA.com — Објаснување на MRSA инфекциите.
- „Staphylococcus aureus“. NCBI Taxonomy Browser. 1280.
- Packham, Christopher (March 16, 2015). „Successful in vivo test of breakthrough Staphylococcus aureus vaccine“. Medical Press. Архивирано од изворникот на September 19, 2012. Посетено на 18 March 2015.
