Тиоредоксински склоп
| Тиоредоксин | |||||||||
|---|---|---|---|---|---|---|---|---|---|
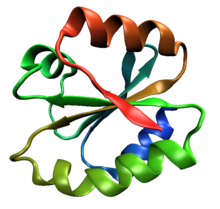 Една молекула на човечки тиоредоксин (PDB ID 1ERT), типичен пример на класата на тиоредоксински склоп. | |||||||||
| Назнаки | |||||||||
| Симбол | Тиоредоксин, Trx | ||||||||
| Pfam | PF00085 | ||||||||
| Pfam-клан | CL0172 | ||||||||
| InterPro | IPR013766 | ||||||||
| PROSITE | PDOC00172 | ||||||||
| SCOP | 3trx | ||||||||
| SUPERFAMILY | 3trx | ||||||||
| CDD | cd01659 | ||||||||
| |||||||||
| Тиоредоксин | |
|---|---|
| Назнаки | |
| Симбол | Trx |
Тиоредоксински склоп — белковински (белковински) склоп кој е заеднички за ензимите кои го катализираат создавањето на дисулфидните врски и изомеризацијата. Склопот е именуван по тиоредоксинот (класа на мали редокс белковини) и може да се најде и кај прокариотските и кај еукариотските организми. Тој е пример за алфа/бета белковински склоп со оксидоредуктазна активност. Просторната топологија на склопот се состои од четири-верижна антипаралелна бета-плоча, која се наоѓа во сендвич меѓу три алфа-завојницаа. Топологијата на бета нишките е 2134, каде 3 е антипаралелна на останатите.
Сочуваност на низата[уреди | уреди извор]
И покрај тоа што постои голема варијабилност во низата, тиоредоксинските белковини споделуваат иста низа на активното место, со две реактивни цистеински остатоци: Cys-X-Y-Cys, каде X и Y се често, но не секогаш, хидрофобни аминокиселини. Редуцираната форма на белковината содржи две слободни тиолни групи на цистеинските остатоци, додека оксидираната форма содржи дисулфидна врска меѓу нив.
Формирање на дисулфидни врски[уреди | уреди извор]
Различните белковини кои содржат тиоредоксин се разликуваат многу во нивната реактивност и во pKa на нивните слободни тиоли, што произлегува од способноста на целокупната структура на белковината да го стабилизира активираниот тиолат. Иако структурата е прилично доследна меѓу белковините кои го содржат тиоредоксинскиот склоп, pKa вредноста е исклучително чувствителна на мали варијации во структурата, особено поставеноста на атомите од полипептидниот ’рбет во близина на првиот цистеин.
Примери[уреди | уреди извор]
Човечки белковини кои го содржат овој склоп се:
- DNAJC10
- ERP70
- GLRX3
- P4HB; P5; PDIA2; PDIA3; PDIA4; PDIA5; PDIA6; PDILT
- QSOX1; QSOX2
- STRF8
- TXN; TXN2; TXNDC1; TXNDC10; TXNDC11; TXNDC13; TXNDC14; TXNDC15; TXNDC16; TXNDC2; TXNDC3; TXNDC4; TXNDC5; TXNDC6; TXNDC8; TXNL1; TXNL3
Наводи[уреди | уреди извор]
- Creighton TE. (2000). Protein folding coupled to disulphide-bond formation. In Mechanisms of Protein Folding 2nd ed. Editor RH Pain. Oxford University Press.
Надворешни врски[уреди | уреди извор]
- SCOP тиоредоксинско натсемејство Архивирано на 16 мај 2011 г. (англиски)
- CATH топологија на глутаредоксин Архивирано на 12 март 2007 г. (англиски)
