Тетразол
Тетразолите се класа на синтетичко органско хетероциклично соединение, кое се состои од 5-член прстен од четири азотни атоми и еден јаглероден атом. Името тетразол се однесува и на матичната соединение со формула CH2N4, од кои може да се формулираат три изомери.
Структура и поврзување[уреди | уреди извор]
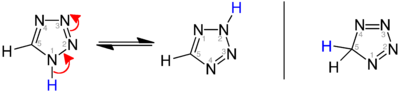
Постојат три изомери на матичниот тетразол, кои се разликуваат во положбата на двојните врски: 1H-, 2H- и 5H -тетразол. 1H-и 2H-изомерите се тавтомери, при што рамнотежата лежи на страната на 1H-тетразол во цврстата фаза.[1][2][3] Во гасната фаза доминира 2H-тетразол.[2][4][5] Овие изомери може да се сметаат за ароматични, со 6 π-електрони, додека 5 H-изомерот е неароматичен.
Синтеза[уреди | уреди извор]
1H-тетразолот првпат бил подготвен со реакција на безводна хидразоева киселина и водород цијанид под притисок. Третманот на органските нитрили со натриум азид во присуство на натриум бисулфат поддржан од јод или силика како хетероген катализатор овозможува поволна синтеза на 5-супституирани 1H-тетразоли. Друг метод е деаминација на 5-аминотетразол, кој може комерцијално да се добие или да се подготви од аминогванидин.[6][7]
2-арил-2H-тетразолите се синтетизираат со [3+2] реакција на циклоадиција помеѓу арил диазониум и триметилсилилдиазометан.[8]
Употреба[уреди | уреди извор]
Постојат неколку фармацевтски агенси кои се тетразоли. Тетразолите можат да дејствуваат како биоизостери за карбоксилатните групи бидејќи имаат слична pKa и се депротонираат на физиолошка pH вредност. Блокаторите на рецепторот на ангиотензин II - како што се лосартан и кандесартан, често се тетразоли. Добро познат тетразол е диметил тиазолил дифенил тетразолиум бромид (MTT). Овој тетразол се користи во анализата на МТТ за квантифицирање на респираторната активност на културата на живи клетки, иако генерално ги убива клетките во процесот. Некои тетразоли може да се користат и во анализите на ДНК.[9] Студиите сугерираат дека VT-1161 и VT-1129 се потенцијални моќни антифунгални лекови бидејќи ја нарушуваат ензимската функција на габите, но не и човечките ензими.[10][11]
Некои деривати на тетразол со висока енергија се испитани како експлозиви со високи перформанси како замена за ТНТ, а исто така и за употреба во формулации за цврсто ракетно гориво со високи перформанси.[12][13] Тие вклучуваат азидотетразолат соли на азотни бази.
Други тетразоли се користат поради нивните експлозивни или согорувачки својства, како што се самиот тетразол и 5-аминотетразол, кои понекогаш се користат како компонента на генераторите на гас во воздушните перничиња на автомобилите. Енергетските материјали базирани на тетразол произведуваат производи за реакција со висока температура, нетоксични, како што се вода и азот гас,[14] и имаат висока стапка на согорување и релативна стабилност,[15] од кои сите се пожелни својства. Енергијата на делокализација во тетразолот е 209 kJ/mol.
1H-тетразол и 5-(бензилтио -1H-тетразол (BTT) се широко користени како кисели активатори на реакцијата на спојување во синтезата на олигонуклеотид.[16]
Поврзани хетероциклични соединенија[уреди | уреди извор]
- Триазоли, аналози со три атоми на азот
- Пентазол, аналог со пет атоми на азот (строго кажано, неоргански хомоцикл, а не хетероцикл)
- Оксететразол
- Тиатетразол
Наводи[уреди | уреди извор]
- ↑ Goddard, R.; Heinemann, O.; Krüger, C. (1997-05-15). „α-1H-1,2,3,4-Tetrazole“. Acta Crystallographica Section C (англиски). 53 (5): 590–592. doi:10.1107/S0108270197000772. ISSN 0108-2701.
- ↑ 2,0 2,1 Kiselev, Vitaly G.; Cheblakov, Pavel B.; Gritsan, Nina P. (2011-03-10). „Tautomerism and Thermal Decomposition of Tetrazole: High-Level ab Initio Study“. The Journal of Physical Chemistry A. 115 (9): 1743–1753. Bibcode:2011JPCA..115.1743K. doi:10.1021/jp112374t. ISSN 1089-5639. PMID 21322546.
- ↑ Razynska, A.; Tempczyk, A.; Malinski, E.; Szafranek, J.; Grzonka, Z.; Hermann, P.: in J. Chem.
- ↑ Wong, Ming Wah; Leung-Toung, Regis; Wentrup, Curt (1993-03-01). „Tautomeric equilibrium and hydrogen shifts of tetrazole in the gas phase and in solution“. Journal of the American Chemical Society. 115 (6): 2465–2472. doi:10.1021/ja00059a048. ISSN 0002-7863.
- ↑ Rażyńska, Anna; Tempczyk, Anna; Maliński, Edmund; Szafranek, Janusz; Grzonka, Zbigniew; Hermann, Peter (1983-01-01). „Application of mass spectrometry to the study of prototropic equilibria in 5-substituted tetrazoles in the gas phase; experimental evidence and theoretical considerations“. Journal of the Chemical Society, Perkin Transactions 2 (англиски) (3): 379–383. doi:10.1039/P29830000379. ISSN 1364-5471.
- ↑ Henry, Ronald A.; Finnegan, William G. (1954-01-01). „An Improved Procedure for the Deamination of 5-Aminotetrazole“. Journal of the American Chemical Society. 76 (1): 290–291. doi:10.1021/ja01630a086. ISSN 0002-7863.
- ↑ Kurzer, F.; Godfrey, L. E. A. (1963). „Syntheses of Heterocyclic Compounds from Aminoguanidine“. Angewandte Chemie International Edition in English (англиски). 2 (8): 459–476. doi:10.1002/anie.196304591. ISSN 1521-3773.
- ↑ Patouret, Remi; Kamenecka, Theodore M. (2016-04-06). „Synthesis of 2-aryl-2H-tetrazoles via a regioselective [3+2] cycloaddition reaction“. Tetrahedron Letters. 57 (14): 1597–1599. doi:10.1016/j.tetlet.2016.02.102. PMC 4810784. PMID 27041776.
- ↑ S Berner; K Mühlegger; H Seliger (Feb 11, 1989). „Studies on the role of tetrazole in the activation of phosphoramidites“. Nucleic Acids Res. 17 (3): 853–864. doi:10.1093/nar/17.3.853. PMC 331708. PMID 2922273.
- ↑ Warrilow, A. G. S.; Hull, C. M.; Parker, J. E.; Garvey, E. P.; Hoekstra, W. J.; Moore, W. R.; Schotzinger, R. J.; Kelly, D. E.; Kelly, S. L. (December 2014). „The Clinical Candidate VT-1161 Is a Highly Potent Inhibitor of Candida albicans CYP51 but Fails To Bind the Human Enzyme“. Antimicrobial Agents and Chemotherapy. 58 (12): 7121–7127. doi:10.1128/AAC.03707-14. PMC 4249504. PMID 25224009.
- ↑ Lockhart, Shawn R.; Fothergill, Annette W.; Iqbal, Naureen; Bolden, Carol B.; Grossman, Nina T.; Garvey, Edward P.; Brand, Stephen R.; Hoekstra, William J.; Schotzinger, Robert J. (April 2016). „The Investigational Fungal Cyp51 Inhibitor VT-1129 Demonstrates Potent Activity against Cryptococcus neoformans and Cryptococcus gattii“. Antimicrobial Agents and Chemotherapy. 60 (4): 2528–2531. doi:10.1128/AAC.02770-15. PMC 4808209. PMID 26787697.
- ↑ „Greener explosives show promise“. Chemistry World. 2 October 2008.
- ↑ Niko Fischer, Konstantin Karaghiosoff, Thomas M. Klapötke and Jörg Stierstorfer (April 2010). „New Energetic Materials featuring Tetrazoles and Nitramines – Synthesis, Characterization and Properties“. Zeitschrift für Anorganische und Allgemeine Chemie. 636 (5): 735–749. doi:10.1002/zaac.200900521.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ Tore Brinck, Thomas M. Klapötke and Jörg Stierstorfer (2014). „Energetic Tetrazole N-oxides“. Energetic Tetrazole N -oxides. Green Energetic Materials. стр. 133–178. doi:10.1002/9781118676448.ch06. ISBN 9781118676448.
- ↑ Nicholas Piekiel; Michael R. Zachariah (2012). „Decomposition of Aminotetrazole Based Energetic Materials under High Heating Rate Conditions“. J. Phys. Chem. A. 116 (6): 1519–1526. Bibcode:2012JPCA..116.1519P. doi:10.1021/jp203957t. PMID 22214278.
- ↑ Xia Wei (May 6, 2013). „Coupling activators for the oligonucleotide synthesis via phosphoramidite approach“. Tetrahedron. 69 (18): 3615–3637. doi:10.1016/j.tet.2013.03.001.

