Орбитален квантен број: Разлика помеѓу преработките
| [непроверена преработка] | [непроверена преработка] |
Нема опис на уредувањето |
Нема опис на уредувањето |
||
| Ред 1: | Ред 1: | ||
{{внимание}} |
|||
{{Квантна механика}} |
{{Квантна механика}} |
||
'''Орбитален квантен број''' - [[квантен број]] за [[атомска орбитала|атомската орбитала]] што го одредува [[Импулс (механика)|импулсот]] на орбиталната аголна динамика и го претставува обликот на орбитата. Овој број е втор од низа на квантни броеви кои ја опишуваат уникатната квантна состојба на еден електрон ( |
'''Орбитален квантен број''' - [[квантен број]] за [[атомска орбитала|атомската орбитала]] што го одредува [[Импулс (механика)|импулсот]] на орбиталната аголна динамика и го претставува обликот на орбитата. Овој број е втор од низа на квантни броеви кои ја опишуваат уникатната [[квантна состојба]] на еден електрон (другите главни квантни броеви, според [[спектроскопска нотација|спектроскопската нотација]] се [[магнетен квантен број|магнетниот квантен број]] и [[спински квантен број|спинскиот квантен број]]). Тој е исто така познат како квантен број на орбитален аголен момент, орбитален квантен број или втор квантен број, и е претставен со ''ℓ''. |
||
==Изведување== |
==Изведување== |
||
[[File:Vector model of orbital angular momentum.svg|250px|right|thumb|Приказ на квантно-механичкиот орбитален аголен импулс.]] |
[[File:Vector model of orbital angular momentum.svg|250px|right|thumb|Приказ на квантно-механичкиот орбитален аголен импулс.]] |
||
Поврзани со енергетските состојби на електроните во атомот се |
Поврзани со енергетските состојби на електроните во атомот се четирите квантни броеви: ''n'', ''ℓ'', ''m''<sub>''ℓ''</sub>, and ''m''<sub>''s''</sub>. Овие броеви ја претставуваат комплетната и уникатна [[квантна состојба]] на еден електрон во атомот, и ја сочинуваат неговата [[бранова функција]] или [[атомска орбита|орбита]]. Брановата функција на [[Шредингерова равенка|Шредингеровата равенка]] се менува во три равенки, кои решени ги даваат првите три квантни броеви. Затоа, равенките за првите три квантни броеви се меѓусебно поврзани. Орбиталниот квантен број настанал во решението на поларниот дел од равенката за брановата функција како што е прикажано подолу. Да се помогне во разбирањето на овој концепт на [[азимут]], исто така може да се проверат [[сферични координатни системи]], или други алтернативни математички координатни системи покрај [[Декартов координатен систем|Декартовиот координатен систем]]. Општо земено, сферичните координатни системи работат најдобро со сферични модели, [[цилиндричен координатен систем|цилиндрични системи]] со цилиндри, итн. |
||
Аголниот |
Аголниот момент на еден атомски електрон, ''L'', е поврзан со неговиот квантен број ''ℓ'' со следната равенка : |
||
:<math>\mathbf{L}^2\Psi = \hbar^2{\ell(\ell+1)}\Psi</math> |
:<math>\mathbf{L}^2\Psi = \hbar^2{\ell(\ell+1)}\Psi</math> |
||
каде |
каде ''ħ'' е намалената [[Планкова константа]], '''L'''<sup>2</sup> е орбиталниот аголен момент и <math>\Psi</math> е брановата функција на електроните. Квантниот број ''ℓ'' е секогаш позитивен цел број : 0,1,2,3 итн. Додека голем број на учебници за основата на квантната механика ќе се однесуваат на '''L''' само по себе, '''L''' нема вистинско значење освен неговата употреба како операторот за аголниот момент. Кога се однесува на аголен момент, подобро е да се користи квантениот број ''ℓ''. |
||
| ⚫ | |||
Квантниот број ℓ е секогаш за не негативни цели броеви : 0,1,2,3 итн. Додека голем број на учебници за основата на квантната механика ќе се однесуваат на L само по себе, L нема вистинско значење освен неговата употреба како операторот за аголниот моментум. Кога се однесува на аголен моментум, подобро е да се користи квантениот број ℓ. |
|||
| ⚫ | |||
| ⚫ | |||
| ⚫ | Нивните [[бранова функција|бранови функции]] се во форма на [[сферична хармоника|сферични хармоники]], и така се опишани од страна [[Лежандреви полиноми|Лежандреевите полиноми]]. Различните орбитали кои се однесуваат на различни вредности на ℓ се понекогаш наречени под- школки, и (главно од историски причини) се означени со букви, како што следува: |
||
| ⚫ | |||
| ⚫ | |||
:{| class="wikitable" |
:{| class="wikitable" |
||
| Ред 26: | Ред 22: | ||
! ℓ !!Буква !! Макс. бр. на електрони !! Облик !! Име |
! ℓ !!Буква !! Макс. бр. на електрони !! Облик !! Име |
||
|- |
|- |
||
| 0 || s || 2 || [[сфера]] || '''s''' |
| 0 || s || 2 || [[сфера]] || '''s''' остра |
||
|- |
|- |
||
| 1 || p || 6 || три [[атомска орбитала|ѕвона]] || '''p''' |
| 1 || p || 6 || три [[атомска орбитала|ѕвона]] || '''p''' принципална |
||
|- |
|- |
||
| 2 || d || 10 || четири ѕвона или единечна || '''d''' |
| 2 || d || 10 || четири ѕвона или единечна || '''d''' дифузна |
||
|- |
|- |
||
| 3 || f || 14 ||осум ѕвона или двојна|| '''f''' |
| 3 || f || 14 ||осум ѕвона или двојна|| '''f''' фундаментална |
||
|- |
|- |
||
| 4 || g || 18 || || |
| 4 || g || 18 || || |
||
| Ред 41: | Ред 37: | ||
|} |
|} |
||
| ⚫ | Секоја состојба на различните аголни моменти може да земе 2( 2''ℓ'' + 1) електрони. Тоа е затоа што третиот квантен број ''m''<sub>''ℓ''</sub> (што може да се смета како [[квантна]] проекција на векторот на аголниот моментум на z-оската) трае од −''ℓ'' to ''ℓ'' во множеството на цели броеви, и така постојат 2''ℓ'' +1 можни состојби. Секоја посебна ''n'', ''ℓ'', ''m''<sub>''ℓ''</sub> орбитала може да биде заземена од страна на два електрона со спротивни спинови (дадени од квантниот број ''m<sub>s</sub>''), давајќи 2( 2ℓ + 1) електрони во целина. Орбитали со повисоки ''ℓ'' од дадените во табелата се совршено дозволени, но овие вредности ги покриваат сите досега откриени атоми. |
||
| ⚫ | За дадена вредност на [[основен квантен број|основниот квантен број]] ''n'', можни вредности на ''ℓ'' се во опсег од 0 до ''n''-1; според тоа, слојот ''n''= 1 поседува само s подслој и може да прими само 2 електрони, ''n''= 2 слојот поседува s, и р подслоeви и може да прими 8 електрони во целост, ''n''= 3 слојот поседува ѕ, р и d подслоеви и има максимум од 18 електрони, и така натаму. Општо земено, максималниот број на електрони во n- нивото на енергија е 2''n''<sup>2</sup>. |
||
| ⚫ | |||
Квантниот број на аголниот момент ''ℓ'', го одредува бројот на рамнински јазли кои минуваат низ јадрото. Во s орбитала, јазли не минуваат низ јадрото, и според тоа соодветниот орбитален квантен број ''ℓ'' има вредност 0. Во p орбиталата, еден јазол преминува низ јадрото и затоа ℓ има вредност од 1. ''L'' има вредност √2''ħ''. |
|||
Во зависност од вредноста на ''n'', постои квантен број на аголниот момент ''ℓ'' и следните серии. Наведените бранови должини се за [[водороден атом]]: |
|||
| ⚫ | |||
| ⚫ | За дадена вредност на основниот квантен број n, можни вредности на ℓ се во опсег од 0 до n |
||
| ⚫ | |||
| ⚫ | |||
''n''= 3, ''L'' = √6''ħ'', [[Пашенова серија]] (речиси инфрацрвена) |
|||
| ⚫ | |||
''n''= 4, ''L'' = 2√3''ħ'', [[Брекетова серија]] (инфрацрвена со кратка бранова должина) |
|||
n = 3, L = √6ħ, Ритц – Пашен серии (скоро инфрацрвена) |
|||
n |
''n''= 5, L = 2√5''ħ'', [[Пфундова серија]] (инфрацрвена со средна бранова должина). |
||
n = 5, L = 2√5ħ, Фунд серии (средно-брановидна инфрацрвена). |
|||
== Собирање на квантни аголни моменти == |
|||
Вкупниот квантен аголен моментум што е збирот на две поединечни квантни аголнимоментуми и , |
|||
Кај даден вкупен квантен аголен момент <math>\vec{\jmath}</math> кој е збир од два поединечни аголни моменти <math>\vec{\ell_1}</math> и <math>\vec{\ell_2}</math>, |
|||
Квантниот број поврзан со неговата големина може да варираат од до каде и се квантните броеви кои одговараат на големините на секој аголен моментум. |
|||
:<math>\vec{\jmath} = \vec{\ell_1} + \vec{\ell_2}</math> |
|||
| ⚫ | |||
магнитудата на [[квантен број|квантниот број]] <math>j</math> може да се движи од <math>|\ell_1 - \ell_2|</math> до <math>\ell_1 + \ell_2</math> каде <math>\ell_1</math> и <math>\ell_2</math> се квантни броеви кои одговараат на магнитудите на поединечните аголни моменти. |
|||
| ⚫ | |||
| ⚫ | |||
[[File:LS coupling.svg|250px|thumb|"Векторски конуси" на вкупниот аголен момент '''J''' (виолетово), орбитала '''L''' (сино), и спин '''S''' (зелено). Конусите се јавуваат поради [[квантна неодреденост|квантната неодреденост]] која се јавува про мерењето на делови од аголниот момент на атомот ([[векторски модел на атом]]]] |
|||
| ⚫ | |||
| ⚫ | Како резултат на [[спин-орбита заемодејството]] на атомот, орбиталниот аголен момент веќе не е комутативен со [[Хамилтонов оператор|Хамилтоновиот оператор]], ниту пак со [[спин]]овите. Затоа тие се менуваат со текот на времето. Сепак, [[вкупен аголен момент|вкупниот аголен момент]] '''J''' е комутативен со Хамилтоновиот оператор и е констатнтен. '''J''' е дефиниран преку |
||
:<math>\vec{J} = \vec{L} + \vec{S}</math> |
|||
| ⚫ | |||
:<math>[J_i, J_j ] = i \hbar \epsilon_{ijk} J_k</math> |
|||
од кое што следува |
од кое што следува |
||
:<math>\left[J_i, J^2 \right] = 0</math> |
|||
каде Ji стои за Jx, Jy, и Jz. |
|||
каде ''J''<sub>i</sub> ги заменува ''J''<sub>x</sub>, ''J''<sub>y</sub>, и ''J''<sub>z</sub>. |
|||
| ⚫ | |||
| ⚫ | |||
:<math>\mathbf{J}^2\Psi = \hbar^2{j(j+1)}\Psi</math> |
|||
| ⚫ | |||
:<math>\mathbf{J}_z\Psi = \hbar{m_j}\Psi</math> |
|||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | ''j'' и ''m''<sub>''j''</sub>, заедно со [[парност]]а на [[квантна состојба|квантните состојби]], ги заменуваат трите [[квантен број|квантни броеви]] ''ℓ'', ''m''<sub>''ℓ''</sub> и ''m''<sub>''s''</sub> (проекцијата на [[спин]]от при одредена оска). Претходните квантни броеви можат да се поврзат со овие. |
||
| ⚫ | |||
| ⚫ | |||
Понатаму, [[вектор]]и од ''j'', ''s'', ''m''<sub>''j''</sub> и парноста, кои се вектори на Хамилтоновиот оператор, се линеарни комбинации на [[вектор]]ите накои исто така се вектори на Хамилтоновиот оператор, се линеарни комбинации на векторите на ''ℓ'', ''s'', ''m''<sub>''ℓ''</sub> and ''m''<sub>''s''</sub>. |
|||
== Листа на квантни броеви за аголен момент == |
|||
* Квантен број за спински аголен момент ([[спински квантен број]]) |
|||
* Квантен број за орбитален аголен момент |
|||
* [[Магнетен квантен број]], поврзан со квантниот број за орбитален момент |
|||
* [[Квантен број за вкупен аголен момент]] |
|||
Историја |
== Историја == |
||
| ⚫ | Орбиталниот квантен број бил пренесен од [[Боров модел на атомот|Боровиот модел на атомот]], а бил утврден од страна на [[Арнолд Зомерфелд]].<ref>{{cite book|last=Аизберг|first=Роберт|title=Квантна физика на Атоми, Молекули, Тврди тела, Јадра, и Честички |year=1974|publisher=Џон Вајли и синови|location=Њу Јорк|isbn=978-0-471-23464-7|pages=114–117}}</ref> Моделот на Бор бил изведен од [[спектроскопска анализа|спектроскопските анализи]] на атомот во комбинација со атомскиот модел на [[Ернест Радерфорд|Радерфорд]]. Најниското квантно ниво има аголна динамика нула. Орбити со нула аголен момент биле сметани за осцилирачки полнежи во една димензија и така се опишуваат како "нишало" орбити.<ref>{{cite journal|title=Белешки за “нишало” орбитите на атомските модели|journal=Случувања на Националната академија за наука|year=1927|volume=13|pages=413-419|url=http://www.pubmedcentral.gov/picrender.fcgi?tool=pmcentrez&blobtype=pdf&artid=1085028|author=Р.Б. Линдзи|authorlink=Роберт Брус Линдзи |doi=10.1073/pnas.13.6.413|bibcode = 1927PNAS...13..413L }}</ref> Во три димензии орбитите стануваат сферични без [[јазли]] кои минуваат низ јадрото, слично (во состојба на најниска енергија) на јаже за скокање кое осцилира во еден голем круг. |
||
== Поврзано == |
|||
* [[Оператор на аголен момент]] |
|||
* [[Основна квантна механика]] |
|||
* [[Честичка во сферно симетричен потенцијал]] |
|||
* [[Квантен број]] |
|||
** [[Магнетен квантен број]] |
|||
** [[Основен квантен број]] |
|||
** [[Спински квантен број]] |
|||
** [[Квантен број за вкупен аголен момент]] |
|||
* [[Клебш-Горданови коефициенти]] |
|||
== Наводи == |
|||
<references/> |
|||
== Надворешни врски == |
|||
* [http://galileo.phys.virginia.edu/classes/252/Bohr_Atom/Bohr_Atom.html Development of the Bohr atom] |
|||
* [http://itl.chem.ufl.edu/ao_pict/ao_pict.html Pictures of atomic orbitals] |
|||
* [http://www.src.wits.ac.za/pages/teaching/Connell/phys284/2005/lecture-03/lecture_03/node7.html Detailed explanation of the Orbital Quantum Number l] |
|||
* [http://hyperphysics.phy-astr.gsu.edu/hbase/quantum/hydazi.html#c1 The azimuthal equation explained] |
|||
[[Category:Atomic physics]] |
|||
| ⚫ | Орбиталниот квантен број бил пренесен од Боровиот модел на атомот, а бил утврден од страна на Арнолд Зомерфелд. Моделот на Бор бил изведен од спектроскопските анализи на атомот во комбинација со |
||
[[Category:Rotational symmetry]] |
|||
[[Category:Quantum numbers]] |
|||
Преработка од 18:33, 24 април 2016
| Квантна механика |
|---|
Орбитален квантен број - квантен број за атомската орбитала што го одредува импулсот на орбиталната аголна динамика и го претставува обликот на орбитата. Овој број е втор од низа на квантни броеви кои ја опишуваат уникатната квантна состојба на еден електрон (другите главни квантни броеви, според спектроскопската нотација се магнетниот квантен број и спинскиот квантен број). Тој е исто така познат како квантен број на орбитален аголен момент, орбитален квантен број или втор квантен број, и е претставен со ℓ.
Изведување
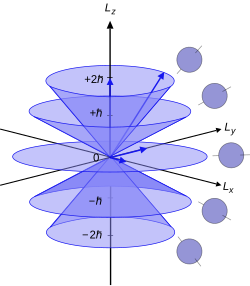
Поврзани со енергетските состојби на електроните во атомот се четирите квантни броеви: n, ℓ, mℓ, and ms. Овие броеви ја претставуваат комплетната и уникатна квантна состојба на еден електрон во атомот, и ја сочинуваат неговата бранова функција или орбита. Брановата функција на Шредингеровата равенка се менува во три равенки, кои решени ги даваат првите три квантни броеви. Затоа, равенките за првите три квантни броеви се меѓусебно поврзани. Орбиталниот квантен број настанал во решението на поларниот дел од равенката за брановата функција како што е прикажано подолу. Да се помогне во разбирањето на овој концепт на азимут, исто така може да се проверат сферични координатни системи, или други алтернативни математички координатни системи покрај Декартовиот координатен систем. Општо земено, сферичните координатни системи работат најдобро со сферични модели, цилиндрични системи со цилиндри, итн.
Аголниот момент на еден атомски електрон, L, е поврзан со неговиот квантен број ℓ со следната равенка :
каде ħ е намалената Планкова константа, L2 е орбиталниот аголен момент и е брановата функција на електроните. Квантниот број ℓ е секогаш позитивен цел број : 0,1,2,3 итн. Додека голем број на учебници за основата на квантната механика ќе се однесуваат на L само по себе, L нема вистинско значење освен неговата употреба како операторот за аголниот момент. Кога се однесува на аголен момент, подобро е да се користи квантениот број ℓ.
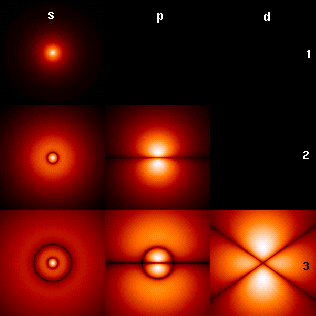
Атомските орбитали имаат карактеристични форми означени со букви. На илустрацијата, буквите ѕ, p и d го опишуваат обликот на атомската орбитала.
Нивните бранови функции се во форма на сферични хармоники, и така се опишани од страна Лежандреевите полиноми. Различните орбитали кои се однесуваат на различни вредности на ℓ се понекогаш наречени под- школки, и (главно од историски причини) се означени со букви, како што следува:
ℓ Буква Макс. бр. на електрони Облик Име 0 s 2 сфера s остра 1 p 6 три ѕвона p принципална 2 d 10 четири ѕвона или единечна d дифузна 3 f 14 осум ѕвона или двојна f фундаментална 4 g 18 5 h 22 6 i 26
Секоја состојба на различните аголни моменти може да земе 2( 2ℓ + 1) електрони. Тоа е затоа што третиот квантен број mℓ (што може да се смета како квантна проекција на векторот на аголниот моментум на z-оската) трае од −ℓ to ℓ во множеството на цели броеви, и така постојат 2ℓ +1 можни состојби. Секоја посебна n, ℓ, mℓ орбитала може да биде заземена од страна на два електрона со спротивни спинови (дадени од квантниот број ms), давајќи 2( 2ℓ + 1) електрони во целина. Орбитали со повисоки ℓ од дадените во табелата се совршено дозволени, но овие вредности ги покриваат сите досега откриени атоми.
За дадена вредност на основниот квантен број n, можни вредности на ℓ се во опсег од 0 до n-1; според тоа, слојот n= 1 поседува само s подслој и може да прими само 2 електрони, n= 2 слојот поседува s, и р подслоeви и може да прими 8 електрони во целост, n= 3 слојот поседува ѕ, р и d подслоеви и има максимум од 18 електрони, и така натаму. Општо земено, максималниот број на електрони во n- нивото на енергија е 2n2. Квантниот број на аголниот момент ℓ, го одредува бројот на рамнински јазли кои минуваат низ јадрото. Во s орбитала, јазли не минуваат низ јадрото, и според тоа соодветниот орбитален квантен број ℓ има вредност 0. Во p орбиталата, еден јазол преминува низ јадрото и затоа ℓ има вредност од 1. L има вредност √2ħ. Во зависност од вредноста на n, постои квантен број на аголниот момент ℓ и следните серии. Наведените бранови должини се за водороден атом:
n= 1, L = 0, Лајманова серија(ултравиолетово) n= 2, L = √2ħ, Балмерова серија(видно достапна) n= 3, L = √6ħ, Пашенова серија (речиси инфрацрвена) n= 4, L = 2√3ħ, Брекетова серија (инфрацрвена со кратка бранова должина) n= 5, L = 2√5ħ, Пфундова серија (инфрацрвена со средна бранова должина).
Собирање на квантни аголни моменти
Кај даден вкупен квантен аголен момент кој е збир од два поединечни аголни моменти и ,
магнитудата на квантниот број може да се движи од до каде и се квантни броеви кои одговараат на магнитудите на поединечните аголни моменти.
Вкупниот аголен момент на еден електрон во атомот

Како резултат на спин-орбита заемодејството на атомот, орбиталниот аголен момент веќе не е комутативен со Хамилтоновиот оператор, ниту пак со спиновите. Затоа тие се менуваат со текот на времето. Сепак, вкупниот аголен момент J е комутативен со Хамилтоновиот оператор и е констатнтен. J е дефиниран преку
каде L е орбиталниот аголен момент и S се спиновите. Вкупниот аголен момент го задоволува истиот комутативен однос како орбиталниот аголен момент,
:
од кое што следува
:
каде Ji ги заменува Jx, Jy, и Jz.
Квантните броеви кои го опишуваат системот, а се константи во текот на времето, сега се j и mj, дефинирани преку дејството на J за брановата функција
Така што j е поврзан со нормата на вкупниот аголен моментум и mj до својата проекција при одредена оска .
Како и со било кој оператор на аголен момент во квантната механика, проекцијата на J по други оски не може да биде ко-дефинирана со Jz, затоа што тие не се комутативни.
Односот меѓу новите и старите квантните броеви
j и mj, заедно со парноста на квантните состојби, ги заменуваат трите квантни броеви ℓ, mℓ и ms (проекцијата на спинот при одредена оска). Претходните квантни броеви можат да се поврзат со овие.
Понатаму, вектори од j, s, mj и парноста, кои се вектори на Хамилтоновиот оператор, се линеарни комбинации на векторите накои исто така се вектори на Хамилтоновиот оператор, се линеарни комбинации на векторите на ℓ, s, mℓ and ms.
Листа на квантни броеви за аголен момент
- Квантен број за спински аголен момент (спински квантен број)
- Квантен број за орбитален аголен момент
- Магнетен квантен број, поврзан со квантниот број за орбитален момент
- Квантен број за вкупен аголен момент
Историја
Орбиталниот квантен број бил пренесен од Боровиот модел на атомот, а бил утврден од страна на Арнолд Зомерфелд.[1] Моделот на Бор бил изведен од спектроскопските анализи на атомот во комбинација со атомскиот модел на Радерфорд. Најниското квантно ниво има аголна динамика нула. Орбити со нула аголен момент биле сметани за осцилирачки полнежи во една димензија и така се опишуваат како "нишало" орбити.[2] Во три димензии орбитите стануваат сферични без јазли кои минуваат низ јадрото, слично (во состојба на најниска енергија) на јаже за скокање кое осцилира во еден голем круг.
Поврзано
- Оператор на аголен момент
- Основна квантна механика
- Честичка во сферно симетричен потенцијал
- Квантен број
- Клебш-Горданови коефициенти
Наводи
- ↑ Аизберг, Роберт (1974). Квантна физика на Атоми, Молекули, Тврди тела, Јадра, и Честички. Њу Јорк: Џон Вајли и синови. стр. 114–117. ISBN 978-0-471-23464-7.
- ↑ Р.Б. Линдзи (1927). „Белешки за "нишало" орбитите на атомските модели“. Случувања на Националната академија за наука. 13: 413–419. Bibcode:1927PNAS...13..413L. doi:10.1073/pnas.13.6.413.














![{\displaystyle [J_{i},J_{j}]=i\hbar \epsilon _{ijk}J_{k}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1c774fd99fb91eb8937cbaaa6b6af2eaf88e7ad6)
![{\displaystyle \left[J_{i},J^{2}\right]=0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/df773fc4aa955999fbf21070fb2d56ae4252b0ef)

